2. 黄河上游水文水资源局, 兰州 730030;
3. 青海省水文水资源勘测局, 西宁 810001
2. Bureau of hydrology and water resources of the upper reaches of the Yellow River, Lanzhou 730030;
3. Hydrology and Water Resource Survey Bureau of Qinghai Province, Xining 810001
氧化亚氮(N2O)是大气中浓度仅次于二氧化碳(CO2)和甲烷(CH4)的温室气体, 它贡献了当前约9%的全球气候辐射强迫(Hu et al., 2016).自工业革命以来, 全球范围内人工化肥的生产, 化石燃料的使用和豆科农业的发展大幅增加了“活性氮”在自然环境中的含量(Galloway et al., 2008), 大气中人为N2O的排放每年大约增加0.25% (Murray et al., 2015).虽然N2O在大气中的浓度远小于CO2和CH4, 但其单位增温潜势分别约为CO2和CH4的300和12倍.它还是破坏平流层臭氧(O3)的主要气体之一, 其消耗O3潜力与氢氯氟碳化物相当, 并且排放量远超其他臭氧消耗物质(Ravishankara et al., 2009;Cavigelli et al., 2012).
此外, 有研究认为氮循环和气候变化存在互馈过程(Greaver et al., 2016), 因此, N2O的排放对气候的影响可能比其直接的温室效应更为复杂.
产生N2O的主要过程是微生物的硝化和反硝化作用.硝化过程是在生物作用下, 氨依次被氧化为亚硝酸盐和硝酸盐的过程, N2O可以在氨氧化过程中以副产物形式生成;此外部分硝化微生物在低氧环境中, 能够将亚硝酸盐还原为N2O.反硝化过程则是在低氧或厌氧条件下, 将硝酸盐还原为氮气(NO3-→NO2-→NO→N2O→N2)的连续过程, N2O是反硝化过程的中间产物, 甚至是部分真菌反硝化过程的最终产物.此外, 硝酸盐异化还原为铵(Dissimilatory nitrate reduction to ammonium, DNRA)、厌氧氨氧化和化学反硝化(chemodenitrification)等也被发现能够产生N2O(Sanford et al., 2012), 并且化学反硝化在许多自然和人工环境中对N2O的生成具有重要贡献.
河流系统是一个运输水和溶解物质的巨大管网, 农业施肥、污废水排放等人类活动使大量氮素进入江河, 导致氮素在水体中持续增加, 致使这一管网正以惊人的速度向大气中释放N2O这一温室气体(Hu et al., 2016).尽管大量文献认为江河在全球范围内是N2O的源, 但是数据的缺乏使内陆水系的N2O排放估算仍存在巨大的不确定性.现有的研究主要集中在欧洲和北美地区, 中国、印度等大型发展中国家的相关研究相对有限.本文总结了N2O排放速率的研究方法, 汇总了我国十大流域35条江河N2O的排放速率, 分析了江河N2O的产生和释放机理及其影响因素, 并预测气候变化和人类活动可能给我国江河N2O排放带来的影响.
2 江河N2O排放速率的研究方法(N2O flux computations)目前, 关于江河N2O排放主要利用“自下而上”的研究方法(Bottom-up approaches), 包括野外原位监测和室内模拟实验以评估江河N2O的排放, 其中, 野外原位监测是根据水气界面N2O通量来计算N2O的排放.通量的正负代表N2O的传输方向——正值表示江河是N2O的源, N2O从江河向大气排放;负值表示江河是N2O的汇, 大气中的N2O被江河吸收.本研究将N2O排放通量的主要研究方法总结归纳如下方法.
2.1 经验公式法经验公式法是根据N2O在水体的溶存浓度来计算其扩散通量, 其中溶存浓度采用顶空平衡技术法(Headspace equilibrium technique)分析, 即先测得N2O的平衡顶空浓度, 再根据质量守恒定律、亨利定律以及理想气体状态方程计算得出N2O在水中的溶存浓度及其饱和度.
N2O溶存浓度计算公式为:
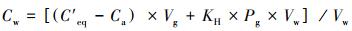
|
(1) |
式中, Cw为溶存气体浓度(mol·m-3);C′eq为平衡后顶空中气体浓度(mol·m-3);Ca为原位大气中气体浓度(mol·m-3);Vg为顶空气体体积(m3);Vw为水的容积(m3);Pg为平衡后顶空气体分压(Pa);KH为亨利常数(mol·L-1·Pa-1).
N2O饱和度(S)计算见式(2).
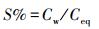
|
(2) |
式中, Ceq为与大气平衡后水中气体浓度(mol·m-3)
然后将N2O溶存浓度代入经验公式(3)以计算水气界面的通量.经验公式法的基本原理是由扩散作用主导的气体在水气之间的交换.这种扩散通量取决于两个因素:一是水气界面的气体浓度梯度;二是水气界面的紊动能量交换, 通常以水气交换速率k表示.
扩散通量(F)表达式为:
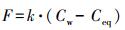
|
(3) |
式中, F为扩散通量(μmol·m-2·d-1);k为水气交换速率(m·d-1).
为了使k值能在不同气体和水温之间作比较, 一般转化为k600, 即气体在20 ℃或17.5 ℃的淡水中对应的k值, 此时相应的CO2或O2的施密特数(Sc, 无量纲)为600.水气交换速率可以与施密特数建立关系进行标准化(Jähne et al., 1987), 因而k值可以通过k600计算:
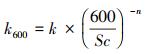
|
(4) |
其中, Sc通过式(5)计算.

|
(5) |
式中, n为风速超过3.6 m·s-1时, n取值0.5;风速低于3.6 m·s-1时, n取值0.67;t为水温(℃).
在计算N2O扩散通量时, 确定合适的水气交换速率(k)是评估N2O排放的关键步骤.Raymond等回顾了文献中已经报道的经验方程(Raymond et al., 2012), 发现将坡降与流速作为参数的方程能更好地预测水气交换速率.水流紊动是江河气体排放的主要驱动力, 水流紊动引起的微漩涡不断改变水中气体的溶存浓度.反过来, 水流紊动又是由不断变化的流量与河床形态所造成.所以, 在监测具有高度时空异质性的江河时, 直接测定k值更加可靠.
2.2 浮箱法浮箱法是另一种常用的方法, 在诸多研究中得到应用(Sun et al., 2012;韩洋等, 2013;陈劲松, 2014;常思琦等, 2015;胡骥, 2015;吴铭, 2016).浮箱是一种隔绝了周围大气, 只对底部(水面)气体开放的通量箱, 能在一定时间内监测N2O箱内浓度, 通常N2O浓度在箱内顶空呈类似Langmuir式增长, 可用线性增长段的斜率来确定N2O的排放通量.浮箱法的优点是设备简单、小空间尺度测量、实验可重复性高.但是有研究认为浮箱法测得的N2O通量比经验公式法计算的通量低2~5倍或高5倍(Murray et al., 2015).偏低是由于箱内空气的温度和压力与外界大气存在偏差, 并且弱化了风力的作用;偏高是因为浮箱置于水中时, 在水气边界层会产生额外湍流(Billett et al., 2008;Campeau et al., 2014).值得一提的是, 最近的研究认为如果把浮箱边缘用柔性塑料包裹能削弱额外湍流的影响起到优化作用(Lorke et al., 2015).所以浮箱法适合应用于风浪较小的江河中.
一般情况下, 浮箱法N2O的排放通量可由式(6)计算.
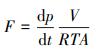
|
(6) |
式中, F为扩散通量(mol·m-2·min-1);dp/dt为浮箱内N2O分压积累斜率(Pa·min-1);V为浮箱体积(m3);A为浮箱底面积(m2);R为气体常数(8.314 Pa·m3·mol-1·K-1);T为气温(K).
2.3 其他研究方法气体示踪物法是在水中加入惰性且易挥发的气体示踪物(SF6、氩气或丙烷), 随着时间的推移, 示踪气体和N2O均会不断从水中逸散, 通过示踪气体和N2O之间的已知关系即可计算N2O的水气交换速率.例如Schade等利用气体示踪物SF6计算美国兰普瑞河中N2O的通量(Schade et al., 2016).但是这种方法不适用于频繁或连续监测, 因其要求示踪气体在水中充分扩散.例如Schade等的研究利用了罗丹明类染料, 在确定SF6已经完全扩散至研究河段中后, 才在河段的上、中、下游分别进行了采样.此外, SF6还可能溶于CH4, 通过CH4的冒泡通量逸散至大气中(Cole et al., 1998), 从而对测定结果造成一定误差.
室内模拟实验是在实验室条件下利用同位素示踪技术模拟真实江河情况来计算N2O的产生量, 再通过尺度推绎评估某河段乃至整条河流N2O的排放.如Xia等采用15N同位素示踪技术对黄河上覆水的耦合硝化-反硝化进行了研究, 结果表明多泥沙河段每年每平方公里1 m深的水柱可产生1.2 kg N2O(Xia et al., 2017);王岚等(2016)进行的培育试验结果表明黄河下游段上覆水中N2O的产生以反硝化作用为主, 并计算得出该河段N2O的平均排放速率为17.8 μmol·m-2·d-1.
3 中国江河水体中N2O的溶存浓度、饱和度以及排放通量(N2O concentrations, saturations and fluxes in China′s rivers)在中国江河N2O排放研究中(表 1), N2O通量的测定方法中66%为经验公式法, 34%为浮箱法.总体来看, 中国江河溶存N2O浓度为0.3~1591 nmol·L-1, 最小值出现在温带季风气候的天津市河流, 最大值出现在亚热带季风气候的上海市河流.N2O饱和度为61.5%~13820.7%, 94%的江河N2O处于过饱和的状态.N2O释放通量为-12.2~2262.1 μmol·m-2·d-1.海南诸河N2O排放通量均值最高, 长江次之, 地处寒冷气候带的雅鲁藏布江、狮泉河和嫩江普遍很低(图 1).各气候带间及气候带内的差异巨大, 这主要是由于各江河的氮污染程度、水环境特征与水文特征差异巨大, 一般受城市污废水影响的河流, 其N2O排放量明显高于其他河流.此外, 世界江河的N2O溶存浓度为0.4~553.6 nmol·L-1, N2O饱和度为42%~2500%, N2O通量为-21.4~6377.1 μmol·m-2·d-1(Hu et al., 2016).由表 1数据可见, 中国江河N2O排放通量范围落在世界江河范围内;除长江部分支流外(Yang et al., 2011;蔡林颖, 2014;张羽, 2016;胡晓婷, 2017;Yang et al., 2018), 中国主要江河N2O溶存浓度和饱和度范围与世界其他河流具有可比性.中国江河众多, 这表明中国江河对全球的N2O排放具有潜在的巨大贡献, 同时也说明中国江河数据的相对缺乏给全球分析增加了很大的不确定性.因此, 未来需要在全球江河N2O预算中纳入更多研究相对稀少国家和地区的数据.
| 表 1 中国江河N2O溶解浓度、饱和度以及排放通量汇总 Table 1 Summary of N2O concentrations, saturations and fluxes in China′s rivers |
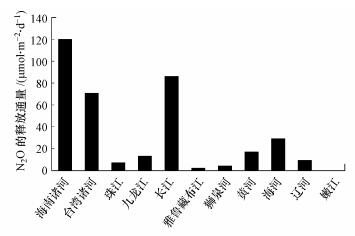 |
| 图 1 中国江河N2O排放通量均值分布图 Fig. 1 Distribution of mean N2O flux from China′s rivers |
江河产生N2O的微生物过程主要是硝化和反硝化作用.完全的硝化作用是氨在好氧条件下被连续氧化为亚硝酸盐和硝酸盐的过程(NH3→NO2-→NO3-), 此过程有中间产物羟胺(NH2OH)产生, 此后NH2OH被氧化成NO2-, NO2-再进一步转化为N2O (Stein, 2019).反硝化作用是硝酸盐在低氧条件下被反硝化菌还原为氮气的连续过程(NO3-→NO2-→NO→N2O→N2), N2O作为中间产物或最终产物生成.另外, 耦合硝化-反硝化作用主要发生在沉积物-水界面和悬浮颗粒物-水界面, 由于这些界面存在溶解氧浓度梯度, 在DO浓度较高区域, 好氧硝化菌占优势, 以硝化作用为主;在DO浓度较低的缺氧区域, 厌氧反硝化菌占优势, 此时反硝化菌能利用硝化作用产生的硝酸根进行反硝化作用, 随着DO的不断扩散, 空间内富氧和缺氧区域不断变化, 从而使硝化作用与反硝化作用同时进行, 形成耦合硝化-反硝化作用(Xia et al., 2017), 期间会产生并释放N2O.而且硝化菌的反硝化作用在江河中也可能是一个产生N2O的重要途径, 特别是在NH4+浓度较高的水环境中.由此说明, 河流中N2O有多种产生途径, 辨析各种途径对河流N2O产生的贡献也是当前的研究热点.N2O产生途径识别的研究方法包括N2O天然同位素特征值法, 室内同位素标记实验及其与抑制剂、微生物实验相结合的方法以及模型模拟方法(Duan et al., 2017;Quick et al., 2019).相对于土壤环境, 目前对于河流N2O来源途径进行解析的研究相对较少, 且研究结果多为定性认识, 无法判断各种产生途径的具体贡献.Thuan等基于N2O的15N和18O同位素组成特征, 推测反硝化是日本多摩川N2O的主要产生途径(Thuan et al., 2018).类似地, Beaulieu等基于源头溪流原位15NO3-的添加实验, 发现反硝化作用是美国源头河流N2O的主要产生途径(Beaulieu et al., 2011).而在塞纳河下游, 研究者发现反硝化速率较低, 推断硝化菌的反硝化过程是N2O的主要产生途径(Aurélie et al., 2005).Beaulieu等通过室内模拟实验研究了俄亥俄河上覆水和沉积物中N2O的产生速率, 推测硝化反应是河流上覆水中N2O产生的主要途径, 而沉积物中以反硝化作用为主(Beaulieu et al., 2010).
对于江河而言, 沉积物中往往发生反硝化作用, 是产生N2O的重要场所.上覆水中的含氮有机物在富氧条件下被矿化为NH4+、NO3-等无机物, NH4+被硝化菌氧化为NO3-的过程中, 不稳定的NH2OH会不断地产生与积累, 部分可能会被分解生成N2O, 进而扩散至大气.另外, 江河上覆水普遍存在悬浮泥沙(颗粒物), 由于DO向颗粒物内部扩散受限, 水沙微界面从外向内能够形成DO递减的浓度梯度, 外层DO浓度较高处以好氧硝化作用为主;内层DO传递受阻处形成缺/厌氧微环境, 反硝化作用占优势(Xia et al., 2017), 因此悬浮颗粒微界面可能同时存在硝化、反硝化和耦合硝化-反硝化作用.Xia等通过15N示踪模拟研究发现由于悬浮颗粒物能提供好氧/低氧微界面, 多泥沙江河的好氧上覆水体可发生硝化、反硝化和耦合硝化-反硝化反应, 且这些反应均随悬浮颗粒物含量的增加而加强, N2O的释放量亦随之增加(Liu et al., 2013;Xia et al., 2017).因此含沙上覆水也可能是产生N2O的重要场所, 如有关俄亥俄河的模拟研究发现上覆水N2O的产生速率几乎是沉积物的两倍, 并估算上覆水对N2O排放量的贡献大于26%(Beaulieu et al., 2010), 但相关研究还有待进一步开展.
通过河流排放的N2O还有一部分来自流域陆源系统, 特别是通过地下水迁移输入的N2O.此外, 城市河流中排放的大量氮污染物, 显著影响河流N2O的排放, 包括污水处理厂携带的大量N2O也会通过城市河流排放.然而, 目前鲜少有区分陆源/地下水与河流自身产生N2O的研究, 大部分研究主要通过稳定同位素—δ15N、δ18O、δ17O和δ2H来确定硝酸根的来源, 进而推测N2O可能的来源(Hu et al., 2019;Xia et al., 2019).
5 江河N2O产生和排放的影响因素(Controlling factors of riverine N2O production and emission) 5.1 水中溶解性无机氮的影响在水环境中控制微生物产N2O速率的主要因素之一是溶解性无机氮(Dissolved Inorganic Nitrogen, DIN, 包括NH4+、NO2-和NO3-).一般认为较高的DIN浓度可以促进N2O的产生与排放.Yan等对长江下游的研究表明N2O溶存浓度和通量均与NO3-浓度呈显著正相关(p < 0.001)(Yan et al., 2012).在一些河口观察到高浓度的NO3-能提高N2O的产量, 使反硝化表现出更高的N2O:N2生产比值(Murray et al., 2015).一些江河中硝化作用也可能是产生N2O的重要过程.有研究报道黄河源头的N2O溶存浓度与NH4+浓度呈显著正相关(Wang et al., 2018);嫩江流域的N2O通量与NH4+浓度呈现显著正相关(Sun et al., 2012), 说明硝化作用可能显著影响N2O的溶存浓度和通量.在塞纳河下游及河口, 硝化作用和硝化菌的反硝化作用是N2O产生的主导过程, 这是因为NH4+浓度很高的市政污水排入塞纳河致使这些过程发生(Cébron et al., 2005).
联合国政府间气候变化专门委员会(IPCC)利用排放因子(EF5-r, N2O-N/NO3--N)来预测世界各地江河N2O的排放, 这一缺省值已从0.75%修改为0.25%.然而, Hu等汇编了全球6400条江河的数据, 发现EF5-r均值为0.17% (Hu et al., 2016);类似地, 中国江河EF5-r均值为0.15%, 这些都低于IPCC缺省值, 所以应当重新审视IPCC缺省值.另外, 利用NO3-负荷量估算江河N2O的排放可能并不适用于所有河流, 因为除反硝化作用外, 硝化作用、硝化菌的反硝化作用、硝酸盐异化还原为铵和氨氧化作用都可以产生N2O.另外, 江河N2O的排放与NO3-、溶解氧、水温等环境变量可能不是简单的线性关系(Baulch et al., 2011; Rosamond et al., 2012), 还需要考虑江河N2O的排放与环境变量的非线性关系.
5.2 水中溶解氧含量的影响溶解氧(Dissolved Oxygen, DO)对N2O产生影响主要是因为微生物硝化和反硝化发生的环境不同.沉积物内部为厌氧条件, 有助于反硝化作用的进行;上覆水多为好氧环境, 更有利于硝化和耦合硝化-反硝化过程(Kester et al., 1997;Barnes et al., 1999).较高的N2O排放一般来自于低氧和高NO3-的环境(Barnes et al., 1999), 这种环境大多出现在水流较慢的江河中, 此时O2仅能穿透沉积物表层几毫米的深度(Revsbech et al., 1980), 加之上覆水的硝化作用能为沉积物提供NO3-作为反硝化的底物, 促进了水体N2O的产生.此外, 反硝化过程中的N2O还原酶nosZ对O2十分敏感, 微量的O2就能抑制N2O的还原却不影响其产生, 致使N2O的释放量增大(Beaulieu et al., 2011).相反, 在DO和NH4+较高的条件下, 江河产N2O过程可能主要以硝化和耦合硝化-反硝化作用为主, 高DO能促进硝化反应并为反硝化作用提供反应底物.
5.3 水中有机碳含量的影响江河中的有机碳(Organic Carbon, OC)主要通过溶解性(DOC)和颗粒态(POC)两种形式的有机碳对反硝化作用产生影响.反硝化是异养过程, DOC为反硝化提供了碳源, 促进了反硝化作用, 因此有利于反硝化过程中N2O的产生.如湘江支流的N2O排放速率与DOC呈显著正相关(p < 0.05)(张羽, 2016).沉积物和悬浮颗粒物作为POC的载体, 也可为反硝化微生物提供碳源, 而且颗粒微界面降解POC的好氧微生物通过消耗氧气为厌氧的反硝化微生物提供了缺/厌氧微生境.此外, 在江河中较高的NO3-/DOC意味着在碳源不足的条件下, N2O还原酶竞争电子能力削弱, 反硝化停留在产N2O阶段使N2O不断积累(尚会来等, 2008).美国马里兰州河流的NO3-/DOC值(0.5)高于九龙江(0.1), 这可能是马里兰州河流的N2O产量(2.1%)远高于九龙江(0.2%)的原因之一(Chen et al., 2015;Gardner et al., 2016).
5.4 水文、地形地貌与气象条件的影响河流水温存在昼夜差异和季节差异, 白天水温较高, 一方面微生物活性得到强化, 另一方面还可降低O2和N2O在水中的溶解度, 促进反硝化作用和N2O的排放.但是白天河流光合作用增强, 由此导致的DO含量增加可能在一定程度上抑制反硝化, 从而降低N2O的产生(Biswas et al., 2005).夜间虽然温度较低, 但夜间无光合作用, 因而低DO增强了沉积物的反硝化作用, 可能促进N2O的排放(Rosamond et al., 2012).所以N2O排放日变化的影响因素较为复杂, 在实际采样中不易阐明日变化规律, 正如嫩江、杭埠河、长江等多条河流中未发现N2O排放存在明显日变化规律(Yang et al., 2011;Sun et al., 2012;Wang et al., 2015), 仅有少量研究报道N2O的排放有时在夜间达到峰值(韩洋等, 2014).水温季节差异的影响主要表现在夏季高温增强了江河中微生物的活性, 直接促进了硝化和反硝化过程以及N2O的排放(Hemond et al., 1989;Beaulieu et al., 2010;Hinshaw et al., 2013).尽管如此, 在其他环境因素的综合影响下, N2O的产生与释放可能与水温相关性很弱, 如在黄河口的研究中发现, 低温并没有限制N2O的产生(王玲玲, 2011).
水文条件和地形地貌共同决定N2O产生与排放的空间差异性.通常源头低等级河流窄而浅, 产N2O的反硝化作用主要发生在河床-潜流带.Gomez-Velez等通过Networks with EXchange and Subsurface Storage模型验证并解释了这一现象的发生机制(Gomez-Velez et al., 2014).此时, 河床表面或内部(潜流)的水动力条件决定了供给微生物溶解性营养物质的量, 因而控制着生物地球化学过程.当江河等级不断上升时, 潜流带的贡献越来越小.对于高等级的大型江河, 上覆水和悬浮泥沙可能是N2O的主导贡献来源.Xia等通过室内模拟实验表明黄河下游悬浮泥沙微界面的脱氮(N2+N2O)贡献高达60%以上(Liu et al., 2013;Xia et al., 2017).水气交换速率与水文条件有关, 流量、流速、水深都决定着水流紊动, 直接影响N2O的水气交换速率.另外, 地形地貌的变化也能强烈地影响水流紊动, 进而影响水气交换速率.例如, 不同江河表现出复杂的空间异质性, 包括急流、水塘以及阶梯状小瀑布, 河床粗糙度、河道的宽窄和蜿蜒程度、河道坡降以及河流等级通常控制着空间性紊流的形成.
降水和风等气象条件对江河N2O释放也有一定的影响.风对水体表面施加切应力, 扰动水面波浪, 增强水气交换速率, 促进N2O的释放.降水一方面会通过地表径流将陆源氮素带入江河中, 并且增大水面扰动情况, 促进N2O的产生和从水体中的释放;另一方面, 降水能够补给江河水量, 在一定程度上稀释N2O浓度, 降水还会加快江河流速, 影响水中含氮物质的停留时间, 不利于N2O的产生和释放.实际江河中N2O的产生与释放受到以上多种因素的综合影响, 需要结合实际情况分析影响的主导因素.
6 变化环境下江河N2O的排放(Riverine N2O emissions under changing environment) 6.1 气候变化对江河N2O排放的影响气候变暖加速了冰冻圈的冰川、冻土融化以及热融湖塘扩张, 可能使寒冷气候带江河的N2O排放呈现增加趋势.一是因为淡水水体的水温上升以及冬季无冰期的延长在一定程度上增加了江河N2O的排放量.二是由于冰雪融水将更多外源氮素冲刷至江河中, 并增大了江河的紊流程度, 从而促进了江河N2O的产生与排放.春季时, 地处泛北极圈的阿萨巴斯卡河是N2O的排放热区, 这是因为营养物质通过冰雪融水进入径流, 为N2O的产生与排放提供了氮源(Shrestha et al., 2018).
气候变化引起水循环的改变可能影响氮循环, 极有可能改变江河作为N2O源或汇的时空变化.气候模型和观测实验表明, 气候变暖导致美国玉米种植带对流性降水事件不断增多, 降水频繁冲刷陆地使陆源氮素不断进入江河, 增强了上游对下游的氮输送能力, 从而强化硝化和反硝化作用促进N2O产生(Griffis et al., 2017).在干旱地区, 陆地有更强的水文隔离效应, 大量氮素得以储存, 一旦发生降水事件, 这些氮素会通过径流输入河道, 使江河含氮量急速增加, 短时间内提升江河N2O的排放量.我国气温在1908—2007年期间增加了0.86 ℃ (丁一汇等, 2016), 东北以及内蒙古东部、青藏高原、东南地区的降水量在1961—2010年期间都呈现增加趋势(梁圆等, 2016), 在日益温暖潮湿的气候背景下, 人为活性氮的持续输入可能促进江河N2O的排放, 这样的正反馈也将加剧气候变化.
6.2 人类活动对N2O排放的影响人类活动已经对江河生态系统产生了显著的影响(Vörösmarty et al., 2010), 有学者认为江河是目前世界上退化最严重的生态系统之一(Carpenter et al., 2011).水库修建和农业生产等人类活动持续影响着江河N2O动力学过程.中国作为世界上水力发电量最大的国家, 仍在继续建设水坝, 目标是增加水电在主要能源结构中的份额, 以达到2020年将非化石燃料占总能源比重提高到15%的目标(Hu et al., 2013).河道上水库的修建导致环境变量的时空变化, 从而造成N2O排放的时空差异.与河道相比, 水库具有较大的径流系数、表观氮沉降速率和平均氮负荷率, 可能显著改变江河N2O的排放.例如, 水库泄洪导致水位急速下降, 库底沉积物再悬浮, 释放大量的营养盐, 并将埋藏在其中的有机质暴露于好氧的上覆水中, 为微生物提供碳/氮源, 从而促进硝化与反硝化作用.同时, 水流通过水轮机时, 大量N2O过饱和水进入坝下河道, 致使河道水流紊动加剧, 更有利于N2O逸散到大气中.乌江流域的乌江渡和洪家渡水库因水力发电泄水导致坝下河道N2O排放剧增, 与通过水库水面释放的N2O排放量相当(Liu et al., 2011).我国作为兴建水电水库的大国, 依旧缺乏对水电水库温室气体排放的全生命周期的综合评价, 可能导致忽视或低估水库N2O的排放.同时, 为了更好地量化我国水电水库N2O的排放, 应该对不同功率密度、不同地理位置、不同建造时间的代表性水库进行监测.
人类对氮循环的影响很大一部分源于施用化肥来缓解农业中的氮素缺乏状况.农业施肥的氮素只有约10%存留在食物中, 40%则输入至河流系统中(Schlesinger, 2009).全球河流系统氮素的年输入量约为184.3 Tg N, 其中, 45.6~49.4 Gg N以N2O的形式返回大气(Maavara et al., 2018).中国作为农业大国, 河流氮污染主要来自于施肥土壤的浸出和淋溶作用, 并且随着我国水库的兴建, 内陆水体面积不断增大, 更有利于接收大气氮沉降以及土壤氮浸出和淋溶, 从而使内陆水系的氮浓度不断上升(Gao et al., 2019).如前所述, 水中含氮化合物浓度增加可能导致N2O的排放上升.因此, 有必要采取一些措施来减少河流中不同来源氮的输入, 包括缩短水库水力停留时间和减少对河流的人工调控来降低河流氮沉降输入, 从而防止河流氮污染程度加重(Gao et al., 2019).
7 结论(Conclusions)根据已有的研究结果可以总结, 在物理、化学和生物等多重环境条件的作用下, 我国江河主要表现为N2O的排放源.尽管目前我国江河N2O的排放数据基本覆盖了不同气候区, 但是数据仍然十分短缺, 这限制了我们对江河N2O排放的生物地球化学过程的理解, 尤其是目前有关N2O的产生途径和机制方面的认识不清.预计未来全球气候变化和人类活动的加剧将进一步影响江河的N2O排放, 我国河流水沙条件变异对氮转化过程、脱氮作用以及N2O排放又将产生怎样的影响, 这些都值得和亟需我们去开展深入系统的研究.
Aurélie C, Josette G, Gilles B. 2005. Nitrous oxide production and nitrification kinetics by natural bacterial communities of the lowerSeine river (France)[J]. Aquatic Microbial Ecology, 41(1): 25-38. |
Barnes J, Owens N J P. 1999. Denitrification and nitrous oxide concentrations in the Humber Estuary, UK, and adjacent coastal zones[J]. Marine Pollution Bulletin, 37(3): 247-260. |
Baulch H M, Schiff S L, Maranger R, et al. 2011. Nitrogen enrichment and the emission of nitrous oxide from streams[J]. Global Biogeochemical Cycles, 25(4): B4013. |
Beaulieu J J, Shuster W D, Rebholz J A. 2010. Nitrous oxide emissions from a large, impounded river:The Ohio River[J]. Environmental Science & Technology, 44(19): 7527-7533. |
Beaulieu J J, Tank J L, Hamilton S K, et al. 2011. Nitrous oxide emission from denitrification in stream and river networks[J]. Proceedings of the National Academy of Sciences, 108(1): 214-219. DOI:10.1073/pnas.1011464108 |
Billett M F, Moore T R. 2008. Supersaturation and evasion of CO2 and CH4 in surface waters at Mer Bleue peatland, Canada[J]. Hydrological Processes, 22(12): 2044-2054. DOI:10.1002/hyp.6805 |
Biswas H, Chatterjee A, Mukhopadhya S K, et al. 2005. Estimation of ammonia exchange at the land-ocean boundary condition of Sundarban mangrove, northeast coast of Bay of Bengal, India[J]. Atmospheric Environment, 39(25): 4489-4499. DOI:10.1016/j.atmosenv.2005.03.041 |
蔡林颖. 2014.巢湖流域不同污染类型河流N2O溶存浓度及释放能量研究[D].保定: 河北农业大学 http://cdmd.cnki.com.cn/Article/CDMD-10086-1015515623.htm
|
Campeau A, Lapierre J F, Vachon D, et al. 2014. Regional contribution of CO2 and CH4 fluxes from the fluvial network in a lowland boreal landscape of Québec[J]. Global Biogeochemical Cycles, 28(1): 57-69. DOI:10.1002/2013GB004685 |
Carpenter S R, Stanley E H, Zanden M J V. 2011. State of the world's freshwater ecosystems:Physical, chemical, and biological changes[J]. Annual Review of Environment and Resources, 36(1): 75-99. DOI:10.1146/annurev-environ-021810-094524 |
Cavigelli M A, Grosso S J D, Liebig M A, et al. 2012. US agricultural nitrous oxide emissions:context, status, and trends[J]. Frontiers in Ecology & the Environment, 10(10): 537-546. |
Cébron A, Josette G, Gilles B. 2005. Nitrous oxide production and nitrification kinetics by natural bacterial communities of the lower Seine river (France)[J]. Aquatic Microbial Ecology, 41(1): 25-38. |
常思琦. 2015.上海市河流N2O和CH4排放特征及沉积物微生物群落的影响[D].上海: 华东师范大学 http://cdmd.cnki.com.cn/Article/CDMD-10269-1015351748.htm
|
常思琦, 王东启, 俞琳, 等. 2015. 上海城市河流温室气体排放特征及其影响因素[J]. 环境科学研究, 28(9): 1375-1381. |
陈劲松. 2014.九龙江河流-河口系统反硝化、厌氧氨氧化以及氧化亚氮的排放[D].厦门: 厦门大学 https://dspace.xmu.edu.cn/handle/2288/96279
|
Chen J, Cao W, Cao D, et al. 2015. Nitrogen loading and nitrous oxide emissions from a river with multiple hydroelectric reservoirs[J]. Bulletin of Environmental Contamination & Toxicology, 94(5): 633. |
Chen N, Wu J, Zhou X, et al. 2015. Riverine N2O production, emissions and export from a region dominated by agriculture in Southeast Asia (Jiulong River)[J]. Agriculture Ecosystems & Environment, 208: 37-47. |
Cheng F, Zhang H, Zhang G, et al. 2019. Distribution and emission of N2O in the largest river-reservoir system along the Yellow River[J]. Science of the Total Environment, 666: 1209-1219. DOI:10.1016/j.scitotenv.2019.02.277 |
Cole J J, Caraco N F. 1998. Atmospheric exchange of carbon dioxide in a low-wind oligotrophic lake measured by the addition of SF6[J]. Limnology and Oceanography, 43(4): 647-656. DOI:10.4319/lo.1998.43.4.0647 |
丁一汇, 王会军. 2016. 近百年中国气候变化科学问题的新认识[J]. 科学通报, 61(10): 1029-1041. |
Duan H, Ye L, Erler D, et al. 2017. Quantifying nitrous oxide production pathways in wastewater treatment systems using isotope technology-A critical review[J]. Water Research, 122: 96-113. |
Galloway J N, Townsend A R, Erisman J W, et al. 2008. Transformation of the nitrogen cycle:Recent trends, questions, and potential solutions[J]. Science, 320(5878): 889-892. DOI:10.1126/science.1136674 |
Gao Y, Zhou F, Ciais P, et al. 2019. Human activities aggravate nitrogen deposition pollution to inland water over china[J]. National Science Review, 7(2): 430-440. |
Gardner J R, Fisher T R, Jordan T E, et al. 2016. Balancing watershed nitrogen budgets:accounting for biogenic gases in streams[J]. Biogeochemistry, 127(2): 1-23. |
Gomez-Velez J D, Harvey J W. 2014. A hydrogeomorphic river network model predicts where and why hyporheic exchange is important in large basins[J]. Geophysical Research Letters, 41(18): 6403-6412. DOI:10.1002/2014GL061099 |
Greaver T L, Clark C M, Compton J E, et al. 2016. Key ecological responses to nitrogen are altered by climate change[J]. Nature Clim. Change, 6(9): 836-843. DOI:10.1038/nclimate3088 |
Griffis T J, Chen Z, Baker J M, et al. 2017. Nitrous oxide emissions are enhanced in a warmer and wetter world[J]. Proceedings of the National Academy of Sciences, 114(45): 12081-12085. DOI:10.1073/pnas.1704552114 |
关道明, 赵化德, 姚子伟. 2009. 辽河口海域N2O分布特征和海气通量研究[J]. 海洋学报:中文版, 31(1): 85-90. |
韩洋, 郑有飞, 吴荣军, 等. 2014. 南京河流夏季水-气界面N2O排放通量[J]. 环境科学, 35(1): 348-355. |
韩洋, 郑有飞, 吴荣军, 等. 2013. 南京典型水体春季温室气体排放特征研究[J]. 中国环境科学, 33(8): 1360-1371. |
韩玉. 2011.海南东部近岸不同环境中CH4和N2O的分布及释放[D].青岛: 中国海洋大学 http://d.wanfangdata.com.cn/thesis/Y1926804
|
Hemond H F, Duran A P. 1989. Fluxes of N2O at the sediment-water and water-atmosphere boundaries of a nitrogen-rich river[J]. Water Resources Research, 25(5): 839-846. DOI:10.1029/WR025i005p00839 |
Hinshaw S E, Dahlgren R A. 2013. Dissolved nitrous oxide concentrations and fluxes from the eutrophic San Joaquin River, California[J]. Environmental Science & Technology, 47(3): 1313-1322. |
Hu B, Wang D, Zhou J, et al. 2018. Greenhouse gases emission from the sewage draining rivers[J]. Science of the Total Environment, 612: 1454-1462. DOI:10.1016/j.scitotenv.2017.08.055 |
胡骥. 2015.若尔盖高原河流三种温室气体排放及时空动态[D].杨凌: 西北农林科技大学
|
Hu M, Chen D, Dahlgren R A. 2016. Modeling nitrous oxide emission from rivers:a global assessment[J]. Global Change Biology, 22(11): 3566-3582. DOI:10.1111/gcb.13351 |
Hu M, Liu Y, Zhang Y, et al. 2019. Coupling stable isotopes and water chemistry to assess the role of hydrological and biogeochemical processes on riverine nitrogen sources[J]. Water Research, 150: 418-430. |
胡晓婷. 2017.上海市主要河流水-气界面温室气体通量及影响因素研究[D].上海: 华东师范大学 http://cdmd.cnki.com.cn/Article/CDMD-10269-1017102917.htm
|
Hu Y, Cheng H. 2013. The urgency of assessing the greenhouse gas budgets of hydroelectric reservoirs in China[J]. Nature Climate Change, 3: 708. DOI:10.1038/nclimate1831 |
Jähne B, Heinz G, Dietrich W. 1987. Measurement of the diffusion coefficients of sparingly soluble gases in water[J]. Journal of Geophysical Research Oceans, 92(C10): 10767-10776. DOI:10.1029/JC092iC10p10767 |
Kester R A, De B W, Laanbroek H J. 1997. Production of NO and N2O by pure cultures of nitrifying and denitrifying bacteria during changes in aeration[J]. Applied & Environmental Microbiology, 63(10): 3872-3877. |
梁圆, 千怀遂, 张灵, 等. 2016. 中国近50年降水量变化区划(1961-2010年)[J]. 气象学报, 74(1): 31-45. |
林华. 2010.南海和珠江口溶解氧化亚氮的分布特征、通量及其调控机制初探[D].厦门: 厦门大学 http://cdmd.cnki.com.cn/Article/CDMD-10384-1014227574.htm
|
Liu T, Xia X, Liu S, et al. 2013. Acceleration of denitrification in turbid rivers due to denitrification occurring on suspended sediment in oxic waters[J]. Environmental Science & Technology, 47(9): 4053-4061. |
Liu X, Bai L, Wang Z, et al. 2015. Nitrous oxide emissions from river network with variable nitrogen loading in Tianjin, China[J]. Journal of Geochemical Exploration, 157: 153-161. DOI:10.1016/j.gexplo.2015.06.009 |
Liu X, Liu C, Li S, et al. 2011. Spatiotemporal variations of nitrous oxide (N2O) emissions from two reservoirs in SW China[J]. Atmospheric Environment, 45(31): 5458-5468. DOI:10.1016/j.atmosenv.2011.06.074 |
Liu X, Li S, Wang Z, et al. 2017. Nitrous oxide (N2O) emissions from a mesotrophic reservoir on the Wujiang River, southwest China[J]. Acta Geochimica, (4): 1-13. |
Lorke A, Bodmer P, Noss C, et al. 2015. Technical note:drifting versus anchored flux chambers for measuring greenhouse gas emissions from running waters[J]. Biogeosciences, 12(23): 7013-7024. DOI:10.5194/bg-12-7013-2015 |
Maavara T, Lauerwald R, Laruelle G G, et al. 2018. Nitrous oxide emissions from inland waters:Are IPCC estimates too high?[J]. Global Change Biology, 25(2): 473-488. |
Murray R H, Erler D V, Eyre B D. 2015. Nitrous oxide fluxes in estuarine environments:Response to global change[J]. Global Chang Biology, 21(9): 3219-3245. DOI:10.1111/gcb.12923 |
Otte S, Schalk J, Kuenen J G, et al. 1999. Hydroxylamine oxidation and subsequent nitrous oxide production by the heterotrophic ammonia oxidizer Alcaligenes faecalis[J]. Applied Microbiology and Biotechnology, 51(2): 255-261. |
Qu B, Aho K S, Li C, et al. 2017. Greenhouse gases emissions in rivers of the Tibetan Plateau[J]. Scientific Reports, 7(1): 16573. DOI:10.1038/s41598-017-16552-6 |
Quick A M, Reeder W J, Farrell T B, et al. 2019. Nitrous oxide from streams and rivers:A review of primary biogeochemical pathways and environmental variables[J]. Earth-Science Reviews, 191: 224-262. DOI:10.1016/j.earscirev.2019.02.021 |
Ravishankara A R, Daniel J S, Portmann R W. 2009. Nitrous oxide (N2O):the dominant ozone-depleting substance emitted in the 21st century[J]. Science, 326(5949): 123-125. DOI:10.1126/science.1176985 |
Raymond P A, Zappa C J, Butman D, et al. 2012. Scaling the gas transfer velocity and hydraulic geometry in streams and small rivers[J]. Limnology and Oceanography:Fluids and Environments, 2(1): 41-53. DOI:10.1215/21573689-1597669 |
Revsbech N P, Sorensen J, Blackburn T H, et al. 1980. Distribution of oxygen in marine sediments measured with microelectrodes[J]. Limnology & Oceanography, 25(3): 403-411. |
Rosamond M S, Thuss S J, Schiff S L. 2012. Dependence of riverine nitrous oxide emissions on dissolved oxygen levels[J]. Nature Geoscience, 5(10): 715-718. DOI:10.1038/ngeo1556 |
Sanford R A, Wagner D D, Wu Q, et al. 2012. Unexpected nondenitrifier nitrous oxide reductase gene diversity and abundance in soils[J]. Proceedings of the National Academy of Sciences of the United States of America, 109(48): 19709. DOI:10.1073/pnas.1211238109 |
Schade J D, Bailio J, Mcdowell W H. 2016. Greenhouse gas flux from headwater streams in New Hampshire, USA:Patterns and drivers[J]. Limnology & Oceanography, 61(S1): S165-S174. |
Schlesinger W H. 2009. On the fate of anthropogenic nitrogen[J]. Proceedings of the National Academy of Sciences of the United States of America, 106(1): 203-208. DOI:10.1073/pnas.0810193105 |
尚会来, 彭永臻, 王淑莹, 等. 2008. 污水生物脱氮过程中N2O的产生和减量化控制[J]. 中国给水排水, 24(16): 104-108. DOI:10.3321/j.issn:1000-4602.2008.16.030 |
Shrestha N K, Wang J. 2018. Current and future hot-spots and hot-moments of nitrous oxide emission in a cold climate river basin[J]. Environmental Pollution, 239: 648-660. DOI:10.1016/j.envpol.2018.04.068 |
Stein L Y. 2019. Insights into the physiology of ammonia-oxidizing microorganisms[J]. Current Opinion in Chemical Biology, 49: 9-15. DOI:10.1016/j.cbpa.2018.09.003 |
Sun Q Q, Whitham C, Shi K, et al. 2012. Nitrous oxide emissions from a waterbody in the Nenjiang basin, China[J]. Hydrology Research, 43(6): 862-869. DOI:10.2166/nh.2012.060 |
孙文凭, 徐继荣, 殷建平, 等. 2010. 三亚河与三亚湾溶存N2O分布特征与影响因素研究[J]. 海洋与湖沼, 41(2): 266-273. |
Thuan N C, Koba K, Yano M, et al. 2018. N2O production by denitrification in an urban river:Evidence from isotopes, functional genes, and dissolved organic matter[J]. Limnology, 19(1): 115-126. |
Vörösmarty C J, McIntyre P B, Gessner M O, et al. 2010. Global threats to human water security and river biodiversity[J]. Nature, 467: 555. DOI:10.1038/nature09440 |
Wang G, Wang J, Xia X, et al. 2018. Nitrogen removal rates in a frigid high-altitude river estimated by measuring dissolved N2 and N2O[J]. Science of the Total Environment, 645: 318-328. DOI:10.1016/j.scitotenv.2018.07.090 |
Wang J, Chen N, Yan W, et al. 2015. Effect of dissolved oxygen and nitrogen on emission of N2O from rivers in China[J]. Atmospheric Environment, 103(103): 347-356. |
王岚, 叶旺旺, 宋达, 等. 2016. 黄河下游垦利站溶解N2O浓度和通量的季节变化及其调控因子分析[J]. 环境科学学报, 36(6): 1917-1927. |
王玲玲. 2011.黄河口滨岸潮滩湿地系统N2O排放规律与影响机制研究[D].北京: 中国科学院研究生院
|
吴铭. 2016.崇州市不同水体CO2、CH4和N2O通量变化特征及其影响因素研究[D].成都: 四川农业大学 http://cdmd.cnki.com.cn/Article/CDMD-10626-1017012192.htm
|
Xia X, Li S, Wang F, et al. 2019. Triple oxygen isotopic evidence for atmospheric nitrate and its application in source identification for river systems in the Qinghai-Tibetan Plateau[J]. Science of the Total Environment, 688: 270-280. DOI:10.1016/j.scitotenv.2019.06.204 |
Xia X, Jia Z, Liu T, et al. 2017. Coupled nitrification-denitrification caused by suspended sediment (SPS) in rivers:Importance of SPS size and composition[J]. Environmental Science & Technology, 51(1): 212-221. |
Xia Y, Li Y, Li X, et al. 2013. Diurnal pattern in nitrous oxide emissions from a sewage-enriched river[J]. Chemosphere, 92(4): 421-428. DOI:10.1016/j.chemosphere.2013.01.038 |
Yan W, Yang L, Wang F, et al. 2012. Riverine N2O concentrations, exports to estuary and emissions to atmosphere from the Changjiang River in response to increasing nitrogen loads[J]. Global Biogeochemical Cycles, 26(4): GB4006. |
Yang L, Lei K. 2018. Effects of land use on the concentration and emission of nitrous oxide in nitrogen-enriched rivers[J]. Environmental Pollution, 238: 379-388. DOI:10.1016/j.envpol.2018.03.043 |
Yang L, Yan W, Pei M, et al. 2011. Seasonal and diurnal variations in N2O concentrations and fluxes from three eutrophic rivers in Southeast China[J]. Journal of Geographical Sciences, 21(5): 820-832. DOI:10.1007/s11442-011-0882-1 |
虞中杰. 2011.上海市河网水体溶存氧化亚氮和甲烷的时空分布及排放通量[D].上海: 华东师范大学 http://cdmd.cnki.com.cn/Article/CDMD-10269-1011131519.htm
|
袁淑方, 王为东. 2012. 太湖流域源头溪流氧化亚氮(N2O)释放特征[J]. 生态学报, 32(20): 6279-6288. |
曾筱君. 2005.台湾周遭水域CH4和N2O的分布[D].台湾: 国立中山大学
|
张晓萌, 杨扬, 蔡楠, 等. 2012. 广东省入库河口N2O分布和通量的时空变化[J]. 生态科学, 31(3): 306-311. DOI:10.3969/j.issn.1008-8873.2012.03.014 |
张羽. 2016.亚热带农业丘陵小流域甲烷、氧化亚氮产生与扩散研究——以湖南脱甲河为例[D].青岛: 青岛大学
|
赵静, 张桂玲, 吴莹, 等. 2009. 长江溶存氧化亚氮的分布与释放[J]. 环境科学学报, 29(9): 1995-2002. DOI:10.3321/j.issn:0253-2468.2009.09.030 |
 2020, Vol. 40
2020, Vol. 40


