2. 中国有色桂林矿产地质研究院有限公司, 桂林 541004
2. China Nonferrous Metal(Guilin) Geology for Mineral Co., Ltd, Guilin 541004
我国作为矿业大国, 每年排放的选矿废水约占工业废水的1/10, 排放量巨大(杨归年, 2018).丁基黄原酸盐又称黄药, 是一种常用的重金属硫化矿捕收剂, 在选矿过程中大量使用(张萌等, 2011), 其结构式如图 1所示.黄药对环境、动植物都有很大危害, 少量黄药会使周围空气有异味, 对水生植物有致死性.同时, 黄药还具有致畸性, 对动物中枢神经系统具有抑制作用, 会严重损害其繁殖能力(张甫英, 1995;刘超等, 2017).
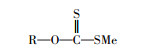 |
| 图 1 丁基黄原酸盐结构式(其中R为C4H9, Me为Na或K) Fig. 1 Structural formula of butyl xanthate(Where R is C4H9 and Me is Na or K) |
目前, 国内外处理黄药废水常用的方法有自然光解法(张振飞等, 2018)、吸附法(Shen et al., 2019)、臭氧催化氧化法(Molina et al., 2013)、Fenton试剂法(徐劲等, 2005)、微生物法(何江超等, 2017), 以及VUV/UV与O3联合的高级氧化技术(Fu et al., 2020).自然光解法降解效率较低(张振飞等, 2018);吸附材料会产生二次污染并且难以再利用;微生物法虽然绿色环保, 但适应性差;臭氧催化氧化法具有氧化能力强、降解效果好、无二次污染等优点(Yan et al., 2016), 但高功率和昂贵的运行费用限制了其应用(曹学锋等, 2012);Fenton试剂法具有操作简单、反应快速等优点(García-Leiva et al., 2019), 但对仪器要求高, 对废水pH的影响大, 不利于实际应用;高级氧化技术能快速降解黄药, 但依旧存在难以实际应用的问题(蒋文艳等, 2017).而使用VUV辐照法处理有机污染的废水具有操作简单、低成本等优势, 具有工程应用潜力.
VUV可以辐射出约90%的hv 254 nm光线和约10%的hv 185 nm光线(Fu et al., 2019a).其中, hv 254 nm光线的作用与UV相同, 在高级氧化中UV常与O3、H2O2联合使用(芮旻等, 2005;冯欣欣等, 2015), 使体系中产生HO ·;此外, UV辐照会使某些有机物光解(李贞燕等, 2014).hv185 nm光线在水中作用原理见式(1)~(3)(Gonzalez et al., 2004).
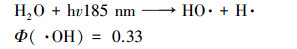
|
(1) |
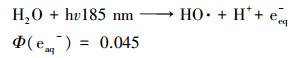
|
(2) |
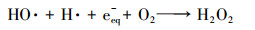
|
(3) |
由式(1)和(2)可知, hv185 nm的光线会使水裂解产生HO ·、氢自由基(H ·)和水合电子(eeq-), 而HO ·、H ·、eeq-和溶解氧之间相互作用会产生过氧化氢(式(3))(Imoberdorf et al., 2012).综上, VUV的降解机理为直接光解和HO ·的共同作用.
Cao等(2020)采用VUV辐照法去除酚类同系物, 结果发现, 纯净水中的酚类同系物去除率至少可达到90%.Fu等(2019b)采用VUV辐照法处理水中黄原酸钠, 反应60 min后水中黄原酸钠去除率达到98%以上.但以往的研究侧重于VUV辐照法对黄药降解效果方面, 没有与工程上常用的药剂及工艺方法进行比较, 对黄药降解的主要影响因素描述较少, 且选矿废水中含有多种共存阴、阳离子, 共存离子在VUV辐照法降解黄药过程中起什么作用还需进一步研究.因此, 本文以丁基黄原酸钾(PBX)为目标污染物, 探讨不同氧化剂和工艺方法(VUV、过氧化氢氧化、次氯酸钠氧化、曝气)对水体中黄药的降解效果, 在此基础上深入研究VUV辐照法降解黄药的影响因素(pH、温度、初始黄药浓度及共存离子), 以探明VUV辐照法降解黄药的关键影响因素并建立降解动力学模型, 为VUV辐照法处理选矿废水中的黄药提供理论依据.
2 材料与方法(Materials and methods) 2.1 试剂丁基黄原酸钾(C4H9OCSSK>98%)购自上海麦克林生化科技有限公司, 过氧化氢(H2O2, 30%)和次氯酸钠(NaClO, 5.5%)均采购于广东光华科技股份有限公司, 其他试剂均为分析纯.半浸没式VUV紫外灯(16 W, 可以辐照出hv 254 nm和hv 185 nm的光线)购自广东亮月亮光电科技有限公司.
丁基黄原酸钾储备液的配置:准确称取一定量的C4H9OCSSK, 用去离子水溶解后定容, 配置成含丁基黄原酸钾100 mg · L-1的标准溶液, 在4 ℃条件下可保存一周.
共存离子配置:以去离子水做溶剂, 称取一定量的Na2SiO3 · 9H2O、Na2CO3、NaCl、Na2SO4、CaCl2加入其中, 将各共存离子配置成500 mL初始浓度为0.1 mol · L-1的储备液, 用时再稀释.
2.2 实验方法 2.2.1 不同处理对丁基黄原酸钾(PBX)降解的影响实验方案设计如表 1所示.PBX的降解均在一个圆柱形棕色玻璃反应器(图 2)中进行, 根据表 1实验方案, 取一定体积的PBX储备液于反应器中, 加入去离子水至最终反应体积为1.0 L, PBX浓度为20 mg · L-1.将反应器置于磁力搅拌器上, 调节转速至400 r · min-1充分搅拌.用0.1 mol · L-1的NaOH和HCl调节溶液pH值为6.80±0.02, 温度为(25±2) ℃.每隔0、2、5、10、15、20、30、40、60 min用注射器取样15 mL, 测定PBX浓度, 根据式(4)计算PBX残留率R.
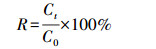
|
(4) |
| 表 1 实验方案设计 Table 1 Design of experimental scheme |
 |
| 图 2 反应装置示意图(VUV灯位于水槽中间) Fig. 2 Schematic diagram of experimental set-up(VUV lamp is placed in the middle of the sink) |
式中, C0、Ct分别为PBX的初始浓度和不同时间取样浓度(mg · L-1).
2.2.2 VUV降解PBX的影响因素研究研究初始pH值、反应温度(T)、初始浓度(C0)和共存离子对溶液中PBX降解的影响, 实验装置同图 2, 设置实验参数详见表 2.共设置6种共存离子(Ca2+、SiO32-、SO42-、Cl-、Na+、CO32-), 每种离子投加量为5 mmol · L-1.取一定体积的储备液于反应器中, 加入去离子水至最终反应体积为1.0 L.将反应器置于磁力搅拌器上, 调节转速至400 r · min-1充分搅拌.用0.1 mol · L-1的NaOH和HCl调节溶液pH值, 用磁力搅拌器控温系统控制反应温度, 共存离子按2.1节所配储备液添加.在0、2、5、10、15、20、30、40、60 min用注射器取样, 分别测定PBX浓度, 反应共进行60 min, 结果用一阶动力学方程(式(5))拟合.
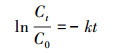
|
(5) |
| 表 2 实验参数 Table 2 Experiment parameter |
式中, k(kT、kpH、kC和kI)为反应动力学常数(min-1), 其中, kT、kpH、kC和kI分别代表不同反应温度、不同初始pH值、不同初始浓度、共存离子与降解后PBX浓度按照式(5)拟合得到的一级动力学反应常数.
2.2.3 PBX降解动力学模型的建立VUV降解PBX符合一级动力学, 降解过程满足方程(6)(Fu et al., 2019b).
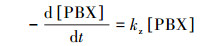
|
(6) |
式中, kZ为PBX降解速率常数(min-1);[PBX]为PBX浓度(mol · L-1).为更直观地反映关键因子对PBX降解的影响, 根据幂函数经验模型的方法及阿伦尼乌斯方程, 建立PBX降解反应速率常数和反应温度、初始pH的模型(张萌, 2011), 具体如式(7)所示.
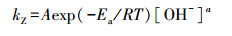
|
(7) |
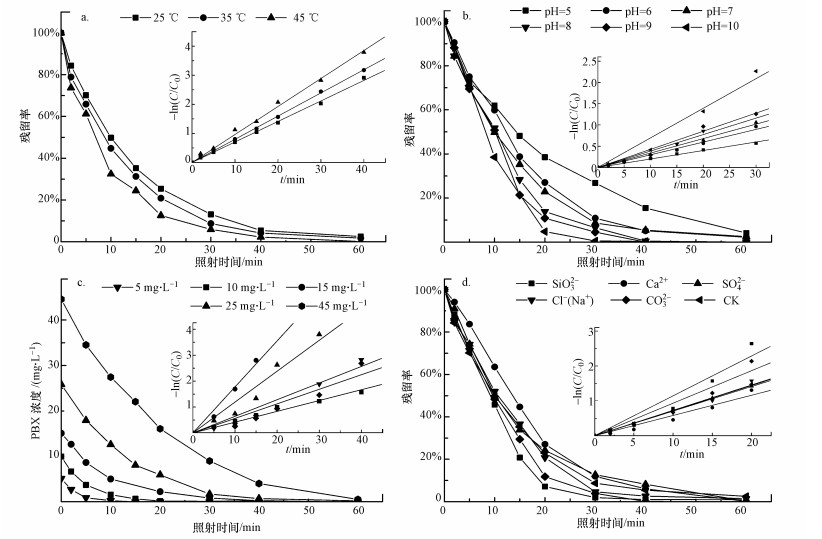
式中, kZ为PBX降解速率常数(min-1);A为前因子(min-1);T为反应温度(K);Ea为活化能(kJ · mol-1);R为通用恒定气体常数(8.314 J · mol-1 · K-1);[OH-]为溶液中OH-浓度(mol · L-1);a为[OH-]的指数.两边取对数可得式(8), 对式(8)中lnkZ~1/T和lnkZ ~ln[OH-]进行线性回归分析, 计算A、Ea、a.
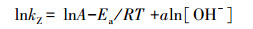
|
(8) |
PBX采用紫外分光光度法(UV-1800PC, 上海美谱达仪器)测定, 测定波长为301 nm(Cui et al., 2016);pH值用玻璃电极法测定(PE28, 梅特勒-托利多仪器).采用Excel2016分析数据, 用Origin2016做图.
3 结果与讨论(Results and discussion) 3.1 VUV与常用氧化法对PBX的降解图 3显示了各处理降解PBX的时间曲线.由图 3可知, 与CK相比, VUV处理在反应前30 min PBX快速降解, 往后趋势变缓, 40 min左右稳定, 60 min时PBX降解率达到97.49%, 是CK的34.94倍.投加H2O2处理的PBX则在反应前30~40 min快速降解, 之后逐渐稳定, 60 min时各处理PBX的降解率分别为54.39%(1 : 1H2O2)、89.59%(1 : 3H2O2)和90.08%(1 : 10H2O2), 分别是CK的19.46、32.46和32.64倍.投加NaClO的处理中, 反应前10~20 min PBX快速降解, 之后趋势变缓, 在30 min左右稳定, 60 min时各处理的PBX降解率分别为40.04%(1 : 5NaClO)和58.46%(1 : 10NaClO), 分别是CK的14.51和20.95倍.曝气法对PBX的降解最缓慢, 60 min时PBX降解率仅为9.34%, 与CK没有明显差别.
 |
| 图 3 不同处理下PBX降解情况 Fig. 3 Degradation of PBX in different treatments |
结果表明, PBX自然降解速率缓慢(徐承焱等, 2016), 两种氧化剂是通过自身的氧化性降解PBX(张亨, 2012;García-Leiva et al., 2019).在物质的量投加比(简称“投加比”)相同的条件下, H2O2对PBX的降解效果优于NaClO.H2O2投加比从1 : 1增加至1 : 3, PBX降解率增加了35.20%, 但继续增加至1 : 10, PBX降解率增加不明显;NaClO投加比从1 : 5增加至1 : 10, PBX降解率增加了18.42%.当两种氧化剂的投加比均为1 : 10时, 处理效果仍然不如VUV辐照法.此外, 加入过量的过氧化氢会导致水中pH值过低, 次氯酸钠在氧化过程中可能会产生氯气造成二次污染(周相武等, 2006).VUV有效降解PBX是hv 254 nm光线和· OH共同作用的结果(Fu et al., 2019b).VUV辐照法比两种氧化剂更有效的原因在于, hv 254 nm光线本身对PBX具有良好的降解效果(陈晓东等, 2010);其次, · OH(E0=2.80 V)的氧化还原电位高于H2O2和ClO-(张乃东等, 2001), 可以深度降解PBX.综上所述, 与常用氧化法相比, VUV辐照法是一种操作简单、经济高效的降解PBX方法.
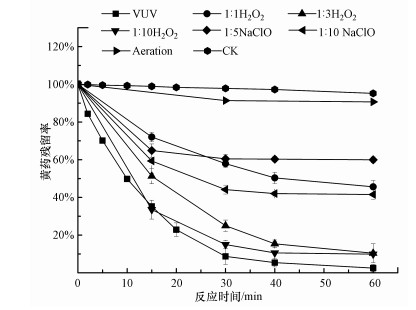
3.2 不同因素对VUV降解PBX的影响 3.2.1 反应温度的影响图 4a所示为反应温度对PBX降解的影响.由图可知, 各处理在反应前30 min PBX快速降解, 30 min时PBX降解率分别为86.86%(25 ℃)、91.28%(35 ℃)和94.08%(45 ℃), 之后降解速率减缓, 在40 min左右达到平衡, 在60 min基本降解完全.按照式(5)进行拟合, 可决系数均大于0.99, 符合一阶动力学(图 4a插图).随着反应温度的升高(25、35、45 ℃), kT值增加, 分别为0.07056、0.07976和0.09626 min-1.温度升高有利于促进反应向正方向进行(王琪等, 2018).但温度升高对紫外光辐照效果和· OH的产生没有影响(Zhang et al., 2020).分析原因可能是PBX热稳定性较差, 在高温条件下分子结构更易被破坏;也可能是温度升高活跃了水中的PBX分子, 使其降解速度加快.
 |
| 图 4 反应温度(a)、初始pH (b)、初始PBX浓度(c)及共存离子(d)对PBX降解的影响 Fig. 4 Effects of reaction temperature (a), initial pH (b), initial concentration of PBX (c) and co-existing ions (d) on PBX degradation |
图 4b所示为不同初始pH对PBX降解的影响.由图 4b可知, 在碱性条件下(pH=8、9、10), 20 min内PBX快速降解, 之后降解速率变缓慢, 在40 min左右稳定, PBX降解率分别达99.53%、99.66%和99.67%.中性偏碱条件下, 反应30 min内PBX快速降解, 在40 min左右稳定, 此时PBX降解率分别为94.58%(pH=6)和95.85%(pH=7).pH=5时, PBX降解最慢, 反应结束时(60 min)降解率才达到96.54%.按照式(5)进行拟合, 从拟合结果看可决系数均大于0.98, 符合一级动力学(图 4b插图).随着pH值的升高(pH=5、6、7、8、9、10), 各处理的kpH值增加, 分别为0.05599、0.06873、0.07824、0.08908、0.09816和0.16030 min-1.这是因为碱性条件下· OH氧化起主导作用(廖云燕等, 2014), 从而促进PBX降解.此外, 由式(3)可知, 溶液中会有少量H2O2产生, H2O2与hv254可以形成“hv254/H2O2”体系.该体系在碱性条件下有利于H2O2的分解产生· OH (张萌等, 2012), 这两个过程共同促进了PBX的降解.
3.2.3 初始PBX浓度的影响图 4c为不同初始浓度对PBX降解的影响.由图可知, 随着初始浓度的增加, 降解所需时间增加.PBX初始浓度为5和10 mg · L-1时, 仅需20 min就能降解完全, PBX初始浓度为15和25 mg · L-1时, 需要40 min才完成降解, 而初始浓度为45 mg · L-1时, 则需要60 min左右才能降解完全.按照式(5)进行拟合, 可决系数大于0.97, 符合一级动力学(图 4c插图).与kT和kpH不同的是, 反应速率常数kC随着PBX初始浓度(5、10、15、25、45 mg · L-1)的升高而降低, 分别为0.1776、0.1192、0.06417、0.05618和0.04173 min-1, 在“VUV-PBX”体系中, PBX降解过程中产生的中间产物会与PBX竞争消耗· OH, 且中间产物的浓度与PBX浓度正相关.同时, 随着污染物浓度的增加, 反应体系内稳态的· OH浓度下降.这两个原因降低了PBX的降解速率常数.
3.2.4 阴阳离子的影响浮选时, 为了达到分选的目的会加入石灰、水玻璃、硫酸、盐酸、氢氧化钠等试剂(张大超等, 2019a).因此, 为了模拟处理实际选矿废水, 引入Ca2+、CO32-、SiO32-、SO42-、Na+、Cl-这6种共存离子探讨PBX的降解效果, 共存离子对PBX降解的影响见图 4d.由图 4d可知, 各处理在反应前20 min PBX快速降解, 30 min左右降解逐渐趋于稳定, 此时PBX降解率排序为98.01%(SiO32-)>96.12%(CO32-)>95.37%(Na+和Cl-)>91.29%(CK)>88.06%(Ca2+)>87.29%(SO42-).按式(5)拟合, 可决系数大于0.98, 符合一级动力学(图 4d插图).各处理反应速率常数(kI, min-1)排序为0.11430(SiO32-)>0.09323(CO32-)>0.07277(Na+和Cl-)>0.07191(CK)>0.07049(SO42-)>0.05801(Ca2+).综上所述, SiO32-、CO32-促进PBX降解, Ca2+抑制PBX降解, SO42-和Cl-和Na+对PBX降解无明显影响.SiO32-、CO32-和Ca2+ 3种离子均是以盐溶液的形式加入, 其中, 钠盐是强碱弱酸盐, 而钙盐是强酸弱碱盐, 盐的加入影响了溶液pH, 进而影响了kI.虽然CO32-是· OH的猝灭剂, 从实验结果来看, pH的影响更大.另外, 有文献指出加入Ca2+会与污染物竞争消耗· OH(张大超等, 2019b).SO42-、Cl-和Na+对PBX降解无明显影响, 反应前30 min降解效果基本相同.
3.3 PBX降解动力学模型的建立VUV降解PBX的原理是紫外光解和· OH的共同作用.光解效率与光子数量和能量有关(孙玉洁等, 2018).在本研究中紫外灯统一规格, 光子数量和波长为定值, 根据光子理论可以认为光解效率一定.根据各影响因素的分析讨论, 反应温度(T)会影响PBX分子在水溶液中的活跃程度, 初始pH值会直接影响· OH的作用效果, 这两个因素直接影响了VUV降解PBX的过程.升高PBX初始浓度(C0)会增加中间产物浓度, 中间产物会与PBX竞争消耗· OH, 同时溶液中稳态· OH减少, 从而降低了PBX降解速率常数(k).共存的阴阳离子实际上是通过改变溶液pH或者竞争· OH的方式来影响PBX的降解速率常数.因此, PBX初始浓度(C0)和共存的阴阳离子主要是间接影响PBX的降解速率常数.经分析, 认为反应温度(T)和初始pH值是影响VUV降解PBX的关键环境因子.VUV降解PBX的过程符合一级动力学且拟合关系良好, R2>0.97, 相关参数见表 3.
| 表 3 VUV法降解PBX的一级动力学参数 Table 3 First-order kinetic parameters of degradation of PBX by VUV |
为更直观地体现反应温度(T)和初始pH对VUV降解PBX反应速率常数的影响, 根据幂函数经验模型的方法和阿伦尼乌斯方程建立PBX降解速率常数的动力学模型, 具体见式(7).基于表 3中的各参数对lnkZ ~1/T和lnkZ ~ ln[OH-]进行回归分析并计算式(8)中参数, 结果见图 5.由图 5可知, lnkZ ~ 1/T和lnkZ ~ ln[OH-]拟合后线性关系良好, R2分别为0.9863和0.9088.图 5a方程式的斜率(即-Ea/R)为-1083.2603, 截距为1.0601.图 5b方程式的斜率(即a)为-0.09234, 截距为-1.0971.用两个方程式的截距可计算出前因子A.通过计算, 得到Ea=9.01 kJ · mol-1, A=12.67, a=0.09234.将各参数代入式(7)得到式(9).
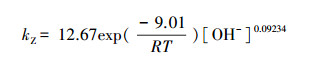
|
(9) |
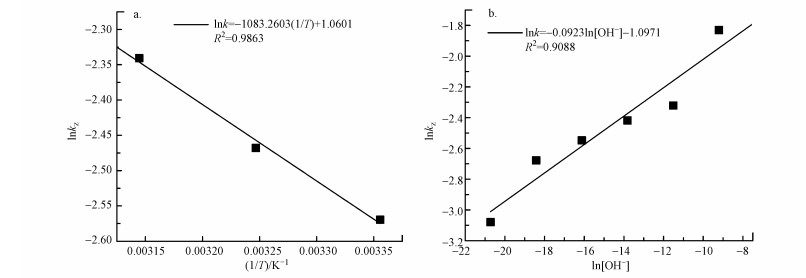 |
| 图 5 lnkZ与1/T和lnkZ与ln[OH-]的拟合曲线 Fig. 5 Fitting curves of lnkZ with 1/T and ln[OH-] |
将式(9)代入式(6), 得到PBX的降解动力学方程(10).
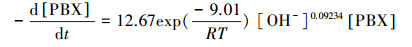
|
(10) |
该方程可以直观地反映温度(T)及初始pH对PBX降解速率的影响.在工程应用中可以通过检测初始PBX浓度、pH值和温度来预测PBX的降解趋势, 也可以通过改变温度和pH两个条件控制PBX的降解速率.
4 结论(Conclusions)1) 与常用的氧化剂和工艺方法相比, VUV辐照法降解PBX具有反应快速、操作简便、成本低廉等优点, 且降解过程中没有二次污染产生, 具有发展潜力.
2)“VUV-PBX”体系中, 反应温度、初始pH、初始PBX浓度和共存离子都会影响PBX降解速率常数.其中, 反应温度和初始pH的升高会促进PBX降解;提高PBX初始浓度会降低降解速率常数(kC);6种共存离子中, SiO32-和CO32-促进PBX降解, Ca2+抑制PBX降解, SO42-、Cl-和Na+对PBX降解无明显影响.从经济有效的角度综合考虑, 反应温度35 ℃、pH=8、合适的阴离子及其浓度有利于促进VUV辐照降解PBX.
3)“VUV-PBX”体系中, 反应温度和初始pH是影响PBX降解的关键因子.在一定的温度和pH范围内, VUV辐照法降解PBX的动力学模型方程为:
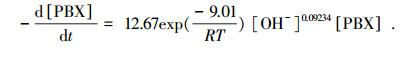
|
陈晓东, 刘红, 师伟, 等. 2010. 烃基黄药浮选捕收剂的光化学降解[J]. 武汉理工大学学报, 32(21): 27-30. |
曹学锋, 孟玮, 孙磊, 等. 2012. 臭氧-电催化联合氧化处理高浓度有机废水[J]. 有色金属(选矿部分), 64(3): 32-35, 43. |
Cui K, He Y, Jin S. 2016. Enhanced UV-visible response of bismuth subcarbonate nanowires for degradation of xanthate and photocatalytic reaction mechanism[J]. Chemosphere, 149: 245-253. DOI:10.1016/j.chemosphere.2016.01.111 |
Cao T, Xu T F, Zhao M N, et al. 2020. Application of vacuum-ultraviolet (VUV) for phenolic homologues removal in humic acid solution:Efficiency, pathway and DFT calculation[J]. Journal of Hazardous Materials: 392. DOI:10.1016/j.jhazmat.2019.121464 |
冯欣欣, 杜尔登, 郭迎庆, 等. 2015. UV/H2O2降解羟苯甲酮反应动力学及影响因素[J]. 环境科学, 36(6): 2129-2137. |
Fu P F, Feng J, Yang H F, et al. 2016. Degradation of sodium n-butyl xanthate by vacuum UV-ozone (VUV/O3) in comparison with ozone and VUV photolysis[J]. Process Safety and Environmental Protection, 102: 64-70. DOI:10.1016/j.psep.2016.02.010 |
Fu P F, Ma Y, Lei B L, et al. 2019a. Decomposition of refractory aniline aerofloat collector in aqueous solution by an ozone/vacuum-UV (O3/VUV) process[J]. Environmental Technology. DOI:10.1080/09593330.2019.1642389 |
Fu P F, Li G, Wu X, et al. 2019b. UV185+254 nm photolysis of typical thiol collectors:decomposition efficiency, mineralization and formation of sulfur byproducts[J]. Royal Society Open Science, 6(5). DOI:10.1098/rsos.190123 |
Fu P F, Wang L, Ma Y, et al. 2020. A comparative study on the degradation of ethyl xanthate collector by O3, UV254nm, UV185+254 nm, O3/UV254 nm and O3/UV185+254 nm processes[J]. Journal of Environmental Chemical Engineering, 8(1). DOI:10.1016/j.jece.2019.103628 |
García-Leiva B, Teixeira L A C, Torem M L. 2019. Degradation of xanthate in waters by hydrogen peroxide, fenton and simulated solar photo-fenton processes[J]. Journal of Materials Research and Technology, 8(6): 5698-5706. DOI:10.1016/j.jmrt.2019.09.037 |
Gonzalez M G, Oliveros E, Wörner M, et al. 2004. Vacuum-ultraviolet photolysis of aqueous reaction systems[J]. Journal of Photochemistry & Photobiology, C:Photochemistry Reviews, 5(3): 225-246. |
何江超, 许称红. 2017. 选矿废水中黄药的生化处理分析[J]. 中国金属通报, 30(7): 8-10. |
Imoberdorf G, Mohseni M. 2012. Kinetic study and modeling of the vacuum-UV photoinduced degradation of 2, 4-D[J]. Chemical Engineering Journal, 187: 114-122. DOI:10.1016/j.cej.2012.01.107 |
蒋文艳, 彭小敏, 张琳叶, 等. 2017. 高级氧化技术处理选矿废水中黄药的研究进展[J]. 金属矿山, 52(12): 123-129. |
刘超, 朱琦, 哈硕, 等. 2017. 国内黄药废水处理技术研究进展[J]. 工业水处理, 37(9): 1-5. |
李贞燕, 陈冰, 平静. 2014. 紫外光(UV)光解油田采出水中多环芳烃[J]. 环境工程学报, 8(6): 2267-2270. |
廖云燕, 刘国强, 赵力, 等. 2014. 利用热活化过硫酸盐技术去除阿特拉津[J]. 环境科学学报, 34(4): 931-937. |
Molina G C, Cayo C H, Rodrigues M A S, et al. 2013. Sodium isopropyl xanthate degradation by advanced oxidation processes[J]. Minerals Engineering, 45: 88-93. DOI:10.1016/j.mineng.2012.12.001 |
芮旻, 高乃云, 徐斌, 等. 2005. UV、H2O2、O3及其联用工艺对水中DMP的去除效果和降解机理分析[J]. 环境科学学报, 25(11): 29-35. |
孙玉洁, 李梦凯, 林佳星, 等. 2018. 基于细管流紫外反应系统探讨紫外和真空紫外/紫外辐照下水中微量磺胺甲噻二唑的光降解效果[J]. 环境科学学报, 38(5): 1851-1857. |
Shen Q, Zhang Y H, Fan Y J, et al 2019.Two-dimensional correlation analysis of continuous online in situ ATR-FTIR on the adsorption of heptyl xanthate at the surface of ZnS and Pb(Ⅱ) activated ZnS[J].Minerals Engineering, DOI: https://doi.org/10.1016/j.mineng.2019.106019
|
王琪, 杨博闻, 申哲民. 2018. 超临界水氧化降解有机物的定量构效关系研究[J]. 环境科学学报, 38(6): 2367-2373. |
徐承焱, 孙体昌, 邹安华, 等. 2016. 乙黄药自然降解的影响试验[J]. 现代矿业, 32(2): 44-49. |
徐劲, 孙水裕, 张萍, 等. 2005. Fenton试剂降解选矿废水中残余黄药[J]. 化工环保, 26(2): 125-127. |
杨归年. 2018. 选矿废水资源化处理现状研究[J]. 民营科技, 24(5): 77. |
Yan P, Chen G, Ye M, et al. 2016. Oxidation of potassium n-butyl xanthate with ozone:Products and pathways[J]. Journal of Cleaner Production, 139: 287-294. DOI:10.1016/j.jclepro.2016.08.027 |
张大超, 吴梦, 陈敏, 等. 2019a. VUV/O3降解选矿药剂酯-105的实验研究[J]. 水处理技术, 45(5): 77-81. |
张大超, 吴梦, 陈敏, 等. 2019b. VUV/O3降解选矿废水残留药剂实验探究[J]. 环境化学, 38(7): 1675-1682. |
张亨. 2012. 次氯酸钠稳定性研究进展[J]. 江苏氯碱, 31(5): 9-12. |
张萌, 田世烜, 张诚, 等. 2012. O3/H2O2法去除浮选药剂丁基黄药[J]. 环境工程学报, 6(3): 729-733. |
张萌, 柳建设. 2011. 臭氧氧化浮选药剂丁基黄原酸钾反应动力学研究[J]. 环境科学学报, 31(3): 511-517. |
张萌.2011.O3、O3/H2O2和UV/O3氧化技术降解浮选药剂丁基黄药的研究[D].上海: 东华大学.48-51
|
张乃东, 郑威. 2001. 羟自由基·OH在水处理中的应用[J]. 哈尔滨商业大学学报(自然科学版), 17(3): 22-24. |
张甫英. 1995. 浮选剂丁基黄原酸钠对草鱼早期发育阶段的毒性效应[J]. 水生生物学报, 41(2): 104-109. |
张振飞, 曾婷, 聂云妮, 等. 2018. 赣南地区选矿药剂自然光解及光催化降解特性[J]. 有色金属工程, 8(5): 50-56. |
Zhang Q, Wang L, Chen B, et al. 2020. Understanding and modeling the formation and transformation of hydrogen peroxide in water irradiated by 254 nm ultraviolet (UV) and 185 nm vacuum UV (VUV):Effects of pH and oxygen[J]. Chemosphere. DOI:10.1016/j.chemosphere.2019.125483 |
周相武, 汪晓军, 刘姣, 等. 2006. 次氯酸钠溶液的氧化性研究[J]. 氯碱工业, 42(8): 28-30. |
 2020, Vol. 40
2020, Vol. 40


