随着社会经济发展和人口数量增加, 餐厨垃圾和剩余污泥的产量也日益增加(Browne et al., 2013; Yang et al., 2015).厌氧发酵是一种能够有效实现有机废物资源化和能源化的生物反应过程(Li et al., 2018).餐厨垃圾通常水解速度较快, 在单独进行餐厨垃圾厌氧发酵过程中极易导致挥发性脂肪酸(VFAs)积累, 甲烷产量较低且不稳定(Zhang et al., 2017;Li et al., 2018).剩余污泥通常具有较低的C/N比, 同时在厌氧发酵过程中, 剩余污泥降解产生的氨氮(NH4+-N)能够形成较强的pH缓冲体系.相关研究表明, 与单独餐厨垃圾或剩余污泥厌氧发酵相比, 将二者进行厌氧混合发酵能够促使微生物发挥协同作用, 稳定厌氧发酵性能(Gou et al., 2014; Micolucci et al., 2014; Nghiem et al., 2017).
因各地饮食习惯不同, 餐厨垃圾中NaCl的浓度差异显著.餐厨垃圾中NaCl最高浓度有时超过12 g·L-1(Xiao et al., 2019).目前, 有关NaCl对餐厨垃圾单独发酵过程的影响已有较为深入的研究(Chen et al., 2008; Zhao et al., 2017).钠离子(Na+)是微生物细胞合成、生长和代谢的必需元素, 较低浓度的Na+(0.1~0.2 g·L-1)可促进酶反应活性, 维持细胞生物膜平衡, 调节微生物生长过程中的渗透压;较高浓度的Na+(3.5~5.5 g·L-1)可以提高渗透压, 分离微生物细胞浆, 同时降低代谢酶活性, 破坏微生物酶的结构, 抑制微生物活性, 导致甲烷产量下降甚至厌氧发酵系统崩溃(Chen et al., 2008).然而, 有关NaCl对于高负荷餐厨垃圾与剩余污泥混合发酵体系的研究鲜见报道.因此, 探究不同NaCl浓度对高负荷餐厨垃圾和剩余污泥厌氧混合发酵系统的影响, 对于高负荷混合发酵系统的高效稳定运行至关重要.此外, 多数研究都是探究NaCl对厌氧发酵过程的影响, 而对于其它类型钠盐的研究较少(Turcios et al., 2016; Zhao et al., 2016;Huang et al., 2019).然而, 在许多工业废水中(如食品加工业、发酵工业)会含有大量的硫酸盐.污泥作为一种良好的吸附剂, 其会吸附硫酸盐从而将硫酸盐引入污泥厌氧发酵体系中.在厌氧环境下, 硫酸盐还原菌(SRB)会与产甲烷菌竞争底物, 并且SRB竞争底物的能力要高于产甲烷菌.此外, SRB在利用底物的同时会产生H2S气体, 而该气体会抑制产甲烷菌的新陈代谢(Zeynep et al., 2019).
因此, 本研究以高负荷稳定运行的餐厨垃圾和剩余污泥中温混合发酵污泥为研究对象, 采用批次试验探究不同盐度和盐类型(CH3COONa、NaCl和Na2SO4)对高负荷混合厌氧发酵过程的影响, 进一步阐明Na+、Cl-和SO42-对高负荷混合发酵水解、酸化、乙酸化和产甲烷过程的抑制作用.
2 材料与方法(Materials and methods) 2.1 试验材料餐厨垃圾依据学生食堂餐厨垃圾进行人工模拟配制, 其中, 基质含有0.2%的食盐(基于湿重), 其余组分详见文献(Li et al., 2018).剩余污泥取自西安市第五污水处理厂.本研究餐厨垃圾与剩余污泥的混合比例为4:1(基于湿重)(Dai et al., 2013; Jang et al., 2016).试验所用混合发酵污泥为餐厨垃圾和剩余污泥中温厌氧完全混合式发酵系统(CSTR)排泥(袁宏林等, 2019).餐厨垃圾和剩余污泥混合发酵污泥收集于CSTR高有机负荷运行阶段.其中, 高有机负荷运行阶段混合发酵反应器的污泥停留时间为8.3 d, 有机负荷(OLR)为(14.46±0.27) g·L-1·d-1, 甲烷产率为(450±27) mL·g-1, 甲烷产量为(3.83±0.95) L·L-1·d-1.收集过程中, 将每天的排泥收集于室温条件下的闭口塑料桶内, 定期开口排气.开展试验前充分混匀后, 测定排泥主要理化指标及餐厨垃圾和剩余污泥混合基质的主要理化特性详见表 1.
| 表 1 高负荷餐厨垃圾和剩余污泥厌氧混合发酵系统排泥和混合基质的理化特性 Table 1 Physico-chemical properties of the seed sludge and feedstock |
首先在120 mL血清瓶内添加50 mL高负荷餐厨垃圾和剩余污泥混合发酵系统排泥, 然后按照高负荷排泥收集期间最高负荷((14.46±0.27) g·L-1·d-1), 添加等负荷混合基质.设定NaCl、Na2SO4和CH3COONa 3种钠盐中Na+均为1、2、4、6和8 g·L-1, 然后加入对应质量的NaCl、Na2SO4和CH3COONa, 迅速摇晃血清瓶, 使其快速均匀分散, 避免局部抑制.同时设置空白对照组, 除不添加钠盐外, 其他操作与试验组等同.试验组和空白组均设置2组平行.血清瓶用N2吹脱2~5 min, 以保持厌氧环境, 橡胶塞封瓶后放入37 ℃摇床内, 2 min后放气以排除受热膨胀的气体.定时采用50 mL和400 μL注射器进行取样测量气组和气量.
2.3 测定项目及分析方法总固体浓度(TS)、挥发性有机物浓度(VS)、化学需氧量(CODCr)、氨氮(NH4+-N)和碱度的测定采用标准方法(APHA, 2005);pH采用便携式pH计(Horiba, 日本)测定;蛋白质和多糖分别采用Folin-酚试剂法(Lowry, 1951)和硫酸-蒽酮法(Dubois, 1956)测定.CH4、CO2、N2和H2采用气相色谱(GC-PE680, 美国)测定, 填充色谱柱固定相(Porapak Q)进样口温度为130 ℃, 柱温箱温度为140 ℃, TCD温度为160 ℃, 载气为氩气, 流速4 mL·min-1;挥发性脂肪酸(VFAs)采用气相色谱(GC-Shimadzu2014, 日本)测定, 色谱柱为DB-FFAP, FID检测器温度为230 ℃, 进样口温度为200 ℃, 程序升温至100 ℃保持2 min, 以10 ℃·min-1的速率上升到120 ℃并保持2 min, 再以5 ℃·min-1的速率上升到200 ℃并保持2 min.气量采用50 mL注射器测定, 以柱塞鼓起高度为准.厌氧发酵过程中相应的水解速率、酸化速率、乙酸化速率和产甲烷速率依据Li等(2017)的方法计算.利用Illumina MiSeq平台进行微生物高通量测序, 具体步骤详见文献(时红蕾等, 2018).
3 结果和讨论(Results and discussion) 3.1 甲烷产量的变化 3.1.1 不同钠盐对混合发酵体系的影响不同类型钠盐对甲烷累积产量的影响如图 1所示.由不同浓度CH3COONa对甲烷累积产量的影响可知(图 1a), 随着CH3COONa浓度的升高, 甲烷累积产量也随之升高, 这是因为产甲烷菌可以利用乙酸盐类物质进行新陈代谢(Xiao et al., 2019).由图 1b~1c可知, 随着NaCl和Na2SO4浓度的升高甲烷累积产量均出现降低趋势, 且在相同Na+条件下, 二者甲烷累积产量分别降低1.8%~17.8%和16.6%~52.7%.由此可见, 在3种钠盐中, Na2SO4对产甲烷菌具有更大的抑制作用.
 |
| 图 1 不同钠盐对于甲烷累积产量的影响(a.CH3COONa;b.Na2SO4;c.NaCl;d.比产甲烷活性) Fig. 1 Effects of CH3COONa (a), Na2SO4 (b), NaCl (c) and SMA (d) on cumulative methane production |
图 2a为添加CH3COONa后理论甲烷产量与实际甲烷产量.由于乙酸根易被产甲烷菌所利用, 故体系内会产生Na+积累, 从而可以间接探讨Na+对于产甲烷菌的影响.图 2a和表 2结果表明, 当Na+浓度较低时(< 2 g·L-1), 其抑制率为5.4%, 这可能与污泥未经驯化有关.雷中方等(2000)研究表明, 当Na+浓度为0.5~2 g·L-1时, 未经驯化的微生物会受到轻微抑制;当Na+浓度提高至2 g·L-1和4 g·L-1时, 其对于甲烷产量具有促进作用;随着Na+浓度的继续提高, 其对甲烷产量会产生更大程度的抑制.这一结果与图 1d结果一致.由此说明, 当Na+浓度高于6 g·L-1时, 其会对产甲烷菌产生抑制作用;当Na+浓度为8 g·L-1时, 其抑制率为21%.然而Chen等(2008)研究表明, 在中温发酵体系中, Na+浓度为8 g·L-1时会严重抑制产甲烷菌.由此可知, 在餐厨垃圾与剩余污泥混合发酵体系中, 产甲烷菌具有更高的Na+耐受潜力.
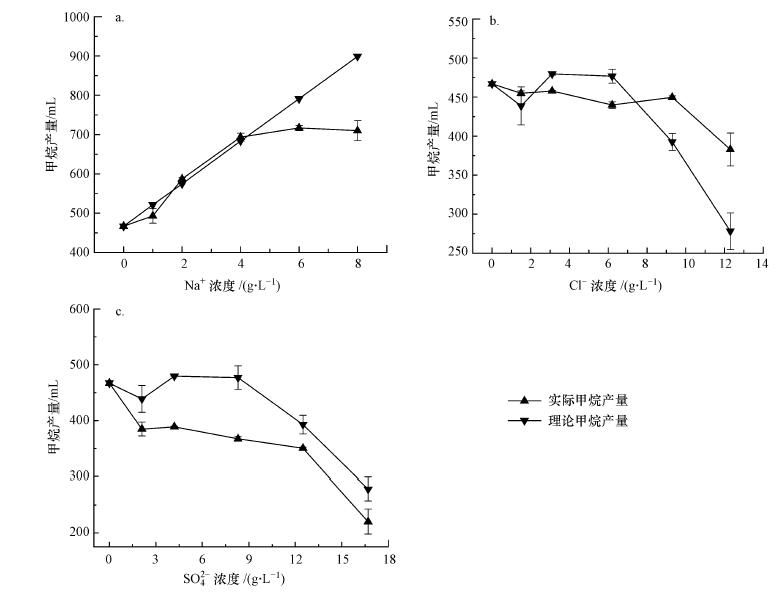 |
| 图 2 不同离子的理论甲烷产量和实际甲烷产量(a.Na+;b.Cl-;c.SO42-) Fig. 2 Theorical and actual methane production under different Na+ (a), Cl- (b) and SO42- (c) concentration |
| 表 2 不同离子浓度对甲烷产率的抑制率/促进率 Table 2 Inhibition/promoting rates of different ion concentrations on methane yield |
图 2b为添加NaCl后实际甲烷产量与消除Na+影响后的理论甲烷产量.由图 2b可知, 在低浓度时(Cl-浓度为1.5 g·L-1), 其对甲烷产量具有一定的促进作用.然而, 随着Cl-浓度提高至3.1 g·L-1和6.2 g·L-1, 其对产甲烷菌逐渐具有一定程度的抑制作用, 相应的抑制率见表 2.由于Cl-不参加生化反应, 随着浓度的增加, Cl-逐渐积累并提高渗透压使细胞脱水;随着Cl-浓度的继续提高, 其对甲烷产量从抑制状态变为促进状态.相似的, 兰天等(2008)研究表明, 当Cl-浓度达到5 g·L-1时, COD去除率开始逐渐下降, 但随着时间的延长, COD去除率又逐渐回升.
图 2c为添加Na2SO4后实际甲烷产量与消除Na+影响后的理论甲烷产量.在厌氧条件下, SRB会和产甲烷菌竞争底物(如乙酸盐), 导致产甲烷活性降低.COD/SO42-是影响SRB与其他厌氧消化过程中微生物竞争关系的重要参数(Hu et al., 2015).理论上, 当COD/SO42-小于0.67时, 表明有机物不足, 无法将硫酸盐完全还原;COD/SO42-值越大, 其越有利于产甲烷.Euiso和Jay (1991)研究表明, 当COD/SO42-大于2.7时, 产甲烷古菌占主导地位;当COD/SO42-小于1.7时, SRB占主导地位.Caroline和Emer(2006)研究表明, 在COD/SO42-为2~16时, SRB无法与产甲烷古菌竞争.如表 2所示, 批次试验中COD/SO42-均大于2.因此, SRB并不占主导地位, 反硫化作用不是产生抑制的主要原因, 抑制作用主要是由SO42-所致.高通量结果也表明, 在该体系内仅存在少量的SRB, 其丰度占比非常低.其中, Desulfobulbus和Desulfomicrobium菌属丰度分别为0.09%和0.02%.当SO42-浓度低于8.3 g·L-1时, 抑制率随着其浓度的升高而增大, 最高可达23%.然而随着SO42-的继续提升, 抑制率相对出现降低的趋势.
3.2 不同钠盐对有机物去除率的影响COD去除率可表征微生物对有机物的利用情况.不同类型钠盐及浓度对COD去除率的影响如图 3所示.图 3a为加入CH3COONa后总有机物(TCOD)的变化情况, 其呈现先降低后升高最后再降低的趋势, 这一结果与图 1d和图 2a结果一致.图 3c为加入Na2SO4后TCOD的变化情况, 其呈现急剧降低的趋势, 与前述结果一致.图 3e为加入NaCl后TOCD的变化情况, 由图可知, 加入NaCl能够促进有机物的去除.如图 3b和3f所示, CH3COONa和NaCl对应的可溶性有机物(SCOD)去除率变化趋势基本吻合, 进一步表明NaCl对混合发酵体系的影响主要来源于Na+.图 3d所示为Na2SO4对SCOD的影响, 可知Na2SO4会严重抑制SCOD的去除.因此, 对于餐厨垃圾与剩余污泥混合发酵体系, SO42-的引入更不利于有机物的去除.
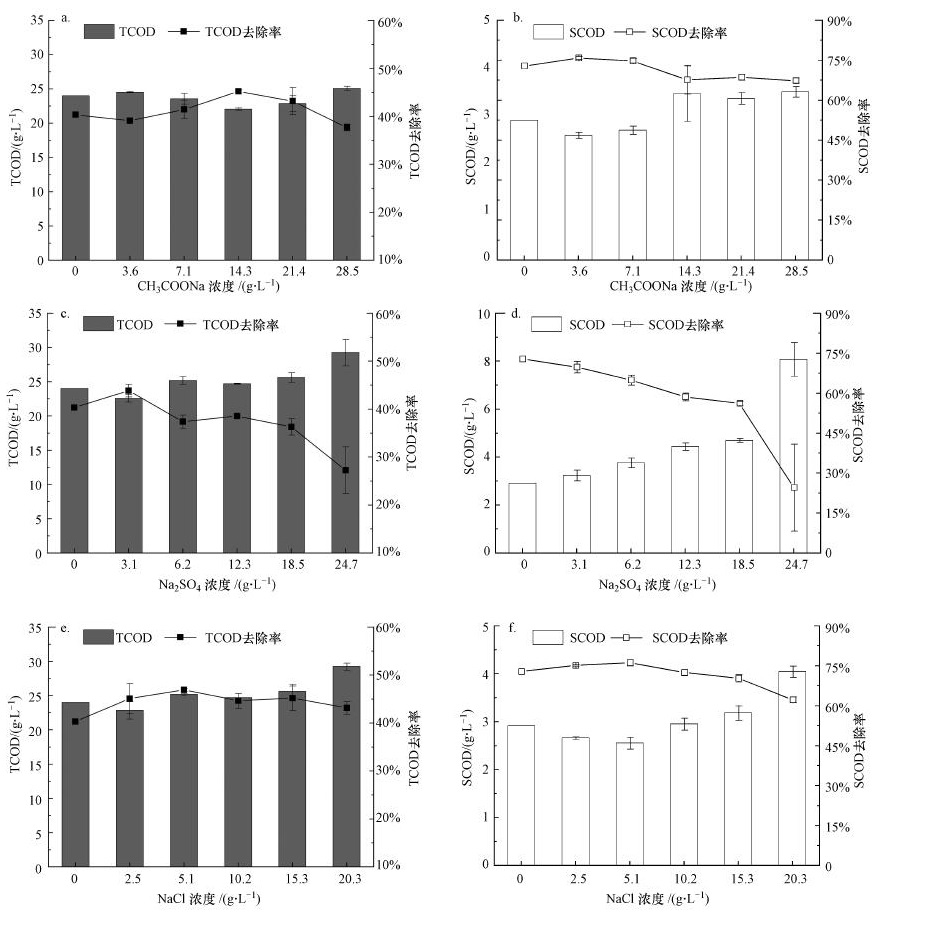 |
| 图 3 不同浓度钠盐(a, b.CH3COONa;c, d.Na2SO4;e, f.NaCl)对TCOD和SCOD去除率的影响 Fig. 3 Effects of CH3COONa(a, b), Na2SO4(c, d) and NaCl(e, f) on TCOD and SCOD removal rate |
不同钠盐所对应的COD物料平衡如图 4所示, 其中, SCOD与颗粒态有机物(PCOD)之和为TCOD.由图可知, 随着Na+浓度提高, CH3COONa出料中相应的甲烷占比分别为50.7%、55.9%、61.4%、61.2%和58.4%;Na2SO4和NaCl出料中甲烷占比逐渐减少, 最低分别为27.9%和33.2%.相比于对照组的50%, Na2SO4和NaCl对应的甲烷占比降低.随着Na2SO4和NaCl浓度的逐步提高, 甲烷占比呈现降低趋势, 说明Na2SO4和NaCl均会抑制产甲烷菌.对于SCOD而言, 相较于对照组6.1%的SCOD占比, 加入Na2SO4和NaCl后SCOD占比逐渐提高, 二者均出现SCOD积累的现象, 说明较高浓度的钠盐可以促进混合基质的水解过程.
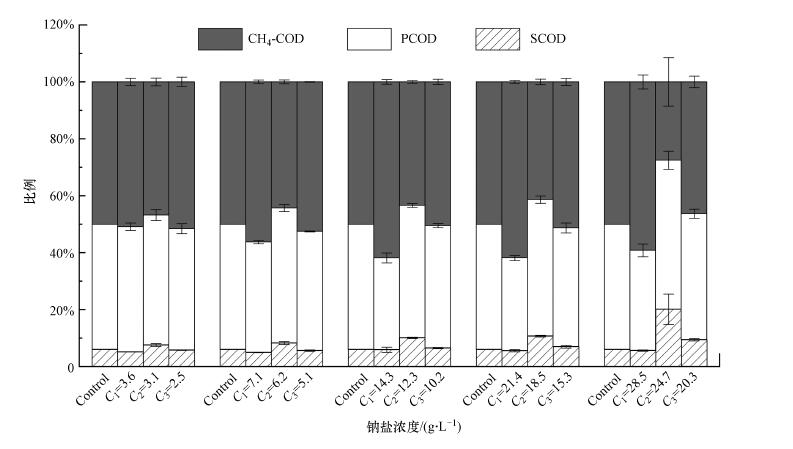 |
| 图 4 不同钠盐浓度下COD平衡(C1、C2、C3分别表示CH3COONa、Na2SO4、NaCl浓度) Fig. 4 COD mass balances at different concentration of sodium salts |
挥发性脂肪酸(VFAs)是厌氧发酵过程中重要的中间产物, 同时也是判断厌氧发酵系统稳定运行的重要参数.盐度会影响VFAs的产生(Zhao et al., 2017).图 5为不同钠盐及浓度对VFAs浓度(以COD计)的影响.如图 5 a所示, 加入CH3COONa试验组与空白组相比, 乙酸浓度呈现逐渐升高的趋势且乙酸是VFAs的主要成分, 由此可知, 乙酸代谢途径被抑制.此外, 在Na+浓度大于2 g·L-1时开始出现戊酸, 而戊酸不利于产甲烷菌的生长.当CH3COONa浓度为21.4 g·L-1时, 出料VFAs达到最大值, 这是因为在该浓度下酸化速率和乙酸化速率均达到最大值(分别为99.8%和96.2%, 图 6).同时, 该浓度对应的酸化速率和乙酸化速率的促进率达到最大.随着CH3COONa浓度的升高至28.5 g·L-1, VFAs浓度较21.4 g·L-1时降低了58.0%, 这与酸化速率、乙酸化速率降低且与甲烷化速率接近有关(分别为94.2%、92.6%和91.0%).图 5b和图 5c分别为加入Na2SO4和NaCl试验组的VFAs变化情况.其中, 当Na2SO4浓度不大于18.5 g·L-1时, VFAs浓度与对照组差异性较小.然而随着Na2SO4浓度的进一步升高, 乙酸、丁酸和戊酸的浓度出现了大幅度上升, 由此表明, 高浓度Na2SO4会促进VFA积累, 这与酸化速率、乙酸化速率和甲烷化速率之间不平衡有关(表 3).在加入NaCl后, 乙酸浓度均不同程度的增加, 然而丁酸和丙酸浓度呈现先升高后降低的趋势.由此表明, 当NaCl浓度为2.5 g·L-1时, 能够促进产丙酸和丁酸途径, 随着NaCl浓度的提高, 产丁酸和丙酸途径逐渐被抑制.在NaCl浓度为2.5 g·L-1时VFAs累积量达到最大值, 这是因为酸化速率加强, 而甲烷化速率降低(表 3).由此说明, 当Na+浓度为1 g·L-1时, 对于酸化速率具有促进作用.随着NaCl浓度的升高, VFAs积累量呈现先降低后升高的趋势, 这与酸化速率、乙酸化速率和甲烷化速率之间的相对大小有关(表 3).
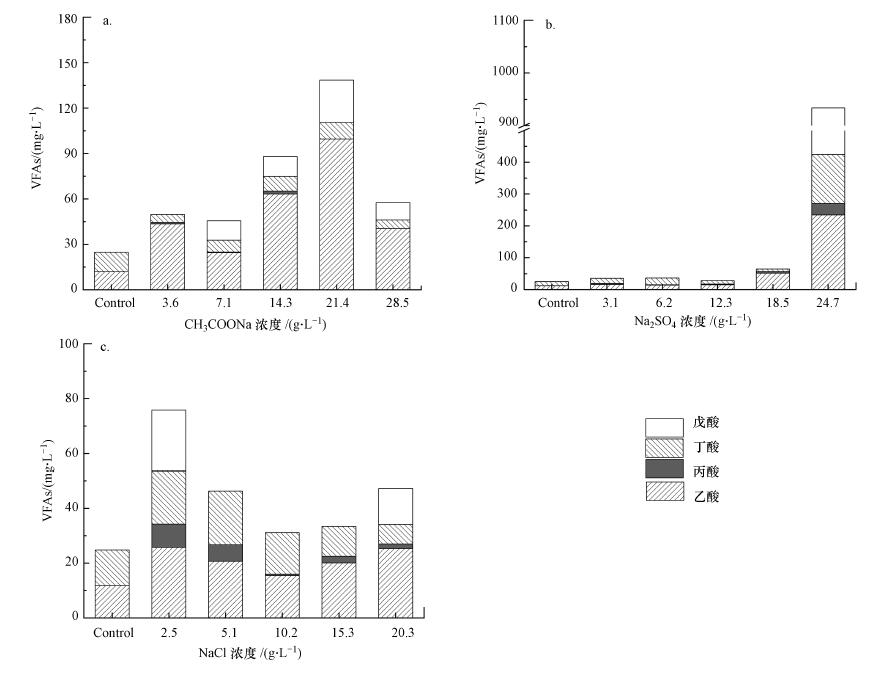 |
| 图 5 不同浓度钠盐对VFAs的影响(a.乙酸钠;b.硫酸钠;c.氯化钠) Fig. 5 Effects of CH3COONa (a), Na2SO4 (b) and NaCl (c) on VFAs |
| 表 3 不同钠盐对于4个步骤反应速率的抑制率/促进率 Table 3 The inhibition/promoting rate of different sodium salts to the reaction rate of the four steps |
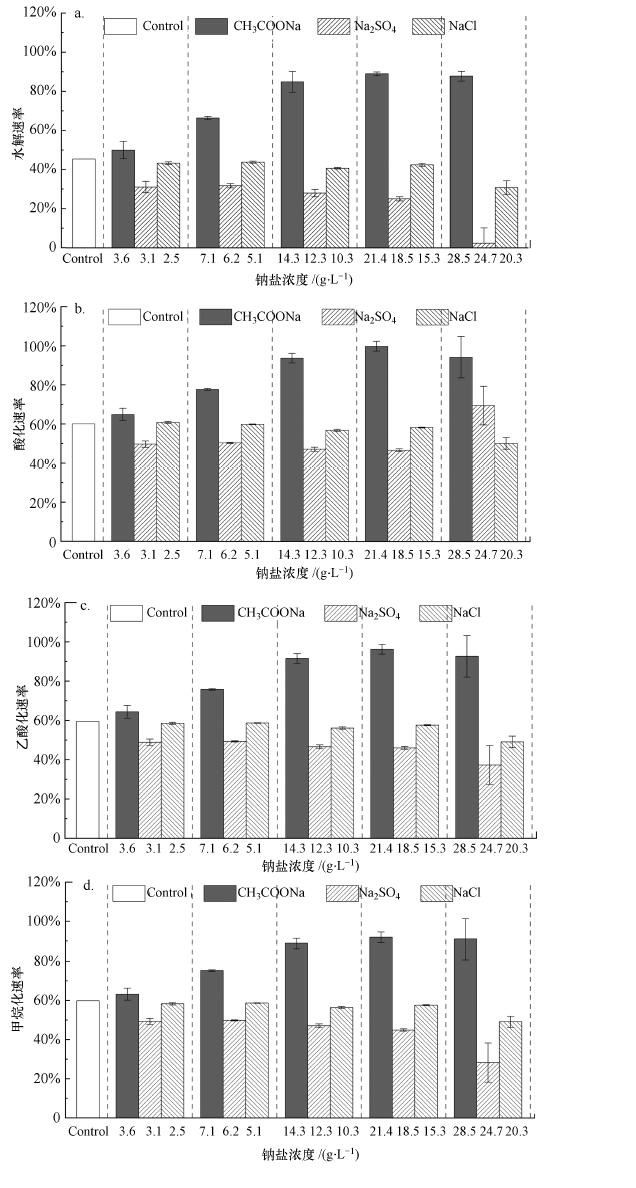 |
| 图 6 不同钠盐对厌氧消化4个步骤反应速率的影响(a.水解速率;b.酸化速率;c.乙酸化速率;d.甲烷化速率) Fig. 6 Effects of different sodium salts and concentrations on hydrolysis(a), acidogenesis(b), acetogenesis(c) and methangenesis(d) reaction rates of anaerobic digestion |
厌氧发酵过程主要包括水解阶段、酸化阶段、乙酸化阶段和产甲烷阶段(Xiao et al., 2018).不同类型钠盐对上述4个步骤反应速率的影响如图 6所示.由图可知, 随着CH3COONa浓度逐渐增加, 水解、酸化、乙酸化及产甲烷速率均呈现先升高后降低的趋势, 这与图 1a、图 1d和图 5a的结果相一致, 然而仍均高于对照组.表 3结果表明, 加入CH3COONa后, 随着浓度的不断提高, 其对水解速率具有很明显的促进作用(最大达到96.0%), 这与反应体系内微生物所能利用的基质增多有关, 此时CH3COONa浓度达到21.4 g·L-1.然而, 当CH3COONa达到最大浓度28.5 g·L-1, 亦即Na+浓度为8 g·L-1时, 促进率均出现降低, 这是因为没有出料排出, 导致反应体系内Na+积累较多.与CH3COONa相比, NaCl和Na2SO4对4个速率均具有抑制作用, 特别是Na2SO4的抑制作用尤其明显.如图 6和表 3所示, 在相同Na+浓度下, 加入Na2SO4的试验组抑制率均高于NaCl试验组, 主要是由于SO42-的抑制作用.在Na2SO4浓度为24.7 g·L-1时, 其对酸化速率却具有15.6%的促进率(表 3), 与图 5b较高的VFAs累积结果一致.此外, 由表 3可知, Na2SO4和NaCl对4个速率的影响作用一致:对于水解阶段的抑制作用最大, 其次是甲烷化阶段, 再次是乙酸化阶段, 而对酸化阶段的抑制作用最小.由于4个步骤同时进行, 彼此相互影响.因此, 为进一步明确盐度对上述4个步骤速率的抑制作用, 需要将4个步骤分开后进一步探究.
4 结论(Conclusions)1) NaCl和Na2SO4对甲烷累积产量具有抑制作用, 而不同浓度CH3COONa对甲烷产量均具有促进作用, 然而在高浓度时, 促进作用降低.相同Na+浓度时, Na2SO4产生的抑制更大.当NaCl和Na2SO4浓度分别为20.3 g·L-1和24.7 g·L-1时, 对高负荷餐厨垃圾和剩余污泥混合发酵系统的甲烷累积产量抑制率分别为17.8%和52.7%.其中, NaCl的抑制作用主要是由于Na+的作用, Na2SO4的抑制作用主要来源于SO42-和Na+的协同作用.
2) 随着Na+浓度的升高, 其对SCOD的去除率呈现先升高后降低的趋势.当Na+浓度小于2 g·L-1时, 会促进SCOD的去除, 但随着浓度持续提高, 会抑制SCOD的去除.而Na2SO4由于SO42-和Na+的协同作用, SCOD去除率呈现更大的抑制.
3) 当NaCl浓度为2.5 g·L-1, 即Na+浓度为1 g·L-1时, 会促进酸化, 导致VFA积累量达到最大值, 但随着NaCl浓度继续提高, 4个步骤速率不平衡, 导致VFAs呈现先下降后升高的趋势.然而, Na2SO4浓度低于18.5 g·L-1时, VFAs无累积现象.Na2SO4浓度为24.7 g·L-1时, VFAs积累量突然升高, 主要是由于乙酸化和甲烷化速率降低的同时酸化速率升高导致.
AP HA. 2005. Standard Methods for the Examination of Water and Wastewater[M]. Washington, DC: American Public Health Association.
|
Browne J D, Murphy J D. 2013. Assessment of the resource associated with biomethane from food waste[J]. Applied Energy, 104: 170-177. DOI:10.1016/j.apenergy.2012.11.017 |
Chen Y, Cheng J J, Creamer K S. 2008. Inhibition of anaerobic digestion process:a review[J]. Bioresource Technology, 99(10): 4044-4064. DOI:10.1016/j.biortech.2007.01.057 |
Caroline O, Emer C. 2006. Effect of influent COD/SO42- ratios on mesophilic anaerobic reactor biomass populations:Physico-chemical and microbiological properties[J]. Fems Microbiology Ecology, 56(1): 141-153. DOI:10.1111/j.1574-6941.2006.00066.x |
Dai X, Duan N, Dong B, et al. 2013. High-solids anaerobic co-digestion of sewage sludge and food waste in comparison with mono digestions:stability and performance[J]. Waste Management, 33(2): 308-316. DOI:10.1016/j.wasman.2012.10.018 |
Dubois M, Gilles K A, Hamilton J K, et al. 1956. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 28(3): 350-356. DOI:10.1021/ac60111a017 |
Euiso C, Jay M R. 1991. Competition and inhibition of sulfate reducers and methane producers in anaerobic treatment[J]. Water Science and Technology, 23(7/9): 1259-1264. |
Gou C, Yang Z, Huang J, et al. 2014. Effects of temperature and organic loading rate on the performance and microbial community of anaerobic co-digestion of waste activated sludge and food waste[J]. Chemosphere, 105: 146-151. DOI:10.1016/j.chemosphere.2014.01.018 |
Huang L, Fu X Z, Cui S, et al. 2019. Intracellular polymers production in anaerobic sludge under salt shock and batch fermentation conditions:Experimental and modelling study[J]. Biochemical Engineering Journal, 142: 68-73. DOI:10.1016/j.bej.2018.11.013 |
Hu Y, Jing Z, Sudo Y, et al. 2015. Effect of influent COD/SO42- ratios on UASB treatment of a synthetic sulfate-containing wastewater[J]. Chemosphere, 130: 24-33. DOI:10.1016/j.chemosphere.2015.02.019 |
Jang H M, Ha J H, Kim M S, et al. 2016. Effect of increased load of high-strength food wastewater in thermophilic and mesopheic anaerobic co-digestion of waste activated sludge on bacterial community structure[J]. Water Research, 99: 140-148. DOI:10.1016/j.watres.2016.04.051 |
Li Q, Yuwen C, Cheng X, et al. 2018. Responses of microbial capacity and community on the performance of mesophilic co-digestion of food waste and waste activated sludge in a high-frequency feeding CSTR[J]. Bioresource Technology, 260: 85-94. DOI:10.1016/j.biortech.2018.03.087 |
Li L, Peng X, Wang X, et al. 2018. Anaerobic digestion of food waste:A review focusing on process stability[J]. Bioresource Technology, 248: 20-28. DOI:10.1016/j.biortech.2017.07.012 |
Lowry O H, Rosebrough N J, Farr a L, et al. 1951. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 193(1): 265-275. |
Li Q, Li H, Wang G, et al. 2017. Effects of loading rate and temperature on anaerobic co-digestion of food waste and waste activated sludge in a high frequency feeding system, looking in particular at stability and efficiency[J]. Bioresource Technology, 237: 231-239. DOI:10.1016/j.biortech.2017.02.045 |
雷中方. 2000. 高浓度钠盐对废水生物处理系统的失稳影响综述[J]. 工业水处理, (4): 6-10. |
兰天, 李东伟, 高先萍. 2008. 高氯离子味精尾母液废水厌氧处理研究[J]. 环境工程学报, 2(8): 1074-1077. |
Micolucci F, Gottardo M, Bolzonella D, et al. 2014. Automatic process control for stable bio-hythane production in two-phase thermophilic anaerobic digestion of food waste[J]. International Journal of Hydrogen Energy, 39(31): 17563-17572. DOI:10.1016/j.ijhydene.2014.08.136 |
Nghiem L D, Koch K, Bolzonella D, et al. 2017. Full scale co-digestion of wastewater sludge and food waste:Bottlenecks and possibilities[J]. Renewable and Sustainable Energy Reviews, 72: 354-362. DOI:10.1016/j.rser.2017.01.062 |
时红蕾, 王晓昌, 李倩, 等. 2018. 四环素对人粪便好氧堆肥过程及微生物群落演替的影响[J]. 环境科学, 39(6): 2810-2818. |
Turcios A E, Weichgrebe D, Papenbrock J. 2016. Effect of salt and sodium concentration on the anaerobic methanisation of the halophyte tripolium pannonicum[J]. Biomass and Bioenergy, 87: 69-77. DOI:10.1016/j.biombioe.2016.01.013 |
Xiao L, Sun R, Zhang P, et al. 2019. Simultaneous intensification of direct acetate cleavage and CO2 reduction to generate methane by bioaugmentation and increased electron transfer[J]. Chemical Engineering Journal, 378: 122229. DOI:10.1016/j.cej.2019.122229 |
Xiao B, Qin Y, Zhang W, et al. 2018. Temperature-phased anaerobic digestion of food waste:A comparison with single-stage digestions based on performance and energy balance[J]. Bioresource Technology, 249: 826-834. DOI:10.1016/j.biortech.2017.10.084 |
Yang G, Zhang G, Wang H. 2015. Current state of sludge production, management, treatment and disposal in China[J]. Water Research, 78: 60-73. DOI:10.1016/j.watres.2015.04.002 |
袁宏林, 马静, 邢保山, 等. 2019. 污泥停留时间对餐厨垃圾与剩余污泥中温厌氧混合发酵系统的影响[J]. 环境科学, 40(2): 994-1002. |
Zhang J, Li W, Lee J, et al. 2017. Enhancement of biogas production in anaerobic co-digestion of food waste and waste activated sludge by biological co-pretreatment[J]. Energy, 137: 479-486. DOI:10.1016/j.energy.2017.02.163 |
Zhao J, Liu Y, Wang D, et al. 2017. Potential impact of salinity on methane production from food waste anaerobic digestion[J]. Waste Management, 67: 308-314. DOI:10.1016/j.wasman.2017.05.016 |
Zhao J, Zhang C, Wang D, et al. 2016. Revealing the underlying mechanisms of how sodium chloride affects short-chain fatty acid production from the cofermentation of waste activated sludge and food waste[J]. ACS Sustainable Chemistry and Engineering, 4(9): 4675-4684. DOI:10.1021/acssuschemeng.6b00816 |
Zeynep C, Jan D, Jessica T, et al. 2019. COD/sulfate ratio does not affect the methane yield and microbial diversity in anaerobic digesters[J]. Water Research, 155: 444-454. DOI:10.1016/j.watres.2019.02.038 |
 2020, Vol. 40
2020, Vol. 40


