2. 陕西省地质矿产实验研究所有限公司, 国土资源部西安矿产资源监督检测中心, 西安 710054
2. Xi'an Testing and Quality Supervision Center for Geological and Mineral Products, Ministry of Land and Resources, Shaanxi Institute of Geology and Mineral Resources Experiment Co., Ltd., Xi'an 710054
目前, 工矿业在发展的过程中, 由于前期粗放式的开采和不合理的利用, 对周边土壤造成了严重的破坏.重金属污染是金属矿山主要的污染特点, 人们在开采过程中虽然提高了对主要开采元素的生态治理, 但未成矿伴生元素的污染却存在一定的隐蔽性.这些污染伴生元素对植物的生理生化参数及生物量的影响作用, 以及其在有益元素作用下在植物体内的转运迁移等已有大量研究(Huang et al., 2009;Wan et al., 2016;Camara et al., 2018;Handa et al., 2018;郭悦等, 2019).
中国是世界上钼矿资源最为丰富的国家之一, 钼矿中钼元素的含量很低, 一般不到0.5%, 且常与多种污染元素伴生, 如铅、镉、砷、铜等(Xu et al., 2012).在钼矿开采过程中, 由于粗放的开采模式会造成钼矿土壤周边遭受伴生元素污染, 镉作为钼矿主要的伴生污染元素之一, 其对钼矿区土壤的污染作用不容忽视.目前, 有关镉元素的污染特性及其与其他重金属的交互作用在大米、小麦、油菜等植物中多有研究(Wang et al., 2006;Filek et al., 2010;Li et al., 2018;Wu et al., 2019;Kaya et al., 2020).有学者认为镉对植物的危害主要是由于其有效性形态进入植物造成的(Chunilall et al., 2004), 在植物体内, 镉主要结合于细胞壁处, 在叶绿体和线粒体中的分布相对较少, 因此, 镉胁迫下油菜的根尖细胞壁结构容易遭受镉的破坏, 造成油菜根系变短(Ali et al., 2014), 并抑制油菜的生长, 造成叶片叶绿素含量降低, 光合能力减弱(Filek et al., 2010), 抗氧化系统遭到破坏, 激素水平紊乱(Wu et al., 2015;Yan et al., 2016), 从而造成油菜生物量和产量严重下降(Zhang et al., 2017).硒、锌等作用下镉对油菜的胁迫危害的缓解效应也有报道, 研究认为硒、锌等主要通过拮抗吸收和调节植物体内生理参数来缓解镉胁迫(Filek et al., 2008;Li et al., 2014).钼矿区土壤中镉和钼经常会伴生出现, 钼对人体及动植物均为必须的有益微量元素(Rollinson et al., 1975;Zhou et al., 2016).目前研究多集中于油菜对钼的吸收及钼在植物体内硝酸盐转化酶的合成方面(Balík et al., 2006;Ide et al., 2011;Qin et al., 2017), 而对于钼矿周边污染土壤中钼与镉的交互作用及钼缓解镉对油菜的胁迫作用还未见报道.
因此, 本文采用盆栽试验模拟镉污染土壤条件下油菜生长, 通过加入不同浓度的外源钼, 研究钼对镉胁迫下油菜生长、生理生态特性及其对油菜吸收转运镉元素的影响, 以探明钼对植物镉毒害的缓解作用的机理和寻求最佳缓解浓度, 为外源钼缓解镉胁迫对植物造成毒害的机理研究提供理论依据, 同时为研究钼矿区镉污染机理提供科学保障.
2 材料与方法(Material and methods) 2.1 盆栽土壤供试土壤为黄棕壤, 采自陕西省洛南县黄龙铺钼矿区周边受矿区影响较小的区域, 以多点取样法采集耕层(0~20 cm)土壤, 将土壤混合后备用.土壤基本理化性状为:pH为7.13, 阳离子交换量(CEC)为13.2 cmol·kg-1, 有机质含量为15.2 g·kg-1, 全氮含量为857 g·kg-1, 全钼含量为0.35 mg·kg-1, 有效钼含量为0.076 mg·kg-1, 全镉含量为0.24 mg·kg-1, 有效镉含量为0.025 mg·kg-1.试验用土壤经自然风干, 过4.0 mm筛, 装入聚乙烯塑料盆(40 cm×20 cm×20 cm)中, 每盆装土20 kg.试验期间用去离子水从底部灌溉, 视天气情况调节土壤水分.所有处理每隔2 d调控pH值在6.5~7.5之间使其保持一致性.
2.2 实验设计盆栽试验在陕西省地质矿产实验研究所试验场进行, 试验根据典型钼矿区钼、镉两种金属元素含量范围进行设计.本次盆栽试验根据前期对陕西某钼矿区钼和镉含量范围的研究结果, 共设置12个处理(表 1), 重复3次.外源施加的钼、镉分别以氯化镉(CdCl2, A.R.)和钼酸铵(NH4MoO3, A.R.)水溶液的形式单独均匀地喷洒在实验用土壤中, 通过计算, 使加入的总钼和总镉含量如表 1所示.然后搅拌使试剂与土壤使其完全均匀混合, 装入塑料盆中, 放置在试验场平衡2周以上.供试油菜品种为当地普遍种植的秦杂油1号, 购自黄龙铺种子销售中心.将油菜籽(Zaqin Rape No.1)消毒后进行盆栽种植, 每盆撒种20粒, 出苗后及时疏苗, 保留生长最好的油菜苗, 每盆定苗6株.80 d后取样, 测定各项指标.
| 表 1 试验设计 Table 1 Design of the experiment |
将油菜按照不同处理及平行整株采集整盆样品, 先用自来水冲洗, 然后用0.02 mol·L-1 EDTA-2Na盐溶液浸泡15~20 min, 再用去离子水冲洗干净后备用.
2.3.1 油菜生理参数及生物量测定油菜植株叶片叶绿素a(Chlorophyll a, Chla)和叶绿素b(Chlorophyll b, Chlb)用乙醇-丙酮提取测定(Riemann et al., 2006);油菜中丙二醛(Malondialdehyde, MDA)采用双组分光光度法测定(Li et al., 2016);可溶性蛋白(Soluble protein, SP)用考马斯亮蓝比色法测定(邓丽莉等, 2012);超氧化物歧化酶(Superoxide Dismutase, SOD)活性用氮蓝四唑法测定(Cui et al., 2015);谷胱甘肽过氧化物酶(Glutathione Peroxidase, GPX)活性用愈创木酚法测定(Bela et al., 2015);叶片中的可溶性糖(Soluble sugar, SS)用蒽酮比色法测定(李合生, 2000);游离脯氨酸(Proline, Pro)用酸性茚三酮比色法测定(高俊凤, 2006).
分别按地下、地上部分测定鲜重、干重和长度.将洗好的油菜用吸水纸吸干净表面水分, 分别用直尺测定地上部分和地下部分长度, 再将油菜分为地上和地下两部分并分别利用千分之一天平测定其鲜重, 然后将地上部分和地下部分分开烘干, 称其干重, 每处理平行4次.
2.3.2 油菜重金属含量测定油菜样品中的重金属采用微波消解(ETHOS A, 意大利MILESTONE公司)法进行前处理, Cd、Mo元素利用电感耦合等离子体质谱仪(X Series 2, 美国热电公司)测定(Chen et al., 2014).
2.4 数据处理转运系数为植物地上部重金属含量与根中重金属含量的比值, 表示重金属由植物根系被转运至茎叶的能力(魏树和等, 2003).富集系数是植物中重金属含量与土壤中重金属含量的比值, 表示植物对重金属的富集能力(刘文菊等, 2006).耐性系数为重金属处理组植物的平均根系长度与所设空白参照组的平均根系长度的比值(Han et al., 2007).
采用SPSS23.0分析软件的Two-way Anova方法和Microsoft Excel 2016进行数据分析和图表绘制.方差分析和多重比较采用最小显著差异法(LSD法), 显著水平为0.05.
3 结果分析(Results) 3.1 Mo对Cd胁迫下油菜生理参数及生物量的影响 3.1.1 生物量由表 2可以看出, 单一0.5 mg·kg-1镉处理与对照相比, 油菜地上部长度显著减小(p < 0.05), 但鲜重、干重却显著增加(p < 0.05);地下部则除干重有所降低外, 其长度、鲜重均无显著变化(p>0.05).施入50、100、200 mg·kg-13个外源钼处理后, 其地上部分变化较地下部分剧烈;施入50 mg·kg-1钼时, 地上部分鲜重和干重降低(p < 0.05), 地下部分干重显著增加(p < 0.05), 其他参数无显著变化(p>0.05);施入100 mg·kg-1钼时, 除了地上部分鲜重无显著变化(p>0.05), 其他参数均显著增大(p < 0.05);施入200 mg·kg-1钼时, 地上部分鲜重也开始上升, 且除地上部分长度、地下部分鲜重外, 均高于对照处理(p < 0.05).说明0.5 mg·kg-1镉可以减小油菜地上部分长度, 但能增大油菜地上部分鲜重和干重, 对地下部分各参数无影响, 施入钼对油菜地上部分和地下部分各参数均具有促进作用.
| 表 2 钼作用下镉胁迫油菜生物量的变化(n=3) Table 2 The biomass of rape with the interaction of Mo and Cd (n=3) |
当单独6.0 mg·kg-1镉处理时, 油菜地上部分和地下部分长度、干重和鲜重均较对照显著减小(p < 0.05);施入钼能够显著增加油菜的长度和质量(p < 0.05), 其中, 施入100 mg·kg-1钼时增加量最大, 但低于对照.说明6.0 mg·kg-1镉能够显著降低油菜的长度和质量, 施入100 mg·kg-1钼能显著增加油菜的生物量.
当单独施入50 mg·kg-1钼时, 油菜地上、地下部分长度较对照均显著增大(p < 0.05), 其他参数无显著变化(p>0.05);当施入100 mg·kg-1钼时, 能显著增加油菜地上部分和地下部分长度、鲜重(p < 0.05), 而200 mg·kg-1时则会显著减少油菜地上部分长度、鲜重, 以及地下部分长度(p < 0.05).说明100 mg·kg-1钼对油菜生物量有增加作用, 但200 mg·kg-1钼会降低油菜的生物量.
3.1.2 丙二醛和脯氨酸由图 1可以看出, 单独0.5 mg·kg-1镉处理时, 随着钼施入量的增加油菜中丙二醛(MDA)和脯氨酸(Pro)含量(以鲜重计)较对照先显著升高后显著降低(p < 0.05), 分别升高了34.9%、49.1%, 降低了35.0%和19.0%.单独6.0 mg·kg-1镉处理时, 随着钼施入量的增加油菜中MDA和Pro含量较对照先显著(p < 0.05)升高, 又在100 mg·kg-1外源钼作用时显著降低(p < 0.05), 分别升高了192%和122%, 降低了39.8%和11.4%, 然后在200 mg·kg-1外源钼作用时又升高, 且高于对照但小于单镉处理.单独施入不同浓度的钼时, 油菜中MDA和Pro含量随着钼元素施入量的增加而显著增大(p < 0.05).说明施钼可以降低镉处理时油菜中MDA和Pro含量, 且在低镉处理时MDA含量能降低至低于对照水平, 但Pro含量无论在低镉处理还是高镉处理时均无法恢复至对照水平.
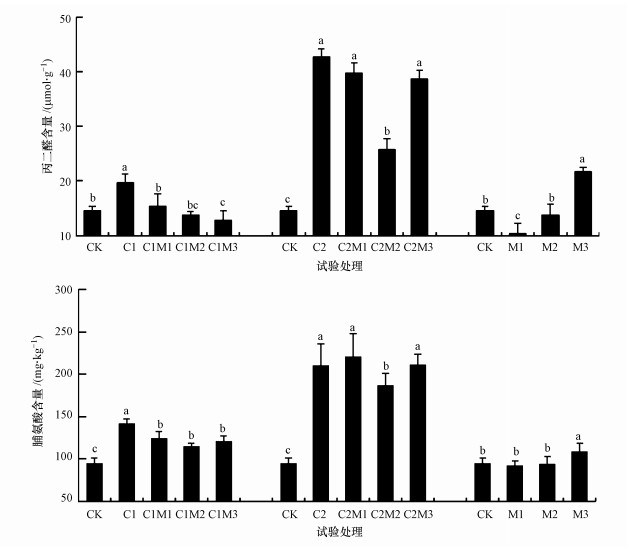 |
| 图 1 钼作用下镉胁迫油菜中丙二醛和脯氨酸含量的变化(n=3) (不同小写字母代表该组值在0.05水平下差异显著(p < 0.05)) Fig. 1 The changes of MDA and Pro in rape with the interaction of Mo and Cd (n=3) |
由图 2可以看出, 单独0.5 mg·kg-1镉处理时, 随着钼含量的增加油菜中可溶性蛋白(SP)含量较对照先显著降低后显著升高(p < 0.05), 降低了18.4%, 升高了31.7%, 而可溶性糖(SS)含量则无变化.单独6.0 mg·kg-1镉处理时, 随着钼施入量的增加油菜中SP和SS含量较对照先显著降低(p < 0.05), 又在施钼量为50 mg·kg-1时显著升高(p < 0.05), 分别降低了75.3%和39.4%, 升高了188%和32.7%;SP含量在施钼量为200 mg·kg-1时升至最高, SS含量在施钼量为100 mg·kg-1时升至最高, 但均低于对着处理.单独施入不同浓度的钼时, 随着钼元素施入量的增加, 油菜中SP含量在50 mg·kg-1时、SS含量在100 mg·kg-1时较对照显著增大(p < 0.05), 在200 mg·kg-1时又显著降低(p < 0.05).说明施钼可以显著提高低镉处理时SP、高镉处理时SP和SS的含量, 但对低镉处理时SS含量无影响, 同时200 mg·kg-1钼单独处理时能显著降低油菜中SP和SS含量, 说明土壤中高含量钼可造成油菜SP和SS含量降低.
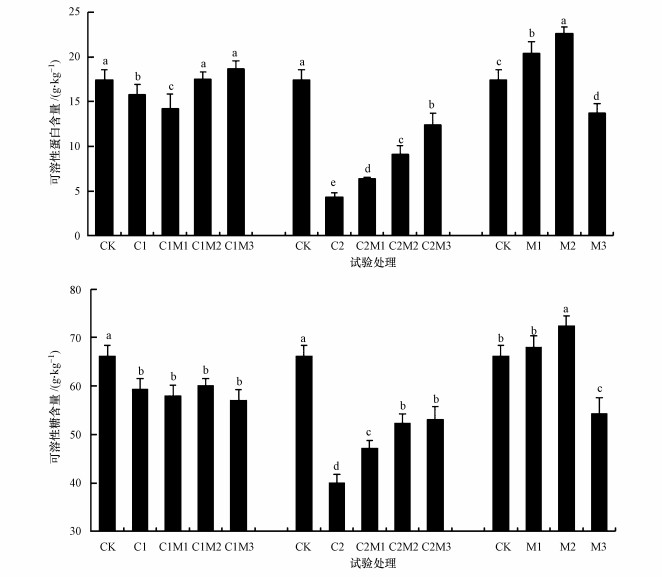 |
| 图 2 钼作用下镉胁迫油菜中可溶性糖和可溶性蛋白含量的变化(n=3) (不同小写字母代表该组值在0.05水平差异显著(p < 0.05)) Fig. 2 The changes of SS and SP in rape with the interaction of Mo and Cd(n=3) |
由图 3可以看出, 单独0.5 mg·kg-1镉处理时, 随着钼含量的增加油菜的SOD活性和GPX活性较对照先显著降低后显著升高, 分别降低了3.46%、27.0%, 升高了10.4%和20.5%, 在200 mg·kg-1钼作用时又显著降低(p < 0.05), 分别降低了12.6%和19.9%.单独6.0 mg·kg-1镉处理时, 与0.5 mg·kg-1镉处理时变化趋势一致, 随着钼施入量的增加油菜的SOD活性和GPX活性较对照先显著(p < 0.05)降低, 又在100 mg·kg-1钼作用时显著增大, 施钼量为200 mg·kg-1时又显著降低(p < 0.05), 分别降低了21.5%和58.6%, 增大了18.6%和35.4%, 然后又降低了13.2%和35.1%, 且低于对照和单镉处理时.单独施入不同浓度的钼时, 油菜的SOD活性随着钼元素施入量的增大先显著增大后显著降低(p < 0.05), 在施钼量为100 mg·kg-1时增至最大, 而GPX活性则在施钼量为0~100 mg·kg-1时无变化, 在施钼量为200 mg·kg-1时显著降低.说明施钼可以增大镉处理时油菜的SOD、GPX活性, 且在0.5 mg·kg-1镉处理时SOD活性高于对照水平, 但施钼量为200 mg·kg-1时会显著降低油菜的SOD和GPX活性.
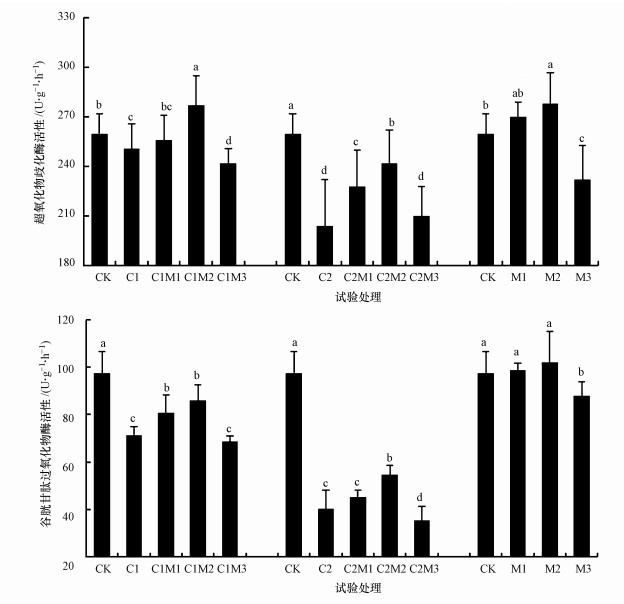 |
| 图 3 钼作用下镉胁迫油菜超氧化物歧化酶活性和谷胱甘肽过氧化物酶活性的变化(n=3) (不同小写字母代表该组值在0.05水平差异显著(p < 0.05)) Fig. 3 The changes of SOD and GPX in rape with the interaction of Mo and Cd (n=3) |
由图 4可以看出, 单独0.5 mg·kg-1镉处理时, 随着施钼量的增加油菜中Chla和Chlb含量较对照先显著降低后显著升高, 在200 mg·kg-1钼作用时又显著降低(p < 0.05).在单独6.0 mg·kg-1镉处理时, 随着钼施入量的增加油菜中Chla和Chlb含量较对照先显著降低(p < 0.05), 在施钼量为100 mg·kg-1时显著增大, 施钼量为200 mg·kg-1时又显著降低(p < 0.05).单独施入不同浓度的钼时, 油菜中Chla含量随着钼元素施入量的增大先显著增大后显著降低(p < 0.05), 在施钼量为100 mg·kg-1时增至最大, 而Chlb含量则在施钼量为0~50 mg·kg-1时无变化, 在施钼量为100 mg·kg-1时显著升高(p < 0.05), 在施钼量为200 mg·kg-1时又显著降低.说明施钼可以增大镉处理时油菜的Chla和Chlb含量, 且在0.5 mg·kg-1镉处理时Chla含量能达到对照水平, 但单独施钼200 mg·kg-1时又会显著降低油菜的Chla和Chlb含量.
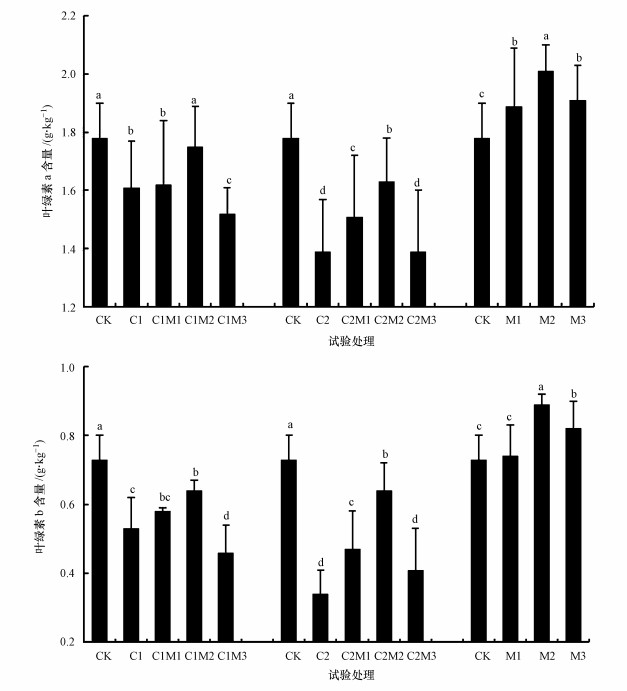 |
| 图 4 钼作用下镉胁迫油菜叶绿素含量的变化(n=3) (不同小写字母代表该组值在0.05水平下差异显著(p < 0.05)) Fig. 4 The changes of chlorophyll in rape with the interaction of Mo and Cd (n=3) |
由表 3可以看出, 相较0.5 mg·kg-1镉处理, 6 mg·kg-1镉处理时油菜地上部分和根部对镉的吸收量均显著增大(p < 0.05), 且两种镉处理油菜体内重金属含量均显著高于对照组(p < 0.05).当0.5 mg·kg-1镉处理时, 随着钼施入量的增加, 油菜地上部分和地下部分对镉的吸收量与单独镉处理相比显著降低(p < 0.05), 并且在钼施入量为200 mg·kg-1时, 油菜地上部分和地下部分对镉的吸收量低于对照组(p < 0.05);油菜对镉的富集系数表现为随着钼施入量增加逐渐降低, 转运系数则表现为随着钼施入量增加先增加后降低, 而油菜对镉的耐性系数则表现为逐渐增大.当6.0 mg·kg-1镉处理时, 随着钼施入量的增加油菜地下部分和地上部分对镉的吸收量较单独镉处理时均显著降低(p < 0.05);油菜对镉的富集系数表现为随着钼施入量增加逐渐降低, 转运系数则表现为随着钼施入量增加先降低后增加, 而油菜对镉的耐性系数则表现为先增大后降低.与单独镉处理相比, 施入钼提高了油菜对镉的耐性系数, 降低了富集系数, 但转运系数的变化较小, 说明外援钼能够有效降低油菜对镉的吸收, 但对进入油菜体内的镉的转运影响较小, 且高浓度钼与高浓度镉协同作用, 可显著降低油菜对镉的耐性系数.
| 表 3 钼作用下镉胁迫油菜吸收转运镉的变化(n=3) Table 3 The changes of Cd in rape with the interaction of Mo and Cd(n=3) |
植物各生物量参数能够直接反映植物的生长状况及其受胁迫的大小.本研究中低镉处理抑制油菜地上部分长度生长, 却促进其质量增加;高镉处理既抑制油菜生长又抑制其质量增加, 表现为高抑低促.这与杨金凤等(2005)对镉、铅污染下油菜生长情况的研究结果一致, 施入100 mg·kg-1钼可以促进油菜生物量的显著增加.这可能与钼能稳定植物生理功能、促进营养生长并结合沉淀镉元素的作用有关(Sun et al., 2014).
丙二醛(MDA)含量既可以反映植物体细胞膜受损程度, 又能衡量其受重金属胁迫程度, 植物体内积累的MDA越多, 表明其自我保护能力越弱(孙约兵等, 2009).脯氨酸(Pro)是植物体内重要的抗胁迫反应指标, 在受到胁迫后迅速升高, 以抵御外来胁迫对植物体的毒害(Schat et al., 1997).本研究结果表明, 0.5、6 mg·kg-1镉处理均会造成MDA、Pro含量增加, 原因可能是镉胁迫造成油菜叶片细胞受损, 自由基的过氧化损失, 导致其发生内膜脂过氧化作用, 启动抵抗胁迫机制, 从而引起油菜MDA、Pro含量增高.施入适量的钼元素时, 油菜体内MDA、Pro含量降低, 证明钼元素可以有效降低镉对油菜细胞内膜的损伤(李路, 2016;Yang et al., 2011).同时, 油菜各处理MDA含量较Pro含量变化剧烈, 证明MDA较Pro更容易反映出油菜受镉胁迫的程度.
植物中可溶性蛋白(SP)含量可以衡量其是否受到重金属的胁迫.通过测定植物SP含量, 可以得出植物体的代谢能力.当受到重金属胁迫时, 高SP含量可以降低植物细胞的渗透势, 从而保护植物体不受重金属的损害(Bonifacio et al., 2016).植物在受到胁迫时可以调节体内可溶性糖(SS)含量来降低胁迫的危害, 但处于长期胁迫环境下的植物其SS含量会降低(杨红飞等, 2011).本研究中, 油菜体内SP、SS含量在镉的作用下较对照显著降低, 而在钼作用下油菜体内SP、SS含量上升, SS含量可达到对照水平.说明钼元素可以有效改善油菜的光合系统, 稳定SS的运输通道, 促进油菜可溶性蛋白的生成, 从而抵抗镉的污染;但高镉胁迫可能已破坏了油菜叶片的光合作用系统, 从而导致油菜SP分解过渡, 同时体内不溶糖分解受损, SS得不到补充(孙赛初等, 1985).
超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPX)是重要的抗氧化物酶, 分析其活性可获得外源污染物对植物体的损伤程度(侯艳伟等, 2008;Iannone et al., 2015).本研究中油菜体内SOD和GPX活性变化趋势相似.镉单独作用降低了两种酶的活性, 钼单独作用促进了两种酶的合成, 证明镉通过加剧细胞膜脂的过氧化而破坏细胞膜结构的完整性, 钼能有效增加油菜的抗氧化能力, 降低镉胁迫的危害(衣艳君等, 2008).
植物体内叶绿素含量高低是其进行光合作用的基础(Boo et al., 2012), 在重金属胁迫下, 叶绿素含量会降低(Goswami et al., 2016).本研究中, 镉单独处理能降低Chla和Chlb含量, 证明重金属镉可能存在于植物体叶绿体细胞壁上, 从而抑制油菜叶片叶绿素的合成(Ma et al., 2018;高桂青等, 2019).而外源钼使油菜叶绿素含量增加, 这可能是由于钼元素具有稳定叶绿体结构、增加叶绿体基粒数和体积并促进叶绿素合成的能力(李文学等, 2000;喻敏等, 2000).另外, 通过计算本研究中Chla与Chlb的比值可知, 油菜在镉胁迫较大时Chla/Chlb显著降低, 证明在胁迫增加时, 油菜逐渐增大了叶绿素b在光合中的作用, 而钼元素在稳定植株细胞结构的过程中主要通过促进素叶绿素b的合成来增加叶绿体数量(翁伯琦等, 2008), 这与本研究结果吻合.
4.2 Mo作用下油菜对Cd吸收、富集和转运植物在受到重金属胁迫时, 虽然会通过多种渠道减少自身吸入重金属的量(张凤琴等, 2005), 比如通过根际微环境作用.但长期暴露于在重金属污染环境中时, 植物体内还是会积累一定量的重金属.本研究中, 在镉元素处理时, 油菜体内镉含量均超过了国家食品安全污染物限量标准(GB 2762—2017)对蔬菜中镉含量的限值, 说明本研究中镉的施加浓度均造成了油菜中镉污染;另外, 也可能是因为油菜对重金属镉本身具有富集作用, 利用油菜富集镉, 修复土壤的研究也有报道(林昕, 2010).但当施入钼时, 低镉处理表现为随着钼施入量的增大油菜体内镉含量显著降低, 尤其是在200 mg·kg-1钼作用时, 油菜体内镉含量低于国家食品安全污染物限量标准中重金属的含量限值, 证明钼元素的施入能有效降低低镉处理时油菜体内镉的含量, 这与油菜其他生理生化及生物量参数的研究结果一致.
而对于高镉处理时, 虽然钼能有效降低油菜对镉的吸入量, 但由于重金属镉含量过高, 再加上油菜本身对镉具有富集作用, 因此, 随着钼元素施入量的增加, 油菜体内重金属镉含量虽然显著降低, 但仍然超标(GB 2760—2017).同时通过研究发现, 油菜对镉的富集能力和转运能力均较大, 证明镉属于活性金属元素(张曦等, 2012).钼元素的施入通过降低油菜对镉的吸收, 从而降低其对镉的富集能力, 但对镉的转运能力影响不大.可能是由于钼能够在土壤中与镉发生化学反应, 降低油菜对镉的吸收, 但无法降低镉进入油菜体内的转运能力, 这与硒元素对进入植物体重金属的作用不同(郭锋等, 2014).本研究发现, 镉处理能显著降低油菜的耐性系数, 可能是由于钼可以促进植物体内多种与光合作用有关的酶的合成及其光合循环(Nie et al., 2007), 进而降低进入油菜体内镉的毒害作用.
5 结论(Conclusions)通过本研究可以得出, 低浓度镉对油菜的生理参数、生物量参数影响较小, 并且能够促进油菜地上部分质量增加;高浓度镉会显著降低油菜的生理活性及生物量.施加钼元素能够显著降低重金属镉对油菜生理、生物量上的毒害作用.对于进入油菜体内的重金属镉污染物, 钼元素通过参与油菜生理生化反应, 促进油菜体内多种与光合作用有关的酶的形成及其循环来降低镉元素的毒害.在本实验条件下, 施入100 mg·kg-1钼能有效提高油菜的生理和生物量参数, 并可有效阻止油菜对重金属镉的吸收.
Ali B, Qian P, Jin R, et al. 2014. Physiological and ultra-structural changes inbrassica napus seedlings induced by cadmium stress[J]. Biologia Plantarum, 58: 131-138. DOI:10.1007/s10535-013-0358-5 |
Bela K, Horváth E, Galléa Á, et al. 2015. Plant glutathione peroxidases:Emerging role of the antioxidant enzymes in plant development and stress responses[J]. Journal of Plant Physiology, 176(3): 192-201. |
Balík J, Balík Pavliková D, Tlustoš P, et al. 2006. The fluctuation of molybdenum content in oilseed rape plants after the application of nitrogen and sulphur fertilizers[J]. Plant Soil and Environment, 52(7): 301-307. |
Bonifacio A, Carvalho F E L, Martins M O, et al. 2016. Silenced rice in both cytosolic ascorbate peroxidases displays pre-acclimation to cope with oxidative stress induced by 3-aminotriazole-inhibited catalase[J]. Journal of Plant Physiology, 201: 17-27. DOI:10.1016/j.jplph.2016.06.015 |
Boo H O, Hwang S J, Bae C S, et al. 2012. Extraction and characterization of some natural plant pigments[J]. Industrial Crops and Products, 40(10): 129-135. |
Camara Y A, Wan Y N, Yu Y, et al. 2018. Effect of selenium on uptake and translocation of arsenic in rice seedlings (Oryza sativa L.)[J]. Ecotoxicology and Environmental Safety, 148: 869-875. DOI:10.1016/j.ecoenv.2017.11.064 |
Chen H, Wang Z B, Chang Q Y, et al. 2014. Determination of trace elements in rape honey and its corresponding rape flower and dtem by ICP-MS[J]. Spectroscopy and Spectral Analysis, 34(2): 548-552. |
Chunilall V, Kindness A, Jonnalagadda S B. 2004. Heavy metal uptake by spinach leaves grown on contaminated soils with lead, mercury, cadmium, and nickel[J]. Journal of Environmental Science and Health Part B, 39: 473-481. |
Cui L J, Huang Q, Yan B, et al. 2015. Molecular cloning and expression analysis of a Cu/Zn SOD gene (BcCSD1) from Brassica campestris ssp. Chinensis[J]. Food Chemistry, 186(10): 306-311. |
邓丽莉, 潘晓倩, 生吉萍, 等. 2012. 考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J]. 食品科学, 33(24): 185-189. |
Filek M, Gzyl-Malcher B, Zembala M, et al. 2010. Effect of selenium on characteristics of rape chloroplasts modified by cadmium[J]. Journal of Plant Physiology, 167(1): 28-33. |
Filek M, Kocielniak J, Abanowska M, et al. 2010. Selenium-induced protection of photosynthesis activity in rape (brassica napus) seedlings subjected to cadmium stress. fluorescence and EPR measurements[J]. Photosynthesis Research, 105: 27-37. DOI:10.1007/s11120-010-9551-y |
Filek M, Keskinen R, Hartikainen H, et al. 2008. The protective role of selenium in rape seedlings subjected to cadmium stress[J]. Journal of Plant Physiology, 165(8): 833-844. DOI:10.1016/j.jplph.2007.06.006 |
高桂青, 简敏菲, 卢龙, 等. 2019. Cu2+、Cd2+胁迫对马来眼子菜光合色素及光合荧光特性的影响[J]. 应用与环境生物学报, 25(3): 517-523. |
高俊凤. 2006. 植物生理学实验指导[M]. 北京: 高等教育出版社.
|
Goswami S, Das S. 2016. Copper phytoremediation potential of Calandula officinalis L.and the role of antioxidant enzymes in metal tolerance[J]. Ecotoxicology and Environmental Safety, 4(126): 211-218. |
郭锋, 樊文华, 冯两蕊, 等. 2014. 硒对镉胁迫下菠菜生理特性、元素含量及镉吸收转运的影响[J]. 环境科学学报, 34(2): 524-531. |
郭悦, 杨军, 郭俊娒, 等. 2019. 氮磷钾配施促进向日葵铅吸收转运的机制[J]. 植物营养与肥料学报, 25(11): 1998-2008. |
Han Y L, Yuan H Y, Huang S H, et al. 2007. Cadmium tolerance and accumulation by two species of iris[J]. Ecotoxicology, 16: 557-563. DOI:10.1007/s10646-007-0162-0 |
Handa N, Kohli S K, Thukral A K, et al. 2018. Protective role of selenium against chromium stress involving metabolites and essential elements in Brassica juncea L. seedlings[J]. Biotech, 8(1): 66. |
侯艳伟, 王琼, 周茂钟. 2008. Cd单一及Cd和Se复合污染对玉米幼苗生理特性的影响[J]. 华侨大学学报(自然科学版), 29(3): 391-394. |
Huang Y Z, Hu Y, Liu Y. 2009. Heavy metal accumulation in iron plaque and growth of rice plants upon exposure to single and combined contamination by copper, cadmium and lead[J]. Acta Ecologica Sincica, 29(6): 320-326. DOI:10.1016/j.chnaes.2009.09.011 |
Iannone M F, Groppa M D, Benavides M P. 2015. Cadmium induces different biochemical responses in wild type and catalase-deficient tobacco plants[J]. Environmental and Experimental Botany, 109: 201-211. DOI:10.1016/j.envexpbot.2014.07.008 |
Ide Y, Kusano M, Oikawa A, et al. 2011. Effects of molybdenum deficiency and defects in molybdate transporter MOT1 on transcript accumulation and nitrogen/sulphur metabolism in Arabidopsis thaliana[J]. Journal of Experimental Botany, 62(4): 1483-1497. |
Kaya C, Ashraf M, Alyemeni M N, et al. 2020. Responses of nitric oxide and hydrogen sulfide in regulating oxidative defence system in wheat plants grown under cadmium stress[J]. Physiologia Plantarum, 168: 345-360. |
Li B, Yang J X, Chen S B, et al. 2014. Field evidence of cadmium phytoavailability decreased effectively by rape straw and/or red mud with zinc sulphate in a Cd-contaminated calcareous soil[J]. PLoS ONE, 9(10): e109967. DOI:10.1371/journal.pone.0109967 |
李合生. 2000. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 195-199.
|
李路.2016.冬小麦对土壤钼污染的响应及其耐钼机制研究[D].武汉: 华中农业大学 http://cdmd.cnki.com.cn/Article/CDMD-10504-1016156208.htm
|
李文学, 王震宇, 张福锁, 等. 2000. 低温对缺钼冬小麦幼苗生长的影响Ⅰ.对糖代谢的影响[J]. 植物营养与肥料学报, 6(3): 312-317. |
Li X D, Zhuang K Y, Liu Z M, et al. 2016. Overexpression of a novel NAC-type tomato transcription factor, SINAM1, enhances the chilling stress tolerance of transgenic tobacco[J]. Journal of Plant Physiology, 204(10): 54-65. |
Li Y P, Wang S L, Zhang Q, et al. 2018. Accumulation, interaction and fractionation of fluoride and cadmium in sierozem and oilseed rape (Brassica napus L.) in northwest China[J]. Plant Physiology and Biochemistry, 127: 457. DOI:10.1016/j.plaphy.2018.04.017 |
林昕.2010.利用油菜对镉、铅污染农田土壤植物修复研究[D].昆明: 昆明理工大学 http://cdmd.cnki.com.cn/Article/CDMD-10674-1011055420.htm
|
刘文菊, 胡莹, 毕淑芹, 等. 2006. 苗期水稻吸收和转运砷的基因型差异研究[J]. 中国农学通报, 22(6): 356-360. |
Ma Y L, Wang H F, Wang P, et al. 2018. Effects of cadmium stress on the antioxidant system and chlorophyll fluorescence characteristics of two Taxodium clones plant[J]. Cell Reports, 37: 1547-1555. DOI:10.1007/s00299-018-2327-0 |
Nie Z J, Hu C X, Sun X C, et al. 2007. Effects of molybdenum on ascorbate-glutathione cycle metabolism in Chinese cabbage (Brassica campestris L. ssp. pekinensis)[J]. Plant and Soil, 295(1/2): 13-21. |
Qin S Y, Sun X C, Hu C X, et al. 2017. Effects of tungsten on uptake, transport and subcellular distribution of molybdenum in oilseed rape at two different molybdenum levels[J]. Plant Science, 256: 87-93. DOI:10.1016/j.plantsci.2016.12.009 |
Riemann B, Ernst D. 2006. Extraction of chlorophylls a and b from phytoplankton using standard extraction techniques[J]. Freshwater Biology, 12(3): 217-223. |
Rollinson C L. 1975. The Chemistry of Chromium, Molybdenum and Tungsten[M]. Oxford: Pergamon Press Ltd.
|
Schat H, Sharma S S, Vooijs R. 1997. Heavy metal-induced accumulation of free proline in a metal-tolerant and a nontolerant ecotype of Silene vulgaris[J]. Physiologia Plantarum, 101: 477-482. DOI:10.1111/j.1399-3054.1997.tb01026.x |
Sun J, Bankston J R, Payandeh J, et al. 2014. Crystal structure of a plant dual-affinity nitrate transporter[J]. Nature, 507(7490): 73-77. DOI:10.1038/nature13074 |
孙赛初, 王焕校, 李启任. 1985. 水生维管束植物受镉污染后的生理生化变化及受害机制初探[J]. 植物生理学报, 11(2): 113-121. |
孙约兵, 周启星, 王林, 等. 2009. 三叶鬼针草幼苗对镉污染的耐性及其吸收积累特征研究[J]. 环境科学, 30(10): 3028-3033. |
Wan Y N, Yu Y, Wang Q, et al. 2016. Cadmium uptake dynamics and translocation in rice seedling:Influence of different forms of selenium[J]. Ecotoxicology and Environmental Safety, 133: 127-134. DOI:10.1016/j.ecoenv.2016.07.001 |
Wang G, Su M Y, Chen Y H, et al. 2006. Transfer characteristics of cadmium and lead from soil to the edible parts of six vegetable species in southeastern China[J]. Environmental Pollution, 144(1): 127-135. DOI:10.1016/j.envpol.2005.12.023 |
魏树和, 周启星, 王新. 2003. 18种杂草对重金属的超积累特性研究[J]. 应用基础与工程科学学报, 11(2): 152-159. |
翁伯琦, 黄东风, 王义祥, 等. 2008. 施用硼、钼肥对圆叶决明生长和叶肉细胞超显微结构的影响[J]. 亚热带资源与环境学报, 3(4): 31-36. |
Wu G M, Hu P J, Zhou J W, et al. 2019. Sulfur application combined with water management enhances phytoextraction rate and decreases rice cadmium uptake in a Sedum plumbizincicola-Oryza sativa rotation[J]. Plant and Soil, 440(6): 539-549. |
Wu Z C, Zhao X H, Sun X C, et al. 2015. Antioxidant enzyme systems and the ascorbate-glutathione cycle as contributing factors to cadmium accumulation and tolerance in two oilseed rape cultivars (Brassica napus L.) under moderate cadmium stress[J]. Chemosphere, 138: 526-536. DOI:10.1016/j.chemosphere.2015.06.080 |
Xu T, Sun C B. 2012. Aerosol flotation of low-grade refractory molybdenum ores[J]. International Journal of Minerals Metallurgy and Materials, 12: 11-16. |
杨红飞, 王友保, 李建龙. 2011. 铜、锌污染对水稻土中油菜(Brassica chinensis L.)生长的影响及累积效应研究[J]. 生态环境学报, 20(10): 1470-1477. |
杨金凤, 卜玉山, 郭小燕, 等. 2005. 土壤外源镉、铅污染对油菜生长的影响研究[J]. 陕西农业科学, (3): 25-28. |
Yan H, Filardo F, Hu X T, et al. 2016. Cadmium stress alters the redox reaction and hormone balance in oilseed rape (Brassica napus L.) leaves[J]. Environmental Science and Pollution Research, 23: 3758-3769. DOI:10.1007/s11356-015-5640-y |
Yang H Y, Shi G X, Xu Q S, et al. 2011. Cadmium effects on mineral nutrition and stress in potamogeton crispus[J]. Russian Journal of Plant Physiology, 58(2): 253-260. DOI:10.1134/S1021443711020245 |
衣艳君, 李芳柏, 刘家尧. 2008. 尖叶走灯藓(Plagiomnium cuspidatum)叶绿素荧光对复合重金属胁迫的响应[J]. 生态学报, 28(11): 5438-5444. |
喻敏, 王运华, 胡承孝. 2000. 种子钼对冬小麦硝酸还原酶活性、干物质重及产量的影响[J]. 植物营养与肥料学报, 6(2): 220-226. |
张付贵, 肖欣, 闫贵欣, 等. 2017. 甘蓝型油菜幼苗期耐镉性评价方法的研究[J]. 中国油料作物学报, 39(1): 47-54. |
张凤琴, 王友绍, 殷建平, 等. 2005. 红树植物抗重金属污染研究进展[J]. 云南植物研究, 27(3): 225-231. |
张曦, 王旭. 2012. 四种土壤调理剂对镉、铅的吸附效果研究[J]. 中国土壤与肥料, (4): 6-10. |
Zhou S H, Zhang C Y, Xiao Q Y, et al. 2016. Effects of different levels of molybdenum on rumen microbiota and trace elements changes in tissues from goats[J]. Biological Trace Element Research, 174(1): 85-92. DOI:10.1007/s12011-016-0706-3 |
 2020, Vol. 40
2020, Vol. 40


