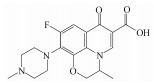
左氧氟沙星是一种氟喹诺酮类抗生素, 被广泛应用于医疗、水产养殖及畜牧业(Kaur et al., 2016), 但其能被机体利用的仅有20%左右, 其余通过各种途径进入到环境中(Hao et al., 2015).近年来, 左氧氟沙星在地表水(Benotti et al., 2009)、地下水(Hu et al., 2010)和饮用水(Burke et al., 2016)中均有检出.研究表明, 抗生素进入水体后会引起严重的环境问题, 包括细菌耐药性的产生(Zhang et al., 2015)、水生植物和藻类的生理致畸、致癌风险及遗传毒性(Li et al., 2013).由于左氧氟沙星具有抑菌性和生物毒性(Nasuhoglu et al., 2012), 生物水处理工艺对其去除效果不佳.因此, 开发新型高效的左氧氟沙星去除技术具有重大现实意义.
以SO4- ·为基础的高级氧化技术(Advanced Oxidation Processes, AOPs)具有廉价高效、环境友好的特点(李轶涵等, 2019).研究表明, SO4- ·能有效破坏抗生素的分子结构, 并使抗菌活性丧失(Yang et al., 2017), 在抗生素污染治理方面引起了广泛关注.与· OH(2.8 eV)相比, SO4- ·(2.6~3.1 eV)具有较高的氧化还原电位、较广的pH适用范围(pH=2~10)(孙昕等, 2019)和较长的半衰期(Yen et al., 2011)等优势, 有更多的机会与污染物发生反应.在复杂的环境基质中, · OH的非选择性使其表现出对目标污染物较低的去除效率(Xiao et al., 2014), 而SO4- ·的选择性优于· OH, 环境基质对其影响较小(Luo et al., 2017), 且SO4- ·倾向于电子转移反应, 可以降解许多· OH无法处理的污染物(Sühnholz et al., 2020).过硫酸盐是SO4- ·的来源, 在室温下以固体形式存在, 性质稳定, 便于运输存放(Yang et al., 2019), 在活化过程中不会产生挥发性气体, 不会因挥发浓度降低而导致硫酸根自由基产量减少, 在溶液中可以通过热、紫外、电磁、过渡金属离子和超声等手段活化产生SO4- ·(Avetta et al., 2015).超声/过硫酸盐体系被认为是一种高效、清洁的方法, 被越来越多的应用于有机污染物的处理(Chen et al., 2015; Gao et al., 2018).
超声/过硫酸盐体系降解污染物可以分为两个关键过程:①超声引起空化气泡的形成、生长与崩塌, 局部产生高温高压(Deng et al., 2015), 一方面活化过硫酸盐产生SO4- ·, 另一方面促进水热解生成· OH、H ·(Zhang et al., 2018)等活性自由基, 具体见式(1)和式(2);②· OH和SO4- ·等自由基与污染物发生降解反应, 同时共存一些副反应, 如SO4- ·促进· OH的生成, · OH与K2S2O8反应生成SO4- ·等.文献报道, 超声活化过硫酸盐体系中包含以下反应, 具体如式(3)~(13)所示(Wang et al., 2015; Monteagudo et al., 2018).
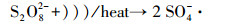
|
(1) |
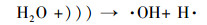
|
(2) |
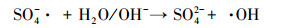
|
(3) |
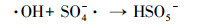
|
(4) |
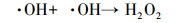
|
(5) |
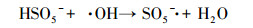
|
(6) |
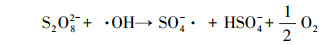
|
(7) |
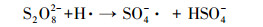
|
(8) |
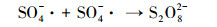
|
(9) |
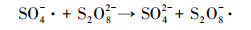
|
(10) |
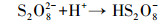
|
(11) |
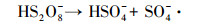
|
(12) |

|
(13) |
上述两个过程在超声/过硫酸盐体系降解污染物反应中缺一不可.现阶段的研究报道主要集中在第2个过程, 即证明超声/过硫酸盐体系降解有机物过程中是什么反应在起作用.如Yin等(2018)采用超声/过硫酸盐体系处理磺胺嘧啶, 认为降解过程主要是自由基氧化(SO4- ·和· OH)及非自由基氧化(如过硫酸盐氧化)共同作用的结果;Nasseri等(2017)采用该体系处理四环素, 发现· OH起主要作用;Li等(2016)采用该体系处理1, 1, 1-三氯乙烷, 结果表明, 降解过程主要是· OH和SO4- ·共同作用的结果.但第1个过程, 即· OH和SO4- ·自由基产生过程, 是第2个过程降解反应发生的前提.影响活性自由基产生的因素有哪些?· OH和SO4- ·的产生随反应时间变化规律是什么?这些问题是工程应用中的关键, 相关研究却鲜有报道.基于此, 本研究拟采用超声/K2S2O8降解左氧氟沙星水溶液, 通过设计单因素的影响实验, 考察自由基产生过程的影响因素, 并开展添加叔丁醇或异丙醇等猝灭剂的对照实验, 对超声/过硫酸盐体系降解左氧氟沙星过程中自由基产生过程及变化规律进行分析.
2 材料与方法(Materials and methods) 2.1 试剂与仪器实验试剂:左氧氟沙星(纯度≥99%, 理化性质见表 1)购自山东齐都药业有限公司, 过硫酸钾(K2S2O8)、氢氧化钠、硫酸、叔丁醇、异丙醇均为分析纯.
| 表 1 左氧氟沙星的理化性质 Table 1 Physical and chemical properties of levofloxacin |
实验仪器:超声波细胞粉碎机(JOYN-2000D)购自上海乔跃电子有限公司, 装置主体包含3个部分(图 1):①超声波发生器, 包含有控制面板及显示屏等;②隔音箱, 包含有样品升降台, 可供放置样品容器;③换能器组件, 包含有换能器及变幅杆, 配备Φ6 mm钛探针.其中, 超声波发生器和换能器组件由电缆相连, 温度探头直接连接控制面板.pH计(徐州亚名仪器仪表有限公司, pH-2603);紫外可见分光光度计(北京普析通用仪器有限责任公司, TU-1810).
 |
| 图 1 超声装置示意图 (1.超声波发生器;2.隔音箱;3.换能器组件;4.温度探头;5.样品升降台;6.样品容器;7.电缆) Fig. 1 Schematic diagram of ultrasonic device |
配制浓度为30 mg · L-1的左氧氟沙星溶液, 加入实验设定量的K2S2O8, 用0.1 mol · L-1的氢氧化钠和硫酸溶液调节pH值, 转移到反应容器中.打开超声波细胞粉碎机, 固定频率25 kHz条件下, 将钛探针插入溶液, 探针浸泡深度为液面下2 cm居中处, 钛脉冲(on/off)为1 s/2 s.在常压和避光条件下超声处理, 并通过温度探头监控温度, 每隔45 min取样一次, 每次取样量约为2 mL, 取样后立即进行测定.每组实验重复3次.左氧氟沙星的去除率r按照式(14)计算.
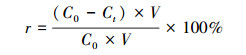
|
(14) |
式中, C0为初始时刻左氧氟沙星浓度(mg · L-1);Ct为t时刻左氧氟沙星浓度(mg · L-1);V为左氧氟沙星溶液体积(L).
2.3 左氧氟沙星浓度测定研究表明, 在检出限不低于0.03 mg · L-1的情况下, 紫外可见分光光度法是一种方便有效的检测方法(崔延瑞等, 2018).本实验采用紫外可见分光光度法对左氧氟沙星浓度进行检测, 在波长295 nm处测量吸光度, 将所测吸光度代入标准曲线(y=0.0242x)计算得出左氧氟沙星浓度.
3 结果与讨论(Results and discussion) 3.1 超声/K2S2O8体系去除左氧氟沙星活性自由基判定为考察超声/K2S2O8体系去除左氧氟沙星的效果, 判定反应过程中产生的活性自由基种类, 本文对比了超声、K2S2O8和超声/K2S2O8 3种体系对左氧氟沙星的去除率, 并分析了超声/K2S2O8体系分别加入过量的叔丁醇和异丙醇对左氧氟沙星去除率的影响, 实验结果如图 2所示.
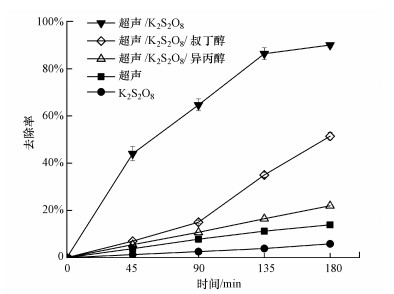 |
| 图 2 超声、K2S2O8、超声/K2S2O8、超声/K2S2O8/异丙醇和超声/K2S2O8/叔丁醇体系去除左氧氟沙星效果比较 (左氧氟沙星浓度30 mg · L-1, 超声频率25 kHz, 超声功率360 W, 体积100 mL, K2S2O8浓度20 mmol · L-1, pH=9) Fig. 2 Comparison of levofloxacin removal efficiency in US, K2S2O8, US/K2S2O8, US/K2S2O8/isopropanol and US/K2S2O8/tertbutanol system |
由图 2可见, 单独体系与协同体系的左氧氟沙星去除率变化曲线有明显差异.K2S2O8体系的左氧氟沙星去除率变化趋势接近于一条水平直线, 180 min后去除率为5.82%;超声体系的左氧氟沙星去除率增长速度缓慢, 180 min后为13.89%;超声/K2S2O8体系的左氧氟沙星去除率增长速度较快, 180 min后去除率达到90%.分析原因可能为, 超声能够引起空化效应, Suslick等(1990)测得, 空化可使气相反应区的温度达到5200 K左右, 液相反应区的有效温度达到1900 K左右, 局部压力在5.05×104 kPa, 并伴有强烈的冲击波, 空化过程中产生的高温高压能够使分子分解、化学键断裂和产生自由基.在这样的条件下, H2O分子生成· OH和H ·等活性自由基(式(2)).但也有文献报道, 体系中H2O分解产生的· OH非常少, 并且产生的· OH只有10%左右能够进入液相主体参与反应(Song et al., 2006), 因此, 超声体系中观察到左氧氟沙星的去除率较低.K2S2O8在室温下较为稳定, 化学反应速率较慢(Matzek et al., 2016), 因而K2S2O8体系对左氧氟沙星的去除率也较低.以上研究表明, 超声体系和K2S2O8体系都未产生足够量的有效参与反应的活性自由基.
超声/K2S2O8体系的左氧氟沙星去除率明显提高, 并且优于超声体系和K2S2O8体系的加和, 表明超声/K2S2O8体系存在协同作用.那么, 协同作用产生的活性自由基是什么?这是需要解释清楚的问题.
叔丁醇是常用的· OH猝灭剂, 异丙醇是常用的· OH和SO4- ·猝灭剂(House, 1962).研究报道(Liu et al., 2016; Qian et al., 2018), · OH与叔丁醇的反应速率为5.2×108 L · mol-1 · s-1, SO4- ·与叔丁醇的反应速率只有1×105 L · mol-1 · s-1, 叔丁醇可以快速将· OH猝灭.异丙醇与· OH和SO4- ·的反应速率分别为2.3×109 L · mol-1 · s-1和8.2×107 L · mol-1 · s-1, 异丙醇可以快速将· OH和SO4- ·猝灭.
超声/K2S2O8/叔丁醇体系(以下简称叔丁醇实验组)的左氧氟沙星去除率低于对照组, 90 min后去除速度略有加快, 180 min时去除率达到51.41%.这是由于叔丁醇的存在导致· OH被清除, 进而使得左氧氟沙星的去除率低于对照组.· OH被清除后, 叔丁醇实验组的去除率比对照组降低了38.59%, 表明超声/K2S2O8体系产生了大量的· OH自由基, 并在左氧氟沙星降解反应中起重要作用.叔丁醇实验组与单独K2S2O8体系比较, 去除率也有较大提高, 表明SO4- ·在超声/K2S2O8体系中的作用大于单独K2S2O8体系.
超声/K2S2O8/异丙醇体系(以下简称异丙醇实验组)的左氧氟沙星去除率缓慢上升, 每45 min上升约5.49%, 180 min时去除率达到21.96%, 比对照组降低了68.04%, 比添加叔丁醇实验组降低了29.45%.这是因为异丙醇实验组中· OH和SO4- ·都被清除, 因此导致左氧氟沙星去除率比叔丁醇实验组更低.异丙醇实验组的去除率与超声和K2S2O8实验组去除率的加和大致相同, 再次验证了超声/K2S2O8体系也产生了大量的SO4- ·.
以上实验结果表明, 超声/K2S2O8体系降解左氧氟沙星反应中· OH和SO4- ·起主要作用, 超声/K2S2O8体系存在协同作用, 比单独体系产生了更多的活性自由基.
3.2 超声/K2S2O8体系中· OH产生过程超声引起的空化效应会产生· OH, 且在一定范围内, 超声功率越大, 空化效应越强, 产生的自由基越多(Monteagudo et al., 2018), 这表明超声是产生· OH的重要原因.但本研究中超声/K2S2O8体系的左氧氟沙星去除率比超声单独体系效果提高很多(图 2).那么, 在超声/K2S2O8体系中如何促进· OH产生, 超声功率的影响是什么?为解决以上问题, 本文设置超声功率分别为90、180、270和360 W的4组对照实验, 对比不同功率对超声/K2S2O8体系降解左氧氟沙星的影响, 并分析· OH产生过程, 实验结果如图 3所示.
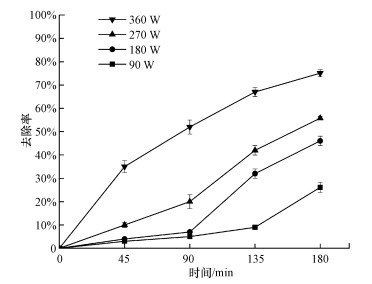 |
| 图 3 不同超声功率(90、180、270和360 W)下超声/K2S2O8体系去除左氧氟沙星的效果比较 (左氧氟沙星浓度30 mg · L-1, 超声频率25 kHz, 体积100 mL, K2S2O8浓度20 mmol · L-1, pH=7) Fig. 3 Comparison of levofloxacin removal efficiency in US/K2S2O8 systems under 90, 180, 270 and 360 W |
如图 3所示, 超声功率分别为90、180、270和360 W时, 反应180 min, 左氧氟沙星去除率分别为26.12%、46.12%、55.78%和75.06%, 相同反应时间的左氧氟沙星去除率变化与超声功率变化呈正向关系.这与Monteagudo等(2015)的研究结果相符, 表明超声是产生· OH的原因.但由图 2单独超声体系的实验结果可以发现, 单独超声产生· OH对左氧氟沙星的降解贡献并不大, 暗示超声/K2S2O8体系中还有其他产生· OH的过程.
不同功率条件下, 左氧氟沙星去除率随时间的变化特征有明显差异, 超声功率为90 W和180 W时, 左氧氟沙星去除率增长速率随反应时间延长逐渐加快, 呈上凹曲线型;270 W条件下, 去除率增长速率基本稳定, 呈直线型;360 W条件下, 左氧氟沙星去除率增长速率先快后慢, 呈上凸曲线型.
多项研究显示, K2S2O8活化过程中产生的自由基可以引发一系列链式反应(Huang et al., 2002; Matzek et al., 2016).在本研究中, 反应初期, 超声引起水热解产生· OH和H ·(式(2)), 随后H ·和· OH会继续与K2S2O8反应生成SO4- ·(式(7)、式(11)和式(12)), 同时H ·会与H2O反应继续生成· OH(式(13)), 体系生成的SO4- ·会与H2O或OH-反应继续生成· OH(式(3)), 呈链式反应的特征.在以上过程中, 超声/K2S2O8体系可以产生更多的SO4- ·和· OH及其他活性自由基(Monteagudo et al., 2018).因此, 可以推断超声/K2S2O8体系中链式反应是产生· OH的又一个过程.参考图 2实验结果, 反应180 min, 超声/K2S2O8体系的左氧氟沙星去除率达到90%, 超声体系只有13.89%, 表明链式反应对自由基产生的贡献较大.
图 3中超声功率为90 W和180 W条件下, 反应初期, 由于超声功率较低, 温度变化相对较慢, 自由基产生数量较少, 而左氧氟沙星浓度高, 导致自由基被消耗, 自由基数量不足以引发链式反应, 因此, 反应初期去除率上升缓慢.随着反应的进行, 左氧氟沙星浓度逐渐降低, 自由基逐渐积累, 从而引发链式反应, 体系生成更多的自由基与左氧氟沙星反应, 因此出现了上凹曲线型的实验现象.功率为270 W条件下, · OH和SO4- ·的生成与消耗接近平衡, 因此出现了直线型的实验现象.功率为360 W条件下, 反应初期体系便能引发链式反应, 因此, 反应初期去除率上升较快.这些实验现象从不同角度证明了超声/K2S2O8体系比超声单独体系去除效果提高很多的原因是链式反应的贡献.
超声功率为360 W条件下, 左氧氟沙星去除率增长速率先快后慢, 呈上凸曲线型, 表明链式反应在后期会受到抑制.有文献报道(Monteagudo et al., 2015), 体系中过多的自由基会彼此发生猝灭反应(式(4)、式(5)和式(9)), 因此, 随着反应时间的延长, 左氧氟沙星去除率的增长速率变小.此外, 随着反应时间的延长, 微小气泡会聚集形成大气泡, 崩塌时间增加, 空化效应减弱(Chen et al., 2009), 局部达不到活化所需的温度与能量, 能源利用率降低(Chen et al., 2012), 这也是出现上凸曲线型的原因.
以上实验结果表明, 超声/K2S2O8体系中· OH的产生有超声和链式反应两个途径, 其中, 链式反应的贡献较大, K2S2O8的存在是· OH产生的必要条件, 链式反应在自由基浓度较高条件下会发生猝灭.
3.3 超声/K2S2O8体系中SO4- ·产生过程图 2结果表明, SO4- ·在超声/K2S2O8体系中的作用大于在单独K2S2O8体系中.文献报道, 超声可以促进K2S2O8生成SO4- ·(Wang et al., 2019).本文3.2节中, 链式反应在促进产生· OH的同时, 也产生了大量的SO4- ·, 那么是否还有其他影响SO4- ·产生的因素?这也是本研究必须解决的问题.为探究K2S2O8浓度对SO4- ·产生的影响, 实验调节K2S2O8浓度分别为5、10、15和20 mmol · L-1, 不同K2S2O8浓度下超声/K2S2O8体系降解左氧氟沙星的实验结果如图 4所示.
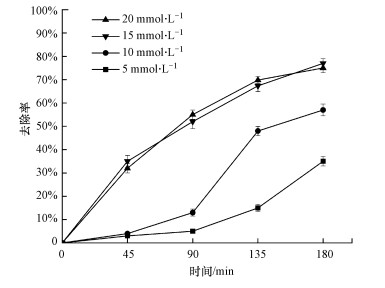 |
| 图 4 不同K2S2O8浓度(5、10、15和20 mmol · L-1)下超声/K2S2O8体系去除左氧氟沙星的效果比较 (左氧氟沙星浓度30 mg · L-1, 超声频率25 kHz, 超声功率360 W, 体积100 mL, pH=7) Fig. 4 Comparison of levofloxacin removal efficiency in US/K2S2O8 systems as K2S2O8 concentration 5, 10, 15 and 20 mmol · L-1 |
由图 4可见, 不同K2S2O8浓度实验组都显示出左氧氟沙星去除率随反应时间延长而增加的规律;其中, 5、10和15 mmol · L-1 3组实验组显示左氧氟沙星去除率与K2S2O8浓度呈正向变化关系.这些实验现象除了可以用链式反应解释外, 还表明K2S2O8浓度对SO4- ·的产生有较大影响.
15和20 mmol · L-1实验组的去除效果相近, 并出现左氧氟沙星去除率增长速率先快后慢的现象.分析原因, 反应初期SO4- ·生成量较多, 能有效降解左氧氟沙星, 随着反应时间的延长, 左氧氟沙星浓度降低, 积累过多的SO4- ·开始猝灭, 左氧氟沙星的降解反应受到抑制, 因此出现了左氧氟沙星去除率增长速率先快后慢的实验现象.当K2S2O8浓度由15 mmol · L-1增加至20 mmol · L-1时, 左氧氟沙星的去除率无明显提高, 这是由于K2S2O8浓度达到15 mmol · L-1后, 在反应初期SO4- ·的产生量达到最大值, 再提高K2S2O8浓度对反应影响不明显, 表现出15和20 mmol · L-1实验组去除效果相近的实验现象, 表明K2S2O8浓度过高对SO4- ·产生的促进作用会降低, 甚至消失.Wang等(2014)的研究也显示, 体系中过多的SO4- ·会与自身发生反应, 过量的S2O82-也会抑制SO4- ·的生成.
以上实验结果表明, 超声/K2S2O8体系中SO4- ·的产生有超声和链式反应两个途径, K2S2O8浓度对SO4- ·的产生有重要影响, 但K2S2O8浓度过高对提高SO4- ·的产生无益.
3.4 超声/K2S2O8体系中SO4- ·和· OH的相互影响由以上研究可知, 超声/ K2S2O8体系中产生· OH和SO4- ·有超声和链式反应两个过程, 其中, 链式反应的贡献较大.链式反应中SO4- ·和· OH的关系如何?是同步增减, 还是此消彼长?这是需要认识清楚的问题.
为探明以上问题, 本研究拟通过削弱超声/ K2S2O8体系中· OH或SO4- ·的产生, 考察对反应效果的影响.文献报道, 酸性条件下SO4- ·占主导, 中性和弱碱性条件下SO4- ·和· OH占主导, 强碱性条件下· OH占主导(Liang et al., 2007).本文选用0.1 mol · L-1硫酸和氢氧化钠溶液调节pH至3、5、7、9和11, 比较不同pH条件下左氧氟沙星的去除效果, 结果如图 5所示.
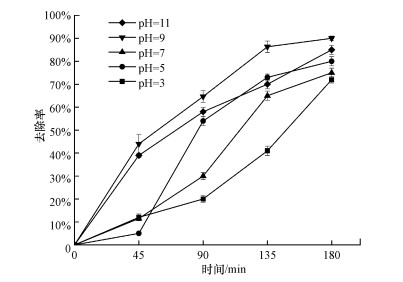 |
| 图 5 不同pH值(3、5、7、9和11)条件下超声/K2S2O8体系去除左氧氟沙星的效果比较 (左氧氟沙星浓度30 mg · L-1, 超声频率25 kHz, 超声功率360 W, 体积100 mL, K2S2O8浓度20 mmol · L-1) Fig. 5 Comparison of levofloxacin removal efficiency in US/K2S2O8 as pH 3, 5, 7, 9 and 11 |
从图 5可以看出, 不同pH条件下左氧氟沙星去除率的变化有较大差异, pH=9时, 左氧氟沙星去除率最高, 溶液为酸性和强碱性时, 左氧氟沙星去除率下降.分析原因, pH=9条件下适合SO4- ·和· OH共存;pH值3和5条件下, SO4- ·占主导地位, · OH生成条件较弱;pH=11条件下, · OH占主导地位, SO4- ·生成条件较弱.由以上实验结果可以推断, SO4- ·和· OH是通过链式反应同步增加的, 某一个活性自由基浓度降低, 都会影响整个体系的反应效果.
通过图 5还可以发现, pH=3实验组的左氧氟沙星去除率最低, 表明在酸性条件下活性自由基氧化能力最小, 从反面暗示· OH在超声/K2S2O8体系中占主导地位;pH=11实验组的去除率高于酸性和中性条件, 证明了· OH在反应中占主导地位的推断.
以上推论从叔丁醇添加实验的结果也可以得到证明, 叔丁醇实验组左氧氟沙星去除率下降较多, 表明· OH占主导地位.Matzek等(2016)研究表明, 过硫酸盐活化体系中污染物降解率取决于链式反应的发生和终止, 考虑到叔丁醇对链式反应的影响, 由于是在· OH产生以后将其猝灭, 文献表明, 超声体系中链式反应速率为107~109 L · mol-1 · s-1(Wei et al., 2017), 而叔丁醇猝灭反应速率为5.2×108 L · mol-1 · s-1 (Liu et al., 2016), 表明链式反应与叔丁醇猝灭反应存在竞争, 叔丁醇猝灭· OH并不能完全抑制链式反应带来的· SO4-增加.因此, 叔丁醇添加实验的去除率低于超声/K2S2O8体系, 但高于K2S2O8体系, 这从另一个侧面证明SO4- ·和· OH是通过链式反应同步增减的.
以上现象表明, 超声/K2S2O8体系降解左氧氟沙星过程中SO4- ·与· OH是通过链式反应共同增减的, · OH在反应中占主导地位.
3.5 超声/K2S2O8体系SO4- ·和· OH作用随时间变化为进一步量化SO4- ·和· OH的作用和分析不同时间点SO4- ·和· OH作用的变化, 本文对图 2的实验结果进行分析, 以对照组与叔丁醇实验组的左氧氟沙星去除质量差反映因· OH作用去除的质量, 叔丁醇实验组与异丙醇实验组的左氧氟沙星去除质量差反映因SO4- ·作用去除的质量, 异丙醇实验组左氧氟沙星去除质量反映的是因其他作用去除的质量.文献表明, 超声/过硫酸盐体系的降解机理主要是热解和自由基协同作用的结果, 也有部分O2- ·作用(Li et al., 2013).猝灭剂实验只能确定· OH和SO4- ·的作用, 为便于研究, 本文将· OH和SO4- ·以外自由基的作用和热解统称为其他作用, 将不同作用引起的去除质量与初始投加质量换算为比例, 表示不同反应时间下SO4- ·作用、· OH作用和其他作用在降解过程中的占比, 并测定不同时间点体系的温度, 结果如图 6所示.
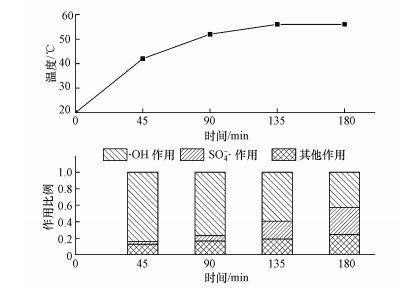 |
| 图 6 超声/K2S2O8体系降解左氧氟沙星反应中· OH、SO4- ·和其他作用的比例及温度变化 (左氧氟沙星浓度30 mg · L-1, 超声频率25 kHz, 超声功率360 W, 体积100 mL, K2S2O8浓度20 mmol · L-1, pH=9) Fig. 6 Comparison of levofloxacin degradation by · OH, SO4- ·and other actions and temperature changes in US/K2S2O8 systems |
从图 6可以看出, 反应初期, · OH对左氧氟沙星去除作用占比较大, SO4- ·和其他作用对左氧氟沙星去除作用较小.随着反应的进行, · OH对左氧氟沙星去除作用的比例逐渐减小, SO4- ·和其他作用对左氧氟沙星去除作用的比例逐渐增大.有研究表明(Wei et al., 2017), 在超声/K2S2O8体系中, · OH产生速率(1.3×10-8 L · mol-1 · s-1)高于SO4- ·(1.5×10-11 L · mol-1 · s-1);SO4- ·在水溶液中的存活时间(3×10-5~4×10-5 s)大于· OH(1×10-9 s)(张倩等, 2019).简言之, · OH的产生速度比SO4- ·快, SO4- ·的存活时间比· OH长.因此, 出现了· OH作用在反应初期较大, 随反应时间延长逐渐减弱, SO4- ·作用和其他作用在反应初期较小, 随着反应进行逐渐增大的实验现象.
如图 6所示, 随反应时间延长体系温度逐渐提高, 热解作用增强.此外, 文献表明, 温度对SO4- ·影响较大, 反应温度越高, 过硫酸盐过氧键越容易断裂, 产生的SO4- ·越多(付冬彬等, 2019).同时, 温度的变化对· OH也具有一定影响, 温度升高, 溶液中溶解氧的浓度会降低, 从而导致· OH浓度降低(Yang et al., 2019).
以上分析表明, 反应初期· OH作用较大, 随反应时间延长逐渐减小, SO4- ·作用在反应初期较小, 随着反应进行作用逐渐增大.
4 结论(Conclusions)1) 在左氧氟沙星浓度30 mg · L-1、过硫酸盐浓度20 mmol · L-1、超声功率360 W、pH=9条件下, 超声/K2S2O8体系反应180 min, 左氧氟沙星去除率达到90%, 效果优于超声体系(13.82%)和K2S2O8体系(5.89%), 超声/K2S2O8体系存在协同作用, 产生了更多的SO4- ·和· OH.
2) 超声/K2S2O8体系降解左氧氟沙星过程中, · OH和SO4- ·的产生有超声和链式反应两个途径, 其中, 链式反应的贡献较大.链式反应在自由基浓度较高条件下会发生猝灭, K2S2O8的存在是· OH产生的必要条件, K2S2O8浓度对SO4- ·的产生有重要影响, 但K2S2O8浓度过高对SO4- ·产生无益.
3) 超声/K2S2O8体系降解左氧氟沙星过程中SO4- ·与· OH是通过链式反应共同增减的, · OH在反应中占主导地位, 反应初期· OH作用较大, 随反应时间延长逐渐减小, SO4- ·作用在反应初期较小, 随着反应进行作用逐渐增大.
Avetta P, Pensato A, Minella M, et al. 2015. Activation of persulfate by irradiated magnetite:implications for the degradation of phenol under heterogeneous photo-Fenton-like conditions[J]. Environmental Science and Technology, 49(2): 1043-1050. DOI:10.1021/es503741d |
Benotti M J, Trenholm R A, Vanderford B J, et al. 2009. Pharmaceuticals and endocrine disrupting compounds in US drinking water[J]. Environmental Science and Technology, 43(3): 597-603. DOI:10.1021/es801845a |
Burke V, Richter D, Greskowiak J, et al. 2016. Occurrence of antibiotics in surface and groundwater of a drinking water catchment area in Germany[J]. Water Environment Research, 88(7): 652-659. DOI:10.2175/106143016X14609975746604 |
Chen W S, Huang G C. 2009. Sonochemical decomposition of dinitrotoluenes and trinitrotoluene in wastewater[J]. Journal of Hazardous Materials, 169(1/3): 868-874. |
Chen W S, Su Y C. 2012. Removal of dinitrotoluenes in wastewater by sono-activated persulfate[J]. Ultrasonics Sonochemistry, 19(4): 921-927. DOI:10.1016/j.ultsonch.2011.12.012 |
Chen W S, Huang C P. 2015. Mineralization of aniline in aqueous solution by electro-activated persulfate oxidation enhanced with ultrasound[J]. Chemical Engineering Journal, 266(15): 279-288. |
崔延瑞, 张璐璐, 程瑶, 等. 2018. 3种水中头孢曲松钠检测方法的对比[J]. 河南师范大学学报(自然科学版), 46(1): 84-88. |
Deng D, Lin X, Ou J, et al. 2015. Efficient chemical oxidation of high levels of soil-sorbed phenanthrene by ultrasound induced, thermally activated persulfate[J]. Chemical Engineering Journal, 265(1): 176-183. |
付冬彬, 陈盈盈, 王广生, 等. 2019. 超声联合热活化过硫酸盐处理垃圾渗滤液[J]. 水处理技术, 45(12): 125-128. |
Gao Y Q, Gao N Y, Wang W, et al. 2018. Ultrasound-assisted heterogeneous activation of persulfate by nano zero-valent iron (nZVI) for the propranolol degradation in water[J]. Ultrasonics Sonochemistry, 49: 33-40. DOI:10.1016/j.ultsonch.2018.07.001 |
Hao R Z, Zhao R T, Qiu S F, et al. 2015. Antibiotics crisis in China[J]. Science, 348(6239): 1100-1101. |
House D A. 1962. Kinetics and mechanism of oxidations by peroxydisulfate[J]. Chemical Reviews, 62(3): 185-203. DOI:10.1021/cr60217a001 |
Huang K C, Couttenye R A, Hoag G E. 2002. Kinetics of heat-assisted persulfate oxidation of methyl tert-butyl ether (MTBE)[J]. Chemosphere, 49(4): 413-420. DOI:10.1016/S0045-6535(02)00330-2 |
Hu X, Zhou Q, Luo Y. 2010. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, northern China[J]. Environmental Pollution, 158(9): 2992-2998. DOI:10.1016/j.envpol.2010.05.023 |
Kaur A, Kansal S K. 2016. Bi2WO6 nanocuboids:An efficient visible light active photocatalyst for the degradation of levofloxacin drug in aqueous phase[J]. Chemical Engineering Journal, 302(15): 194-203. |
Liang C J, Wang Z S, Bruellb C. 2007. Influence of pH on peroxydisulfate oxidation of TCE at ambient temperatures[J]. Chemosphere, 66(1): 106-113. DOI:10.1016/j.chemosphere.2006.05.026 |
Li B Z, Li L, Lin K F, et al. 2013. Removal of 1, 1, 1-trichloroethane from aqueous solution by a sono-activated persulfate process[J]. Ultrasonics Sonochemistry, 20: 855-863. DOI:10.1016/j.ultsonch.2012.11.014 |
Li B, Zhu J. 2016. Simultaneous degradation of 1, 1, 1-trichloroethane and solvent stabilizer 1, 4-dioxane by a sono-activated persulfate process[J]. Chemical Engineering Journal, 284(15): 750-763. |
Li M, Wei D B, Zhao H M, et al. 2013. Genotoxicity of quinolones:Substituents contribution and transformation products QSAR evaluation using 2D and 3D models[J]. Chemosphere, 95: 220-226. |
Liu Y Q, He X X, Fu Y S. 2016. Kinetics and mechanism investigation on the destruction of oxytetracycline by UV-254nm activation of persulfate[J]. Journal of Hazardous Materials, 305(15): 229-239. |
Luo S, Wei Z S, Dionysiou D D, et al. 2017. Mechanistic insight into reactivity of sulfate radical with aromatic contaminants through single-electron transfer pathway[J]. Chemical Engineering Journal, 327(1): 1056-1065. |
李轶涵, 姜恬, 周旭, 等. 2019. 热活化过硫酸盐氧化降解水溶液中的抗生素卡巴多司和奥喹多司[J]. 环境科学学报, 39(11): 3821-3831. |
Matzek L W, Carter K E. 2016. Activated persulfate for organic chemical degradation:A review[J]. Chemosphere, 151: 178-188. DOI:10.1016/j.chemosphere.2016.02.055 |
Monteagudo J M, Durán A, González R, et al. 2015. In situ chemical oxidation of carbamazepine solutions using persulfate simultaneously activated by heat energy, UV light, Fe2+ ions, and H2O2[J]. Applied Catalysis B:Environmental, 176-177: 120-129. DOI:10.1016/j.apcatb.2015.03.055 |
Monteagudo J M, Taliawy H E, Durána A, et al. 2018. Sono-activated persulfate oxidation of diclofenac:Degradation, kinetics, pathway and contribution of the different radicals involved[J]. Journal of Hazardous Materials, 357(5): 457-465. |
Nasuhoglu D, Rodayan A, Berk D, et al. 2012. Removal of the antibiotic levofloxacin (LEVO) in water by ozonation and TiO2 photocatalysis[J]. Chemical Engineering Journal, 189-190(1): 41-48. |
Nasseri S, Mahvi A H, Seyedsalehi M, et al. 2017. Degradation kinetics of tetracycline in aqueous solutions using peroxydisulfate activated by ultrasound irradiation:effect of radical scavenger and water matrix[J]. Journal of Molecular Liquids, 241: 704-714. DOI:10.1016/j.molliq.2017.05.137 |
Qian Y, Xue G, Chen J. 2018. Oxidation of cefalexin by thermally activated persulfate kinetics, products, and antibacterial activity change[J]. Journal of Hazardous Materials, 354(15): 153-160. |
Song W H, Rein K, O'Shea K E, et al. 2006. Ultrasonically induced degradation of microcystin-LR and -RR:Identification of products, effect of pH, formation and destruction of peroxides[J]. Environmental Science & Technology, 40(12): 3941-3946. |
Suslick K S. 1990. Sonochemistry[J]. Science, 247(4949): 1439-1445. DOI:10.1126/science.247.4949.1439 |
孙昕, 孙杰, 李鹏飞, 等. 2019. 超声活化过硫酸盐降解水中典型嗅味[J]. 环境科学, 40(4): 1811-1818. |
Sühnholz S, Kopinke F D, Mackenzie M. 2020. Reagent or catalyst?-FeS as activator for persulfate in water[J]. Chemical Engineering Journal, 387(1): 123804. |
Wang X, Wang L, Li J, et al. 2014. Degradation of Acid Orange 7 by persulfate activated with zero valent iron in the presence of ultrasonic irradiation[J]. Separation & Purification Technology, 122(3): 41-46. |
Wang S, Zhou N, Wu S, et al. 2015. Modeling the oxidation kinetics of sono-activated persulfate's process on the degradation of humic acid[J]. Ultrasonics Sonochemistry, 23: 128-134. DOI:10.1016/j.ultsonch.2014.10.026 |
Wang Q, Cao Y, Zeng H, et al. 2019. Ultrasound-enhanced zero-valent copper activation of persulfate for the degradation of bisphenol AF[J]. Chemical Engineering Journal, 335(1): 122143. |
Wei Z, Villamena F A, Weavers L K. 2017. Kinetics and mechanism of ultrasonic activation of persulfate:An in situ EPR spin trapping study[J]. Environmental Science & Technology, 51(6): 3410-3417. |
Xiao R Y, Wei Z S, Chen D, et al. 2014. Kinetics and mechanism of sonochemical degradation of pharmaceuticals in municipal wastewater[J]. Environmental Science & Technology, 48(16): 9675-9683. |
Yang L, Xue J M, He L Y, et al. 2019. Review on ultrasound assisted persulfate degradation of organic contaminants in wastewater:Influences, mechanisms and prospective[J]. Chemical Engineering Journal, 378(15): 122146. |
Yang Y, Lu X, Jiang J, et al. 2017. Degradation of sulfamethoxazole by UV, UV/H2O2 and UV/persulfate (PDS):Formation of oxidation products and effect of bicarbonate[J]. Water Research, 118(1): 196-207. |
Yen C H, Chen K F, Kao C M, et al. 2011. Application of persulfate to remediate petroleum hydrocarbon-contaminated soil:Feasibility and comparison with common oxidants[J]. Journal of Hazardous Materials, 186(2/3): 2097-2102. |
Yin R L, Guo W Q, Wang H Z, et al. 2018. Enhanced peroxymonosulfate activation for sulfamethazine degradation by ultrasound irradiation:Performances and mechanisms[J]. Chemical Engineering Journal, 335(1): 145-153. |
Zhang N, Zhang G, Chong S, et al. 2018. Ultrasonic impregnation of MnO2/CeO2, and its application in catalytic sono-degradation of methyl orange[J]. Journal of Environmental Management, 205(1): 134-141. |
Zhang X X, Li R P, Jia M K, et al. 2015. Degradation of ciprofloxacin in aqueous bismuth oxybromide (BiOBr) suspensions under visible light irradiation:a direct hole oxidation pathway[J]. Chemical Engineering Journal, 274(15): 290-297. |
张倩, 谢陈飞洋, 仇玥, 等. 2019. Fe/污泥基生物炭持久活化过硫酸盐降解酸性橙G[J]. 中国环境科学, 39(9): 3879-3886. |
 2020, Vol. 40
2020, Vol. 40