2. 北京林业大学环境科学与工程学院, 北京 100083;
3. 北京市昌平区水务局, 北京 102200;
4. 北京市北运河管理委员会昌平区管理段, 北京 102209;
5. 北京市昌平区沙河闸管理处, 北京 102206
2. College of Environmental Science and Engineering, Beijing Forestry University, Beijing 100083;
3. Water Bureau of Changping District, Beijing 102200;
4. North Canal Management Committee of Changping Section, Beijing 102209;
5. Shahe Sluice Management Office of Changping District, Beijing 102206
沉水植物是水生态系统中的重要初级生产者, 与其它类型水生植物相比, 具有独特的生态功能(何起利等, 2019), 主要体现在:①茎叶能够吸收氮、磷等营养物质并可释放化感物质抑制藻类生长;②根系可有效阻止风浪扰动引起的沉积物再悬浮, 防止底泥污染物的释放;③通过光合作用向水体复氧, 为水生动物和微生物提供充足氧环境;④增加水下环境空间生态位, 为水生生物提供栖息环境(Ferreira et al., 2018;王苏鹏等, 2019).因此, 构建沉水植物群落进行水生态修复, 对维持水生态系统稳定的清水状态及健康的水生生物群落结构具有重要的意义(Su et al., 2019).
然而, 沉水植物群落的构建过程会受到各种生物因素(如鱼类摄食、藻类竞争等)和非生物因素(如光照、温度、深水等)的影响(周裔文等, 2018;Yin et al., 2020).其中, 水体中氮、磷等营养盐的浓度是影响沉水植物构建的重要非生物因素之一.适宜的氮、磷浓度会促进沉水植物的生长(Zhang et al., 2018), 而过高的氮、磷浓度会抑制沉水植物的光合作用(宋玉芝等, 2011)或诱导产生氧化应激反应(Wang et al., 2008), 甚至直接对沉水植物造成毒害.目前, 国内外学者针对沉水植物对营养盐的耐受性已开展了大量研究.宋睿等(2011)研究发现, 当NH4+浓度低于0.6 mg·L-1时, 苦草生长状况良好, 但高于1.0 mg·L-1时, 苦草会受到抑制.Cao等(2009)研究发现, NH4+浓度为1.0 mg·L-1时, 可促进金鱼藻的生长, 但浓度为5.0 mg·L-1时, 金鱼藻开始受到抑制.周金波等(2018)研究发现, 苦草、轮叶黑藻、金鱼藻和小茨藻对NH4+的最大耐受浓度分别为6、6、4和2 mg·L-1.目前国内外已报道的文献多围绕NH4+对沉水植物的影响展开, 而关于水中NO3-和PO43-对沉水植物影响的研究相对较少.
在我国北方缺水地区再生水已成为河湖补给的重要来源之一(王怡等, 2018), 《城市污水再生利用景观环境用水水质》(GB/T18921—2002)标准中的氮、磷浓度远高于《地表水环境质量标准》(GB3838—2002)中Ⅴ类水限值, 并且再生水回用的河湖水体补水单一、流动性差且自净能力较弱, 使得再生水回用存在一定的环境风险(赵磊, 2019).北京市降水量较少, 水资源短缺, 再生水逐渐代替天然水, 成为河湖的主要补给水源.北京市包括沙河水库、清河、龙潭湖在内的一大批水体都属于再生水补给水源(张瑞等, 2016), 普遍存在NO3-和PO43-污染负荷严重的问题.针对北京市再生水补给河湖水库的水污染问题, 研究北京市典型沉水植物对NO3-和PO43-的耐受性, 对于北京市再生水补给河湖水库的水生态修复及其沉水植物群落的构建具有重要的理论指导意义.
沉水植物受到胁迫时会产生抗逆响应, 导致植物防御过氧化系统的重要保障酶过氧化氢酶(Peroxidase, POD)活性先增高后降低;胁迫严重时, 植物体会发生脂质过氧化作用和膜损伤(Ni et al., 2015), 产生丙二醛(Malondialdehyde, MDA) (Li et al., 2018;Singh et al., 2018);同时, 植物膜损伤又会影响到植物叶绿素(Chlorophyll, Chl)和蛋白质(Protein, Pr)的生成.Chl是与绿色植物光合作用最密切相关的一种色素, 其含量的高低对于植物的光合能力起着至关重要的作用, 光合作用也为植物的生长提供动力(简敏菲等, 2016).Pr在生物体中维持细胞结构和调节生理代谢方面发挥着重要作用.Chl和Pr能够间接反映植物的生长状况, 进而可以反映沉水植物对水体中NO3-和PO43-的耐受性.
基于此, 本文以北京市3种典型土著沉水植物轮叶黑藻、狐尾藻和金鱼藻为研究对象, 构建模拟水生生态系统, 通过测定过氧化氢酶(POD)、丙二醛(MDA)、叶绿素(Chl)和蛋白质(Pr)4个指标, 确定NO3-和PO43-对3种沉水植物的胁迫效应, 以期为沉水植物在北京再生水补给河湖水体的构建提供理论依据.
2 材料与方法(Materials and methods) 2.1 试剂与材料实验过程中使用到的所有化学药剂均购自国药集团化学试剂有限公司.轮叶黑藻、狐尾藻和金鱼藻购自北京运通园林绿化有限公司.为防止土壤中氮、磷进入水体, 影响实验结果, 实验采用纯天然红土(购自河南大横山园艺有限公司).红土使用前用自来水及蒸馏水反复冲洗多次, 并通过检测确保所用红土不向水体中释放氮、磷.
2.2 实验装置本实验装置采用PVC和有机玻璃板加工而成, 每个水箱的尺寸为60 cm×60 cm×80 cm(长×宽×高), 其中包括3个互不联通的小水箱, 尺寸均为60 cm×20 cm×80 cm(长×宽×高).为防止室外杂物落入槽内影响实验效果, 在每个水箱上均盖有透光的有机玻璃板, 尺寸为80 cm×30 cm×5 cm(长×宽×高).实验装置放置在北京林业大学环境楼采光较好的空旷位置.在不观察植物生长情况时, 采用不透光黑布遮住有机玻璃面以保证槽内不受其它光源影响实验.实验装置示意图及实物图见图 1a和1b.
 |
| 图 1 装置示意图和实物图(a.装置示意图, b.装置实物图, c.实验过程实物图) Fig. 1 Schematic and physical diagram of the device |
实验开始前选取长度一致、长势良好的轮叶黑藻、狐尾藻和金鱼藻, 用有土栽培营养液(唐智伟, 2018)培养5 d后, 再挑选生长状态良好的植株用蒸馏水反复冲洗后, 用吸水纸吸干水分, 称取4.5 g移栽至装有红土的培养箱(10 cm×15 cm×10 cm)中, 此时种植密度为3 g·L-1(张萌等, 2016), 株高约为15 cm, 种植后将培养箱放入水箱中, 并用不透光黑布遮挡侧面观测区域(图 1c).实验所需植物于5月初开始培养, 5月和6月进行实验.实验期间采用自然光照, 昼夜温度为白天(25±5) ℃、晚上(20±5) ℃.
本实验共设置7个水箱分别编号1~7, 均加入72 L已消除余氯的自来水.1~3号水箱控制PO43-浓度为0.1 mg·L-1, NO3-初始浓度分别为3、5、8 mg·L-1;4~6号水箱控制NO3-浓度为3 mg·L-1, PO43-初始浓度分别为0.2、0.4、0.6 mg·L-1;7号水箱不投加NO3-和PO43-, 作为空白对照.实验过程中定期补充蒸发所损耗的水分.
实验周期为35 d, 每4 d取植物叶片0.5 g测定其体内POD和MDA含量, 第1 d和第35 d取植物叶片1.0 g测定植物体内Chl和Pr含量, 研究NO3-和PO43-对3种沉水植物体内的酶活性、叶绿素和蛋白质的影响, 以确定3种沉水植物对NO3-和PO43-的耐受范围.各种指标每次测定重复3次, 取平均值.Chl和Pr指标的相对增长率(R)计算公式见式(1).
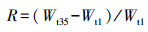
|
(1) |
式中, Wt35为实验结束后的各指标测定值, Wt1为试验开始第1 d的各指标的测定值.
2.4 分析方法采集的植物样品带回实验室进行分析, 测定POD、MDA、Chl和Pr 4个指标.POD和MDA分别采用北京索莱宝生物科技有限公司的试剂盒法和试剂盒硫代巴比妥酸(TBA)法测定, 具体步骤均参照北京索莱宝生物科技有限公司的试剂盒说明书(肖能文等, 2017), Chl采用丙酮提取法进行提取并采用紫外分光光度计法进行测定(李小方等, 2016;王哲, 2019), Pr的测定采用考马斯蓝法(高俊凤, 2006).
3 结果与讨论(Results and discussion) 3.1 三种沉水植物对水体中NO3-的耐受性研究 3.1.1 不同NO3-浓度对3种沉水植物体内POD含量的影响不同NO3-浓度下3种沉水植物体内POD含量变化如图 2所示.由图 2可以看出, 当NO3-浓度为3 mg·L-1时, 3种沉水植物体内的POD含量均无显著变化, 说明此浓度条件下3种沉水植物生长均未受到影响.当NO3-浓度升高至5 mg·L-1时, 金鱼藻和狐尾藻体内的POD含量均显著升高, 并均在第16 d时分别达到峰值25558.6 U·g-1和26264.2 U·g-1, 这说明金鱼藻和狐尾藻在NO3-为5 mg·L-1时会产生抗逆响应;之后POD含量逐渐下降, 并分别于第27 d和第23 d时低于对照组, 表明二者体内均发生较强的脂质过氧化作用和膜损伤.当NO3-浓度达到8 mg·L-1时, 金鱼藻和狐尾藻体内的POD含量增长率变化较NO3-浓度为5 mg·L-1时更加显著, 峰值出现时间提前并且峰值更高, 说明NO3-浓度由5 mg·L-1提升至8 mg·L-1时, 金鱼藻和狐尾藻产生更加强烈的抗逆响应, 并形成更强烈的脂质过氧化作用和膜损伤.由图 2c可以看出, 虽然NO3-浓度为8 mg·L-1时轮叶黑藻体内的POD含量略有升高, 但3种浓度条件下均未出现显著变化, 说明轮叶黑藻在实验范围内未产生抗逆响应, 即轮叶黑藻具有更强的耐NO3-能力.
 |
| 图 2 不同NO3-浓度下3种沉水植物体内POD含量变化 Fig. 2 Changes of POD content in three submerged plants under different NO3- concentrations |
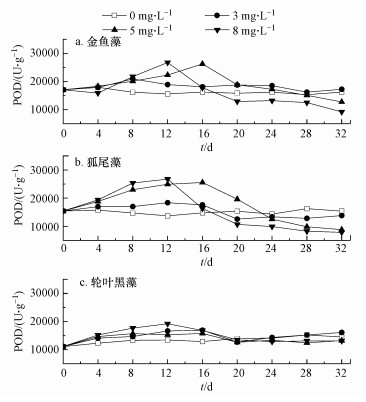
不同NO3-浓度下3种沉水植物体内MDA含量变化如图 3所示.由图 3可以看出, 当NO3-浓度为3 mg·L-1时, 3种沉水植物体内的MDA含量与对照组基本相同, 说明此浓度条件下3种沉水植物生长均未受到影响.当NO3-浓度升高至5 mg·L-1时, MDA逐渐在金鱼藻和狐尾藻体内产生积累, 并最终稳定在15.5 nmol·g-1和13.8 nmol·g-1, 表明NO3-刺激了两种沉水植物细胞膜发生了膜脂过氧化作用(Li et al., 2020), 膜系统逐渐受到损害.当NO3-浓度达到8 mg·L-1时, 金鱼藻和狐尾藻体内的MDA含量继续增加, 并持续稳定在18.0 nmol·g-1和17.2 nmol·g-1, 说明随着NO3-浓度的增加, 两种沉水植物受到更加强烈的膜脂过氧化作用.由图 3c可以看出, 虽然NO3-浓度为8 mg·L-1时轮叶黑藻体内的MDA含量略有升高, 但在3种浓度条件下均未出现显著变化.MDA是植物在逆境条件下, 体内自由基作用于脂质发生过氧化反应产生的最终产物, 其含量可反映植物遭受胁迫伤害的程度.因此, 轮叶黑藻具有更强的耐NO3-能力.
 |
| 图 3 不同NO3-浓度下3种沉水植物体内MDA含量变化 Fig. 3 Changes of MDA content in three submerged plants under different NO3- concentration |
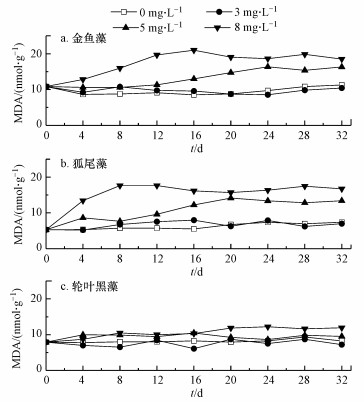
以第1 d植物体内Chl含量为背景值, 研究不同NO3-浓度下第35 d时3种沉水植物体内Chl含量变化及其较背景值的增长率情况, 结果如图 4所示.由图 4可以看出, 实验结束时所有实验组的3种沉水植物均为正增长, 说明NO3-在实验浓度范围内并没有完全抑制植物的生长及其光合作用, 但对不同植物类型的影响程度存在差异.当NO3-浓度从0 mg·L-1升高至8 mg·L-1时, 金鱼藻体内的Chl含量增长率先升高后降低.当NO3-浓度为3 mg·L-1左右时, 为金鱼藻提供了适量的氮素, 使其Chl生成量增加;随着浓度的继续升高, 金鱼藻体内的Chl生成量逐渐降低.狐尾藻在各浓度条件下的Chl增长率均低于金鱼藻, 金鱼藻比狐尾藻具有更好的耐受性, 当NO3-浓度由0 mg·L-1升高到5 mg·L-1时, 狐尾藻体内的Chl含量呈现出降低的趋势, 说明适宜狐尾藻Chl合成的NO3-浓度可能在0~3 mg·L-1之间.轮叶黑藻各浓度条件下的Chl增长率均低于狐尾藻, 并在0~8 mg·L-1的浓度范围内, 表现为持续下降, 表明轮叶黑藻Chl合成受NO3-影响较明显.
 |
| 图 4 不同NO3-浓度下3种沉水植物体内Chl含量变化 Fig. 4 Changes of Chl content in three submerged plants under different NO3- concentrations |
以第1 d植物体内Pr含量为背景值, 研究不同NO3-浓度下第35 d时3种沉水植物体内Pr含量变化及其较背景值的增长率情况, 结果如图 5所示.由图 5可以看出, 在NO3-浓度为8 mg·L-1时, 金鱼藻和狐尾藻体内的Pr出现了负增长, 可能是由于高浓度NO3-干扰了植物体内的代谢和光合作用从而抑制了植物的生长(Zhong et al., 2018), 或是由于NO3-使蛋白酶或其他分解代谢酶的活性增加, 这些酶被激活并破坏了Pr(Singh et al., 2006).其他实验浓度条件下, 3种沉水植物体内Pr含量均表现出不同程度的正增长.当NO3-浓度从0 mg·L-1升高至5 mg·L-1时, 金鱼藻体内的Pr含量先升高后降低, 适宜的NO3-浓度(3 mg·L-1左右)可促进金鱼藻的生长和Pr的生成;狐尾藻的体内的Pr含量持续降低, 说明狐尾藻对NO3-的耐受能力弱于金鱼藻.当NO3-浓度从0 mg·L-1升高至8 mg·L-1时, 轮叶黑藻的Pr增长率从74.5%持续下降至29.6%, 变化率明显低于其他两种植物类型, 说明轮叶黑藻具有更强的耐受性.
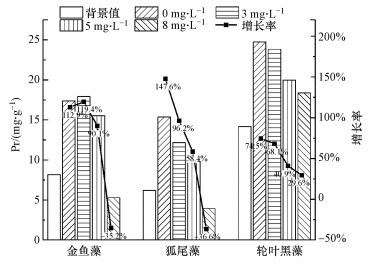 |
| 图 5 不同NO3-浓度下3种植物体内Pr含量变化 Fig. 5 Changes in Pr content of three plants under different NO3- concentrations |
通过对植物POD、MDA、Chl和Pr 4种指标进行检测发现, 当NO3-浓度为3 mg·L-1时, 3种沉水植物体内的POD、MDA和Chl均未发生变化, Pr虽有所变化但不显著, 表明3种沉水植物在此浓度下并未受到胁迫作用, 未发生抗逆响应.当NO3-浓度提升到5 mg·L-1时, 金鱼藻和狐尾藻最先受到胁迫, 产生H2O2的同时发生抗逆响应生成POD, 导致两者体内POD含量升高, 产生的H2O2作用于植物细胞, 发生脂质过氧化作用和膜损伤, 最终生成MDA, 导致两者体内MDA均升高;同时, NO3-浓度过高也影响了光合作用及Chl的合成(Shrestha et al., 2012), 导致Chl含量降低, 植物膜损伤及光合作用下降等问题, 又导致植物体内Pr合成量降低;轮叶黑藻在此浓度下并未发生抗逆响应, 因此, POD及MDA并未发生变化.当NO3-浓度提升至8 mg·L-1时, 金鱼藻和狐尾藻受到的胁迫作用进一步增强, 4种指标变化更为明显, 此浓度条件下, 轮叶黑藻也开始受到胁迫作用, POD和MDA出现小幅度增加, Chl和Pr出现小幅度降低.
因此, 轮叶黑藻对NO3-具有较强的耐受性, 其耐受浓度达到8 mg·L-1, 金鱼藻和狐尾藻对NO3-的耐受性相对较差, 其耐受浓度介于3~5 mg·L-1之间.
3.2 三种沉水植物对水体中PO43-的耐受性研究3种沉水植物对水体中PO43-的耐受性研究方法与NO3-的耐受性研究相同.不同PO43-浓度下3种沉水植物体内POD、MDA、Chl和Pr含量变化如图 6所示.由图 6可以看出, 当PO43-浓度为0.2 mg·L-1时, 3种沉水植物体内的POD、MDA和Pr均未发生变化, 表明3种沉水植物在此浓度下并未受到胁迫作用, 未发生抗逆响应, 但金鱼藻和狐尾藻体内的Chl变化较为明显, 可能是由于PO43-抑制了两者的光合作用和叶绿素生成(Radwan et al., 2016).当PO43-浓度提升到0.4 mg·L-1时, 3种沉水植物均受到不同程度的胁迫, 产生H2O2的同时发生抗逆响应生成POD, 导致体内POD含量升高, 3种沉水植物体内POD含量达到峰值的排序为:轮叶黑藻20016.6 U·g-1(第12 d)<金鱼藻21127.6 U·g-1(第8 d)<狐尾藻29173.4 U·g-1(第20 d);产生的H2O2作用于植物细胞, 发生脂质过氧化作用和膜损伤, 最终生成MDA, 导致三者体内MDA含量均升高, 3种沉水植物体内MDA含量达到峰值的排序为:金鱼藻18.5 nmol·g-1鲜重(第12 d)<轮叶黑藻18.6 nmol·g-1(第16 d)<狐尾藻27.5 nmol·g-1(第16 d), 说明PO43-刺激了3种沉水植物细胞膜发生了膜脂过氧化作用, 膜系统受到损害, 且狐尾藻所受胁迫性最大, 金鱼藻和轮叶黑藻的耐受性相同.当PO43-浓度为0.6 mg·L-1时, 3种沉水植物受到的胁迫作用进一步增强, POD和MDA也变化更为明显.
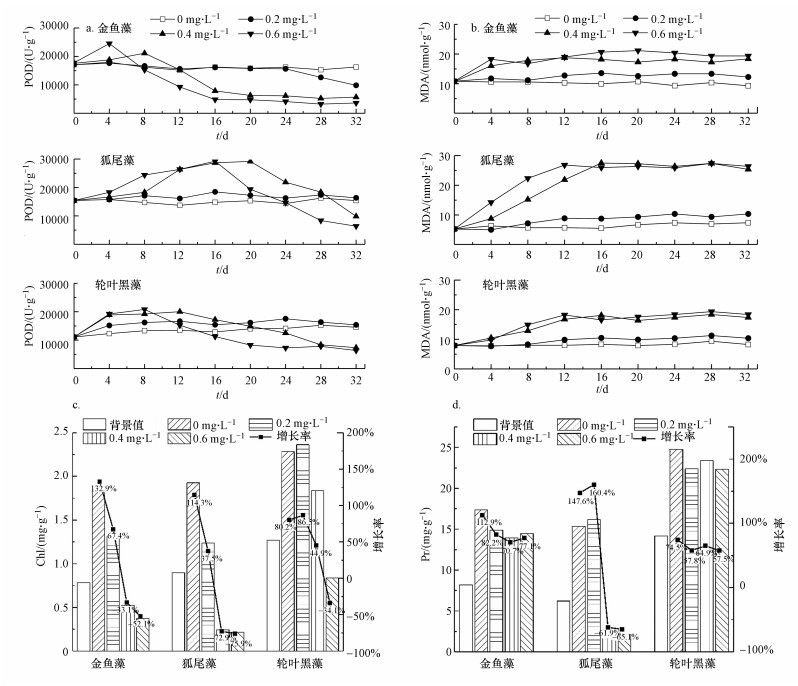 |
| 图 6 不同PO43-浓度下3种植物体内POD(a)、MDA(b)、Chl(c)和Pr(d)含量变化 Fig. 6 Changes in POD(a)、MDA(b)、Chl(c) and Pr(d) content of three plants under different PO43- concentrations |
磷是类囊体膜中不可缺少的成分, 类囊体是植物细胞中色素和光合蛋白复合物的重要载体(Tang et al., 2019), 适量的磷浓度能够促进Chl的合成.当PO43-浓度从0 mg·L-1升高到0.2 mg·L-1时, 轮叶黑藻的Chl增长率先增后降, 说明轮叶黑藻的最适PO43-浓度为0.2 mg·L-1;而金鱼藻和狐尾藻的Chl增长率降低, 说明两种沉水植物的最适PO43-浓度在0~0.2 mg·L-1之间.当PO43-浓度为0.4~0.6 mg·L-1时, 金鱼藻和狐尾藻均出现了负增长, 轮叶黑藻在PO43-浓度达到0.6 mg·L-1时出现负增长, 可能是由于高浓度PO43-不仅干扰了植物体代谢和光合作用, 甚至导致细胞膜发生了膜脂过氧化作用, 膜系统受到损害.
金鱼藻和轮叶黑藻Pr含量受PO43-浓度变化影响较小, 表明在两种植物体内各个生理活动均较为活跃, 可能是由于植物体中的抗氧化酶被激活, 保证了有机体的稳定性(Nguyen et al., 2018).狐尾藻受PO43-浓度变化影响较大, 当PO43-浓度从0 mg·L-1增长到0.6 mg·L-1时, Pr增长率先上升后下降, 且在PO43-浓度为0.4和0.6mg·L-1时, Pr增长率出现负增长, 表明狐尾藻在这两个浓度梯度中体内的各个生理活动所受到的抑制性较强.
因此, 狐尾藻对PO43-的耐受性最差, 其耐受浓度约为0.2 mg·L-1;轮叶黑藻和金鱼藻的耐受性相当, 当PO43-浓度达到0.4 mg·L-1时开始出现显著胁迫.
4 结论(Conclusions)1) 轮叶黑藻对NO3-具有较强的耐受性, 其耐受浓度达到8 mg·L-1, 金鱼藻和狐尾藻对NO3-的耐受性较差, 其耐受浓度介于3~5 mg·L-1之间.因此, 在本研究的实验条件下, 当水体NO3-浓度<5 mg·L-1时, 建议3种沉水植物同时种植, 群落物种多样性越高, 群落的稳定性越高.但当NO3-浓度>8 mg·L-1时, 建议种植轮叶黑藻.
2) 狐尾藻对PO43-的耐受性最差, 其耐受浓度约为0.2 mg·L-1;轮叶黑藻和金鱼藻的耐受性相当, 当PO43-浓度达到0.4 mg·L-1时开始出现显著胁迫.因此, 在本研究实验条件下, 当水体PO43-浓度<0.2 mg·L-1时, 建议3种沉水植物同时种植, 但当PO43-浓度在0.2~0.4 mg·L-1之间时, 建议种植轮叶黑藻和金鱼藻.
Cao T, Xie P, Ni L, et al. 2009. Carbon and nitrogen metabolism of an eutrophication tolerative macrophyte, Potamogeton crispus, under NH4+ stress and low light availability[J]. Environmental and Experimental Botany, 66(1): 74-78. DOI:10.1016/j.envexpbot.2008.10.004 |
Ferreira T F, Crossetti L O, Marques D M L M, et al. 2018. The structuring role of submerged macrophytes in a large subtropical shallow lake:Clear effects on water chemistry and phytoplankton structure community along a vegetated-pelagic gradient[J]. Limnologica, 69: 142-154. DOI:10.1016/j.limno.2017.12.003 |
高俊凤. 2006. 植物生理学实验指导[M]. 北京: 高等教育出版社.
|
何起利, 洪鑫, 全渊康. 2019. 清晖河生态修复技术中的沉水植物技术探讨[J]. 水资源开发与管理, (11): 25-28. |
简敏菲, 汪斯琛, 余厚平, 等. 2016. Cd2+、Cu2+胁迫对黑藻(Hydrilla verticillata)的生长及光合荧光特性的影响[J]. 生态学报, 36(6): 1719-1727. |
Li B, Gu B W, Yang Z G, et al. 2018. The role of submerged macrophytes in phytoremediation of arsenic from contaminated water:A case study on Vallisneria natans (Lour) Hara[J]. Ecotoxicology EnvironMental Safety, 165: 224-231. DOI:10.1016/j.ecoenv.2018.09.023 |
Li H M, Li Q, Luo X, et al. 2020. Responses of the submerged macrophyte Vallisneria natans to a water depth gradient[J]. Science of theTotal Environment, 701: 134944. DOI:10.1016/j.scitotenv.2019.134944 |
李小方, 张志良. 2016. 植物生理学实验指导[M]. 第5版. 北京: 高等教育出版社, 46-51.
|
Nguyen H, Lin K H, Hsiung T C, et al. 2018. Biochemical and physiological characteristics of photosynthesis in plants of two calathea species[J]. International Journal of Molecular Sciences, 19(3): 704. DOI:10.3390/ijms19030704 |
Ni L, Jie X, Wang P, et al. 2015. Effect of linoleic acid sustained-release microspheres on Microcystis aeruginosa antioxidant enzymes activity and microcystins production and release[J]. Chemosphere, 121: 110-116. DOI:10.1016/j.chemosphere.2014.11.056 |
Radwan D E M, Fayez K A. 2016. Photosynthesis antioxidant status and gas-exchange are altered by glyphosate application in peanut leaves[J]. Photosynthetica, 54(2): 307-316. DOI:10.1007/s11099-016-0075-3 |
Shrestha S, Brueck H, Asch F. 2012. Chlorophyll index, photochemical reflectance index and chlorophyll fluorescence measurements of rice leaves supplied with different N levels[J]. Journal of Photochemistry Photobiology B:Biology, 113: 7-13. DOI:10.1016/j.jphotobiol.2012.04.008 |
Singh S, Eapen S, D'Souza S F. 2006. Cadmium accumulation and its influence on lipid peroxidation and antioxidative system in an aquatic plant, Bacopa monnieri L.[J]. Chemosphere, 62(2): 233-246. DOI:10.1016/j.chemosphere.2005.05.017 |
Singh P, Prasad S M. 2018. Antioxidant enzyme responses to the oxidative stress due to chlorpyrifos, dimethoate and dieldrin stress in palak (Spinacia oleracea L.) and their toxicity alleviation by soil amendments in tropical cropland[J]. Science Total Environment, 35: 985-999. |
宋睿, 姜锦林, 耿金菊, 等. 2011. 不同浓度铵态氮对苦草的生理影响[J]. 中国环境科学, 31(3): 98-103. |
宋玉芝, 杨美玖, 秦伯强. 2011. 苦草对富营养化水体中氮磷营养盐的生理响应[J]. 环境科学, 32(9): 2569-2575. |
唐智伟.2018.三种沉水植物对水体中氮磷的耐受性及其去除效能研究[D].北京: 北京林业大学
|
Su H J, Chen J, Wu Y, et al. 2019. Morphological traits of submerged macrophytes reveal specific positive feedbacks to water clarity in freshwater ecosystems[J]. Science of the Total Environment, 684: 578-586. DOI:10.1016/j.scitotenv.2019.05.267 |
Tang Q H, Peng L, Yang Y, et al. 2019. Total phosphorus-precipitation and Chlorophyll a-phosphorus relationships of lakes and reservoirs mediated by soil iron at regional scale[J]. Water Research, 154: 136-143. DOI:10.1016/j.watres.2019.01.038 |
Wang C, Zhang S H, Wang P F, et al. 2008. Metabolic adaptations to ammonia-induced oxidative stress in leaves of the submerged macrophyte Vallisneria natans (Lour.) Hara[J]. Aquatic Toxicology, 87(2): 88-98. DOI:10.1016/j.aquatox.2008.01.009 |
王哲.2019.沉水植物狐尾藻(Myriophyllum verticillatum L.)对水体铵态氮胁迫响应的研究[D].上海: 上海师范大学
|
王苏鹏, 陈吉炜, 刘意恒, 等. 2019. 城区河流中沉水植物分布特征及其影响因素分析-以宁波城区内河为例[J]. 湖泊科学, 31(4): 1064-1074. |
王怡, 郭晓瑜, 赵超. 2018. 营养物质和藻类在再生水制取及景观水体补给中的变化[J]. 西安建筑科技大学学报(自然科学版), 50(1): 105-110. |
肖能文, 张宇, 李卫兵, 等. 2017. 1, 2, 4-三氯苯对金鱼藻氧化压力及生理特性的影响[J]. 环境科学与技术, 40(1): 49-54. |
Yin X J, Lu J, Wang Y C, et al. 2020. The abundance of nirS-type denitrifiers and anammox bacteria in rhizospheres was affected by the organic acids secreted from roots of submerged macrophytes[J]. Chemosphere, 240: 124903. DOI:10.1016/j.chemosphere.2019.124903 |
Zhang L, Hoshika Y, Carrari E, et al. 2018. Effects of nitrogen and phosphorus imbalance on photosynthetic traits of poplar Oxford clone under ozone pollution[J]. Journal of Plant Research, 131(6): 915-924. DOI:10.1007/s10265-018-1071-4 |
张萌, 李雄清, 邹新, 等. 2016. 典型沉水植物修复富营养水体的最优种植密度[J]. 湖北农业科学, 55(20): 5218-5224. |
张瑞, 刘操, 孙德智, 等. 2016. 北京地区再生水补给型河湖水质改善工程案例分析与问题诊断[J]. 环境科学研究, 29(12): 1872-1881. |
赵磊.2019.用于沙河水库水质净化的生态浮岛构建与实验研究[D].北京: 北京林业大学
|
Zhong G D, Wu Z, Yin J, et al. 2018. Responses of Hydrilla verticillata (L.f.) Royle and Vallisneria natans (Lour.) Hara to glyphosate exposure[J]. Chemosphere:Environmental Toxicology and Risk Assessment, 193(1): 385-393. |
周金波, 金树权, 包薇红, 等. 2018. 不同浓度氨氮对4种沉水植物的生长影响比较研究[J]. 农业环境与发展, 35(1): 74-81. |
周裔文, 许晓光, 韩睿明, 等. 2018. 水体氮磷营养负荷对苦草净化能力和光合荧光特性的影响[J]. 环境科学, 39(3): 1180-1187. |
 2021, Vol. 41
2021, Vol. 41


