2. 中南财经政法大学环境科学与工程系, 武汉 430073;
3. 中南财经政法大学环境管理与政策研究所, 武汉 430073
2. Department of Environmental Science and Engineering, Zhongnan University of Economics and Law, Wuhan 430073;
3. Institute of Environmental Management and Policy, Zhongnan University of Economics and Law, Wuhan 430073
矿石在开采、洗选、冶炼过程中会产生大量的废石(郑刘春等, 2015), 大多数未经处理自然堆放, 经过长期淋浸、氧化及微生物作用形成酸性矿山废水(AMD)(魏东洋等, 2019).AMD的pH值通常为2.00~4.00, 且含有高浓度Fe、SO42-及重金属元素(曾威鸿等, 2020).我国每年产生的采矿废水约占全国工业废水排放总量的10%, 但只有4.23%的采矿废水被处理, 其余的直接排入自然界中, 从而严重污染矿区周边土壤和水源, 导致动植物大量死亡(朱琳, 2011; 牟力等, 2017), 其中的重金属离子等还可通过食物链富集进入人体而影响生命健康(李宁, 2015).
AMD的产生是废弃矿石长期氧化的结果.矿山废石中主要的氧化还原活性成分是金属硫化矿物, 可在水、氧气和微生物存在的环境下被氧化分解(MS2+2H2O+O2→M2++SO42- +4H+), 释放大量的金属离子(Kaur et al., 2018).大量研究表明, 在矿山环境中, Acidithiobacillus ferrooxidans (A.ferrooxidans)对金属硫化矿物的氧化分解具有重要作用(蔡长江等, 2014).在A.ferrooxidans存在条件下, 金属硫化矿物的生物氧化速率是自然氧化速率的106倍(Xie et al., 2018).研究发现, 不同矿产类型对AMD水质情况影响较大(蒋仲安, 2009; 巫銮东, 2010; 朱琳, 2011; Pinto et al., 2011).例如, 湖北谭山硫铁矿区废水的pH为2.00~3.00, SO42-浓度为4000~5000 mg·L-1, Fe浓度可超过900 mg·L-1; 安徽凹山磁铁矿区废水的pH小于2.00, 废水中SO42-浓度高达7789 mg·L-1; 福建铜矿区废水的pH低至1.30, Fe和Cu浓度分别达到8210 mg·L-1和390 mg·L-1.可见, 富含硫化矿物的矿石更容易产生AMD.然而, 目前关于不同类型硫化矿物随时间变化的产酸特征及污染物释放规律的报道相对较少.
此外, 与硫化矿物接触的地表水或地下水中所存在的作为微生物营养的无机离子差别亦迥异.这些营养物质在一定程度上有利于AMD中特有微生物(如A.ferrooxidans)的生命活动, 能够显著加快硫化矿物的氧化分解, 直接加剧水质的污染(Kefeni et al., 2017).因此, 本研究选择富含硫化矿物的黄铁矿、磁黄铁矿、黄铜矿作为能源底物, 考察A.ferrooxidans介导下3种硫化矿物的生物产酸特点及污染物(Fe2+、TFe、SO42-)的释放规律; 同时, 以不同浓度梯度的9K培养基来进一步研究营养水平对硫化矿物生物产酸效应的影响及机理, 以期为不同类型矿山中AMD的形成规律和调控提供理论参考.
2 材料与方法(Materials and methods) 2.1 供试材料9K液体培养基的配制(Silverman et al., 1959): (NH4)2SO4 3.5 g、KCl 0.119 g、K2HPO4 0.058 g、CaSO4·4H2O 0.0168 g、MgSO4·7H2O 0.583 g, pH=2.50, 蒸馏水1000 mL.
A.ferrooxidans的制备(Harahuc et al., 2000): 将密度为4×106 cell·mL-1的A.ferrooxidans菌液按10%(V/V)接种到含一定体积9K液体培养基的三角瓶中, 按160 mmol·L-1的Fe2+浓度添加FeSO4·7H2O, 用1∶1 H2SO4调节体系pH值至2.50;然后将三角瓶置于28 ℃、180 r·min-1摇床中振荡扩培, 待指数生长阶段后期停止培养;将扩培终点混合溶液用中速定性滤纸过滤以去除合成的次生铁矿物沉淀, 所得滤液即为供试A.ferrooxidans菌液.因A.ferrooxidans储存时间不宜过长, 为确保其具备较强的生物氧化活性, 每批次实验前都通过上述方法重新扩培, 并采用双层平板计数法测得A.ferrooxidans密度(王世梅等, 2005).
矿石样品: 黄铁矿(含FeS2约73%)、黄铜矿(含CuFeS2约82%)和磁黄铁矿(含FeS约78%)为市场购置样品.黄铁矿、黄铜矿和磁黄铁矿样品首先用锤子敲碎, 然后用玛瑙研磨机粉碎, 筛选出粒径在60~100目之间的颗粒, 在无水乙醇中浸泡2 h, 然后用去离子水清洗两遍, 40 ℃烘干备用.
2.2 不同能源底物的生物产酸效果及污染物释放特点比较准确称取黄铁矿、黄铜矿、磁黄铁矿各5.00 g, 分别置于250 mL三角瓶中, 依次加入135 mL去离子水, 用1∶1 H2SO4调节pH值至2.20, 然后接种密度为4×107 cell·mL-1的A.ferrooxidans 15 mL.用无菌纱布将三角瓶封口后, 置于28 ℃、180 r·min-1的摇床中持续振荡反应38 d.每种矿物设置3个重复.期间, 定时测定各体系pH值, 并取2 mL样品经0.45 μm滤膜过滤, 分析滤液中Fe2+、TFe和SO42-的浓度.因实验周期较长, 为避免水分蒸发导致的实验误差, 每次取样前都预先补充去离子水至上一次取样完成后的有效体积.
2.3 不同营养水平对黄铁矿生物产酸效果及污染物释放影响准确称取5.00 g黄铁矿置于250 mL三角瓶中, 根据营养水平不同将上述三角瓶设置如下4个处理: ①加入去离子水135 mL, 记为0×9K组; ②加入33.75 mL 9K培养基, 再用去离子水补充至135 mL, 记为1/4×9K组; ③加入67.50 mL 9K培养基, 再用去离子水补充至135 mL, 记为1/2×9K组; ④加入135 mL 9K培养基, 记为1×9K组.用1∶1 H2SO4调节各体系pH值至2.20, 然后依次加入密度为7×106 cell·mL-1的A.ferrooxidans 15 mL.用无菌纱布将三角瓶封口后, 置于28 ℃、180 r·min-1的摇床中持续振荡反应16 d.每种矿物设置3个重复.期间, 定时测定各体系pH值, 并取2 mL样品经0.45 μm滤膜过滤, 分析滤液中Fe2+、TFe和SO42-的浓度.因实验周期较长, 为避免水分蒸发导致的实验误差, 每次取样前都预先补充去离子水至上一次取样完成后的有效体积.培养终点时, 用中速定性滤纸收集矿物(包括添加的黄铁矿), 60 ℃烘干后进行矿物相(XRD)鉴定和扫描电镜(SEM)观察.
2.4 测定方法溶液pH值采用METTLER TOLEDE-FE20型pH计进行测定, 其最小精度为0.01.Fe2+与TFe浓度采用邻菲啰啉比色法测定, Fe3+浓度为TFe与Fe2+浓度的差值(Ma et al., 2016).SO42-浓度采用硫酸钡比浊法测定(鲍士旦, 2000).为减少测定过程中的随机误差, 分析时随机抽取样品的10%做平行双样测定, 同时做到平行样品测定结果的相对标准偏差小于5%.矿物相采用X射线衍射仪测定(XRD, Bruker D8), 测试工作条件为: 管电压40 kV, 管电流40 mA, 扫描区间10°~80°(2θ), 步长0.01°, 扫描速率6°·min-1, Cu靶.SEM采用SU8010型扫描电镜观察.
2.5 数据处理及绘图使用Microsoft Office Excel进行数据分析, 获得每个数据点的平均值及标准偏差, 所得数据采用Origin 2018进行分析作图.
3 结果与讨论(Results and discussion) 3.1 不同能源底物的生物产酸效果及污染物释放特点比较 3.1.1 不同能源底物组溶液pH变化分析磁黄铁矿、黄铜矿及黄铁矿生物氧化过程中溶液pH值变化如图 1所示.pH值的变化主要受溶液中生化反应消耗或产生H+影响, 当能源底物不同时, 溶液中发生的生化反应方程式也存在差异(Lilova et al., 2005).磁黄铁矿组和黄铜矿组pH值变化趋势基本一致, 反应初期pH值保持升高, 并分别在第4 d和第7 d达到最高值, 之后逐渐下降直至第11 d时保持平稳.由反应式(1)~(2)可知, 磁黄铁矿和黄铜矿的氧化均为耗酸反应, 导致pH上升.实验观察磁黄铁矿和黄铜矿组在反应进行到第7 d时沉淀颜色呈乳黄色.根据前人对AMD中产生的乳黄色沉淀进行X射线衍射分析的结果推测该沉淀为单质硫(蒋磊等, 2007).后期体系pH值下降是单质硫发生氧化反应(式(3))产生H+所致.
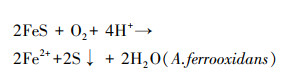
|
(1) |
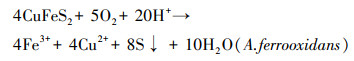
|
(2) |
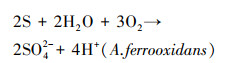
|
(3) |
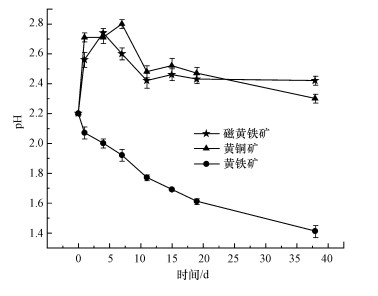 |
| 图 1 磁黄铁矿、黄铜矿及黄铁矿生物氧化过程中溶液pH值随时间的变化 Fig. 1 Changes of pH in solution with time during biological oxidation of pyrrhotite, chalcopyrite and pyrite |
不同于磁黄铁矿和黄铜矿组, 黄铁矿组pH值一直保持下降趋势, 最终达到1.41, 这与前人实验结论一致(蒋磊等, 2007; 乔星星等, 2018).黄铁矿的直接氧化(反应式(4))和间接氧化(反应式(5))均为产酸反应, 生成的Fe2+在A.ferrooxidans的作用下迅速氧化为Fe3+(反应式(6)).虽然该过程为耗酸反应, 但总反应仍存在产酸效应, 导致体系pH值降低.可见, 以黄铁矿作为A.ferrooxidans能源物质会导致体系pH值不断下降, 且最终pH值远低于磁黄铁矿和黄铜矿组.
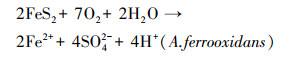
|
(4) |
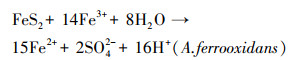
|
(5) |
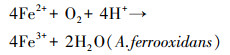
|
(6) |
从图 2可以看出, 不同能源底物组溶液中SO42-、TFe和Fe2+浓度在11 d前大致处于动态平衡中, 即该阶段各硫化矿物释放污染物的程度较小.这是由于体系无营养成分时, 微生物无法完成正常繁殖过程, 必须吸附在硫化矿物表面才能利用能源物质(周顺桂等, 2002).硫化矿物为固体介质, 微生物需要克服界面作用到达矿物表面, 此吸附过程势必要消耗一段时间(杨松荣等, 2003; 柳建设等, 2006).虽然反应初期A.ferrooxidans很难快速附着在硫化矿物表面, 但通过pH值的变化趋势可以判断, 仍有部分A.ferrooxidans优先与硫化矿物发生接触并消耗能源底物.根据前人研究可知, AMD产生过程中, S元素在溶液中可能有多种存在形式, 如SnO62-、S0等, 然而它们绝大部分都会被氧化为SO42-, 因而SO42-成为AMD中的主要污染物之一(何环, 2009; 刘金艳等, 2013; Tu et al., 2017).由图 2还可知, 第11 d后, 磁黄铁矿、黄铜矿及黄铁矿组SO42-浓度随时间延长不断增加, 增长幅度依次为黄铁矿>磁黄铁矿>黄铜矿.
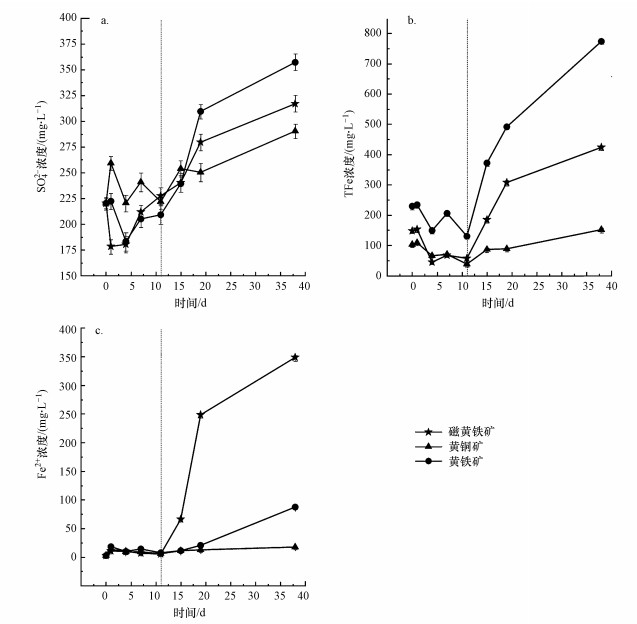 |
| 图 2 磁黄铁矿、黄铜矿及黄铁矿生物氧化过程中SO42-、TFe、Fe2+浓度随时间的变化 Fig. 2 Variation of SO42-, TFe and Fe2+ concentration over time during oxidation process of pyrrhotite, chalcopyrite and pyrite |
生化反应11 d后, 各处理组TFe和Fe2+浓度均呈上升趋势.其中, 磁黄铁矿组Fe2+浓度上升较快, 且TFe和Fe2+浓度的增加趋势基本一致.由反应式(1)可知, A.ferrooxidans氧化磁黄铁矿产生的Fe以正二价态形式存在, 说明以磁黄铁矿为能源物质的条件下, A.ferrooxidans活性不强, 对离子态的Fe2+氧化能力较弱.然而, 第11~19 d, 黄铁矿组溶液中Fe2+浓度上升趋势相对缓慢, 而TFe浓度增加较为迅速, 说明此时的A.ferrooxidans仍能够不断地将产生的Fe2+氧化为Fe3+, 这与Tu等(2017)和乔星星等(2018)的研究结果类似.第19 d后, 黄铁矿组溶液中Fe2+/TFe比例上升, 分析认为由于长时间的反应, 在缺乏营养条件下, A.ferrooxidans数量减少、活性变弱.与此现象类似的, 蒋磊等(2007)在考察硫化矿物的生物氧化过程中发现, A.ferrooxidans数量在15~22 d之间出现明显的减少趋势.对应地, 黄铜矿组体系反应全过程Fe2+浓度一直维持在较低水平, TFe增长趋势也并不显著.可见, 以黄铜矿为能源物质时, A.ferrooxidans对其生物氧化作用较弱.第38 d时, 各体系中SO42-和TFe最终浓度依次为黄铁矿>磁黄铁矿>黄铜矿.显然, 黄铁矿更容易受A.ferrooxidans的影响而释放出更多的污染物.
3.2 不同营养水平对黄铁矿生物产酸效果及污染物释放影响 3.2.1 不同营养水平组pH值变化分析前已述及, 黄铁矿作为能源底物时, 由于发生了生化反应(4)~(6), 从而导致溶液pH值不断下降(图 1).图 3表明营养水平在黄铁矿的生物产酸过程中也起着至关重要的作用.4个处理体系pH值下降的速度和幅度依次为: 1×9K组≈1/2×9K组>1/4×9K组> 0×9K组, 反应最终pH值分别为1.29、1.30、1.44、1.68.说明充足的营养会提高A.ferrooxidans活性或繁衍速度, 从而加快其对黄铁矿的生物氧化及产酸效应, 导致酸性矿山废水产生.
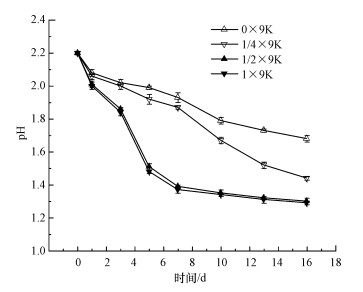 |
| 图 3 营养水平对生物氧化过程中溶液pH值的影响 Fig. 3 Effect of nutrient supply on solution pH in the process of biological oxidation |
黄铁矿生物氧化过程中溶液SO42-变化如图 4a所示.由于9K培养基中存在(NH4)2SO4和MgSO4等, 4个营养水平组添加的9K培养基量不同导致初始SO42-浓度存在较大差异.整体来看, 0×9K组SO42-浓度呈缓慢上升趋势, 这与图 2中黄铁矿处理的SO42-浓度变化趋势一致; 而1/4×9K、1/2×9K和1×9K组反应体系SO42-浓度变化过程相似, 第1~5 d先逐渐下降之后又开始有所回升, 特别地, 在3个含9K培养基体系中都观察到有赭黄色沉淀物生成.理论上, 由生化反应式(4)~(6)可知, 在A.ferrooxidans的作用下, 黄铁矿体系中SO42-浓度应该呈逐渐上升趋势.猜测1/4×9K、1/2×9K和1×9K组中SO42-浓度下降可能跟生成的赭黄色沉淀物有一定的关系.
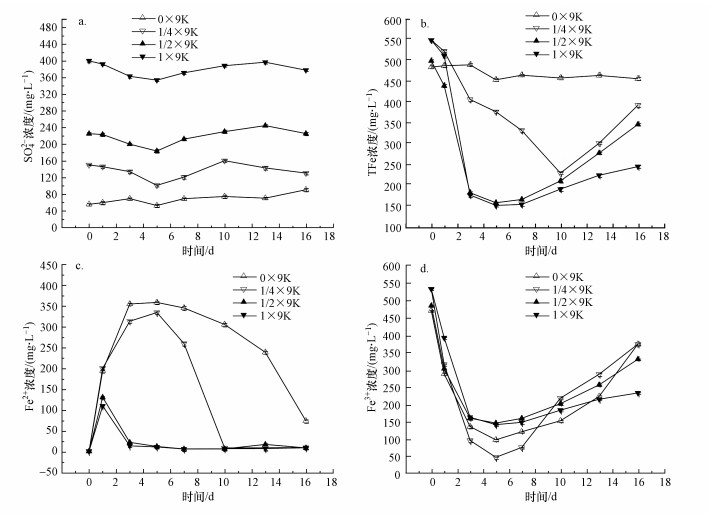 |
| 图 4 不同营养水平对生物氧化过程中SO42-、TFe、Fe2+和Fe3+浓度随时间变化的影响 Fig. 4 Effects of different nutrient supply on the variation of SO42-, TFe, Fe2+ and Fe3+ concentration with time during biological oxidation |
溶液中的TFe、Fe2+和Fe3+浓度随时间变化如图 4b~4d所示.4个营养水平组的初始TFe浓度接近, 其主要来自接种的A.ferrooxidans菌液(含Fe3+).在为期16 d的生化反应时间内, 1/2×9K和1×9K组的TFe浓度迅速下降至第5 d的最低值后又开始缓慢回升; 1/4×9K组TFe浓度下降幅度迟缓直至第11 d才下降至最低值; 而0×9K处理TFe浓度在整个反应过程中的变化幅度较小.对应地, 4组溶液Fe2+浓度均呈现先上升后下降的趋势, 浓度变化幅度依次为: 0×9K>1/4×9K>1/2×9K≈1×9K;并且, 高营养水平体系中Fe2+浓度的上升和下降周期明显缩短.而4个处理体系Fe3+浓度均呈现先大幅度降低后缓慢增加的趋势.结合Fe2+和Fe3+浓度推断, 由于体系中初始Fe3+浓度较高, 相对A.ferrooxidans对黄铁矿生物氧化作用生成Fe2+(反应式(4)), Fe3+可能优先与黄铁矿发生化学反应而快速产生Fe2+, 从而导致Fe2+或Fe3+浓度快速上升或下降.在营养充足条件下, A.ferrooxidans具备更强的生物氧化活性或更快的繁衍速度, 使得产物Fe2+优先被氧化完全.
诚然, 体系中离子浓度的降低意味着其发生了相的改变, 即从液相向固相迁移.已有文献报道, 在含有一价阳离子(M=K+、NH4+、Na+等)的酸性硫酸盐环境中, A.ferrooxidans能够高效催化Fe2+向Fe3+转化, 并伴随着Fe3+水解产生红棕色的施氏矿物或赭黄色的黄铁矾等次生铁矿物(宋永伟等, 2018; 2020).本研究的1/4×9K、1/2×9K和1×9K体系中含有一价阳离子K+和NH4+, 结合SO42-浓度和TFe浓度的变化趋势, 以及赭黄色沉淀来推断, 上述体系中合成的沉淀可能为黄铁矾类矿物(MFe3[SO4]2(OH)6).该类矿物合成的化学反应式可表示如下(乔星星, 2018):
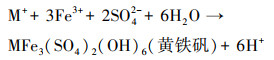
|
(7) |
为进一步确认生成矿物的种类, 对不同营养水平组反应终点收集得到的矿物进行XRD和SEM分析(图 5).0×9K组收集矿物的衍射峰与供试黄铁矿样品相吻合, 未出现其它特殊衍射峰, 说明该反应体系中未生成高结晶度的次生铁矿物.1/4×9K组开始出现微弱特征衍射峰(典型衍射峰位置2θ=17.41°、28.97°、45.86°、49.93°等), 且随着营养水平的提高, 特征衍射峰不断增强.参考XRD标准图谱确定次生铁矿物中含有黄钾铁矾(JCPDS#22-0827)(JCPDS, 2002).可能由于新生成的黄钾铁矾等矿物覆盖在黄铁矿表面, 使得不同处理中供试黄铁矿的特征衍射峰不再显著.SEM与XRD分析结果相吻合, 0×9K组黄铁矿表面产生的矿物排列无序, 矿物颗粒大小无规则; 1/4×9K组已经初步形成一定颗粒度的矿物, 但矿物间棱角模糊; 1/2×9K和1×9K组所得次生矿物颗粒分布相对更加均匀密实, 颗粒大小在0.1 μm左右, 且颗粒间棱角显著, 具备一定的结晶度.乔星星等(2018)在考察硫铁矿的生物氧化时也观察到硫铁矿表面存在次生铁矿物覆盖的现象, 但并未对其矿相作深入分析.Liu等(2020)利用A.ferrooxidans对含黄铁矿的煤进行生物脱硫时发现, 脱硫后的煤矿通过XRD分析也出现了黄钾铁矾的特征衍射峰.综上分析可知, 营养供给水平会影响黄铁矿的生物氧化速度, 进而间接决定氧化产物Fe3+通过水解作用向黄铁矾等次生铁矿物转变而产生更多的酸性废水.
4 结论(Conclusions)1) 磁黄铁矿、黄铜矿和黄铁矿分别作为能源底物时, A.ferrooxidans更容易利用黄铁矿作为能源物质进行生化反应, 从而导致含更高浓度污染物质(Fe和SO42-等)的酸性废水产生.
2) 充足营养物质可以提高A.ferrooxidans活性或密度, 从而加快黄铁矿的生物氧化速度, 同时促进氧化产物Fe3+通过水解作用向次生铁矿物转变并释放出更多的H+, 对黄铁矿酸性废水的产生起决定作用.
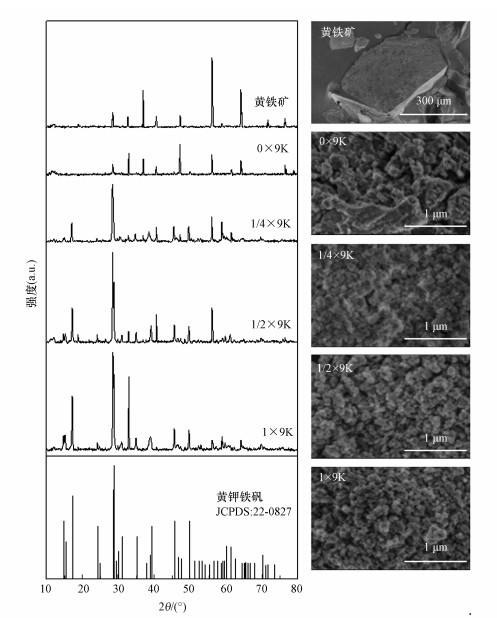 |
| 图 5 不同营养水平组生成矿物的XRD和SEM图 Fig. 5 XRD patterns and SEM photographs of minerals generated by different nutrient supply group |
鲍士旦. 2000. 土壤农化分析[M]. 北京: 中国农业出版社.
|
蔡长江, 卢桂宁, 廖长君, 等. 2014. 氧化亚铁硫杆菌对黄铜矿的生物氧化研究[J]. 地球与环境, 42(3): 361-368. |
Harahuc L, Lizama H M, Suzuki I. 2000. Selective inhibition of the oxidation of ferrous iron or sulfur in Thiobacillus ferrooxidans[J]. Applied & Environmental Microbiology, 66(3): 1031-1037. |
何环. 2009. 典型嗜酸硫氧化菌作用下元素硫的形态及其转化的研究[D]. 长沙: 中南大学
|
JCPDS (Joint Committee on Powder Diffraction Standards). 2002. Mineral Powder Diffraction Files[Z]. International Center for Diffraction Data, Swarthmore: Pennsyvania
|
蒋磊, 周怀阳, 彭晓彤. 2007. 氧化亚铁硫杆菌对黄铁矿、黄铜矿和磁黄铁矿的生物氧化作用研究[J]. 科学通报, 52(15): 1802-1813. DOI:10.3321/j.issn:0023-074x.2007.15.014 |
蒋仲安. 2009. 矿山环境工程[M]. 北京: 冶金工业出版社, 94.
|
Kaur G, Couperthwaite S J, Hatton-jones B W, et al. 2018. Alternative neutralisation materials for acid mine drainage treatment[J]. Journal of Water Process Engineering, 22: 46-58. DOI:10.1016/j.jwpe.2018.01.004 |
Kefeni K K, Msagati T A M, Mamba B B. 2017. Acid mine drainage: Prevention, treatment options, and resource recovery: A review[J]. Journal of Cleaner Production, 151: 475-493. DOI:10.1016/j.jclepro.2017.03.082 |
李宁. 2015. SRB法处理用城市生活污水稀释的酸性矿山废水的研究[D]. 吉林: 吉林大学
|
Lilova K, Karamanev D. 2005. Direct oxidation of copper sulfide by a biofilm of Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 80(3): 147-154. DOI:10.1016/j.hydromet.2004.12.010 |
Liu F W, Lei Y S, Shi J, et al. 2020. Effect of microbial nutrients supply on coal bio-desulfurization[J]. Journal of Hazardous Materials, 384: 121324. DOI:10.1016/j.jhazmat.2019.121324 |
柳建设, 王兆慧, 耿梅梅, 等. 2006. 微生物浸出中微生物-矿物多相界面作用的研究进展[J]. 矿冶工程, 26(1): 40-44. DOI:10.3969/j.issn.0253-6099.2006.01.012 |
刘金艳, 陶秀祥, 何环, 等. 2013. 嗜酸性氧化亚铁硫杆菌对单质硫的生物氧化作用研究[J]. 福州大学学报(自然科学版), 41(6): 1137-1141. |
Ma L, Li Q, Shen L, et al. 2016. Insights into the fluoride-resistant regulation mechanism of Acidithiobacillus ferrooxidans ATCC 23270 based on whole genome microarrays[J]. Journal of Industrial Microbiology & Biotechnology, 43(10): 1441-1453. |
牟力, 何腾兵, 黄会前, 等. 2017. 酸性矿山废水治理技术的研究进[J]. 天津农业科学, 23(2): 42-45. DOI:10.3969/j.issn.1006-6500.2017.02.010 |
Pinto P X, Al-Abed S R, Reisman D J. 2011. Biosorption of heavy metals from mining influenced water onto chitin products[J]. Chemical Engineering Journal, 166: 1002-1009. DOI:10.1016/j.cej.2010.11.091 |
乔星星, 刘冠兰, 周立祥, 等. 2018. 氧化亚铁硫杆菌密度与营养供给对硫铁矿生物氧化的影响[J]. 环境科学学报, 38(2): 449-456. |
Silverman M P, Lundgren D G. 1959. Studies on the chemoautotrophic iron bacterium Ferrobacillus ferrooxidans: I.An improved medium and a harvesting procedure for securing high cell yields[J]. Journal of Bacteriology, 77(5): 642-647. DOI:10.1128/jb.77.5.642-647.1959 |
宋永伟, 王鹤茹, 曹艳晓, 等. 2018. NH4+对次生铁矿物形成及重金属去除的影响[J]. 中国环境科学, 38(6): 2116-2123. DOI:10.3969/j.issn.1000-6923.2018.06.014 |
宋永伟, 王蕊, 杨琳琳, 等. 2020. 三种次生矿物固定A.ferrooxidans的Fe2+氧化及成矿性能比较[J]. 中国环境科学, 40(5): 2073-2080. DOI:10.3969/j.issn.1000-6923.2020.05.025 |
Tu Z H, Guo C L, Zhang T, et al. 2017. Investigation of intermediate sulfur species during pyrite oxidation in the presence and absence of Acidithiobacillus ferrooxidans[J]. Hydrometallurgy, 167: 58-65. DOI:10.1016/j.hydromet.2016.11.001 |
王世梅, 周立祥. 2005. 提高氧化亚铁硫杆菌和氧化硫硫杆菌平板检出率的方法: 双层平板法[J]. 环境科学学报, 25(10): 1418-1420. DOI:10.3321/j.issn:0253-2468.2005.10.022 |
魏东洋, 安坤, 王龙乐, 等. 2019. 矿山酸性废水中重金属离子处理方法综述[A]//2019中国环境科学学会科学技术年会论文集(第三卷)[C]. (8): 726-730
|
巫銮东. 2010. 某金铜矿区含铜废水处理试验研究[J]. 广东化工, 37(11): 241-242. DOI:10.3969/j.issn.1007-1865.2010.11.124 |
Xie X H, Xiao S M, Liu J S. 2009. Microbial communities in acid mine drainage and their interaction with pyrite surface[J]. Current Microbiology, 59: 71-77. DOI:10.1007/s00284-009-9394-y |
杨松荣, 邱冠周, 胡岳华. 2003. 硫化矿生物氧化机理的探讨[J]. 有色金属, 55(3): 80-83. DOI:10.3969/j.issn.2095-1744.2003.03.023 |
曾威鸿, 董颖博, 林海. 2020. 酸性矿山废水源头控制技术研究进展[J]. 安全与环境工程, 27(1): 104-110. |
郑刘春, 党志, 曹威, 等. 2015. 基于改性农业废弃物的矿山废水中重金属吸附去除技术及应用[J]. 华南师范大学学报(自然科学版), 47(1): 1-12. |
周顺桂, 周立祥, 黄焕忠. 2002. 生物淋滤技术在去除污泥中重金属的应用[J]. 生态学报, 22(1): 125-133. DOI:10.3321/j.issn:1000-0933.2002.01.017 |
朱琳. 2011. Fe2+生物氧化和矿山酸性废水资源化利用研究[D]. 南京: 南京大学
|
 2021, Vol. 41
2021, Vol. 41


