2. 西北水资源与环境生态教育部重点实验室, 西安 710055
2. Key Laboratory of Northwest Water Resource, Environment and Ecology, Ministry of Education, Xi'an 710055
厌氧氨氨氧化(Anammox)是在缺氧条件下, Anammox菌利用NO2--N(电子受体)将NH4+-N(电子供体)氧化为N2并生成少量NO3--N, 同时利用CO2进行细胞合成(Schmidt et al., 2003; Kuenen, 2008; Bagchi et al., 2012). 相比于传统硝化-反硝化脱氮工艺, Anammox工艺具有曝气量少、不消耗有机物及污泥产率低等特点, 并已成功应用于处理污泥水等含有高浓度氨氮的废水(Kartal et al., 2010; Terada et al., 2011).然而, Anammox菌生长缓慢, 世代周期长(Jetten et al., 1998; Lopez et al., 2008), 这极大地限制了Anammox技术的实际应用, 尤其在主流系统内.因此, 如何快速富集Anammox菌是一种突破其限制的有效手段.
在城市污水处理厂(主流系统)内富集培养Anammox菌时, 由于原水中NH4+-N浓度较低, 稳定的亚硝化过程难以实现, 其生长所需的NO2--N仅能通过投加亚硝酸盐的形式提供, 这使得主流系统内Anammox菌的培养存在一定难度.在部分反硝化过程为Anammox菌提供NO2--N的概念提出后(CastroBarros et al., 2017), 如何将部分反硝化同厌氧氨氧化耦合成为目前的研究热点. Chen等(2020)以生物膜为研究对象, 在低C/N条件下运行SMBBR实现了稳定的部分反硝化过程, 验证了以缺氧生物膜为载体富集Anammox菌的可能性. 吕恺等(2020)以某城市污水处理厂生物膜为接种污泥, 通过以NH4+-N、NO3--N及HAc为进水基质成功富集Anammox菌, 活性最高达到3018.19 mg·m-2·d-1.虽然通过投加亚硝酸盐和部分反硝化过程都能完成Anammox菌的富集培养, 但关于两种启动方法差异的研究报道较少, 因此, 探究不同进水基质条件下厌氧氨氧化反应器的启动特性是有必要的.
本实验采用相同的接种生物膜, 在35 ℃条件下分别以NH4+-N+NO2--N和NH4+-N+NO3--N+HAc为进水基质启动厌氧氨氧化SMBBR, 探讨不同基质条件下Anammox菌生长特性, 并采用高通量测序对微生物群落变化进行分析, 以期为主流系统内Anammox菌的富集培养提供参考.
2 材料与方法(Materials and methods) 2.1 SMBBR运行参数实验用SMBBR反应器由圆柱形有机玻璃制成(图 1), 反应器内置推进器且在其侧壁垂直方向设置进、出水及取样口. 反应器采用水浴加热控制温度为35 ℃, pH控制在7.5~8.1.进出水均由自控系统控制, SMBBR-1分为一次性进水和连续进水两个阶段, 一次性进水时实验工序包括进水(10 min)、反应(340 min)、排水(10 min); 连续进水实验工序包括进水(210 min)、反应(20 min)、排水(10 min). SMBBR-2实验工序包括进水(10 min)、反应(220 min)、排水(10 min).为比较不同进水基质条件下厌氧氨氧化SMBBR启动特性, 原则上需保证除进水基质外的其余条件均相同, 但在以NH4+-N+NO3--N+HAc为进水基质的SMBBR-2中, 由于进水中含有机物, 异养菌的快速增殖使得溶液中含有大量的异养菌, 因此, 为保证基质尽可能在生物膜上反应, 该反应器采用100%的排水比, 通过缩短HRT的方式减少溶液中的异养菌数量.在以NH4+-N+NO2--N为进水基质的SMBBR-1中, 由于仅进行厌氧氨氧化反应, 其以33%的排水比运行.SMBBR-1和SMBBR-2有效容积分别为4.5 L和3.0 L, 填充率分别为18%和27%, HRT分别为12~18 h和6 h.接种生物膜来自某城市污水处理厂填料, 填料型号为K3(比表面积500 m2·m-3), 接种填料数量均为80颗.
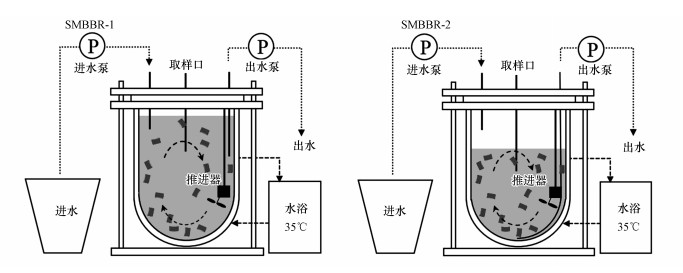 |
| 图 1 反应器示意图 Fig. 1 Schematic of the SMBBR reactor |
SMBBR-1进水组分为: NH4+-N 0.03~0.20 g·L-1, NO2--N 0.04~0.21 g·L-1, KHCO3 0.5 g·L-1, KH2PO4 0.5 g·L-1, CaCl2·2H2O 0.18 g·L-1, MgSO4·7H2O 0.10 g·L-1, 微量元素为1 mL·L-1(Graaf et al., 1996). SMBBR-2进水组分为: NH4+-N 0.03~0.05 g·L-1, NO3--N 0.04~0.05 g·L-1, C(HAc)/N(NO3--N)为2.86, 其余同SMBBR-1.
2.2 水质指标测定NH4+-N、NO2--N和NO3--N的测定参照标准分析方法(国家环境保护局, 2002), 其中, NH4+-N的测定采用纳氏试剂分光光度法, NO2--N的测定采用N-(1-萘基)-乙二胺分光光度法, NO3--N的测定采用紫外分光光度法.
2.3 活性的测定Anammox菌活性测定方法如下: 取出若干填料, 用无氧水淘洗2~3次后, 置于600 mL的反应瓶中, 同时加入30 mg·L-1 NH4+-N、40 mg·L-1 NO2--N及微量元素, 然后通入氮气5 min, 使DO降低至0.05 mg·L-1以下, 最后加入KHCO3(0.5 g·L-1).在测定过程中, 反应瓶置于恒温摇床上以保证基质混合均匀, 温度设定为35 ℃, 定期从反应瓶中取出水样, 通过分析水样中的NH4+-N、NO2--N和NO3--N浓度变化以确定Anammox活性.
2.4 高通量测序从生物填料上取下一定数量的生物膜, 经去离子水淘洗离心后按照试剂盒E.Z.N.A.®soil DNA Kit(Omega Bio-tek, Norcross GA, U.S.)规定的方法对DNA进行提取.以提取的DNA为PCR模板, 采用V3~V4引物(序列为: 338F: 5′-ACTCCTACGGG AGGCAGCAG-3′和806R: 5′-GGACTACHVGGGTW TATAAT-3′), 在ABI Gene Amp®9700 PCR thermo-cycler(ABI, CA, USA)上进行PCR反应.所获数据均在上海美吉生物云在线平台进行分析.
3 结果与讨论(Results and discussion) 3.1 SMBBR运行效果图 2为两反应器运行效果.由图 2a可知, SMBBR-1进水NH4+-N和NO2--N浓度分别从30 mg·L-1和40 mg·L-1逐步增至200 mg·L-1和215 mg·L-1, 平均出水NH4+-N和NO2--N浓度分别维持在(15.37±10.49) mg·L-1和(5.52±14.50) mg·L-1.经过100 d的启动, 脱氮负荷从(0.05±0.01) kg·m-3·d-1增至(0.67±0.02) kg·m-3·d-1, 平均去除率达到81.82%±1.20%.厌氧氨氧化反应进行过程中, Anammox菌会以一定的比例消耗NH4+-N和NO2--N并生成NO3--N, 因此, 反应器的基质消耗和生成系数可作为对厌氧氨氧化反应器运行效果判断的指标.本实验中, 第1 d的NH4+-N和NO2--N消耗量与NO3--N生成量的比值关系为1∶2.76∶0.37, 此数值高于Strous等(1999)所给的理论值(1∶1.32∶0.26), 这主要是因为反应器运行初期存在内源反硝化和硝化过程.在反应器启动后, 由于进水中不含有机物, 异养菌难以适应新环境而发生细胞自溶(Tang et al., 2009), 这为反硝化过程创造了条件, NO2--N消耗量因此大于理论值.除反硝化过程外, 由于接种生物膜上还存在一定数量的硝化菌且反应器未严格保证厌氧环境, 反应器中还存在硝化过程, NO3--N生成量因此大于理论值.随着反应器的不断运行, 异养菌被逐步淘汰且厌氧氨氧化成为主导反应, NH4+-N和NO2--N的消耗量与NO3--N生成量最终趋于稳定, 比值关系为1∶(1.13±0.01)∶(0.32±0.02), 标志着厌氧氨氧化SMBBR-1启动成功.
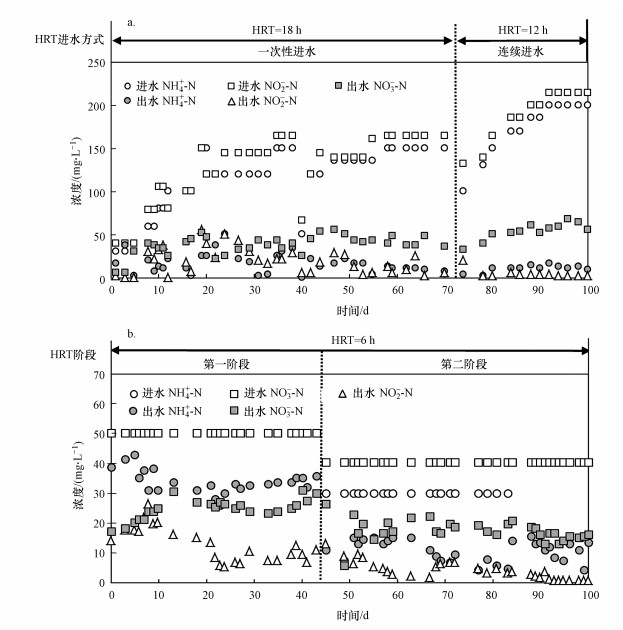 |
| 图 2 SMBBR-1(a)和SMBBR-2(b)的运行效果 Fig. 2 Performance of SMBBR-1(a) and SMBBR-2(b) |
由图 2b可知, SMBBR-2的运行可分为2个阶段.在第1阶段中, 经过45 d的运行, 脱氮负荷由起始的(0.09±0.02) kg·m-3·d-1增至(0.13±0.02) kg·m-3·d-1, 去除率由24.84%±4.68%升至32.64%±4.52%, TN脱除的效果并不明显.在第2阶段中, 脱氮负荷有明显的增加, 达到(0.21±0.02) kg·m-3·d-1, TN去除率为66.35%±4.79%. 根据乙酸钠为碳源的完全反硝化化学方程式(1)(Kalyuzhnyi et al., 2009), NH4+-N的同化量和去除NO3--N的比值为0.17, 而在本实验中, 去除的NH4+-N和NO3--N比值为1.18±0.14, 表明反硝化过程并非唯一的脱氮途径, 还存在厌氧氨氧化脱氮, 标志着厌氧氨氧化SMBBR-2启动成功.
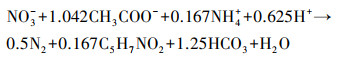
|
(1) |
在SMBBR-1运行前73 d, 采用一次性进水, 由于进水浓度较高, NH4+-N和NO2--N浓度分别达到150 mg·L-1和165 mg·L-1, 为避免FA和FNA对Anammox菌产生抑制, 在第74 d后将反应器改为连续进水方式运行.图 3a为SMBBR-1以连续流进水模式的典型周期内氮组分变化情况.整个周期内NH4+-N和NO2--N浓度均维持在较低水平, 最大浓度分别为13.70 mg·L-1和14.96 mg·L-1, 对应FA和FNA浓度分别为1.32 mg·L-1和0.0003 mg·L-1, 均低于文献报道的Anammox菌的抑制阈值(Jin et al., 2012), 避免Anammox菌受到抑制的同时, 也保证了Anammox菌可获得充足的基质从而以最大速率进行增殖.
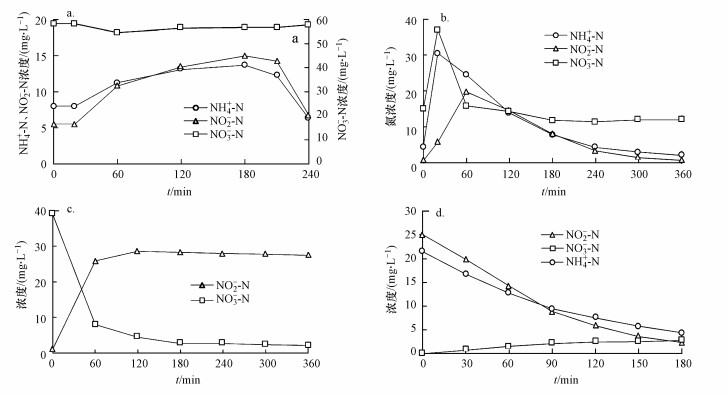 |
| 图 3 SMBBR典型周期内氮组分变化 (a. SMBBR-1典型周期; b. SMBBR-2典型周期; c. SMBBR-2部分反硝化性能; d. SMBBR-2厌氧氨氧化性能) Fig. 3 Variations of nitrogen components in typical cycle |
图 3b为SMBBR-2典型周期内氮组分变化情况.NO3--N浓度在进水结束时达到最大, 随后先快速降低, 然后缓慢升高, 这主要与主导反应发生变化有关.在进水结束时, 部分反硝化过程为主导反应, 异养菌利用乙酸迅速将NO3--N还原为NO2--N, 由于生成NO2--N的速率大于Anammox菌的消耗速率, NO2--N发生积累. 当乙酸被消耗完后, 厌氧氨氧化过程成为主导反应, 此时NH4+-N和NO2--N被同步去除且伴随有NO3--N增加.在整个典型周期内, NH4+-N和NO3--N浓度分别下降37.88 mg·L-1和28.02 mg·L-1且出水NO2--N浓度仅为0.68 mg·L-1.若假设NH4+-N均由厌氧氨氧化过程脱除, 根据Strous所给的反应式, 其理论上可生成9.85 mg·L-1的NO3--N, 则实际NO3--N下降量应为37.87 mg·L-1, 而此数值与NH4+-N的减少量接近, 说明氮的脱除主要由Anammox菌化完成.为表征反应器内部分反硝化反应的情况, 以NO3--N+HAc为进水基质运行反应器, 其氮组分变化情况见图 3c.当反应开始后, NO3--N迅速被还原为NO2--N且浓度基本保持不变, NO3--N减少量与NO2--N生成量差值仅为6.20 mg·L-1, 从NO3--N的转化路径上证明氮的脱除并非由完全反硝化过程完成.为表征反应器内厌氧氨氧化反应的情况, 以NH4+-N+NO2--N为进水基质运行反应器, 其氮组分变化情况见图 3d.经过180 min的反应, NH4+-N和NO2--N浓度分别下降17.10 mg·L-1和22.71 mg·L-1, 同时伴随有2.78 mg·L-1的NO3--N生成, 表明该反应器确有一定的厌氧氨氧化能力.综上所述, 该反应器内氮的脱除主要由厌氧氨氧化贡献而非完全反硝化.
3.3 生物膜及Anammox活性变化生物膜在培养前后发生明显变化, 结果见图 4.接种生物膜呈现黑灰色, 这主要是因为Anammox菌数量较少且其它微生物及杂质较多.在以NH4+-N+NO2--N为进水基质培养后, 填料上的生物量明显增加, 且生物膜呈现出明显的红棕色, 表明Anammox菌富集成功.而在以NH4+-N+NO3--N+HAc为进水基质培养后, 生物量虽有明显增加, 但并未呈现出明显的红棕色, 这主要是因为异养菌数量较多而Anammox菌数量较少.
 |
| 图 4 培养前后生物膜变化 Fig. 4 Images of biofilms with different enrichment strategies |
Anammox活性变化如图 5所示, 在以NH4+-N+NO2--N为进水基质的SMBBR-1中, 经过100 d的启动, Anammox活性(以NH4+-N计)达到6448.32 mg·m-2·d-1, 而在以NH4+-N+NO3--N+HAc为进水基质的SMBBR-2中, 活性仅有1980.32 mg·m-2·d-1, 仅为前者活性的31%, 造成这一结果的主要原因是两反应器生物膜上微生物组分差异较大.在以NH4+-N+NO2--N为进水基质培养的生物膜上, 微生物主要以Anammox菌为主, 其细胞产率低(YAnammox=0.066 g VSS/g NH4+-N)(Strous et al., 1998), 填料所能容纳的生物量达到饱和所需时间较长, 增殖的Anammox菌大部分会附着在填料上, 污泥流失较少.而在以NH4+-N+NO3--N+HAc为进水基质培养的生物膜上, 异养菌为主体(Y异养菌=0.66 g VSS/g COD)(Kujawa et al., 1999), 填料上的生物量很快达到饱和并发生脱落, Anammox菌会随异养菌的脱落而脱落, Anammox活性也就难以增加.
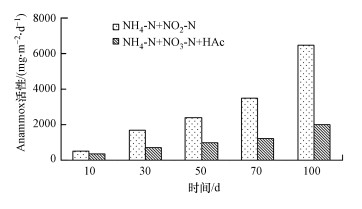 |
| 图 5 Anammox活性变化 Fig. 5 Variation of activities of Anammox |
高通量结果显示(图 6), 两种培养策略培养前后, Chloroflexi和Proteobacteria仍为主要微生物, 其相对占比始终均大于20%(图 6a), Chloroflexi普遍存在于Anammox反应器中(Kindaichi et al., 2012; Bhattacharjee et al., 2017), 而Proteobacteria包括部分反硝化菌; Planctomycetota相对占比从接种生物膜的2.71%分别增至14.26%和11.73%, 其包含已知所有Anammox菌(Kuenen, 2008; Cao et al., 2019).从属水平可知(图 6b), 本实验中的Anammox菌主要为Ca. Brocadia, 此结果与主流系统内已探明的典型种属一致(Laureni et al., 2016; ClaracReino et al., 2018).除Ca. Brocadia外, 两SMBBR中还发现Ca. Jettenia, 其占比从接种生物膜的未检出分别增至2.07%和0.56%.由于SMBBR-2中通过部分反硝化过程为Anammox菌提供NO2--N, 因此, 随着反应器的运行, 部分反硝化菌会在生物膜上富集.经检测, SMBBR-2中包含Thauera和Flavobacterium两种部分反硝化菌, 其富集后的占比分别达到2.84%和0.66%.研究表明, Thauera属中部分菌种同时存在其它的反硝化酶, 但当NO3--N存在时, 微生物无法合成亚硝酸盐还原酶(Nir)(Liu et al., 2013), 即它们仅能以NO3--N作为电子受体, 对NO2--N积累起主导作用.而Flavobacterium具有和Thauera相同的特性.本实验中, SMBBR-2中始终能维持一定浓度的NO3--N, 这使得SMBBR-2能获得稳定的NO2--N积累, 从而快速完成厌氧氨氧化SMBBR的启动.
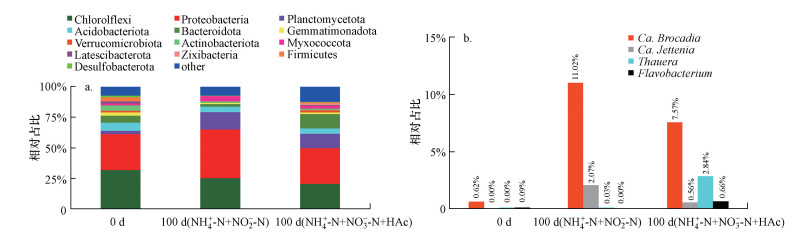 |
| 图 6 生物膜种群组成结构 (a.门水平, b.属水平) Fig. 6 Composition of bacterial community in biofilm |
1) 以NH4+-N+NO2--N和NH4+-N+NO3--N+HAc分别为进水基质启动厌氧氨氧化SMBBR, 经过100 d的运行, 在进水负荷分别为0.83和0.32 kg·m-3·d-1的条件下, 氮去除率分别达到81.82%±1.20%和66.35%±4.79%. 活性测定结果显示, SMBBR-1和SMBBR-2中的Anammox性分别达到6448.32和1980.32 mg·m-2·d-1, 远大于起始活性, 表明以两种不同进水基质均能实现厌氧氨氧化反应器的成功启动.
2) 高通量结果显示, SMBBR-1中Chloroflexi、Proteobacteria和Planctomycetota门的相对占比均高于SMBBR-2.在属水平上, 两SMBBR启动阶段的Ca. Brocadia由接种生物膜中的0.62%分别增至启动成功后的11.02%和7.57%, Ca. Jettenia由接种生物膜中的未检出分别增至2.07%和0.66%.此外, SMBBR-2中还检测出Thauera(2.84%)和Flavobacterium菌(0.66%), 其为部分反硝化菌, 可为Anammox菌提供生长所需的NO2--N.
3) 相比于以NH4+-N+NO3--N+HAc为进水基质, 以NH4+-N+NO2--N为进水基质的启动方法可更快启动厌氧氨氧化反应器, 但需要投加大量的亚硝酸盐, 这使得污水处理厂运行成本增加.考虑到城市污水处理厂出水中含有一定浓度的NO3--N, 通过引入一定量的原水, 就能通过部分反硝化过程为Anammox菌提供生长所需的NO2--N, 其可极大节省运行成本且有助于城市污水处理厂脱氮效果的提升.
Bagchi S, Biswas R, Nandy T. 2012. Autotrophic ammonia removal processes: ecology to technology[J]. Critical Reviews in Environmental Science and Technology, 42: 1353-1418. DOI:10.1080/10643389.2011.556885 |
Bhattacharjee A S, Wu S, Lawson C E, et al. 2017. Whole-community metagenomics in two different anammox configurations: Process performance and community structure[J]. Environmental Science & Technology, 51: 4317-4327. |
Cao S, Du R, Peng Y, et al. 2019. Novel two stage partial denitrification(PD)-Anammox process for tertiary nitrogen removal from low carbon/nitrogen(C/N) municipal sewage[J]. Chemical Engineering Journal, 362: 107-115. DOI:10.1016/j.cej.2018.12.160 |
CastroBarros C M, Jia M, Loosdrecht M C M V, et al. 2017. Evaluating the potential for dissimilatory nitrate reduction by anammox bacteria for municipal wastewater treatment[J]. Bioresource Technology, 233: 363-372. DOI:10.1016/j.biortech.2017.02.063 |
Chen K, Zhang L, Sun S, et al. 2020. In situ enrichment of anammox bacteria in anoxic biofilms are possible due to the stable and long-term accumulation of nitrite during denitrification[J]. Bioresource Technology, 300: 1-7. |
ClaracReino, Suárez-Ojeda M E, Pérez J, et al. 2018. Stable long-term operation of an upflow anammox sludge bed reactor at mainstream conditions[J]. Water research, 128: 331-340. DOI:10.1016/j.watres.2017.10.058 |
国家环境保护局. 2002. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境科学出版社.
|
Graaf A A V D, Bruijn P D, Robertson L A, et al. 1996. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor[J]. Microbiology, 142: 2187-2196. DOI:10.1099/13500872-142-8-2187 |
Jetten M S M, Strous M, Passchoonen K V D, et al. 1998. The anaerobic oxidation of ammonium[J]. FEMS Microbiology Reviews, 22: 421-437. DOI:10.1111/j.1574-6976.1998.tb00379.x |
Jin R C, Yang G F, Yu J J, et al. 2012. The inhibition of the Anammox process: A review[J]. Chemical Engineering Journal, 197: 67-79. DOI:10.1016/j.cej.2012.05.014 |
Kalyuzhnyi S, Marina G. 2009. DEAMOX-New microbiological process of nitrogen removal from strong nitrogenous wastewater[J]. Desalination, 248: 783-793. DOI:10.1016/j.desal.2009.02.054 |
Kartal B, Kuenen J G, Loosdrecht M C M V. 2010. Sewage treatment with anammox[J]. Science, 328: 702-703. DOI:10.1126/science.1185941 |
Kindaichi T, Yuri S, Ozaki N, et al. 2012. Ecophysiological role and function of uncultured Chloroflexi in an anammox reactor[J]. Water Science & Technology, 66: 2556-2561. |
Kuenen J G. 2008. Anammox bacteria: From discovery to application[J]. Nature Reviews Microbiology, 6: 320-326. DOI:10.1038/nrmicro1857 |
Kujawa K, Klapwijk B. 1999. A method to estimate denitrification potential for predenitrification systems using NUR batch test[J]. Water Research, 33: 2291-2300. DOI:10.1016/S0043-1354(98)00459-X |
Laureni M, Fal S P, Robin O, et al. 2016. Mainstream partial nitritation and anammox: long-term process stability and effluent quality at low temperatures[J]. Water Research, 101: 628-639. DOI:10.1016/j.watres.2016.05.005 |
Liu B, Mao Y, Bergaust L. 2013. Strains in the genus Thauera exhibit remarkably different denitrification regulatory phenotypes[J]. Environmental Microbiology, 15: 2816-2828. |
Lopez H, Puig S, Ganigue R, et al. 2008. Start-up and enrichment of a granular anammox SBR to treat high nitrogen load wastewaters[J]. Journal of Chemical Technology & Biotechnology, 83: 233-241. |
吕恺, 王康舟, 姚雪薇, 等. 2020. 基于氨氮, 硝氮及乙酸条件下Anammox菌的培养[J]. 中国环境科学, 40(10): 4348-4353. DOI:10.3969/j.issn.1000-6923.2020.10.019 |
Schmidt I, Sliekers O, Schmid M, et al. 2003. New concepts of microbial treatment processes for the nitrogen removal in wastewater[J]. FEMS Microbiology Reviews, 27: 481-492. DOI:10.1016/S0168-6445(03)00039-1 |
Strous M, Heijnen J J, Kuenen J G, et al. 1998. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied and Environmental Microbiology, 50: 589-596. |
Strous M, Kuenen J G, Jetten M S. 1999. Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology, 65: 3248-3250. DOI:10.1128/AEM.65.7.3248-3250.1999 |
Tang C, Zheng P, Mahmood Q, et al. 2009. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge[J]. Journal of Industrial Microbiology & Biotechnology, 36: 1093-1100. |
Terada A, Zhou S, Hosomi M. 2011. Presence and detection of anaerobic ammonium-oxidizing (anammox) bacteria and appraisal of anammox process for high-strength nitrogenous wastewater treatment: A review[J]. Clean Technologies and Environmental Policy, 13: 759-781. DOI:10.1007/s10098-011-0355-3 |
 2021, Vol. 41
2021, Vol. 41


