2. 哈尔滨工业大学, 化工与化学学院, 哈尔滨 150001
2. School of Chemistry and Chemical Engineering, Harbin Institute of Technology, Harbin 150001
氯酚类有机物是环境介质中普遍存在的一类典型污染物.虽然含量较低, 但由于其芳香环结构和氯原子形成的稳定化学共轭体系, 几乎所有的氯酚类化合物都具有很强的毒性和化学稳定性(Ke et al., 2017;Munoz et al., 2017;甘国强等, 2020).研究发现, 多数氯酚类物质表现出明显的“三致”效应, 并且容易通过食物链在生物体内富集, 采用传统的生物法很难将其去除(Li et al., 2018).目前, 大多数氯酚类有机物被世界各国列为优先控制污染物, 受到严格的监测和控制(Li et al., 2017).因此, 高效的氯酚类有机物去除技术一直被环境领域重点关注.
氯酚类有机物的高毒性主要来源于自身的Cl官能团.在氯酚类物质中, Cl原子越多, 其毒性越大(Chen et al., 1999; Liang et al., 2016).近年发展起来的电催化还原工艺, 由于自身具有的反应条件温和、能耗低、底物局限性小等优势, 在还原环境中通过催化脱氯, 可以显著降低氯酚类有机废水的毒性, 同时还可以对脱氯产物进行回用, 因而受到了研究者的广泛关注(马红星, 2016;Xu et al., 2020).Xu等(2016)通过制备Pd-Au合金催化剂加速了电化学脱氯过程, 同时为了减少贵金属的使用;Sharnouby等(2018)制备了Pd纳米颗粒(nPd)在水相中对氯代有机物进行催化加氢脱氯;Peng等(2019)通过引入Ag组分, 制备了单分散AgPd纳米颗粒, 进一步提高了电极的催化性能.虽然制备的电极催化活性不断提高, 但这些催化电极依然无法摆脱对贵金属的依赖, 这些问题极大地制约了电催化还原工艺在氯酚类有机废水处理中的发展和应用.近年的研究开始逐渐关注于新型碳材料、过渡金属材料等对贵金属材料的替代.2020年, Wei等创新性地将Ni2P用于电催化还原降解污染物, 并取得了较好的效果(Wei et al., 2020).目前, 过渡金属材料对于电化学脱氯过程的影响仍处于研究阶段, 同时还原电极催化活性不高, 电极稳定性较差(Liang et al., 2019; Yin et al., 2020; Lou et al., 2020).因此, 制备高性能非贵金属催化剂实现氯酚类废水的有效降解依然是一个巨大的挑战.
针对上述问题, 本文以泡沫镍为载体, 制备氧掺杂的过渡金属磷化物O-NiCoP/Ni2P催化电极, 并将其作为工作电极对2, 4-二氯苯酚废水进行电催化还原降解研究.同时, 主要考察2, 4-二氯苯酚浓度、电流密度、电解质浓度、pH和温度等因素对O-NiCoP/Ni2P电极催化还原2, 4-二氯苯酚效能的影响, 探讨O-NiCoP/Ni2P催化电极最佳的还原脱氯反应条件, 以期为电催化处理氯酚类有机废水提供基础数据和理论指导.
2 材料与方法(Materials and methods) 2.1 O-NiCoP/Ni2P催化电极制备O-NiCoP/Ni2P催化电极采用多步低温磷化工艺进行制备.以泡沫镍为基底, Ni(NO3)2·6H2O、Co(NO3)2·6H2O和NaH2PO2·H2O分别作为Ni源、Co源和P源.裁剪泡沫镍(2 cm×4 cm)作为基底, 用丙酮溶剂对其进行除油处理, 然后将泡沫镍浸泡于100 mL丙酮溶剂中, 超声清洗30 min, 超声频率为50 kHz.处理后的泡沫镍用无水乙醇和去离子水交替清洗5次后, 放入60 ℃真空干燥箱中干燥6 h备用.将预处理后的泡沫镍和1 g的NaH2PO2·H2O分别置于管式炉的上下风口, 在N2保护气氛中以2 ℃·min-1的升温速率加热至300 ℃, 恒温反应120 min.之后将产物自然冷却至室温, 用无水乙醇和去离子水交替清洗5次后, 放入60 ℃真空干燥箱中干燥6 h, 在泡沫镍表面合成纳米结构的磷化镍(标记为Ni2P-NF).配置溶液浓度为0.35 mol·L-1 Ni(NO3)2·6H2O和0.7 mol·L-1 Co(NO3)2·6H2O的镍/钴混合溶液(标记为Ni/Co-ink), 将制备得到的Ni2P-NF浸没Ni/Co-ink中20 min后, 放入60 ℃真空干燥箱中干燥.然后将样品和1 g的NaH2PO2·H2O分别置于管式炉的上下风口, 在N2保护气氛中以2 ℃·min-1的升温速率加热至300 ℃, 恒温反应120 min后冷却至室温.用无水乙醇和去离子水交替清洗5次后, 放入60 ℃真空干燥箱中干燥6 h, 得到样品标记为NiCoP/Ni2P.样品再次浸没Ni/Co-ink中20 min, 重复上述操作, 即得到氧掺杂过渡金属磷化物O-NiCoP/Ni2P催化电极.
2.2 实验装置和条件2, 4-二氯苯酚降解实验在三电极体系中进行.实验装置采用H型玻璃电解槽, 阴阳极室单池容积为150 mL, 用阳离子交换膜进行分隔.制备的O-NiCoP/Ni2P催化电极作为工作电极, 选用Pt片电极作为对电极, 选用饱和甘汞电极作为参比电极, 电解质溶液为Na2SO4溶液.2, 4-二氯苯酚模拟废水质量浓度为10 mg·L-1, 处理体积为100 mL.CHI660e电化学工作站(上海辰华公司)为实验供应稳定的电压和电流.反应不同pH条件通过1 mol·L-1 H2SO4溶液和1 mol·L-1 KOH溶液进行调节, 同时利用恒热式磁力搅拌器给予所需的恒温条件和适宜的搅拌速率.
2.3 分析方法采用S4800 HSD扫描电子显微镜(日本Hitachi公司)对催化电极的表面形貌进行分析;用Bruker D8-Advance型X-射线衍射仪(德国Bruker公司)分析电极表面物质构成.
采用恒定电流密度法对电极催化降解2, 4-二氯苯酚性能进行测试.2, 4-二氯苯酚浓度随时间的变化, 采用高效液相色谱(Agilent 1100 Infinity)进行检测.液相色谱采用C8分离柱, 柱温35 ℃, 流动相使用甲醇和水(体积比为70∶30), 流速为0.8 mL·min-1, 进样体积为20 μL.检查器为紫外检测器, 紫外检查波长设置为280 nm.
3 结果与讨论(Results and discussion) 3.1 O-NiCoP/Ni2P催化电极结构表征通过多步低温磷化工艺制备的O-NiCoP/Ni2P杂化结构电极表面形貌如图 1所示, 可见通过磷化在商用泡沫镍(NF)上合成了Ni2P层.与水热或溶剂热反应导致NF氧化和能耗过程不同, 由于Ni2P层的亲水性, 使得反应前体可以通过浸没Ni/Co-ink直接磷化制备O-NiCoP.同时, Ni2P层的引入可以提供良好的力学性能和较强的界面连接(Mishra et al., 2018).多次磷化后, 尺寸约为500 nm的O-NiCoP纳米粒子外延紧密堆积生长在Ni2P层上, 并均匀分布于泡沫镍表面.制备的晶粒大小分布均匀, 表面粗糙且具有较大的比表面积, 这有利于暴露大量的催化活性位点和加快质子交换过程(Xiao et al., 2012).
 |
| 图 1 泡沫镍(a)和O-NiCoP/Ni2P催化电极(b)扫描电镜图 Fig. 1 SEM images of Ni foam(a) and O-NiCoP/Ni2P catalytic electrode(b) |
图 2为O-NiCoP/Ni2P催化电极的X射线衍射(XRD)图谱, 位于41.0°、47.6°和54.4°处的XRD衍射峰分别与NiCoP(ICSD no.71-2336)的(111)、(210)和(300)平面相对应, 44.5°、51.8°和76.4°处的强峰对应于NF基底(ICSD no.87-0712), 相对较低的O掺杂强度不会改变晶体结构.此外, 对比于NiCoP/Ni2P, 由于O掺杂, O-NiCoP/Ni2P中六方NiCoP的晶格偏移, NiCoP晶体(111)面对应的衍射峰向高角度区移动.结合后续电化学测试, O-NiCoP/Ni2P的电化学特性在氧掺杂后有明显改善(图 3), 这表明氧掺杂的O-NiCoP/Ni2P催化电极成功制备.
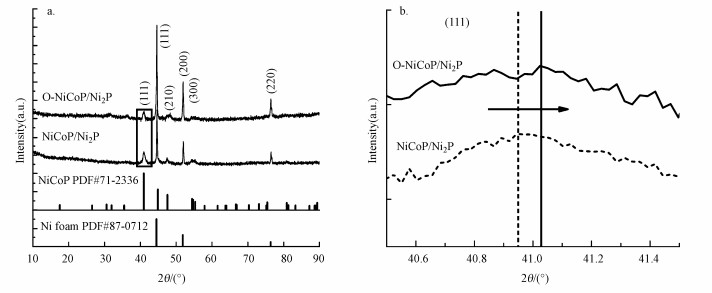 |
| 图 2 O-NiCoP/Ni2P催化电极XRD图(a)及XRD局部放大图(b) Fig. 2 XRD patterns(a) and XRD partial enlargement pattern(b) of O-NiCoP/Ni2P catalytic electrode |
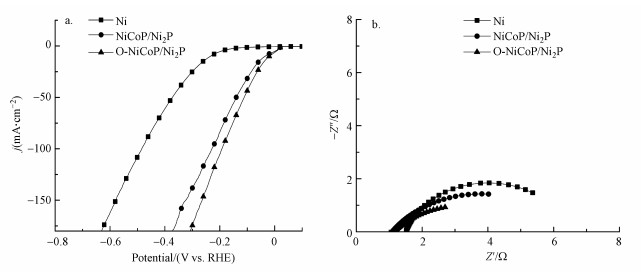 |
| 图 3 泡沫镍、NiCoP/Ni2P和O-NiCoP/Ni2P的极化曲线图(a)及电化学阻抗谱图(b) Fig. 3 LSV curves(a) and Nyquist plots(b) of Ni foam, NiCoP/Ni2P, and O-NiCoP/Ni2P |
本研究使用三电极装置研究了O-NiCoP/Ni2P催化电极的电化学性能, 将泡沫镍和NiCoP/Ni2P作为对比样, 结果如图 3所示.图 3a为材料通过线性扫描伏安法(LSV)测试得到的极化曲线, 测试扫描速率为5 mV·s-1.对比可知, 在相同电流密度下, O-NiCoP/Ni2P催化电极的过电势比泡沫镍和NiCoP/Ni2P电极的过电势更低.同时, 随着电流密度的不断增加, O-NiCoP/Ni2P催化电极表现出更快的电压响应.这表明O-NiCoP/Ni2P催化电极具有较高的析氢催化活性.在电催化加氢脱氯过程中, 间接活性氢还原起主要作用(Yin et al., 2020).更高的活性氢催化性能有利于O-NiCoP/Ni2P电极对氯酚类有机物的催化降解.同时, 通过拟合电极的电化学阻抗谱(EIS)(图 3b), 泡沫镍、NiCoP/Ni2P和O-NiCoP/Ni2P催化电极的传输电阻(Rct)分别为5.40、5.01和4.32 Ω.O-NiCoP/Ni2P电极的Rct较低, 这表明电极在反应过程中具有较快的电子迁移速率.O原子的掺杂有效地提高了O-NiCoP/Ni2P催化电极的电导率, 从而提高了电极的催化降解性能.
3.3 O-NiCoP/Ni2P催化电极电催化活性 3.3.1 初始浓度的影响在电流密度为10 mA·cm-2, pH为7, 反应体系温度为25 ℃, 电解质为50 mmol·L-1 Na2SO4溶液的条件下, 反应180 min, 考察O-NiCoP/ Ni2P电极对不同初始浓度(10、20、50和100 mg·L-1)2, 4-二氯苯酚去除率的影响, 结果见图 4a.
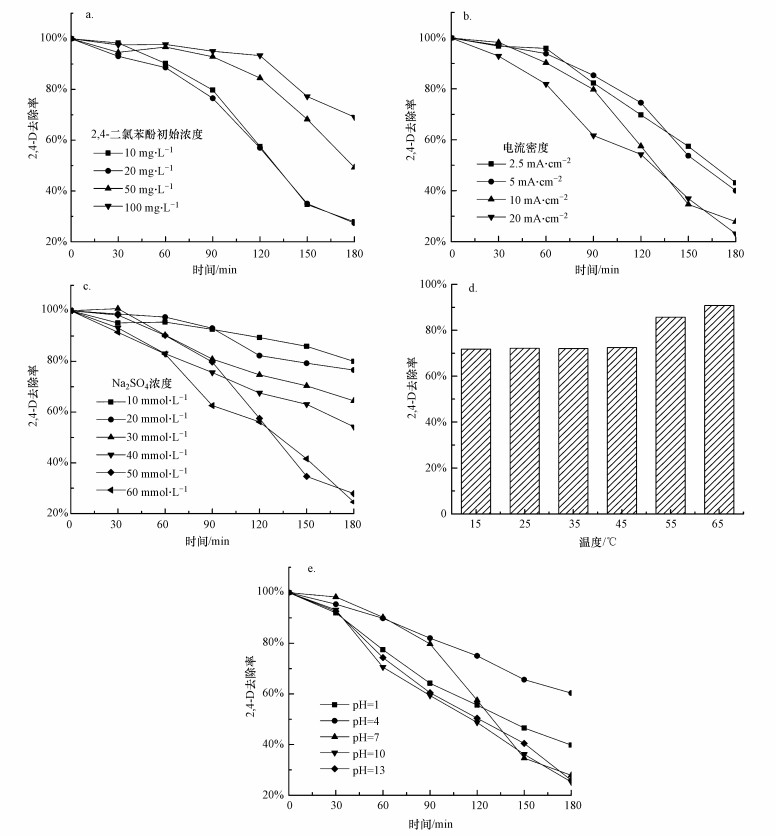 |
| 图 4 2, 4-二氯苯酚初始浓度(a)、电流密度(b)、Na2SO4电解质浓度(c)、温度(d)及pH(e)对O-NiCoP/Ni2P降解2, 4-二氯苯酚性能的影响 Fig. 4 Effect of 2, 4-dichlorophenol initial concentration(a), current density(b), Na2SO4 electrolyte concentration(c), temperature(d), and pH(e) on the degradation performance of O-NiCoP/Ni2P |
从图 4a可以看出, 当2, 4-二氯苯酚初始浓度从10 mg·L-1增加到20 mg·L-1时, O-NiCoP/Ni2P电极对2, 4-二氯苯酚的去除率基本保持不变, 但随着2, 4-二氯苯酚初始浓度进一步提高, 电极的去除率不断降低.为了在后续研究中消除2, 4-二氯苯酚初始浓度对反应的影响, 研究电极最佳的反应条件, 进一步实验在2, 4-二氯苯酚初始浓度为10 mg·L-1的条件下进行.
3.3.2 电流密度的影响实验分别选取2.5、5、10和20 mA·cm-2的电流密度, 在电解质为50 mmol·L-1 Na2SO4溶液, pH为7, 温度为25 ℃条件下反应180 min, 研究不同电流密度对O-NiCoP/Ni2P电极去除2, 4-二氯苯酚的影响, 结果见图 4b.
从图 4b可以看出, 在电极电流密度分别为2.5、5、10和20 mA·cm-2条件下催化降解3 h后, 2, 4-二氯苯酚的降解效率分别达到56.9%、60.0%、72.2%和76.9%.当电极电流密度从2.5 mA·cm-2增长到10 mA·cm-2时, 随着电流密度的增加, O-NiCoP/Ni2P电极对2, 4-二氯苯酚的去除率不断增加, 但当电流密度达到10 mA·cm-2后, 随着电流密度的进一步增加, 2, 4-二氯苯酚去除率的增幅减弱.这是由于电流密度的提高增加了反应过程中分解水的副反应, 降低了催化过程中的电流效率(Liu et al., 2019).综合考虑能耗, 将电流密度10 mA·cm-2作为O-NiCoP/Ni2P电极对2, 4-二氯苯酚降解的最佳电流密度.
3.3.3 电解质浓度的影响为了探究电解质浓度对O-NiCoP/Ni2P电极降解2, 4-二氯苯酚的影响, 选取不同的Na2SO4电解液浓度(10~60 mmol·L-1), 在pH=7的情况下考察O-NiCoP/Ni2P电极对2, 4-二氯苯酚的降解效果, 结果见图 4c.
如图 4c所示, 溶液中Na2SO4电解质可以为电催化还原过程提供大量可导电的自由离子, 提高溶液的导电性能, 进而促进产生活性氢, 有利于2, 4-二氯苯酚的电催化还原脱氯(Yin et al., 2020).但电解质浓度过高又会加快副反应(如产生H2), 进而减弱2, 4-二氯苯酚的电催化还原速率的增幅.当溶液中Na2SO4电解质浓度较低时, 2, 4-二氯苯酚去除率随着反应溶液电解质浓度的升高而增加, 当溶液中Na2SO4电解质浓度增加到50 mmol·L-1后, Na2SO4电解质浓度对2, 4-二氯苯酚去除率的影响相对较小.因此, 确定Na2SO4浓度50 mmol·L-1为2, 4-二氯苯酚降解的最佳电解质浓度.
3.3.4 反应温度的影响反应温度会对催化过程中的反应速率和传质速率产生影响, 进而影响O-NiCoP/Ni2P电极对2, 4-二氯苯酚的降解效果.为了进一步探究反应温度的影响, 本实验分别在15~65 ℃恒温条件, 考察催化电极对2, 4-二氯苯酚的降解情况, 结果见图 4d.
由图 4d可知, 在15~45 ℃时, 反应温度对于2, 4-二氯苯酚的降解效果基本没有影响, O-NiCoP/Ni2P电极对2, 4-二氯苯酚的降解效率保持在71.8%~72.5%.随着反应温度进一步提高, 2, 4-二氯苯酚的降解效率随着反应温度的升高而逐渐增大, 当反应温度达到65 ℃时, 2, 4-二氯苯酚的降解效率达到90.8%.考虑到实际运行过程中增加反应温度会带来的额外成本, 实验将室温25 ℃作为反应的最佳温度.
3.3.5 pH的影响调节溶液pH分别为1、4、7、10和13, 电极在10 mA·cm-2电流密度下催化降解2, 4-二氯苯酚180 min, 结果如图 4e所示.研究表明, 溶液pH值对O-NiCoP/Ni2P电极催化降解2, 4-二氯苯酚有一定的影响, 当溶液为酸性时, O-NiCoP/Ni2P电极催化对2, 4-二氯苯酚的去除率较低, 这主要是由于在酸性条件下, 催化电极更容易获得质子和加速电极表面析氢副反应的发生(张健, 2016).当溶液为中性或碱性时, 溶液pH值对反应去除率影响不大.因此, 将pH=7作为反应最佳pH.
3.3.6 催化还原2, 4-二氯苯酚反应机理O-NiCoP/Ni2P催化电极电催化加氢脱氯还原2, 4-二氯苯酚的主要反应路径如图 5所示, 在阴极负电势下, O-NiCoP/Ni2P催化电极将水分子分解产生活性氢, 通过加氢脱氯作用将2, 4-二氯苯酚的氯脱去, 形成2-氯酚或4-氯酚;接着氯酚继续还原生成苯酚.如果还原剂还原能力强, 还可以继续开环反应.开环位置不同, 生成的产物也不同(徐新华等, 2004;张健, 2016).
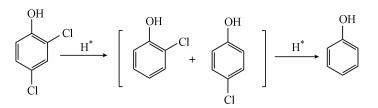 |
| 图 5 2, 4-二氯酚电催化降解过程示意图 Fig. 5 Schematic diagram for electro-catalysis on 2, 4-dichlorophenol |
为了考察O-NiCoP/Ni2P电极的稳定性, 在上述最佳条件下(25 ℃, 2, 4-二氯苯酚为10 mg·L-1, 50 mmol·L-1 Na2SO4电解液, pH=7, 电流密度10 mA·cm-2), 进行连续循环电催化降解2, 4-二氯苯酚实验, 结果如图 6所示.从图中可以看到, 在循环使用10次后, O-NiCoP/Ni2P电极对2, 4-二氯苯酚的去除率保持在72.1%~72.7%, 基本保持不变.这说明所制备的O-NiCoP/Ni2P电极具有良好的稳定性, 因而具有良好的实用潜力, 为进一步的实际应用提供了可能.
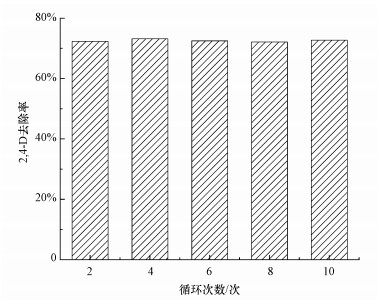 |
| 图 6 O-NiCoP/Ni2P电极的稳定性 Fig. 6 Stability test of O-NiCoP/Ni2P electrode |
1) 利用NF表面氧化层制备Ni2P层, 通过多次浸没, 采用低温磷化的方法制备O-NiCoP/Ni2P电极, 制备方法简单.O-NiCoP/Ni2P电极表面催化剂晶粒分布均匀, 粗糙度较大, 制备的Ni2P层提供了良好的力学性能和界面连接.
2) 将O-NiCoP/Ni2P电极作为工作电极在不同条件下对目标污染物2, 4-二氯苯酚进行降解, 发现不同的反应条件对降解效果的影响很大, 在2, 4-二氯苯酚初始浓度为10 mg·L-1时, O-NiCoP/Ni2P电极催化去除的最优反应条件为:温度25 ℃, 溶液pH=7, Na2SO4电解质浓度为50 mmol·L-1, 电流密度为10 mA·cm-2, 电极催化降解180 min后, 在此条件下对2, 4-二氯苯酚的去除率达72.2%.
3) 催化降解过程循环10次, O-NiCoP/Ni2P电极对2, 4-二氯苯酚的去除效率保持在72.1%~72.7%, 表明所制备的催化电极具有良好的稳定性和实际应用的潜在价值.
Chen S T, Stevens D K, Kang G Y. 1999. Pentachlorophenol and crystal violet degradation in water and soils using heme and hydrogen peroxide[J]. Water Research, 33(17): 3657-3665. DOI:10.1016/S0043-1354(99)00262-6 |
El-Sharnouby O, Boparai H K, Herrera J, et al. 2018. Aqueous-phase catalytic hydrodechlorination of 1, 2-dichloroethane over palladium nanoparticles (nPd) with residual borohydride from nPd synthesis[J]. Chemical Engineering Journal, 342(15): 281-292. |
甘国强, 李新勇. 2020. 氯代挥发性有机物的光, 电催化去除研究进展[J]. 科学通报, (26): 2804-2819. |
Ke J, Liu J, Sun H Q, et al. 2017. Facile assembly of Bi2O3/Bi2S3/MoS2 n-p heterojunction with layered n-Bi2O3 and p-MoS2 for enhanced photocatalytic water oxidation and pollutant degradation[J]. Applied Catalysis B Environmental, 200: 47-55. DOI:10.1016/j.apcatb.2016.06.071 |
Liang Y J, Lin F G R, Adeli Y, et al. 2019. Efficient electrocatalysis for the preparation of (hetero)aryl chlorides and vinyl chloride with 1, 2-dichloroethane[J]. Angewandte Chemie, 58(14): 4566-4570. DOI:10.1002/anie.201814570 |
Liang Y M, Yu L L, Yang R, et al. 2016. High sensitive and selective graphene oxide/molecularly imprinted polymer electrochemical sensor for 2, 4-dichlorophenol in water[J]. Sensors & Actuators B Chemical, 240: 1330-1335. |
Li G, Xu Q Y, Jin X Y, et al. 2018. Enhanced adsorption and Fenton oxidation of 2, 4-dichlorophenol in aqueous solution using organobentonite supported nZVI[J]. Separation & Purification Technology, 191(31): 401-406. |
Li J, Wang C C, Ji S J, et al. 2017. Mechanism of cobalamin-mediated reductive dehalogenation of chloroethylenes[J]. Acs Catalysis, 7(8): 5294-5307. DOI:10.1021/acscatal.7b00540 |
Liu Q, Shen Y, Song S, et al. 2019. Enhanced electrocatalytic hydrodechlorination of 2, 4-dichlorophenoxyacetic acid by a Pd-Co3O4/Ni foam electrode[J]. RSC Advances, 9(21): 12124-12133. DOI:10.1039/C9RA01843C |
Lou Y Y, Hapiot P, Floner D, et al. 2020. Efficient dechlorination of alpha-halocarbonyl and alpha-haloallyl pollutants by electroreduction on bismuth[J]. Environmental Science and Technology, 54(1): 559-567. DOI:10.1021/acs.est.9b05732 |
马红星. 2016. 银, 钯, 铑催化的氯代和氟代芳香化合物电化学氢化脱卤反应[D]. 杭州: 浙江工业大学
|
Mishra I K, Zhou H Q, Sun J Y, et al. 2018. Hierarchical CoP/Ni5P4/CoP microsheet arrays as a robust pH-universal electrocatalyst for efficient hydrogen generation[J]. Energy & Environmental Science, 11(8): 2246-2252. |
Munoz M, Zhang G R, Etzold B. 2017. Exploring the role of the catalytic support sorption capacity on the hydrodechlorination kinetics by the use of carbide-derived carbons[J]. Applied Catalysis B Environmental, 203: 591-598. DOI:10.1016/j.apcatb.2016.10.062 |
Peng Y Y, Cui M Y, Zhang Z Y, et al. 2019. Bimetallic composition-promoted electrocatalytic hydrodechlorination reaction on silver-palladium alloy nanoparticles[J]. ACS Catalysis, 9(12): 10803-10811. DOI:10.1021/acscatal.9b02282 |
Wei L, Liu D J, Rosales B A, et al. 2020. Mild and selective hydrogenation of nitrate to ammonia in the absence of noble metals[J]. ACS Catalysis, 10(6): 3618-3628. DOI:10.1021/acscatal.9b05338 |
Xiao J W, Yang S H. 2012. Bio-inspired synthesis of NaCl-type CoxNi1-xO (0 ≤ x< 1) nanorods on reduced graphene oxide sheets and screening for asymmetric electrochemical capacitors[J]. Journal of Materials Chemistry, 22(24): 12253-12262. DOI:10.1039/c2jm31057k |
Xu L, Yao X Q, Khan A, et al. 2016. Chloroform hydrodechlorination over palladium-gold catalysts: A first-principles DFT study[J]. Chemcatchem, 8(9): 1739-1746. DOI:10.1002/cctc.201600144 |
徐新华, 金剑, 卫建军, 等. 2004. 纳米Pd/Fe双金属对2, 4-二氯酚的脱氯机理及动力学[J]. 环境科学学报, 34(4): 561-567. DOI:10.3321/j.issn:0253-2468.2004.04.001 |
Xu Y H, Yiao Z Q, Mao Z H, et al. 2020. Single-Ni-atom catalyzes aqueous phase electrochemical reductive dechlorination reaction[J]. Applied Catalysis B: Environmental, 277(15): 119057. |
Yin H S, Cao X K, Lei C, et al. 2020. Insights into electroreductive dehalogenation mechanisms of chlorinated environmental pollutants[J]. ChemElectroChem, 7(8): 1825-1837. DOI:10.1002/celc.202000067 |
张健. 2016. 钯修饰电极的制备及电催化降解氯代有机物的研究[D]. 哈尔滨: 哈尔滨工业大学
|
 2021, Vol. 41
2021, Vol. 41


