2. 玉溪师范学院化学生物与环境学院, 玉溪 653100
2. College of Chemistry Biology and Environment, Yuxi Normal University, Yuxi 653100
城镇污泥出厂前需要进行脱水处理, 而污泥脱水后由于外源营养物质中断, 代谢产物扩散困难, 以及内部供氧不足等使污泥中微生物重组演替, 这一过程的剧烈变化使污泥极不稳定, 易腐败发臭.因此, 在进行农用前需对其进行稳定化处理.而好氧转化过程, 如蚯蚓堆肥就是理想的生物废弃物稳定化处理方法.蚯蚓堆肥是蚯蚓和微生物相互作用的有机质的生物氧化过程(Mupambwa et al., 2018;秦洁等, 2020).但蚯蚓无法在缺氧或厌氧的污泥环境中生存, 因此, 污泥预处理是常见于蚯蚓堆肥前的一种处理途径(Rékási et al., 2019).例如, Fu 等(2015)报道了一种将污泥造粒后直接用于蚯蚓堆肥的城镇污泥预处理方法, 该方法简单省时, 不仅获得了稳定有益的堆肥产品, 并且还省略了繁琐的混合膨化材料的添加, 避免了堆肥过程中新的不可降解物质被引入的风险.
污泥造粒是通过将含水率80%左右的污泥制成粒径5 mm左右的颗粒污泥, 从而改善污泥的通气性, 形成有利于蚯蚓生存的堆肥环境.造粒改变了污泥物理性状, 增加了污泥颗粒的比表面积, 为蚯蚓的生长及好氧微生物的生存繁衍提供了良好的环境(Fu et al., 2016).蚯蚓可通过机械运动、蚓粪排泄和粘液分泌等活动对基质理化环境及微生物群落造成显著影响(Gómez-Brandón et al., 2011; Yang et al., 2014; Heděnec et al., 2020).而微生物作为堆肥系统中有机物降解的主力军(Gómez-Brandón et al., 2013), 其群落组成、数量和活性会随着堆肥过程中基质环境的改变发生明显的演替(Fu et al., 2016).然而, Tian等(2016)报道微生物群落结构和组成的变化不一定会引起其代谢功能的改变.而微生物群落的代谢功能是影响堆肥系统中有机物降解的关键因素, 也是阐释微生物在基质中作用的有效途径(Zhang et al., 2019; Duan et al., 2020).到目前为止, 有关造粒处理对城镇污泥蚯蚓堆肥中微生物群落代谢功能的影响尚不清楚, 仅用微生物的群落结构和数量不足以全面反映造粒污泥蚯蚓堆肥系统中微生物的生态相关性, 因此, 对微生物代谢功能的研究是有必要的.在微生物代谢功能多样性的研究中, Biolog EcoPlates可以通过微生物对不同单一碳源的利用情况, 直接获得微生物群落的整体活性及代谢功能的差异, 是分析微生物群落功能多样性和描述微生物对环境变化响应的有力工具(Song et al., 2021).
基于此, 本研究采用Biolog EcoPlates微平板法比较分析缺(厌)氧状态污泥、好氧状态污泥(造粒污泥)及造粒污泥蚯蚓堆肥3种不同系统中微生物群落碳源利用的共性与特性, 探讨城镇污泥造粒的预处理方法对微生物碳源利用的影响, 明确以造粒污泥为基质的蚯蚓堆肥系统中微生物群落的碳源利用模式.以期为城镇污泥造粒预处理方法的进一步应用, 以及提高对不同环境中微生物群落碳源利用的认识提供参考.
2 材料与方法(Materials and methods) 2.1 实验材料供试蚯蚓取自实验室用污泥喂养的赤子爱胜蚓(Eisenia fetida), 城镇污泥取自兰州市七里河污水厂的污泥脱水车间.供试污泥的有机质含量为34.2%, 含水率为73.3%.供试污泥分为2种形态:一种是未造粒污泥, 污泥保持原有自然脱水状态(Sewage sludge), 文中以S表示;另一种是造粒污泥, 污泥被制成5 mm粒径的颗粒污泥(Pelletized dewatered sludge), 文中以P表示.
2.2 实验设计实验共分为3个组, 第1组为未造粒污泥(S组), 第2组为造粒污泥(P组), 第3组为造粒污泥加蚯蚓(V组).实验用不锈钢容器尺寸为φ36 cm×12 cm, 每个容器中污泥量为3 kg.V组接种300 g蚯蚓, 污泥与蚯蚓质量比为10∶1.每个实验组设置3个重复.将所有容器置于生物培养箱中, 培养箱温度设定在20 ℃, 各反应器遮光、保湿.S组保持实验初期的状态不变, P组和V组容器定期人工翻动一次.实验共进行45 d, 每隔5 d采一次样.
为了了解蚯蚓肠道对污泥中微生物群落碳源利用的影响, 另设置蚓粪组(C组).蚯蚓粪收集过程如下:先将300 g蚯蚓排空肠道, 用清水洗净后再用无菌水漂洗3次, 大张滤纸吸去蚯蚓体表水后放入供试污泥中, 自由进食3 h后将蚯蚓取出, 用无菌水清洗后置于灭菌滤纸上排泥6 h, 收集蚯蚓粪, 随后再将蚯蚓放回基质中.分别于实验的第20 d和45 d进行蚯蚓粪收集的操作.
2.3 微生物碳源利用测定污泥微生物碳代谢多样性采用Biolog-Eco(31种碳源)进行分析测定.每个Biolog-Eco平板上的96个微孔被分为3个平行的样品, 每个平行组由31种碳源和1个纯水对照样品组成.31种碳源被分为六大类:酚类(2种)、氨基酸类(6种)、胺类(2种)、羧酸类(7种)、聚合物类(4种)、碳水化合物类(10种)(Zeng et al., 2018).
称取5.0 g样品加入95 mL无菌生理盐水(0.85%)溶液, 150 r·min-1摇床振荡30 min后, 静置10 min, 待分层稳定取上清液梯度稀释至2×10-2, 取150 μL稀释液用8通道移液枪将其加至Biolog-Eco板的微孔中, 接种好的平板置于25 ℃恒温培养, 分别于24、48、72、96、120 h在Biolog EmaxTM自动读盘机上用BiologReader 4.2软件(Biolog, Hay ward, CA, USA) 读取OD590值和OD750值.
2.4 微生物碳源利用分析计算每个板在每个阅读时间的平均颜色变化率(Average Well Color Development, AWCD), 并对所获得的吸光值进行标准化处理(RSi)用于后续统计分析(Garland, 1996).计算公式如下:
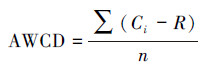
|
(1) |
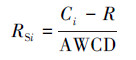
|
(2) |
式中, Ci为反应孔对应的在590 nm与750 nm下吸光值的差值;R为对照孔的吸光值;n为碳源数量.
采用Shanno-Winner多样性指数(H′)、Simpson优势度指数(D)和McIntosh均匀度指数(U)表征微生物群落功能多样性.Shanno-Winner多样性指数(H′)反映微生物群落丰富度, 其值越大, 表示微生物群落越丰富;Simpson优势度指数(D)反映样品中微生物群落的优势度, 其值越小, 表示微生物群落的优势度越高;McIntosh均匀度指数(U)是基于群落物种空间距离的多样性指数, 反映微生物群落的均匀度, 其值越大, 表明微生物群落的均匀度越高(Zhou et al., 2020).计算公式如下:
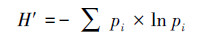
|
(3) |
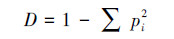
|
(4) |
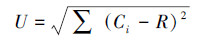
|
(5) |
式中, ni为第i孔的相对吸光值(ni=Ci-R);Pi为ni与整板相对吸光值总和的比值.
2.5 数据处理与分析用SPSS 18.0统计软件对不同处理组差异性进行单因素方差分析(ANOVA), 随后用LSD事后检验分析组内的差异性, 差异显著性定义为P <0.05.对不同实验组微生物代谢特征指纹分析采用多元统计方法中的主成分分析(Principal Component Analysis, PCA).其他的数据处理和图形分析利用Excel 2016和OriginPro 2018软件完成.
3 结果和讨论(Results and discussion) 3.1 造粒处理对微生物碳源代谢活性的影响AWCD值被用于评价微生物群落对碳源的利用能力和活性变化, 其数值越高, 表明微生物群落碳代谢越好(Zeng et al., 2018).实验的AWCD曲线如图 1所示, 可以看出, 各实验组AWCD值均随着培养时间的延长不断增大, 96 h后趋于水平, 说明此时碳代谢能力稳定, 因此, 在后文中均选择96 h的AWCD值进行微生物群落碳源代谢的分析.
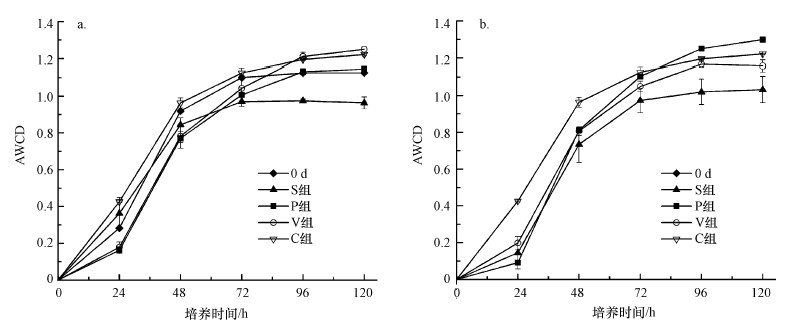 |
| 图 1 不同样品的AWCD值变化曲线 (a.0~15 d, b.15~45 d) Fig. 1 Changes in AWCD with incubation time in different groups |
根据S、P和V 3个组AWCD值随时间变化的趋势, 将整个实验过程分为0~15 d(图 1a)和15~45 d(图 1b)两个阶段.图 1显示, S组微生物碳源代谢能力显著低于P组和V组.这主要是由于未造粒污泥从表面向内部分别呈现好氧、缺氧、厌氧多种状态, 致使系统微生物消长和演替也极不稳定, 从而影响了微生物的代谢途径和代谢能力.此外, P组和V组在15 d前后AWCD值差异明显.15 d前, P组和V组的AWCD值分别为1.132和1.211(图 1a), 与第0 d时的1.126相比, 分别增加了0.53%和7.02%, 说明蚯蚓在前期对微生物碳源代谢具有明显积极的影响.两组中微生物碳源代谢能力的升高与前期基质中易降解有机物含量较丰富有关, 而蚯蚓的加入可以通过粉碎及分泌等作用增加基质中易利用有机物的总量, 进而加速基质中有机物的降解.Zheng等(2020)和Paudel等(2016)也报道蚯蚓可以通过物理干扰和营养物质分泌影响微生物群落的组成和有机物的降解.
15 d后两组情况相反, P组AWCD值与15 d前相比增加了9.44%, 而V组则下降了3.63%(图 1b), 说明造粒污泥系统中微生物群落的碳源代谢能力是个逐级递增的过程.这可能是因为P组中造粒处理改变了污泥的物理性状, 使其中的微生物群落经历了一个自我调整和恢复的过程, 其碳源代谢能力也相应的呈逐级递增的趋势.而V组中AWCD的降低可能与基质中有机物的丰富度、微生物的数量及蚯蚓粪的影响有关.前期微生物对易利用物质的大量利用, 使其在基质中的总量减少, 导致中后期微生物的代谢能力有所降低.Zeng等(2018)的研究结果也显示, 堆肥前期由于基质中易降解有机物较丰富, 微生物的碳源代谢能力较强, 随着易降解有机物的减少, 微生物的代谢能力也逐渐降低.其次, 相关学者指出, 与未加蚯蚓的对照组相比, 随着堆肥的进行, 蚯蚓可以改变微生物的群落结构, 降低基质中微生物的数量、生物量及纤维素酶和碱性磷酸酶等胞外酶的活性(Aira et al., 2009; Villar et al., 2016; Heděnec et al., 2020).Doan等(2013)也报道堆肥前期蚯蚓通过刺激微生物的活性提高基质的适口度, 从而增加中后期蚯蚓对微生物的消耗, 导致部分功能微生物的丧失, 对微生物碳源的代谢产生负面影响.此外, 堆肥后期蚯蚓粪在基质中占比增大, 其对此阶段基质中微生物碳源代谢的影响也逐渐增大.从图 1b可以看出, 蚓粪中AWCD值在72 h前均明显高于其余3组, 之后趋于稳定, 说明蚯蚓粪中微生物群落对碳源的利用速率快, 利用能力强, 这可能与蚯蚓粪中含有丰富的微生物群落及代谢淀粉、蛋白质、脂质等的水解酶有关(Kiyasudeen et al., 2018; Gusain et al., 2020).然而由于蚯蚓肠道菌群的特殊性, 推测其对碳源的代谢也具有某种偏好.再者由于V组堆肥后期微生物总量的减少, 与碳源代谢能力不断增加的P组相比, V组中碳源代谢能力仍较低.
以上结果说明, 污泥造粒可以显著增强微生物的碳源代谢活性, 用造粒污泥进行蚯蚓堆肥可以明显提高堆肥前期微生物群落对碳源的综合利用能力.
3.2 微生物群落功能多样性指数的变化4个实验组微生物碳源代谢功能多样性指数如表 1所示.S组的H′值与初始污泥相比无明显变化, 而P和V组的H′值则随时间呈降低的趋势.15 d后V组的H′值为3.363, 显著低于P组的3.389(P <0.05).D值的结果显示, 3个组中微生物群落代谢优势度与初始污泥相比均有所增大, 其中, V组的优势度显著高于其余两组(P <0.05).以上结果可能与S组、P组和V组的生境多样性有关.S组虽以厌氧为主, 但并存好氧和缺氧生境, 生境多样性使得S组具有较高的生物多样性.同时, 生境多样性使不同功能微生物群落分布更加不均匀, 优势微生物类群的生态功能弱于P组和V组这种好氧环境条件下的微生物类群.因此, S组与其余两组相比多样性较高而优势度和均匀度均较低.相比较P组和V组, 由于V组中蚯蚓的引入, 对微生物的群落产生了明显的调控作用.Gómez-Brandón等(2011)也报道蚯蚓在堆肥过程中通过减少微生物数量和多样性、提高微生物活性来优化微生物群落.此外, 3个处理组中, S组的U值低于第0 d, 而P组和V组则大幅升高.15 d前V组的U值显著高于P组(P <0.05), 这可能与蚯蚓运动及翻堆操作对微生物群落分布的影响有关.15 d后, V组的U值有所降低, 而P组则明显高于V组(P <0.05), 这可能一方面由于P组的翻堆操作使微生物分布均匀;另一方面, V组受蚓粪积累的影响, 使不同功能的微生物群落呈现不均匀的分布状态, 从而影响了微生物对碳源代谢的均匀度.
| 表 1 不同处理组微生物碳源代谢功能多样性指数 Table 1 The functional diversity indices of microbial carbon metabolism among different treatments |
以上结果表明, 造粒处理会降低系统中微生物群落碳源代谢的多样性, 但会提高微生物碳源代谢的优势度和均匀度.
3.3 造粒对碳源利用的影响 3.3.1 造粒对6大类碳源利用的影响图 2展示了3个实验组中微生物群落对不同类型碳源利用能力的强弱.3个实验组中微生物群落对胺类和酚类的利用能力最强, 15 d前和15 d后分别占总利用率的39.94%和38.87%.其中, 微生物对胺类的利用率为19.17%±0.49%, 在3个实验组中无明显差异(p>0.05).说明具有代谢胺类碳源的微生物种类多、环境适应能力强, 具有多途径完成代谢过程的能力.Zeng等(2018)对城镇污泥和绿色废弃物等固体废弃物的堆肥结果也显示微生物对胺的利用率明显高于其余碳源.酚类在V组中的利用率在整个实验过程中均显著高于其余两组(P <0.05), 而S组和P组之间差异不显著(P <0.05).与S组和P组相比, 15 d前和15 d后V组中微生物对酚类的利用率分别提高了13.58%和21.20%.说明污泥造粒对酚类碳源的利用无明显影响, 而蚯蚓对代谢酚类碳源的微生物具有明显积极的调控作用, 这种积极的作用可能来自蚯蚓肠道.Gopal等(2017)报道蚯蚓肠道高度富集了可以降解苯和芳烃类物质的微生物群落.
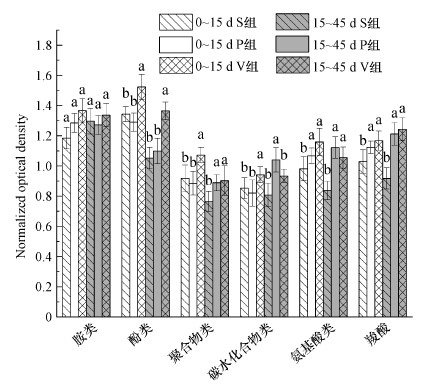 |
| 图 2 不同实验组微生物碳源利用强度 Fig. 2 Microbial carbon utilization for six kinds of carbon sources in different treatment groups |
剩余4种碳源中, 微生物对氨基酸类和羧酸类碳源的利用率较高, 占总利用率的14.74%~18.28%;对聚合物类和碳水化合物类碳源的利用率略低, 占总利用率的12.68%~14.82%.15 d以前S组和P组微生物群落对聚合物类和碳水化合物类碳源的利用率无显著差异(p>0.05), 但V组与这两组相比, 对聚合物类和碳水化合物类碳源的利用率分别提高了11.12%和11.59%.这表明以上两类碳源的利用易受蚯蚓的影响, 与堆肥透气性相关性不显著.此外, V组和P组对氨基酸类和羧酸类碳源的利用率无显著差异(p>0.05), 但二者显著高于S组(P <0.05), 说明造粒对这两类碳源的利用具有明显积极的影响.15 d以后P组微生物对碳水化合物类碳源的利用强度明显增强, 比S组和V组分别提高了22.35%和10.20%.而氨基酸类、羧酸类和聚合物类碳源的利用在P组和V组之间差异不显著(p>0.05), 但却显著高于S组(P <0.05), 表明氧对这3种碳源的利用影响显著.Insam等(1996)对牛粪堆肥的结果也显示厌氧区微生物对碳源的利用明显低于有翻堆操作和通风操作的好氧区.
因此, 本研究中污泥造粒处理可以显著改善基质氧环境, 明显提高微生物对氨基酸类和羧酸类碳源的利用能力, 加入蚯蚓后还可以同时提高微生物对酚类、聚合物类和碳水化合物类的碳源利用率, 从而在堆肥前期明显促进基质中有机物的降解.而中后期, 由于V组中易利用物质的减少, 使微生物对除羧酸外其他碳源的利用能力均有所降低, 降低幅度为0.78%~15.79%.而P组中微生物群落经过自我调整与恢复, 其生长繁殖需要大量的能量, 像碳水化合物类和氨基酸类等高能量输入的碳源(Martínez-Toledo et al., 2021)成为了它们的首选.同时为了满足微生物生长的需求, 其对聚合物类这种较难利用的碳源的利用能力也显著增强.
综上, 以城镇污泥为基质的蚯蚓堆肥系统中, 胺类和酚类是微生物利用的首要底物, 而在自然生态系统中或受污染的生态系统中微生物以碳水化合物类、聚合物类和羧酸类为微生物使用最多的底物(Martínez-Toledo et al., 2021).城镇污泥蚯蚓堆肥特殊的碳源消费模式凸显出了城镇污泥基质的特殊性及蚯蚓对有机物降解的重要性, 而污泥造粒后微生物所表现出显著增高的碳源利用能力也体现出了造粒处理对城镇污泥有机物降解的优势.
3.3.2 造粒对单一碳源利用的影响对31种单一碳源的差异性分析结果显示, 15 d前和15 d后分别有14种和25种碳源具有显著的差异性(图 3), 说明前期环境改善及蚯蚓的作用对超过半数的碳源并未造成明显的影响, 而15 d以后不同基质的微生物群落对碳源的利用出现明显的分化.
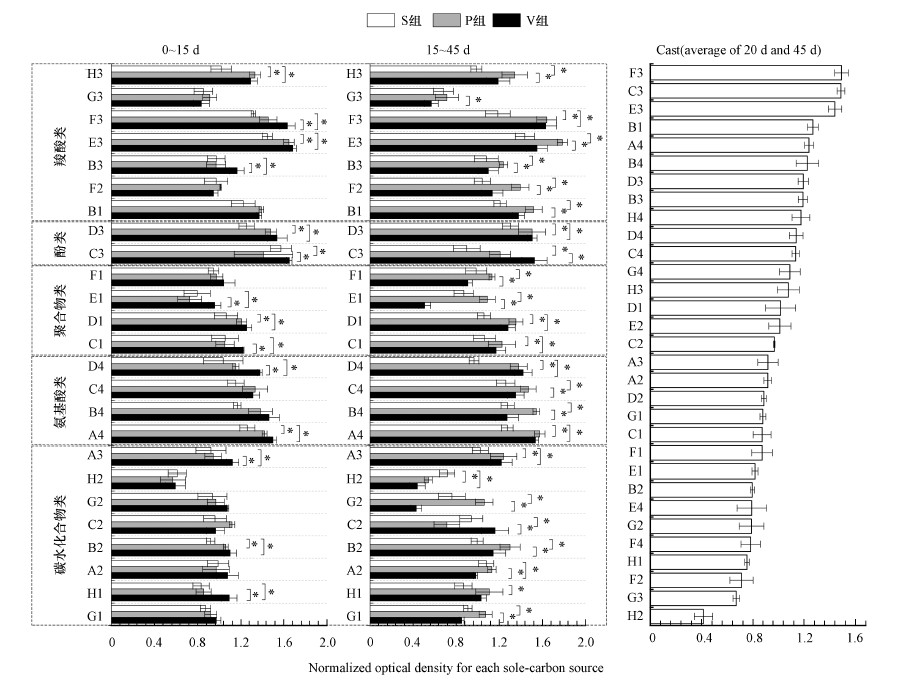 |
| 图 3 3个实验组不同时期具有显著差异的单一碳源及蚯蚓粪中单一碳源的吸光值变化 Fig. 3 Changes of microbial community utilization of each sole-carbon source in three different treatments and earthworm casts |
31种碳源中, B2(D-木糖)、A4(L-精氨酸)、D1(吐温80)、D3(4-羟基苯甲酸)、E3(r-羟基丁酸)、H3(D-苹果酸)、G1(D-纤维二糖)、H1(a-D-乳糖)、G2(葡萄糖-1-磷酸盐)、A3(D-半乳糖酸γ内酯)、B4(L-天冬酰胺酸)、C4(L-苯基丙氨酸)、D4(L-丝氨酸)、C1(吐温40)、E1(a-环状糊精)、F1(肝糖)、C3(2-羟苯甲酸)、B1(丙酮酸甲酯)、F2(D-氨基葡萄糖酸)、B3(D-半乳糖醛酸)和F3(衣康酸), 这21种碳源15 d以后在P组的代谢强度显著高于S组(P <0.05, LSD), 增高幅度达到4.59%~30.04%, 平均为19.18%.这些碳源大部分归属于碳水化合物类、氨基酸类、聚合物类和羧酸类, 说明代谢这四大类碳源的微生物群落更偏爱于有氧环境.其中, 代谢B2、A4、D1、D3、E3、H3这6种碳源的微生物群落在氧环境改善后可以迅速增殖, 而代谢剩余15种碳源的微生物群落, 其细胞增殖则需要较长的时间.
相较于V组和P组, 15 d以前V组微生物群落显著提高了H1、A3、D4、C1、E1、C3、B3和F3这8种碳源的利用率(P <0.05, LSD), 增高幅度达到10.81%~24.83%.这一结果说明代谢这8种碳源的微生物群落会受到蚯蚓活动的积极影响, 从而使堆肥前期V组的AWCD值明显升高.15 d以后, G1、A2(β-甲基D-葡萄糖苷)、B2、G2、B4、C4、E1、F1、B1、F2、B3、E3、G3(a-丁酮酸)、H3这14种碳源在V组的利用率显著低于P组(P <0.05, LSD), 但与前15 d相比, 碳水化合物类和聚合物类降低幅度较大, 分别达到19.60%和29.42%, 其余3类碳源无明显差异.说明在蚯蚓堆肥中后期微生物群落对碳源的利用产生了明显的偏好.
碳水化合物类底物易被微生物降解, 一般在堆肥早期可以被迅速利用(Albrecht et al., 2010).聚合物类虽然是比较难以利用的底物, 但在蚯蚓的参与下, 提高了前期微生物对聚合物类物质的利用强度, 因此, 在中后期随着底物的减少, 其利用率也逐渐降低.另外3种底物中, 氨基酸类物质即是形成腐殖质的前体(Zhang et al., 2019), 又是微生物能量获取和碳的来源, 其在堆肥过程中代谢强度一直保持在较高的水平(López-González et al., 2015).Duan等(2020)也报道了在堆肥过程中有关氨基酸代谢的基因丰度相当丰富.酚类物质的代谢与堆肥的腐殖化过程密切相关.形成腐殖质的关键反应底物之一的木质素就是一种富含羧基、羰基、羟基、甲基等多种侧链的复杂酚类聚合物(He et al., 2013).随着木质素的降解, 其不断释放出对羟基苯甲酸、羧酸等的多种中间产物(Albrecht et al., 2010), 增加了代谢这些物质的微生物群落的丰度, 使堆肥后期酚类和羧酸类物质一直保持着相对较高的代谢强度.此外, 结合蚓粪中微生物群落对碳源的利用可知, 蚯蚓粪的碳源代谢特征与污泥的相一致, 即蚓粪中微生物群落对羧酸类、酚类和氨基酸类的大部分碳源具有较高的利用率, 而对于碳水化合物类和聚合物类的利用较弱.胡艳霞等(2003)报道, 蚯蚓粪的理化性质与蚯蚓所摄食的食物及消化程度关系密切.这说明基质的碳源组成随着堆肥的进行发生了明显的变化, 而另一方面随着蚓粪的积累, 其对基质中微生物的碳源利用也产生了越来越显著的影响.
3.4 微生物群落代谢特征指纹分析对31个碳源因子进行降维分析, 共提取到7个主成分, 累计贡献率为82.5%, 其中, 第一主成分(PC1)方差贡献率为38.1%, 第二主成分(PC2)方差贡献率为12.3%, 第三主成分(PC2)方差贡献率为10.2%, 前3个主成分权重较大, 累计贡献率达到60.6%, 能够反映微生物群落对大部分碳源的利用特征(图 3).
PCA结果说明S组的碳源代谢类型与其余各组分异明显.S组的投影主要从PC1的负端向PC3的负端转移, 与H2(D, L-a-甘油)呈正相关关系, 与其他大部分碳源均呈负相关, 说明S组碳源的整体代谢能力较低.
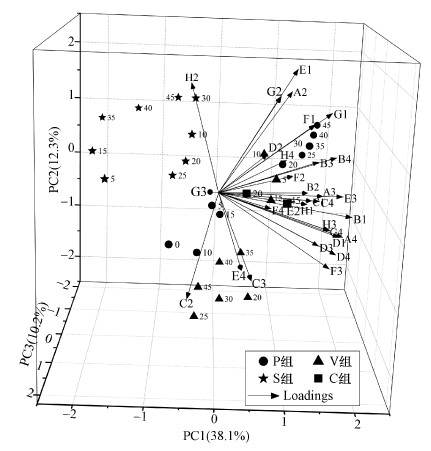 |
| 图 4 不同样品中微生物群落代谢功能的主成分分析 Fig. 4 Principal component analysis of metabolic function of microbial communities in different samples |
P组前15 d的样点主要位于PC3的正轴, 15 d以后向PC1的正轴转移;V组前15 d的样点位于PC1的正轴, 15 d后向PC2的负轴转移;C组3个样点均位于PC1轴的正方向.从表 2可以看出, PC3正轴载荷较高的碳源有9种, 大多数分属于碳水化合物类和羧酸类;PC1正轴上载荷较高的碳源有20种, 涉及到所有的大类;与PC2负轴相关性较高的碳源有9种.由此可知, 蚓粪中微生物群落对碳源的利用以这20种碳源为主.而P组和V组在整个实验过程中对碳源代谢的规律明显不同:P组对碳源的代谢前期以碳水化合物类和羧酸类为主, 中后期碳源代谢的种类多元化;而V组前期碳源的代谢种类较多, 中后期碳源代谢种类逐渐减少.V组中后期与其相关的9种碳源(C2、D4、E3、F3、C3、G4、D3、A4、D1), 大多均是蚯蚓粪中代谢强度较高的碳源(图 3), 说明15 d以后V组碳源代谢活性受到蚓粪积累的影响较大.结合前文中两组AWCD值的变化趋势可知, P组中微生物对碳源的利用具有代谢强度逐渐增强、代谢种类逐渐增多的特点.而V组由于蚯蚓对微生物的调节, 可以直接越过微生物群落对这些碳源代谢能力的增长期, 提前进入碳源代谢强度及种类的高峰期, 但随后由于系统中污泥碳源组成的变化及蚯蚓粪积累的影响, 使其碳源代谢强度和种类亦逐渐减少.Fu等(2016)报道显示, 造粒污泥蚯蚓堆肥过程中, 前期蚯蚓组中微生物数量和活性明显增强, 但到后期, 其数量明显少于无蚯蚓的对照组.本结果与Fu等(2016)对微生物数量和活性的研究结果相符.
| 表 2 在PC1、PC2、PC3上载荷较高(|r|≥0.18)的碳源 Table 2 Factors with higher loading values(|r|≥0.18) on PC1, PC2 and PC3 |
综上, 造粒处理后污泥中微生物对碳源的利用呈现出由单一化向多元化发展的利用模式, 而用造粒污泥进行蚯蚓堆肥则可以提前多元化的代谢期, 使其碳源的利用表现出由多元化向单一化发展的特点.
4 结论(Conclusions)污泥造粒处理对基质氧环境的改善可以显著提高微生物对碳源的代谢能力, 且其大部分微生物群落的碳源代谢强度是一个逐级递增的过程.接种蚯蚓后可以直接越过微生物群落对这些碳源代谢强度的增长期, 提前进入碳源代谢强度及种类的高峰期, 但在中后期随着系统中污泥碳源组成的变化和蚓粪的积累使其对羧酸类、酚类和氨基酸类碳源的代谢产生了明显的偏好, 且总体的碳源代谢能力有所降低.此外, Biolog生态平板所含碳源以环境微生物为对象, 是否能全面反映城镇污泥中微生物的代谢特点还有待更多的实验结果印证.
Aira M, Monroy F, Domínguez J. 2009. Changes in bacterial numbers and microbial activity of pig slurry during gut transit of epigeic and anecic earthworms[J]. Journal of Hazardous Materials, 162: 1404-1407. DOI:10.1016/j.jhazmat.2008.06.031 |
Albrecht R, Périssol C, Ruaudel F, et al. 2010. Functional changes in culturable microbial communities during a co-composting process: Carbon source utilization and co-metabolism[J]. Waste Management, 30(5): 764-770. DOI:10.1016/j.wasman.2009.12.008 |
Doan T T, Jusselme D M, Lata J, et al. 2013. The earthworm species Metaphire posthuma modulates the effect of organic amendments(compost vs.vermicompost from buffalo manure) on soil microbial properties.A laboratory experiment[J]. European Journal of Soil Biology, 59: 15-21. DOI:10.1016/j.ejsobi.2013.08.005 |
Duan M, Zhang Y, Zhou B, et al. 2020. Effects of Bacillus subtilis on carbon components and microbial functional metabolism during cow manure-straw composting[J]. Bioresource Technology, 303: 122868. DOI:10.1016/j.biortech.2020.122868 |
Fu X, Cui G, Huang K, et al. 2016. Earthworms facilitate the stabilization of pelletized dewatered sludge through shaping microbial biomass and activity and community[J]. Environmental Science and Pollution Research, 23(5): 4522-4530. DOI:10.1007/s11356-015-5659-0 |
Fu X, Huang K, Chen X, et al. 2015. Feasibility of vermistabilization for fresh pelletized dewatered sludge with earthworms Bimastus parvus[J]. Bioresource Technology, 175: 646-650. DOI:10.1016/j.biortech.2014.11.007 |
Garland J L. 1996. Patterns of potential C source utilization by rhizosphere communities[J]. Soil Biology and Biochemistry, 28(2): 223-230. DOI:10.1016/0038-0717(95)00113-1 |
Gómez-Brandón M, Aira M, Lores M, et al. 2011. Changes in microbial community structure and function during vermicomposting of pig slurry[J]. Bioresource Technology, 102(5): 4171-4178. DOI:10.1016/j.biortech.2010.12.057 |
Gómez-Brandón M, Lores M, Domínguez J. 2013. Changes in chemical and microbiological properties of rabbit manure in a continuous-feeding vermicomposting system[J]. Bioresource Technology, 128: 310-316. DOI:10.1016/j.biortech.2012.10.112 |
Gopal M, Bhute S S, Gupta A, et al. 2017. Changes in structure and function of bacterial communities during coconut leaf vermicomposting[J]. Antonie van Leeuwenhoek, 110(10): 1339-1355. DOI:10.1007/s10482-017-0894-7 |
Gusain R, Suthar S. 2020. Vermicomposting of duckweed(Spirodela polyrhiza) by employing Eisenia fetida: Changes in nutrient contents, microbial enzyme activities and earthworm biodynamics[J]. Bioresource Technology, 311: 123585. DOI:10.1016/j.biortech.2020.123585 |
He X S, Xi B D, Jiang Y H, et al. 2013. Structural transformation study of water-extractable organic matter during the industrial composting of cattle manure[J]. Microchemical Journal, 106: 160-166. DOI:10.1016/j.microc.2012.06.004 |
Heděnec P, Cajthaml T, Pižl V, et al. 2020. Long-term effects of earthworms(Lumbricus rubellus Hoffmeister, 1843) on activity and composition of soil microbial community under laboratory conditions[J]. Applied Soil Ecology, 150: 103463. DOI:10.1016/j.apsoil.2019.103463 |
胡艳霞, 孙振钧, 程文玲. 2003. 蚯蚓养殖及蚓粪对植物土传病害抑制作用的研究进展[J]. 应用生态学报, 14(2): 296-300. DOI:10.3321/j.issn:1001-9332.2003.02.031 |
Insam H, Amor K, Renner M, et al. 1996. Changes in functional abilities of the microbial community during composting of manure[J]. Microbial Ecology, 31(1): 77-87. |
Kiyasudeen K, Ibrahim M H, Muhammad S A, et al. 2018. Earthworms as plug flow reactors: A first-order kinetic study on the gut of the vermicomposting earthworm Eudrilus eugeniae[J]. Environmental Science and Pollution Research, 25(31): 31062-31070. DOI:10.1007/s11356-018-3074-z |
López-González J A, Suárez-Estrella F, Vargas-García M C, et al. 2015. Dynamics of bacterial microbiota during lignocellulosic waste composting: Studies upon its structure, functionality and biodiversity[J]. Bioresource Technology, 175: 406-416. DOI:10.1016/j.biortech.2014.10.123 |
Martínez-Toledo Á, González-Mille D J, García-Arreola M E, et al. 2021. Patterns in utilization of carbon sources in soil microbial communities contaminated with mine solid wastes from San Luis Potosi, Mexico[J]. Ecotoxicology and Environmental Safety, 208: 111493. DOI:10.1016/j.ecoenv.2020.111493 |
Mupambwa H A, Mnkeni P N S. 2018. Optimizing the vermicomposting of organic wastes amended with inorganic materials for production of nutrient-rich organic fertilizers: a review[J]. Environmental Science and Pollution Research, 25(11): 10577-10595. DOI:10.1007/s11356-018-1328-4 |
Paudel S, Longcore T, Macdonald B, et al. 2016. Belowground interactions with aboveground consequences: Invasive earthworms and arbuscular mycorrhizal fungi[J]. Ecology, 97(3): 605-614. DOI:10.1890/15-1085 |
秦洁, 伏小勇, 陈学民, 等. 2020. 蚯蚓对城镇污泥堆肥过程中微型动物群落演替的影响[J]. 环境科学学报, 40(2): 631-638. |
Rékási M, Mazsu N, Draskovits E, et al. 2019. Comparing the agrochemical properties of compost and vermicomposts produced from municipal sewage sludge digestate[J]. Bioresource Technology, 291: 121861. DOI:10.1016/j.biortech.2019.121861 |
Song B, Zeng Z, Zeng G, et al. 2021. Effects of hydroxyl, carboxyl, and amino functionalized carbon nanotubes on the functional diversity of microbial community in riverine sediment[J]. Chemosphere, 262: 128053. DOI:10.1016/j.chemosphere.2020.128053 |
Tian J, Wang J, Dippold M, et al. 2016. Biochar affects soil organic matter cycling and microbial functions but does not alter microbial community structure in a paddy soil[J]. Science of the Total Environment, 556: 89-97. DOI:10.1016/j.scitotenv.2016.03.010 |
Villar I, Alves D, Pérez-Díaz D, et al. 2016. Changes in microbial dynamics during vermicomposting of fresh and composted sewage sludge[J]. Waste Management, 48: 409-417. DOI:10.1016/j.wasman.2015.10.011 |
Yang J, Lv B, Zhang J, et al. 2014. Insight into the roles of earthworm in vermicomposting of sewage sludge by determining the water-extracts through chemical and spectroscopic methods[J]. Bioresource Technology, 154: 94-100. DOI:10.1016/j.biortech.2013.12.023 |
Zeng Z, Guo X, Xu P, et al. 2018. Responses of microbial carbon metabolism and function diversity induced by complex fungal enzymes in lignocellulosic waste composting[J]. Science of the Total Environment, 643: 539-547. DOI:10.1016/j.scitotenv.2018.06.102 |
Zhang Z, Zhao Y, Yang T, et al. 2019. Effects of exogenous protein-like precursors on humification process during lignocellulose-like biomass composting: Amino acids as the key linker to promote humification process[J]. Bioresource Technology, 291: 121882. DOI:10.1016/j.biortech.2019.121882 |
Zheng Y, Chen X, Gong X, et al. 2020. The geophagous earthworm Metaphire guillelmi effects on rhizosphere microbial community structure and functioning vary with plant species[J]. Geoderma, 379: 114647. DOI:10.1016/j.geoderma.2020.114647 |
Zhou H, Zhang T, Zhuang J, et al. 2020. Study on the regulation of earthworm physiological function under cadmium stress based on a compound mathematical model[J]. Environmental Toxicology and Pharmacology, 80: 103499. DOI:10.1016/j.etap.2020.103499 |
 2021, Vol. 41
2021, Vol. 41


