2. 中国科学院动物研究所干细胞与生殖生物学国家重点实验室, 北京 100101;
3. 中国科学院动物研究所农业虫害鼠害综合治理研究国家重点实验室, 北京 100101;
4. 江苏师范大学生命科学学院, 徐州 221116;
5. 浙江工业大学环境科学学院, 杭州 310014;
6. 中国科学院大学, 北京 100049
2. State Key Laboratory of Stem Cell and Reproductive Biology, Institute of Zoology, Chinese Academy of Sciences, Beijing 100101;
3. State Key Laboratory of Integrated Management of Pest Insects and Rodents, Institute of Zoology, Chinese Academy of Sciences, Beijing 100101;
4. School of Life Sciences, Jiangsu Normal University, Xuzhou 221116;
5. College of Environment, Zhejiang University of Technology, Hangzhou 310014;
6. University of Chinese Academy of Sciences, Beijing 100049
随着经济以及科学技术的不断发展, 金属、尤其是重金属的使用量越来越大, 最终使得重金属的污染日益加剧, 给生态环境的平衡以及人类的健康造成了严重的影响(Waalkes, 2003).镉(cadmium, Cd)污染主要来源于工业排污、垃圾的不完全焚烧及尾矿堆等, 并且可通过食物链、呼吸道吸入等途径进入人或动物体内, 性质稳定, 不易排出, 在体内半衰期长达10~30年.镉进入人或动物体内后, 随血液流动在体内多种器官中积累并产生毒性效应(Agarwal et al., 2011).同时, 少量的镉还可以穿过血胎屏障, 积聚于胚胎组织, 对胚胎及其器官发育产生毒性作用(Thompson et al., 2008).更重要的是, 胚胎或胎儿较成人对外源污染物的毒性更为敏感(Peterson et al., 1993).一系列的流行病学调查结果显示:孕期母体胎盘和血液中的镉含量与胎儿生长受限等多种不良妊娠结局存在相关性(Shirai et al., 2010; Lin et al., 2011).例如, 我们和其他研究者前期的体内实验结果也证实了孕期母体镉暴露可导致胎儿生长受限的发生(Wang et al., 2012; Xu et al., 2016).
镉的毒性效应和毒性机制的研究可追溯至约150年以前(Hinder, 1866), 有关孕期镉暴露对胎儿生长、发育的毒性作用的研究也已经有近40年的历史(Parízek et al., 1968).然而, 这些研究大都集中于孕期镉暴露对胎儿体长、重量和发育畸形的毒性效应(Wang et al., 2012), 而对胎儿器官发育受限的研究相对较少.因此, 有必要通过动物模型的构建和相关分子实验来系统阐明孕期低剂量镉暴露对胎儿器官发育的毒性效应及其相关分子机理.
肝脏是胎儿的重要器官, 该器官相对较大, 其体积占腹腔容积一半以上, 可达体质量的1/20(姜春峰等, 2011).在妊娠中期时, 胎儿肝脏是造血的活跃部位, 也是胎儿时期发生贫血症时髓外造血的重要场所.在妊娠末期时, 胎儿肝脏是胎儿营养物质代谢的最主要场所, 当胎儿营养过剩时, 肝脏将营养物质转化为糖原储存于肝细胞内, 造成肝脏细胞体积的增大, 肝脏也相应地增大;如果胎儿营养不足, 肝细胞将分解储存的糖原以保证心、脑等重要脏器的营养供给(姚琴等, 2003).临床研究结果显示:胎肝面积、重量等指标是预测胎儿发育质量的敏感指标, 对母胎安全具有重要意义.因此, 检测孕期母体镉暴露对胎儿肝脏发育的毒性作用将有助于揭示镉对胚胎发育的影响.胎儿肝脏发育过程较为复杂, 其中小鼠妊娠14.5 d(Embryonic 14.5, E14.5)是胎儿肝脏功能由造血功能转变为代谢功能的重要临界点, 肝脏细胞的增殖和凋亡功能均较为活跃(Riger et al., 2012).
基于此, 本研究拟构建孕期低剂量镉暴露小鼠模型, 通过TUNEL染色和Ki67染色的方法探究镉对E14.5 d胎鼠肝脏细胞的增殖和凋亡功能的影响.并且通过PCR芯片和实时定量PCR(quantitative real-time PCR, qRT-PCR)等实验方法分析镉暴露后胎鼠肝脏相关功能基因的表达变化, 从而探究镉对胎鼠肝脏毒性作用的相关分子机制.此外, 本研究还将讨论性别差异在镉诱导的胎肝发育毒性作用中所发挥的功能.
2 材料与方法(Materials and methods) 2.1 实验试剂与仪器氯化镉(CdCl2·2.5H2O, 分析纯, 博迪化工有限公司, 天津), 实验前用蒸馏水配成20000 mg·L-1的母液;石蜡组织包埋机和切片机购自于Leica公司(德国);PCR仪购自于Eppendorf公司(德国);无水乙醇、二甲苯等试剂均为分析纯级别, 购自于北京化工厂.
2.2 实验动物分组及处理选用性成熟的8周龄的C57BL/6小鼠(雄性小鼠体重:25~28 g, 雌性小鼠体重:20~23 g;购自山西医科大学动物中心), 严格按照山西医科大学动物伦理委员会制订的实验动物操作相关规范在山西医科大学动物中心进行小鼠的日常饲养和管理.饲养温度为(23±1.1) ℃, 湿度为60%±4.9%, 光照周期12 h/12 h, 自由采食饮水, 适应环境1周后开始进行合笼操作.合笼操作每天晚上9:00开始(每笼中放置1只雄鼠与2~3只雌鼠), 第2天早晨7:00检查阴栓, 以出现阴栓的当天作为E0.5 d.自E7.5 d开始, 15只体重相近的孕鼠随机分为3组, 分别经口暴露0、20和40 mg·L-1浓度的氯化镉(CdCl2)溶液.经口暴露的CdCl2溶液每天更换, 并且利用原子吸收仪对相关溶液进行检测以确保浓度恒定.E14.5 d收集各组小鼠的胎肝、胎盘、血液等组织标本, 每组5只孕鼠.收集的组织分别用甲醛固定后进行石蜡包埋或用RNase free的1.5 mL小管保存于-80 ℃冰箱中.
2.3 镉水浓度的测定镉暴露期间对水体中镉浓度进行测定, 水样采集时间为每次换水后(0 h)和24 h, 暴露期间共连续收集2次水样, 参考杨晓婧等(2010)方法, 采用火焰原子吸收光谱法测定水样中镉离子浓度.
2.4 组织中镉含量的测定参考Vihnanek等(2013)方法, 浓硝酸(优级纯)硝化完全, 定容后用石墨炉原子吸收分光光度计(VARIAN AA-6300, CA, USA)测定各处理组的整个胎鼠的镉含量.该仪器检测限是1 μg·kg-1, 回收率为80%~90%.
2.5 DNA提取和性别鉴定胎儿组织的DNA通过基因组DNA提取试剂盒(天根生化科技有限公司, 北京)操作完成, 其操作步骤参见说明书.
我们通过PCR反应特异性扩增雄性特异性基因Sry来检测胎儿性别.PCR反应体系:Master Mix(2x) 10 μL, 正、反向引物(10 μmol·L-1)各0.4 μL, DNA模板1 μL, 双蒸水8.2 μL.扩增循环参数:预变性:95℃预变性3 min;95 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸30 s, 30个PCR循环;72 ℃延伸10 min.Sry基因扩增的正向、反向引物序列(5′-3′)分别为:正向TGGGACTGGTGACAATTGTC;反向GAGT ACAGGT GTGCAGCTCT.琼脂糖凝胶电泳检测DNA条带.
2.6 Ki67染色厚度4 μm的胎肝组织切片经脱蜡、水合、抗原修复等步骤, 分别与Ki67抗体(巴傲得生物科技有限公司, 南京)和相应的二抗(中杉金桥, 北京)孵育后, DAB显色, 中性树胶封片.
以细胞核内出现棕褐色为阳性细胞标准, 每个实验组选取10个视野, 对每个视野的所有细胞均进行计数, 计算细胞增殖指数(proliferation index, PI), 见式(1).
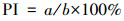
|
(1) |
式中, a为阳性细胞数, b为总细胞数.
2.7 TUNEL染色TUNEL试剂盒购自于罗氏生命科技公司(瑞士), 其具体步骤如下:厚度4 μm的胎肝组织切片经脱蜡、水合、蛋白酶K消化、抗原修复等步骤后, 按照试剂盒说明书要求分别与标记反应混合物、转化剂-POD进行避光孵育反应后, DAB显色, 中性树胶封片.
以细胞核内出现棕褐色为阳性细胞标准, 每个实验组选取10个视野, 对每个视野的所有细胞均进行计数, 计算细胞凋亡指数(apoptotic index, AI), 见式(1).
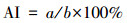
|
(2) |
式中, a为阳性细胞数, b为总细胞数.
此外, 为验证实验体系无误, 我们分别添加阳性对照组和阴性对照组, 阳性对照组为蛋白酶K消化后添加100 μL DNase I反应液, 室温下处理1 h, 使之产生DNA缺口.阴性对照组用不添加转化剂-POD的BSA进行孵育.
2.8 RNA提取和cDNA模板的制备TRizol试剂提取胎鼠肝脏组织中的总RNA, 紫外分光光度计测定结果显示, 其OD260/OD280值为1.9~2.1, 表明其纯度相对较高.同时, 用琼脂糖凝胶电泳检测提取RNA的完整性.定量2 μg RNA用反转录酶、oligo-dT和dNTP等试剂进行逆转录合成cDNA用于后续研究.
2.9 PCR芯片分析PCR芯片实验由沃吉基因公司完成.PCR芯片反应在ViiATM7实时定量PCR仪(ABI公司, 美国)中进行操作.每个样品检测90个与增殖相关的基因和4个内参基因.实时定量PCR反应体系:SYBR Master Mix(2x) 5 μL, 正、反向引物(10 μmol·L-1)各0.75 μL, cDNA模板0.5 μL, 双蒸水3 μL.扩增循环参数:95 ℃预变性10 min;95 ℃变性30 s, 60 ℃退火30 s, 40个PCR循环.
2.10 实时定量PCR实时定量PCR实验在ABI7500实时定量PCR仪器(ABI公司, 美国)中进行操作.两步法PCR反应体系:SYBR Premix Ex TaqTMII(2x) 10 μL, cDNA 1 μL, 正、反向引物(10 μmol·L-1) 0.25 μL, ROX DyeII 0.4 μL, 双蒸水8.1 μL.扩增循环参数:95 ℃预变性10 min;95 ℃变性15 s, 60 ℃退火1 min, 40个PCR循环.以β-actin为内参, 用2-ΔΔCt表示各目的基因的相对表达量. 其中ΔΔCt= Ct.target-Ct.β-actin.引物由上海生工生物工程有限公司设计合成, 序列参见表 1.
| 表 1 引物序列 Table 1 Primer sequences |
所有实验数据均采用SPSS 16.0软件单因素方差分析(One-Way ANOVA)进行统计分析.结果用平均值±标准差(Mean±SD)表示, *p < 0.05表示存在显著性差异.
3 结果(Results) 3.1 水样中镉浓度的测定表 2为镉暴露后每组水样中镉的浓度变化.在0 h时, 与标准镉暴露浓度相比, 各组中的镉浓度无显著性变化.但除对照组外, 所有处理组水样中的镉浓度在24 h时显著降低.
| 表 2 各处理组水样镉浓度的测定 Table 2 Cd concentration analysis in water from experimental groups exposed to Cd |
孕期低剂量镉暴露对雌性和雄性胎儿的体重(图 1a~1b)、胎肝重量(图 1c~1d)和胎儿肝脏指数(图 1e~1f)均无显著性影响(p>0.05).
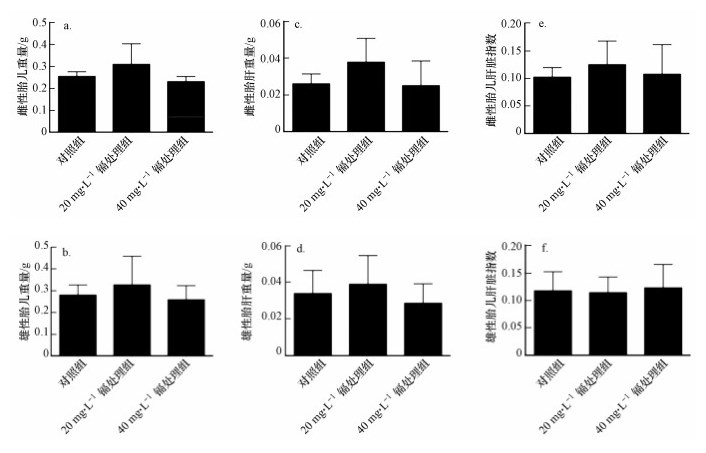 |
| 图 1 孕期低剂量镉暴露对雌性和雄性胎鼠重量(a, b)、胎肝重量(c, d)和肝脏指数的影响(e, f) ((n=20), p>0.05) Fig. 1 Effects of maternal Cd exposure on the fetal weights (a, b), fetal liver weights (c, d) and the fetal liver coefficients (including females and males) in mice(e, f) ((n=20), p>0.05) |
如图 2所示, 不同浓度镉暴露后, 与对照组相比, 镉在雌性胎儿中的积累量显著升高, 而在雄性胎儿中的积累量无显著性差异.
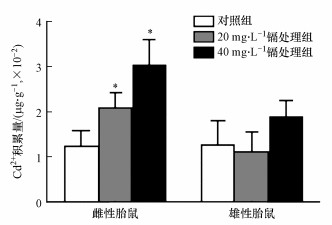 |
| 图 2 镉在雄性和雌性胎鼠中的积累 (统计结果表示为平均值±标准差, *p < 0.05, (n=15)) Fig. 2 Bioaccumulation of cadmium in the female and male fetuses (Results were presented as mean±SD, *: p < 0.05; compared with the controls, n=15) |
如图 3所示, 雌性和雄性胎鼠肝脏(包括对照组和不同浓度镉处理组)免疫组化后(DAB染色)细胞核内均出现不同数量的棕黄色颗粒.对于雌性胎鼠, 对照组胎鼠肝脏中可见较为明显的棕黄色沉淀, 呈强阳性;而在不同浓度的镉处理后, 20 mg·L-1和40 mg·L-1镉处理组的胎鼠肝脏中棕黄色染色强度呈减弱趋势, 且与对照组相比, 均显著降低.对于雄性胎鼠, 空白组和不同浓度镉处理组的胎鼠肝脏中均呈现一定程度的棕黄色沉淀, 但无显著性差异.
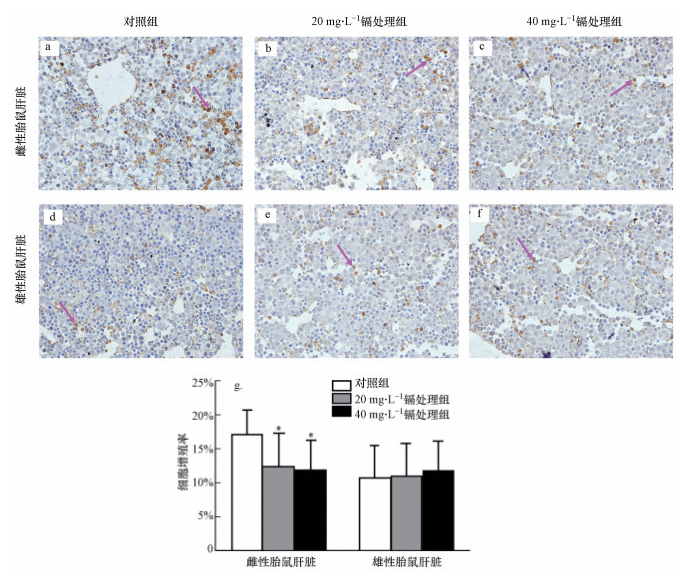 |
| 图 3 孕期低剂量镉暴露对雌性和雄性胎鼠肝脏增殖功能的影响 (箭头:Ki67阳性细胞.细胞增殖率统计结果表示为平均值±标准差, *p < 0.05, n=15) Fig. 3 Effects of maternal Cd exposure on the cell proliferation of the fetal liver (including females and males), arrowhead: Ki67 positive cells (Results were presented as mean±SD. *: p < 0.05; compared with the controls, n=15) |
如图 4所示, 对于雌性和雄性胎鼠, 对照组和不同浓度镉处理组的肝脏中都几乎无法观察到TUNEL阳性细胞.因此在本实验条件下, 不同浓度的镉暴露对雄性和雌性胎儿肝脏的凋亡功能均无显著性影响.此外, 为证明实验系统无误, 我们也对阳性对照组和阴性对照组进行了实验, 结果显示:阴性对照组几乎不存在阳性凋亡细胞, 细胞排列紧密;阳性对照组视野范围内存在大量棕褐色的阳性细胞, 细胞凋亡指数显著升高(图 5).
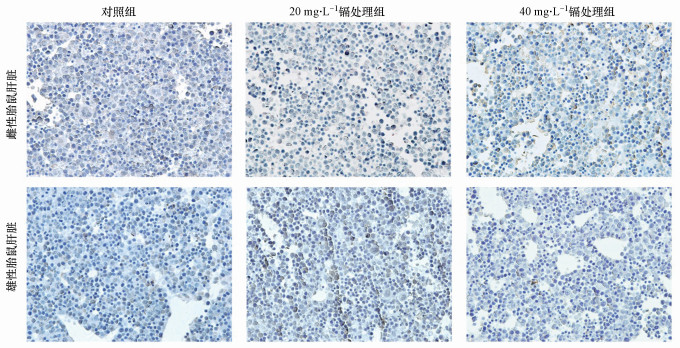 |
| 图 4 孕期低剂量镉暴露对雌性和雄性胎鼠肝脏凋亡功能的影响 (n=15) Fig. 4 The effects of maternal Cd exposure on the cell apoptosis of the fetal liver (including females and males, n=15) |
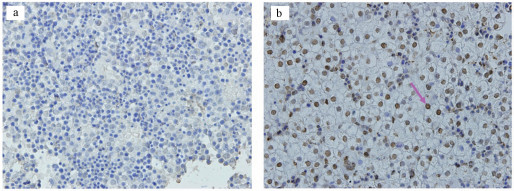 |
| 图 5 阴性对照组和阳性对照组的胎肝切片的TUNEL实验检测 (箭头:TUNEL阳性细胞) Fig. 5 The negative control and positive control of the TUNEL experiments (arrowhead: TUNEL positive cells) |
为进一步探讨孕期低剂量镉暴露对雌性胎鼠肝脏增殖功能抑制作用的分子机理, 我们通过PCR芯片技术检测孕期低剂量镉暴露的雌性胎鼠肝脏中与增殖功能相关的90个基因的表达变化.如图 6、7a、7c、7e和7g所示, 与对照组相比, 40 mg·L-1镉处理组的雌性胎鼠肝脏中NF1、TGF-β1、TGFβR3和TNF的表达水平显著升高.
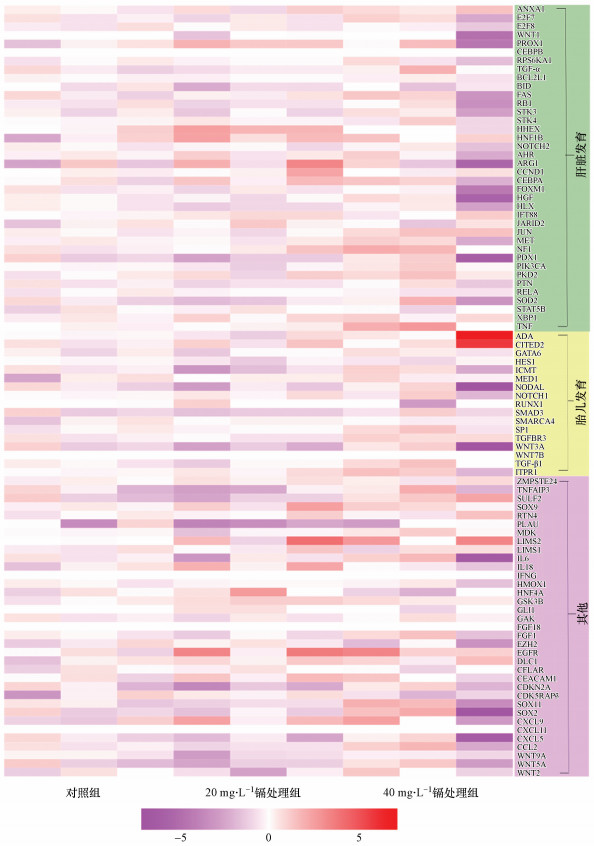 |
| 图 6 孕期低剂量镉暴露后雌性胎鼠肝脏中增殖相关基因表达变化的热图分析结果 (热图分析数据为不同剂量镉暴露雌性胎鼠肝脏中增殖相关基因的倍数变化的对数值, 倍数变化是通过与对照组的平均值比较获得, 热图的颜色范围从红色到紫色, 分别表示基因表达水平的上调或下调(n=3)) Fig. 6 Heatmap showing the log(fold-changes) in cell proliferation genome after maternal Cd exposure in the liver of the female fetuses (Fold-changes were calculated versus the solvent control average. Color scale ranges from red to purple which respectively denotes the up- or down-regulated of the genes (n=3)) |
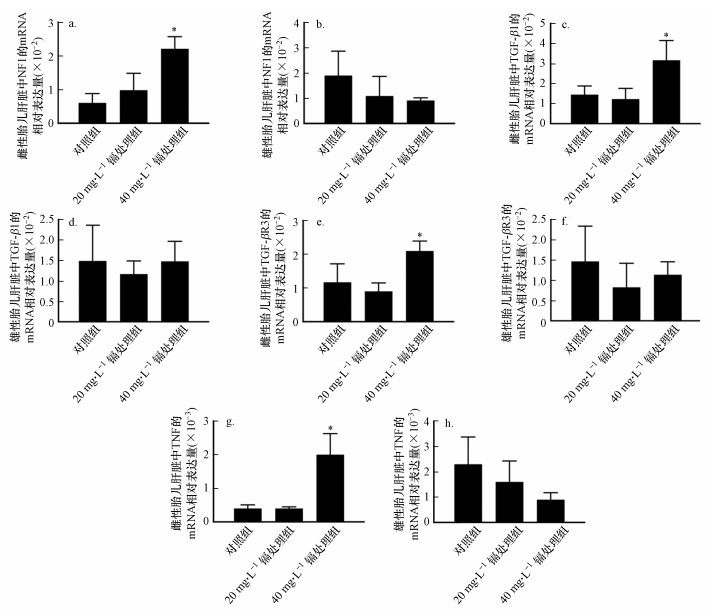 |
| 图 7 孕期低剂量镉暴露雌性(a, c, e, g)和雄性(b, d, f, h)胎鼠肝脏中增殖功能相关基因(NF1、TGF-β1、TGFβR3和TNF)的mRNA表达水平检测 (实验结果表示为平均值±标准差, *p < 0.05, n=15) Fig. 7 Effects of maternal Cd exposure on the mRNA expression levels of the genes (NF1, TGF-β1, TGFβR3 and TNF) in the livers of the female (a, c, e and g) and male (b, d, f and h) fetuses (Results were presented as mean±SD. *: p < 0.05; compared with the controls, n=15) |
同时, 我们通过DAVID Function Annotation Clustering工具(https://david.ncifcrf.gov/tools.jsp)对PCR芯片中的90个增殖相关基因进行GO分析可知, NF1、TNF与肝脏发育相关, 而TGF-β1、TGFβR3与胎儿宫内发育相关(图 6).
此外, 我们还通过qRT-PCR技术对孕期低剂量镉暴露的雄性胎鼠肝脏中上述4个基因的表达情况进行检测, 结果显示:孕期低剂量镉暴露对雄性胎鼠肝脏中NF1、TGF-β1、TGFβR3和TNF的表达水平无显著性影响(图 7b、7d、7f和7h).
3.7 孕期低剂量镉暴露对雌性胎鼠肝脏中TGF-β1信号通路相关分子表达水平的影响我们通过qRT-PCR方法对镉处理的雌性胎鼠肝脏中TGF-β1信号通路的其他成员分子(TGFβR1、TGFβR2、Smad2和Smad4)的表达水平进行检测(由于PCR芯片检测结果显示:孕期低剂量镉暴露对雌性胎鼠肝脏中Smad3的表达水平无显著性影响, 故我们不再通过qRT-PCR实验方法检测Smad3的表达水平变化).如图 8所示, 与对照组相比, 20 mg·L-1和(或)40 mg·L-1镉处理组雌性胎鼠肝脏中TGF-β信号通路各成员分子的表达水平相对较高;40 mg·L-1镉处理组雌性胎鼠肝脏中TGFβR1的表达水平显著升高.
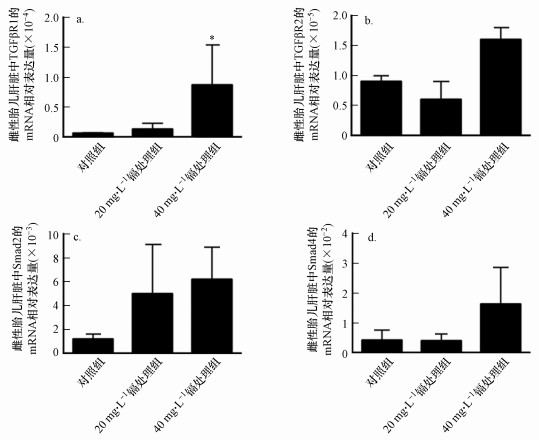 |
| 图 8 孕期低剂量镉暴露雌性胎鼠肝脏中TGF-β信号通路相关分子的mRNA表达水平检测 (a. TGFβR1, b. TGFβR2, c. Smad2, d. Smad4)(实验结果表示为平均值±标准差, *p < 0.05, n=15) Fig. 8 Effects of maternal Cd exposure on the mRNA expression levels of the genes of TGF-β signaling in the fetal livers (including females and males) (a. TGFβR1, b. TGFβR2, c. Smad2, d. Smad4)(Results were presented as mean±SD. *: p < 0.05; compared with the controls, n=15) |
Bcl-2、Bax、caspase-3、caspase-8、caspase-9和caspase-12基因在细胞中表达水平的失衡与细胞凋亡功能紧密相关(Van Opdenbosch et al., 2019; Nasehi et al., 2020).qRT-PCR实验结果显示, 孕期低剂量镉暴露对雌性和雄性胎鼠肝脏中上述6个基因的表达水平无显著性影响(p>0.05)(图 8).这与我们前期的TUNEL实验结果(图 4)相符.
4 讨论(Discussion)由于动物实验结果显示:食物是孕期母胎重金属暴露的重要来源, 孕期和哺乳期的小鼠和大鼠在通过膳食吸收的镉等重金属元素含量是非孕的雌性小鼠和大鼠的2~3倍甚至3倍以上(Kostial et al., 1972; Bhattacharyya et al., 1982).基于此, 本研究采取经口暴露方式进行小鼠动物模型构建.由于动物实验数据显示:高浓度经口镉暴露(50~180 mg·L-1)可能导致子代生长受限(Barański, 1987), 甚至出现发育畸形(Chernoff, 1973), 低浓度经口镉暴露(1~10 mg·L-1)则对子代发育几乎没有任何毒性效应(Luo et al., 2015), 基于此, 本研究采用20 mg·L-1和40 mg·L-1作为经口镉暴露浓度.本研究在E7.5 d(胚胎植入完成)时开始进行镉暴露, 从而避免镉对胎儿植入产生影响所导致的不良妊娠结局(如流产).此外, 各实验组孕鼠每只饮水量为(4.64±0.18)mL, 波动范围相对较小(< 5%)(Xu et al., 2016), 对实验结果不会造成太大的影响.
胚胎时期的肝脏组织是造血、免疫和肝脏系统干/祖细胞的主要来源, 与胎儿发育密切相关(Rieger et al., 2012).小鼠胎肝的形成和发育过程较为复杂, 研究者普遍认为, 胎儿肝脏起源于腹腔前肠内胚层细胞, E8.5~9.5 d时, 肝脏干/祖细胞迅速增殖;E9.5 d后, 迁移到原始横隔, 形成肝原基;E10.5 d后肝原基开始形成血管, 胎肝造血功能开始活跃;E14.5 d后, 胎肝发育完成并开始形成多种肝细胞酶(Rieger et al., 2012).因此, E14.5 d时, 胎儿肝脏细胞生长增殖活跃, 代谢功能旺盛.另一方面, 由于E14.5 d后胎儿的造血器官由肝脏转移到骨髓, 胎肝造血功能退化, 部分造血细胞发生程序性死亡以适应该生理变化过程(方军捷等, 1995).因此, E14.5 d是胎肝细胞增殖和凋亡的活跃时期.本研究中, 我们通过Ki67染色和TUNEL染色的方法来检测孕期低剂量镉暴露对E14.5 d小鼠胎肝细胞增殖和凋亡功能的影响.实验结果显示:在本实验条件下, 孕期低剂量镉暴露对雌性和雄性胎鼠肝脏的凋亡功能均无显著性影响(图 4);孕期低剂量镉暴露对雌性胎鼠肝脏的增殖功能具有抑制作用, 而对雄性胎鼠肝脏的增殖功能无显著性影响(图 3).此外, 本实验结果显示, 正常情况下, 雄性胎鼠肝脏细胞增殖率只有雌性胎鼠的60%左右(图 3).这可能是由于雌性小鼠肝脏的糖原合成功能相对较高, 生物能量供给较为充足, 因此肝细胞增殖水平相对较高(方芳, 2010).
PCR芯片技术可同时检测大量基因(高达90个), 且具有样品用量少、测试准确、操作方便和反应快速等优点, 广泛用于生物学、医学和环境化学等多种学科的基因筛查和检测(Cong et al., 2018).因此, 为进一步探究孕期低剂量镉暴露对雌性胎鼠肝脏增殖调控的分子机制, 我们通过PCR芯片技术对镉暴露的雌性胎肝样品中增殖功能相关调控基因的表达水平进行筛查.结果显示:与对照组相比, NF1、TGF-β1、TGFβR3和TNF在40 mg·L-1镉处理组中的表达水平显著降低(图 6、7a、7c、7e和7g).同时, qRT-PCR结果显示:镉暴露的雄性胎鼠肝脏中上述4个基因的表达水平无显著性变化(图 7b、7d、7f和7h).GO分析结果显示:NF1、TNF与肝脏发育相关, 而TGF-β1、TGFβR3与胎儿宫内发育相关(图 6).并且一系列的研究结果也已经证实了上述4个基因在胎儿和(或)胎肝发育中的重要功能(Zhang et al., 1998; Kamiya et al., 2004; Caja et al., 2011).因此, 孕期低剂量镉暴露对雌性胎鼠肝脏增殖功能的特异性抑制作用可能与镉暴露的雌性胎肝中NF1、TGF-β1等基因的表达失衡相关.
有趣的是, TGF-β1和TGFβR3是TGF-β超家族的重要成员(Ikushima et al., 2010; Wilson et al., 2021), PCR芯片分析结果显示这两个分子在镉暴露的雌性胎鼠肝脏中表达水平显著降调(图 6、7c和7e).有趣的是, TGF-β1和TGFβR3都是TGF-β信号分子超家族的重要成员.TGF-β在哺乳动物中有TGF-β1、2、3 3种异构体, 而以TGF-β1分布最广, 活性最强, 对其了解最为深入(Wilson et al., 2021), 并且该信号通路与胎儿及多种胎儿器官发育功能密切相关(Wu et al., 2009).一系列体内和体外研究结果显示, TGF-β1对细胞的增殖、凋亡和分化等功能具有正向或负性的调控作用, 其调控作用随细胞种类、培养条件等的差异而不同(Ikushima et al., 2010).然而, TGF-β1主要是作为负向调节因子在胎肝的造血干/祖细胞水平发挥生长抑制作用(Caja et al., 2011).TGF-β1通过跨膜的I型和II型受体传导信号, 继而胞内的信号分子Smads作为跨膜受体的底物, 继续传递信号(Ikushima et al., 2010).因此, 为探究TGF-β1信号通路在孕期低剂量镉暴露对雌性胎鼠肝脏细胞的增殖功能的抑制作用中所发挥的功能, 我们通过qRT-PCR实验方法对TGF-β1信号通路中的其他分子在镉暴露的雌性胎鼠肝脏中的表达水平进行检测, 结果显示:与对照组相比, 40 mg·L-1镉处理组的TGFβR1的mRNA表达水平显著升高(图 8a).因此, 孕期低剂量镉暴露可能通过诱导雌性胎肝组织中TGF-β1、TGFβR1的表达失衡, 进而对TGF-β1信号通路产生干扰作用;孕期低剂量镉暴露对雌性胎鼠肝脏增殖功能的抑制作用可能与镉对雌性胎鼠肝脏中TGF-β1信号通路的干扰作用相关.
Bcl-2家族和caspase家族是参与细胞凋亡调控的重要基因, 前者能通过促进线粒体外膜通透性控制并调节线粒体的凋亡途径(Nasehi et al., 2020);而后者作为细胞凋亡的执行者, 可直接或间接地导致细胞凋亡结构特征的出现(Van Opdenbosch et al., 2019).本研究结果显示:孕期低剂量镉暴露的雄性和雌性胎鼠肝脏中Bcl-2、Bax、caspase-3、caspase-8、caspase-9和caspase-12的mRNA表达水平均无显著性变化(图 9a~9f).因此, 孕期低剂量镉暴露对雌性和雄性胎鼠肝脏中多种凋亡相关基因的mRNA表达水平无显著性影响, 这与我们的TUNEL染色结果是相符的(图 4).
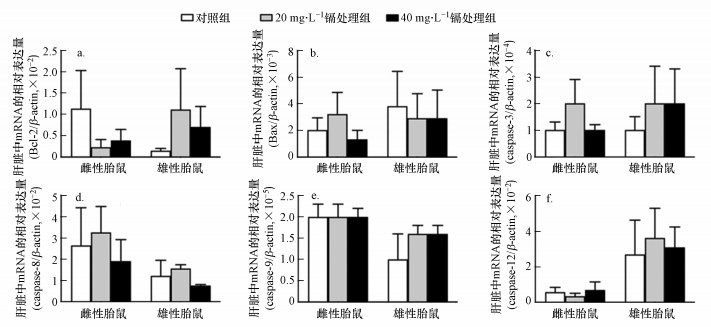 |
| 图 9 孕期低剂量镉暴露对雌性和雄性胎鼠肝脏中Bcl-2(a)、Bax(b)、caspase-3(c)、caspase-8(d)、caspase-9(e)和caspase-12(f)基因的mRNA表达水平的影响 (实验结果表示为平均值±标准差, n=15, p>0.05) Fig. 9 Effects of maternal Cd exposure on the mRNA expression levels of the apoptotic genes in the fetal livers (including females and males) (a. Bcl-2, b. Bax, c. caspase-3, d. caspase-8, e. caspase-9, f. caspase-12) (Results were presented as mean±SD, n=15, p>0.05) |
越来越多的研究证据表明孕期污染物暴露能够性别依赖性的影响胎儿发育, 例如孕期DEHP暴露会影响雄性子代的空间学习和记忆能力, 但是对雌性子代的影响不显著(Dai et al., 2015);孕期PAEs暴露可导致胎儿发生胎儿生长受限, 且男胎对PAEs的敏感性较女胎更为显著(Zhao et al., 2014).与上述研究结果相似, 本研究发现, 孕期低剂量镉暴露特异性对雌性胎鼠肝脏中增殖功能产生抑制作用, 而对雄性胎鼠肝脏中增殖功能无显著性影响(图 3);而该性别特异性抑制作用可能与镉暴露的雌性胎鼠肝脏中TGF-β1等增殖相关基因的表达失衡相关(图 7a、7c、7e、7g和8a).这些雌性特异性的抑制作用可能与镉在雌性胎儿中相对较高的积累量相关(图 2).
5 结论(Conclusions)1) 在本实验条件下, 孕期低剂量镉暴露对E14.5 d胎鼠肝脏的细胞凋亡功能无显著性影响, 对增殖功能具有抑制作用, 且该抑制作用具有性别依赖特性.
2) 孕期低剂量镉暴露对E14.5 d雌性胎鼠肝脏细胞增殖功能的抑制作用可能与镉处理的雌性胎鼠肝脏中NF1、TGF-β1、TGFβR3和TNF等细胞增殖功能相关基因的表达失衡和TGF-β1信号通路的异常激活相关.
3) 孕期低剂量镉暴露对E14.5 d雌性胎鼠肝脏细胞增殖功能的特异性抑制作用以及对相关基因表达的影响可能与镉在雌性胎儿中的较多积累量有关.
Agarwal S, Zaman T, Tuzcu E M, et al. 2011. Heavy metals and cardiovascular disease: results from the National Health and Nutrition Examination Survey (NHANES) 1999-2006[J]. Angiology, 62: 422-429. DOI:10.1177/0003319710395562 |
Bhattacharyya M H, Whelton B D, Peterson D P. 1982. Gastrointestinal absorption of cadmium in. mice during gestation and lactation. Ⅱ. Continuous exposure studies[J]. Toxicology and Applied Pharmacology, 66: 368-375. DOI:10.1016/0041-008X(82)90303-9 |
Barański B. 1987. Effect of cadmium on prenatal development and on tissue cadmium, copper, and zinc concentrations in rats[J]. Environmental Research, 42(1): 54-62. DOI:10.1016/S0013-9351(87)80006-3 |
Caja L, Bertran E, Campbell J, et al. 2011. The transforming growth factor-beta (TGF-β) mediates acquisition of a mesenchymal stem cell-like phenotype in human liver cells[J]. Journal of Cellular Physiology, 226(5): 1214-1223. DOI:10.1002/jcp.22439 |
Chernoff N. 1973. Teratogenic effects of cadmium in rats[J]. Teratology, 8(1): 29-32. DOI:10.1002/tera.1420080105 |
Cong F, Zhu Y, Liu X, et al. 2018. Development of an xTAG-multiplex PCR array for the detection of four avian respiratory viruses[J]. Molecular and Cellular Probes, 37: 1-5. DOI:10.1016/j.mcp.2017.10.002 |
Dai Y, Yang Y, Xu X, et al. 2015. Effects of uterine and lactational exposure to di-(2-ethylhexyl) phthalate on spatial memory and NMDA receptor of hippocampus in mice[J]. Hormones and Behavior, 71: 41-48. DOI:10.1016/j.yhbeh.2015.03.008 |
方军捷, 马东初. 1995. 胎肝造血与凋亡[J]. 国外医学.输血及血液学分册, 18(3): 137-140. |
方芳. 2010. 雌性及雄性小鼠肝脏再生能力比较[D]. 广州: 广州医学院. 1-47
|
Hinder J. 1866. Poisoning by Chloride of Cadmium; Death[J]. The Indian Medical Gazette, 1(6): 156-157. |
Ikushima H, Miyazono K. 2010. TGFbeta signaling: A complex web in cancer progression[J]. Nature Reviews Cancer, 10(6): 415-424. DOI:10.1038/nrc2853 |
姜春峰, 卢洪涛, 李雪媛, 等. 2011. 孕16~40周正常胎儿肝脏长度变化[J]. 山东医药, 51(50): 92. DOI:10.3969/j.issn.1002-266X.2011.50.067 |
Kamiya A, Gonzalez F J. 2004. TNF-alpha regulates mouse fetal hepatic maturation induced by oncostatin M and extracellular matrices[J]. Hepatology, 40(3): 527-536. DOI:10.1002/hep.20362 |
Kippler M, Engstrom K, Mlakar S J, et al. 2013. Sex-specific effects of early life cadmium exposure on DNA methylation and implications for birth weight[J]. Epigenetics, 8(5): 494-503. DOI:10.4161/epi.24401 |
Kostial K, Momcilović B. 1972. The effect of lactation on the absorption of 203 Pb and 47 Ca in. rats[J]. Health Physics, 23: 383-384. |
Lin C M, Doyle P, Wang D, et al. 2011. Does prenatal cadmium exposure affect fetal and child growth?[J]. Occupational and Environmental Medicine, 68: 641-646. DOI:10.1136/oem.2010.059758 |
Luo X, Li L B, Ma M F, et al. 2015. Effects of low-dose cadmium exposure during gestation and lactation on development and reproduction in rats[J]. Environmental Science and Pollution Research, 22(14): 10569-10579. DOI:10.1007/s11356-015-4249-5 |
Mohanty A F, Farin F M, Bammler T K, et al. 2015. Infant sex-specific placental cadmium and DNA methylation associations[J]. Environmental Research, 138: 74-81. DOI:10.1016/j.envres.2015.02.004 |
Nasehi M, Torabinejad S, Hashemi M, et al. 2020. Effect of cholestasis and NeuroAid treatment on the expression of Bax, Bcl-2, Pgc-1α and Tfam genes involved in apoptosis and mitochondrial biogenesis in the striatum of male rats[J]. Metabolic Brain Disease, 35(1): 183-192. DOI:10.1007/s11011-019-00508-y |
Nilsson E, Ling C. 2017. DNA methylation links genetics, fetal environment, and an unhealthy lifestyle to the development of type 2 diabetes[J]. Clinical Epigenetics, 9: 105. DOI:10.1186/s13148-017-0399-2 |
Parízek J, Ostádalová I, Benes I, et al. 1968. Pregnancy and trace elements: the protective effect of compounds of an essential trace element--selenium--against the peculiar toxic effects of cadmium during pregnancy[J]. Journal of Reproduction and Fertility, 16(3): 507-509. DOI:10.1530/jrf.0.0160507 |
Peterson R E, Theobald H M, Kimmel G L. 1993. Developmental and reproductive toxicity of dioxins and relatedcompounds: cross-species comparisons[J]. Critical Reviews in Toxicology, 23(3): 283-335. DOI:10.3109/10408449309105013 |
Rieger M A, Schroeder T. 2012. Hematopoiesis[J]. Cold Spring Harbor Perspectives in Biology, 4(12): a008250. |
Shirai S, Suzuki Y, Yoshinaga J, et al. 2010. Maternal exposure to low-level heavy metals during pregnancy and birth size[J]. Journal of Environmental Science and Health. Part A, Toxic/Hazardous Substances & Environmental Engineering, 45: 1468-1474. |
Thompson J, Bannigan J. 2008. Cadmium: toxic effects on the reproductive system and the embryo[J]. Reproductive Toxicology, 25: 304-315. DOI:10.1016/j.reprotox.2008.02.001 |
Van Opdenbosch N, Lamkanfi M. 2019. Caspases in cell death, inflammation, and disease[J]. Immunity, 50(6): 1352-1364. DOI:10.1016/j.immuni.2019.05.020 |
Waalkes M P. 2003. Cadmium carcinogenesis[J]. Mutation Research, 533(1/2): 107-20. |
Wang Z, Wang H, Xu Z M, et al. 2012. Cadmium-induced teratogenicity: Association with ROS-mediated endoplasmic reticulum stress in placenta[J]. Toxicology and Applied Pharmacology, 259(2): 236-247. DOI:10.1016/j.taap.2012.01.001 |
Wilson S E. 2021. TGF beta-1, -2 and -3 in the modulation of fibrosis in the cornea and other organs[J]. Experimental Eye Research, 207: 108594. DOI:10.1016/j.exer.2021.108594 |
Wu M Y, Hill C S. 2009. Tgf-beta superfamily signaling in embryonic development and homeostasis[J]. Developmental Cell, 16(3): 329-343. DOI:10.1016/j.devcel.2009.02.012 |
Xu P, Wu Z Q, Xi Y, et al. 2016. Epigenetic regulation of placental glucose transporters mediates maternal cadmium-induced fetal growth restriction[J]. Toxicology, 372: 34-41. DOI:10.1016/j.tox.2016.10.011 |
杨晓婧, 李美丽, 白建华. 2010. 火焰原子吸收光谱法测定废水中的重金属离子[J]. 光谱实验室, 27(1): 247-249. DOI:10.3969/j.issn.1004-8138.2010.01.057 |
姚琴, 潘维敏, 邵东红, 等. 2003. B超测量胎儿肝脏面积预测胎儿体重的价值[J]. 山东医药, 43(24): 15-16. DOI:10.3969/j.issn.1002-266X.2003.24.007 |
Zhao Y, Chen L, Li Y X, et al. 2014. Gender-specific relationship between prenatal exposure to phthalates and intrauterine growth restriction[J]. Pediatric Research, 76(4): 401-408. DOI:10.1038/pr.2014.103 |
Zhang Y Y, Vik T A, Ryder J W, et al. 1998. Nf1 regulates hematopoietic progenitor cell growth and ras signaling in response to multiple cytokines[J]. Journal of Experimental Medicine, 187(11): 1893-1902. DOI:10.1084/jem.187.11.1893 |
 2021, Vol. 41
2021, Vol. 41


