2. 新疆大学生命科学与技术学院, 乌鲁木齐 830046;
3. 库尔勒市农业技术推广中心, 库尔勒 841000
2. College of life science and technology, Xinjiang University, Urumqi 830046;
3. Korla Agricultural Technology Extension Center, Korla 841000
沙尘暴是指干旱及半干旱地区频繁发生的一种典型自然灾害.根据可见度, 分为浮尘、扬沙、沙尘暴(Gao et al., 2003).全球沙尘暴的主要来源地在撒哈拉沙漠、萨赫乐沙漠、澳大利亚地区、塔克拉玛干沙漠及黄土高原等地(Yamaguchi et al., 2016).沙尘暴对全球范围内的地球化学循环、气候变化以及生态环境起着重要作用(Lee et al., 2015; Weil et al., 2017).据统计, 世界上主要的沙漠每年可向大气中投入约0.5~10亿吨的沙尘(Perkins et al., 2001).沙尘暴通过沙尘颗粒不仅能运输矿物质和营养物质, 而且能运输污染物、杀虫剂、重金属等(Thalib et al., 2012; Lee et al., 2013; Yu et al., 2015), 对人类健康、动物、植物、经济发展和农业生产造成严重影响(Griffin et al., 2004; Cook et al., 2005; Dabbas et al., 2012).因此, 沙尘暴成为全球环境热议的重要问题.
目前, 国内外学者对沙尘暴中可吸入颗粒物、沙尘暴的时空变化、沙尘暴的季节变化和日变化、沙尘暴天气和非沙尘暴天气空气微生物群落结构变化等进行了大量研究.Goudarzi等研究指出, 沙尘中的PM10、PM2.5、PM1的浓度明显高于正常天气中可吸入颗粒物浓度(Goudarzi et al., 2014).Xu等研究表明, 内蒙古沙尘暴的时空变化总体上受到人为因素破坏环境的影响(Xu et al., 2015).Mingjie等对塔克拉玛干沙漠周边地区发生的沙尘暴研究表明, 沙尘暴发生日显示明显的季节性变化, 按降序排列:夏季>春季>秋季>冬季.沙尘暴通常在一天中发生的变化为:在12:00—16:00左右发生相对较高, 高峰出现在14:00—15:00(Mingjie et al., 2020).Al-Dabbas等对非洲沙尘暴空气微生物研究指出, 发生沙尘暴时的空气微生物浓度是正常数量的2~3倍.在沙尘暴时期, 分离出了芽孢杆菌属(Bacillus)、节杆菌属(Arthrobacter)、假单孢菌属(Pseudomonas)和微杆菌属等(Microbacterium)等19个属, 而非沙尘暴时期分离出8个菌属, 表明前者空气微生物多样性高于后者(Al-Dabbas et al., 2001).
近年来, 随着分子生物学技术的发展, PCR-DGGE技术和高通量测序技术广泛应用于沙尘暴空气微生物多样性和群落结构研究中.2008年, Teruya等利用DGGE方法, 研究亚洲沙尘暴发生区域的敦煌市空气微生物, 结果表明, 不同海拔, 空气细菌群落结构不同(Teruya et al., 2008).2015年, Riccardo等采用高通量测序对地中海沙尘暴空气微生物进行研究, 主要有变形菌门、厚壁菌门、拟杆菌门和放线菌门, 且其多样性指数高于非沙尘天气(Riccardo et al., 2015).但对沙尘暴发生之前, 沙尘暴发生时及沙尘暴发生之后空气微生物的多样性和群落结构的变化研究较少.新疆且末地区位于塔克拉玛干沙漠南缘, 由于特殊的地理位置, 每年春夏季节沙尘暴活动频繁发生.众所周知, 沙尘暴能携带沙尘颗粒远距离运输.悬浮在沙尘颗粒中的空气微生物含有细菌、真菌、病毒和污染物(Maki et al., 2013), 它们对当地及下游地区的动物、植物、人类健康及生态系统造成巨大威胁(Hua et al., 2007; Lee et al., 2009; Maki et al., 2010; Jeon et al, 2011; Colson et al., 2017; Jonguk et al., 2018).因此, 对沙尘暴中的空气微生物进行检测和分析有重要的意义.本研究以沙尘暴高发的新疆且末地区为研究区域, 以新疆且末地区沙尘暴空气微生物为研究对象, 采用高通量测序技术, 结合环境因子信息进行冗余分析(RDA), 探讨环境因子对沙尘暴空气微生物的影响, 为沙尘暴灾害预警、全球性气候变迁、空气微生物传输和荒漠化治理提供一定的理论依据, 可为挖掘极端环境微生物资源奠定基础.
2 材料与方法(Materials and methods) 2.1 样品采集2018年4月18—20日对新疆且末地区沙尘暴空气微生物进行采样(图 1), 图中的3个位点代表沙尘暴不同时期的采样点.沙尘暴前期为发生沙尘暴之前1 d, 中期为沙尘暴发生时的时间段, 后期为发生沙尘暴之后1 d.沙尘暴样品设置3组样品处理, 每组样品4个重复, 沙尘暴前期样品用Q表示, 中期样品用Z表示, 后期样品用H表示, 分别是Q_1、Q_2、Q_3、Q_4、Z_1、Z_2、Z_3、Z_4、H_1、H_2、H_3和H_4, 共12个样品.且末1号采样点采集了沙尘暴前期样品, 且末2号采样点采集了沙尘暴中期样品, 且末3号采样点采集了沙尘暴后期样品.采样点的环境因子信息见表 1.
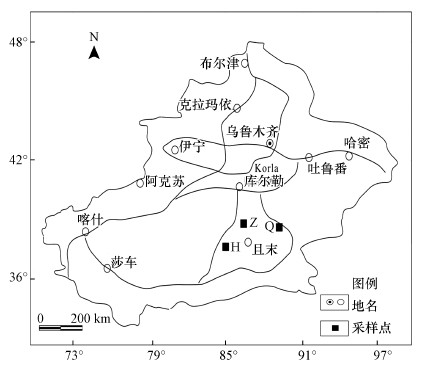 |
| 图 1 沙尘暴采样点图 Fig. 1 Location of sand storm sampling site |
| 表 1 采样点环境因子信息 Table 1 Environmental factor information table of sampling points |
使用液体撞击式微生物气溶胶采样器(Li et al., 2017)将20 mL PBS缓冲液(样品吸附液)装入玻璃采样管中, 调节空气流量为11 L·min-1, 设置采样计时时间为20 min, 采集新疆且末地区沙尘暴不同时期的空气微生物样品各80 mL.采集沙尘暴前、中、后期空气微生物样品共500 mL, 采集的样品冷藏后带回实验室进行进一步分析.
2.2 DNA提取、PCR扩增和高通量测序采集到的空气PBS缓冲液解冻后, 样品按照不同时期分类, 并将其对应的PBS缓冲液充分混匀.先用5 μm孔径滤膜过滤去除颗粒杂志, 再用0.22 μm滤膜进行过滤, 最后将过滤后的0.22 μm孔径滤膜置于高温灭菌后的1.5 mL的离心管中用于DNA的提取.利用DNA提取试剂盒(E.Z.N.A.Water DNA Kit)提取细菌总DNA(李红梅等, 2015).然后用1%凝胶电泳检测提取DNA的质量, 并利用Nano Drop 2000 UV-Vis Spectrophometer(Thermo Fisher Scientific, USA)测定其浓度.在260 nm和280 nm处吸光度值比值均在1.8左右, 这说明获得了高质量的DNA.细菌引物采用(孙丕海, 2017)338F(5′-ACTCCTACGGGAGGCAGCAC-3′)和806R(5′-GGACTACHVGGGTWHCTAAT-3′)对细菌16S rRNA基因V3~V4高变区进行PCR扩增.PCR采用20 μL反应体系:5×FastPfu Buffer 4 μL, dNTPs(2.5 mmol·L-1) 2 μL, 正向引物0.8 μL, 反向引物序列0.8 μL, FastPfu polymerase 0.4 μL, BSA 0.2 μL, Template DNA 10 ng, 补ddH2O至20 μL.PCR反应条件:95 ℃预变性3 min; 循环数×(95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s); 72 ℃延伸10 min, 10 ℃直到反应结束.扩增产物均取3 μL于1%的琼脂糖凝胶中, 在凝胶成像系统中检测.待扩增PCR产物经琼脂糖凝胶电泳检测阳性后, 采用琼脂糖凝胶DNA回收试剂盒(TIAN GEN)进行纯化, 为进行下一步测序做好准备.
2.3 数据处理与分析高通量测序技术部分在上海美吉生物医药科技有限公司Illumina Miseq平台完成.首先通过对Miseq测序得到的是双末端序列数据进行过滤和去除低质量序列处理, 得到沙尘暴空气微生物优质序列; 然后利用Usearch软件以97%的相似性将得到的有效序列聚类成为OTU(Operational Taxononmic Units), 并采用RDP classifier贝叶斯算法对OTU代表序列进行分类学分析获得各样本的群落物种组成; 在OTU数据基础上, 进行稀释曲线分析, 计算α多样性和β多样性指数; 利用R语言“vegan”软件包进行NMDS分析; 原始数据上传至NCBI数据库中, 获得登录号为:SRR12153402-SRR12153413.结合环境因子信息, 利用Canoco 4.5计算环境因子与细菌群落之间的关系(王悦等, 2019).
3 结果与分析(Results and analysis) 3.1 测序数据统计通过Illumina Miseq高通量测序并优化后, 从沙尘暴前中后期12个空气微生物样品共获得740364条有效序列, 总碱基数目为327501803 bp, 平均长度为442 bp.通常在97%的相似水平下对序列进行OTU的聚类, 统计得到所有样品在不同OTUs中的丰度信息.12个沙尘暴空气微生物样品共产生156个OTU, 分属于9门、16纲、29目、52科、87属、112种, 优质序列长度为441~460 bp.
采用随机抽样的方法抽取数据, 以抽到的序列数与它们所能代表OTU的数目构建稀释性曲线.稀释性曲线往往用来反映样品的取样深度, 来评价测序量是否足以覆盖所有类群.12个沙尘暴空气样品的稀释性曲线(图 2), 曲线趋于平缓, 表明测序数据量合理, 更多的数据量对发现新OTU的边际贡献很小.Sobs指数在10~140之间, 16S rRNA基因在V3~V4区的数据量在50000左右.韦恩图用于统计多个样本中所共有和独有的物种(艾叶, 2019), 可以直观地表现环境样本的物种组成相似性及重叠情况.在相同测序深度下, OTU数从高到低的样品依次为沙尘暴中期样品、沙尘暴前期样品、沙尘暴后期样品.从图 3韦恩图中可以看出, 沙尘暴前期共有112个OTUs, 沙尘暴中期共有149个OTUs, 沙尘暴后期共有85个OTUs, 这说明沙尘暴中期空气细菌物种种类最多.沙尘暴前期和沙尘暴中期共有的OTUs共106个, 分别占94.6%和71.1%.沙尘暴前期和沙尘暴后期共有的OTUs共64个, 分别占57.1%和75.3%.沙尘暴中期和后期共有的OTUs共84个, 分别占56.4%和98.8%.这些数据说明, 沙尘暴前期和沙尘暴中期空气细菌群落结构更为相似.
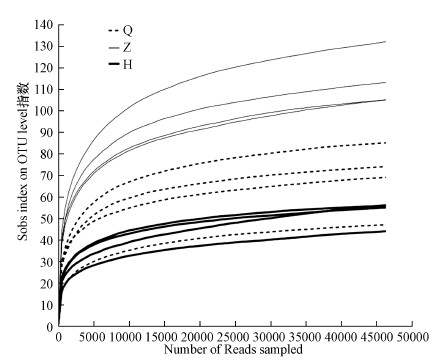 |
| 图 2 不同空气样本细菌稀释性曲线(Q:沙尘暴前期, Z:沙尘暴中期, H:沙尘暴后期) Fig. 2 Rarefaction curves of air bacteria in different sample |
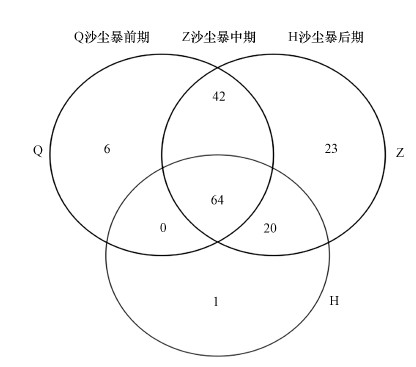 |
| 图 3 韦恩图 Fig. 3 Venn diagrams |
Alpha多样性指数是研究物种多样性分析的一个重要指标.其中, 一般利用Chao 1指数和ACE指数表示细菌群落丰度, 而细菌群落多样性主要采用Shannon指数和Simpson指数表示, Coverage指数反映微生物物种的覆盖度, 其数值越高, 则样品中序列没有被测到的概率越低.由表 2可知, 各样本的文库覆盖率(Coverage)范围均达到99.99%以上, 能进一步反映且末地区沙尘暴细菌群落的真实水平.该地区沙尘暴3个时期的Chao 1、ACE、Shannon和Simpson值均在沙尘暴中期最高, 其次是沙尘暴前期, 最后是沙尘暴后期, 说明沙尘暴中期空气细菌群落丰富度和多样性是最高的, 这结果与图 3结果一致.沙尘暴不同时期OTU平均数呈:中期(114)>前期(69)>后期(53), 即沙尘暴中期OTU数目最多, 此结果可能为沙尘暴灾害预警提供理论数据参考.同时利用统计学检验的方法, 检测沙尘暴不同时期多样性指数值是否具有显著性差异如图 4所示, p值< 0.001, 沙尘暴前、中、后期细菌群落Alpha多样性差异极显著, 具有统计学意义.
| 表 2 沙尘暴不同时期空气细菌丰富度指数和多样性指数 Table 2 Diversity and richness of the air bacteria in different periods of sandstorm |
 |
| 图 4 不同样品间微生物Alpha多样性分析(Q:沙尘暴前期, Z:沙尘暴中期, H:沙尘暴后期)(注:此图呈现沙尘暴不同时期样品之间的显著性差异情况, 并对有显著性差异的样品之间进行标记(0.001 < p ≤ 0.01标记为**, p ≤ 0.001标记为***).横坐标为沙尘暴不同时期, 纵坐标为沙尘暴不同时期的Alpha多样性指数平均值.) Fig. 4 Alpha diversity index analysis of different sample groups |
Beta多样性指数分析(Beta diversity)是用来对比不同样品在物种多样性方面存在的差异.为了能够直观地看出沙尘暴前、中、后不同时期空气细菌群落组成结构的差异, 绘制PCA分析图(图 5).如图 5所示, 提取的前两个主成分(PC1和PC2)是沙尘暴空气细菌群落组成结构差异的主要贡献者, 两轴对排序结果的解释分别为24.77%和18%.沙尘暴前期、沙尘暴中期和沙尘暴后期样品在两轴上的排序有一定的距离, 表明沙尘暴不同时期空气细菌群落结构具有差异性.
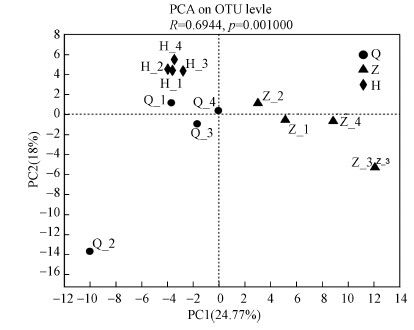 |
| 图 5 沙尘暴不同时期空气细菌群落的PCA主成分分析 Fig. 5 Principal component analysis of PCA in air bacterial community in different periods of sandstorm |
对沙尘暴空气样品基于Bray-Curtis距离的样品聚类如图 6所示, 12个样品分为3组, 分别显示沙尘暴前期、中期和后期.同一时期采集的样品均单独归类一类, 其中中期和后期的样品归为一个大的分支, 前期单独归为一支.
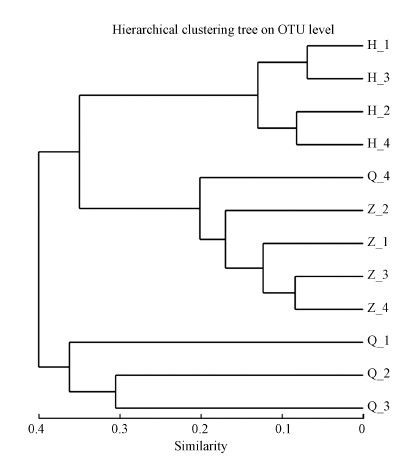 |
| 图 6 基于Bray-Curtis距离的采样点聚类 Fig. 6 A Based on Bray-Curtis dissimilarity samples |
本次研究中156条OTUs属于9个门87个属.从门的分类水平看(图 7a), 丰度最高的变形菌门(Proteobacteria, 80.52%), 其次为拟杆菌门(Bacteroidetes, 20.96%)、放线菌门(Actinobacteria, 5.84%)和厚壁菌门(Firmicutes, 2.63%), 其他门类别的丰富均小于0.05%.在属水平上看, 沙尘暴不同时期空气中共有优势属及沙尘暴前期、沙尘暴中期和沙尘暴后期优势菌见图 7b.沙尘暴不同时期空气中共有菌属主要为Acinetobacter(24.24%)、Pseudomonas(22.23%)、Sphingobium(8.22%).沙尘暴前期特有菌群主要有Pseudomonas(17.46%)、Unclassified-f-Oxalobacteraceae(13.32%)、Sphingobium (9.32%)和Ponibacter(9.01%).沙尘暴中期特有菌群主要有Pseudomonas(47.08%)、Acinetobacter(19.08%)和Ponibacter(9.03%).沙尘暴后期特有菌群主要有Acinetobacter(53.63%)、Sphingobium(12.50%)和Sphingobacterium(9.98%).
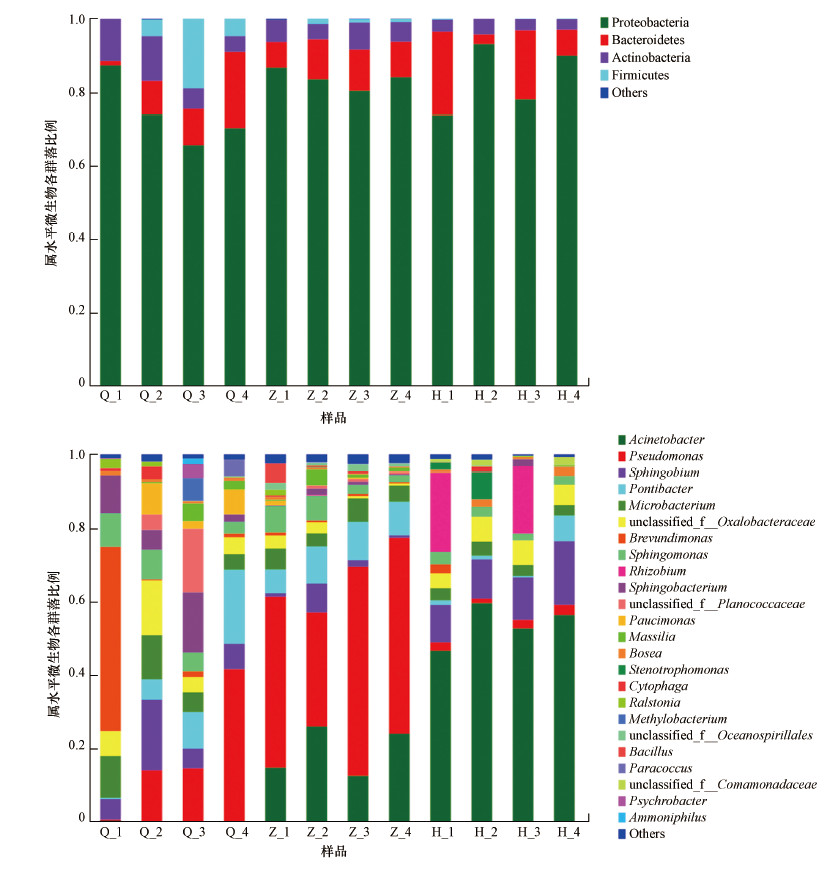 |
| 图 7 沙尘暴空气微生物门水平(a)及属水平(b)细菌分类 Fig. 7 Phylum-level(a) and genus-level(b) taxonomic of the bacterial community in the different periods of sandstorm |
图 8为环境因子对细菌群落的冗余分析结果.RDA二维轴序可以直观看出研究对象与环境变量之间的关系, 排序轴与箭头连线夹角表示各因子与排序轴的相关性, 夹角越小关系越密切, 而箭头连线表示各因子与环境变量相关程度的大小, 连线越短, 相关性越小, 反之则越大.利用Canoco 4.5对环境参数和微生物群落分析后发现, 其中RDA前两个排序轴的特征值分别为0.4788和0.1592, 分别解释了47.88%和15.92%的细菌物种变化, 两者结合解释率达到63.8%, 说明前两轴的贡献值可以较好的解释各因子对沙尘暴空气细菌群落结构的影响.6类环境因子对沙尘暴空气细菌群落多样性的影响差异极显著(p=0.004 < 0.01), 湿度和气压可能与沙尘暴空气细菌多样性呈正相关, 与经度、维度、海拔和温度呈负相关.
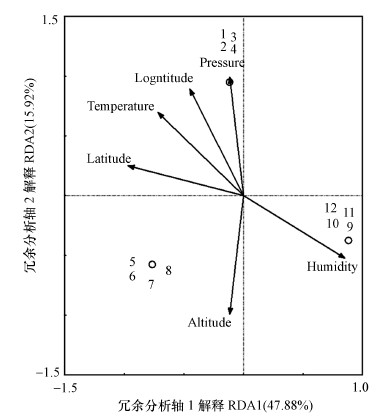 |
| 图 8 空气细菌群落和环境因子的RDA分析(1~4为沙尘暴前期样品, 5~8为沙尘暴中期样品, 9~12为沙尘暴后期样品) Fig. 8 RDA analysis of air bacterial community and environmental factors |
本研究利用高通量测序技术对新疆且末地区沙尘暴空气微生物进行了研究, 分析沙尘暴空气细菌多样性和群落结构, 并研究环境因子对沙尘暴空气细菌多样性的影响.
4.1 沙尘暴空气细菌多样性极端生境微生物的研究帮助人类了解和探索生命的策略和极限, 大多数未知种群蕴藏着无法估量的资源, 因而研究微生物多样性显得十分重要(阎章才等, 2001).沙尘暴是一类流动性较强的特殊生境, 蕴藏着丰富的微生物资源.本课题利用高通量测序技术对新疆且末地区沙尘暴空气样品进行分析, 获得了新疆且末地区沙尘暴空气微生物多样性和群落结构相关的数据, 弥补了可培养方法无法获得的菌种信息.从采集到的沙尘暴不同时期的12个空气样品中, 一共获得有效序列的总数为740364, 平均测序读长为441~460 bp, 有效OTU个数为156, 共涵盖了9门16纲29目52科87属的细菌.通过观察稀释曲线可知, 本课题的采样工作合理, 其分析结果能够正确的反映研究区的沙尘暴空气微生物群落组成情况.同时, 沙尘暴空气微生物研究的文库覆盖率在0.999以上, 可以进一步说明采集的沙尘暴空气样品适合用于空气微生物多样性的研究.该地区沙尘暴3个时期的Chao 1、ACE、Shannon和Simpson值均在沙尘暴中期最高, 说明沙尘暴中期空气细菌物种多样性最高.甄泉等在研究沙尘暴对北京市细菌多样性特征的影响中表明, 沙尘暴不能引起细菌OTU数目的增加, 但沙尘暴天气下细菌群落Shannon和Simpson指数显著增加(甄泉等, 2019).Teruya等对戈壁滩沙尘暴空气细菌多样性研究发现, 沙尘天气空气细菌多样性数值远高于非沙尘暴天气空气细菌多样性数值(Teruya et al., 2017), 此结果与本研究结果基本相似.沙尘暴不同时期的α多样性指数和OTU数据均表明, 沙尘暴中期空气微生物多样性>沙尘暴前期空气微生物多样性>沙尘暴后期空气微生物多样性, 这两方面的数据对沙尘暴多样性分析进行了相互对应, 更能说明沙尘暴空气细菌数据的合理和正确性.β多样性数据表明, 沙尘暴不同时期空气细菌群落结构差异显著.纵观以上关于沙尘暴不同时期的数据, 能够表明沙尘暴不同时期呈现出了不同的多样性和群落结构变化, 可为沙尘暴灾害预警提供一定理论依据.
4.2 沙尘暴空气细菌群落组成对沙尘暴空气细菌群落组成信息概括表明, 在门水平得到优势菌群是放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes), 其中变形菌门的丰度最高, 门水平的结果与国外关于沙尘暴空气微生物多样性研究的结果基本相似(Munday et al., 2016; Maki et al., 2017)说明放线菌门、厚壁菌门、变形菌门和拟杆菌门是沙尘暴空气细菌菌门最基本的组成部分.在属水平上, 含量最高的为未分类细菌, 这表明沙尘暴中还蕴含着大量未知的微生物种类, 为我们探索物种多样性提供了宝贵的资源.其中, 芽孢杆菌属(Bacillus)、纤维粘网菌(Cytophagia)、鞘氨醇杆菌属(Sphingobacterium)、不动杆菌属(Acinebacter)、微杆菌属(Microbacterium)、马西莉亚属(Massilia)、假单胞菌属(Pseudomans)为沙尘暴中常见的菌属类别(Munday et al., 2016; Maki et al., 2017).有研究指出(Keunje et al., 2018), 芽孢杆菌属、不动杆菌属、假单胞菌属为潜在的病原菌属, 对人类健康有严重影响.通过与前人利用传统的分离方法对沙尘暴空气微生物多样性研究对比发现(段巍巍等, 2011; 白雪等, 2013; 王丹丹等, 2018)可培养方法获得的物种群落组成和丰度远远低于高通量测序得到的物种群落组成和丰度, 而未培养微生物中蕴藏着大量未知空气微生物信息, 在微生物资源开发利用、病原微生物的探索和沙尘暴预警工作方面有较大的应用前景.2014年, 张亚丽等对贵州省仁怀地区茅台气溶胶微生物多样性的鉴定与分析研究中指出, 利用可培养方法获得空气细菌为32个属, 而利用高通量测序技术获得了空气细菌248个属, 从而体现高通量测序技术在分析空气微生物多样性方面的优越性(张亚丽等, 2014).
4.3 环境因子对沙尘暴空气细菌多样性的影响细菌群落与环境因子的RDA分析发现, 湿度与沙尘暴空气细菌群落呈显著正相关, 而温度、海拔、气压、经度和维度与沙尘暴空气细菌群落呈显著负相关, 表明湿度可能是引起沙尘暴空气细菌群落结构差异的主要因子.不同采样环境和环境因子对微生物群落丰度具有不同的影响.肖汉玉等(2019)在基于高通量测序的乐安江冬季细菌群落特征分析中发现, DO(p=0.018)是对门水平细菌群落具有显著影响的环境因子; 万盼等(2018)在甘肃小陇山油松与柴胡栽培土壤细菌群落特征研究中指出, 有机质、全氮、全钾、碱解氮和全磷含量均对土壤细菌具有显著影响; 段育龙等(2019)对天梯山石窟壁画保存环境中空气细菌的季节性变化进行研究, 表明相对湿度和温度均会影响空气细菌群落结构变化.Zahra等(2015)研究表明, 温度和湿度等环境因子与沙尘暴空气微生物多样性显著相关.Gandolfi等(2013)研究表明, 温度和紫外线与空气细菌丰度有密切的联系.因此, 环境因子参数可作为影响微生物群落结构产生变化的重要原因, 为获得更加全面的微生物群落结构变化, 在以后的研究中更应关注环境因子.
本研究的结果仅基于一次性取样, 只能代表一个时间段上沙尘暴空气细菌多样性的变化, 未来的研究中继续对其进行进一步检测, 这对荒漠化治理和环境保护有重要的意义.
5 结论(Conclusions)采用高通量测序技术检测沙尘暴空气细菌, 结果表明, 从沙尘暴前中后期12个空气微生物样品共获得740364条有效序列, 共产生156个OTU, 分属于9门87属.主要菌门包括:变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、线菌门(Actinobacteria)和厚壁菌门(Firmicutes).主要菌属为假单胞菌属(Pseudomonas)、鞘氨醇宝盒菌属(Sphingobium)、不动杆菌属(Actinobacteria)和海洋杆菌属(Ponibacter).沙尘暴不同时期空气微生物多样性和群落结构差异显著.RDA分析结果指出:湿度和气压与沙尘暴空气细菌多样性呈正相关, 与经度、维度、海拔和温度呈负相关.
Al-Dabbas M A, Abbas M A, Al-Khafaji R M. 2012. Dust storms loads analyses-Iraq[J]. Arabian Journal of Geosciences, 5(1): 121-131. DOI:10.1007/s12517-010-0181-7 |
艾叶, 谢泰祥, 刘江枫, 等. 2019. 竹叶兰根系共生真菌群落结构及生物学功能初探[J]. 菌物学报, 38(10): 1631-1642. |
白雪.2013.塔克拉玛干沙漠西源沙尘天气过程中空气微生物多样性[D].乌鲁木齐: 新疆大学
|
Bottos E M, Woo A C, Zawar-Reza P, et al. 2014. Airborne bacterial populations above desert soils of the McMurdo Dry Valleys, Antarctica[J]. Microbial Ecology, 67(1): 120-128. DOI:10.1007/s00248-013-0296-y |
Colson A J, Vredenburgh L, Guevara R E, et al. 2017. Large-scale land development, fugitive dust, and increased coccidioidomycosis incidence in the antelope valley of California, 1999-2014[J]. Mycopathologia, 182(5/6): 439-458. |
Cook A G, Weinstein P, Centeno J A. 2005. Health effects of natural dust:Role of trace elements and compounds[J]. Biological Trace Element Research, 103(1): 1-15. DOI:10.1385/BTER:103:1:001 |
Dale W G, Viarginia H G, Jay R H, et al. 2001. African desert dust in the Caribbean atmosphere:Microbiology and public health[J]. Aerobiologia, 17(3): 203-213. DOI:10.1023/A:1011868218901 |
段魏魏.2011.新疆沙尘暴源区塔克拉玛干沙漠空气微生物多样性研究[D].乌鲁木齐: 新疆大学
|
段育龙, 武发思, 汪万福, 等. 2019. 天梯山石窟壁画保存环境中空气细菌的季节性变化[J]. 微生物学通报, 46(3): 35-47. |
Gao T, Yu X, Ma Q, et al. 2003. Climatology and trends of the temporal and spatial distribution of sandstorms in Inner Mongolia[J]. Water, Air and Soil Pollution:Focus, 3(2): 51-60. DOI:10.1023/A:1023265818114 |
Griffin D W, Kellogg C A. 2004. Dust storms and their impact on ocean and human health:Dust in Earth's atmosphere[J]. EcoHealth, 1(3): 284-295. |
Goudarzi G, Shirmardi M, Khodarahmi F, et al. 2014. Particulate matter and bacteria characteristics of the Middle East Dust (MED) storms over Ahvaz, Iran[J]. Aerobiologia, 30(4): 345-356. DOI:10.1007/s10453-014-9333-7 |
García-Mena, Jaime, Murugesan S, et al. 2016. Airborne bacterial diversity from the low atmosphere of greater Mexico City[J]. Microbial Ecology, 72(1): 70-84. DOI:10.1007/s00248-016-0747-3 |
Gandolfi I, Valentina B, Roberro A, et al. 2013. Unravelling the bacterial diversity in the atmosphere[J]. Applied Microbiology and Biotechnology, 97(11): 4727-4736. DOI:10.1007/s00253-013-4901-2 |
Hua N P, Kobayashi F, Iwasaka Y, et al. 2007. Detailed identification of desert-originated bacteria carried by Asian dust storms to Japan[J]. Aerobiologia, 23(4): 291-298. DOI:10.1007/s10453-007-9076-9 |
Jeon E M, Kim H J, Jung K, et al. 2011. Impact of Asian dust events on airborne bacterial community assessed by molecular analyses[J]. Atmospheric Environment, 45(25): 4313-4321. DOI:10.1016/j.atmosenv.2010.11.054 |
Keunje Y, Hyunji Y, Min L J, et al. 2018. Classification and regression tree approach for prediction of potential hazards of urban airborne bacteria during Asian Dust Events[J]. Scientific Reports, 8(1): 101-113. DOI:10.1038/s41598-017-18474-9 |
Lee S, Choi B, Yi S M, et al. 2009. Characterization of microbial community during Asian dust events in Korea[J]. Science of the Total Environment, 407(20): 5308-5314. DOI:10.1016/j.scitotenv.2009.06.052 |
Lee P K, Youm S J, Jo H Y. 2013. Heavy metal concentrations and contamination levels from Asian dust and identification of sources:A case-study[J]. Chemosphere, 91(7): 1018-1025. DOI:10.1016/j.chemosphere.2013.01.074 |
Lee P K, Ho Y J, Kang M J, et al. 2015. Seasonal variation in trace element concentrations and Pb isotopic composition of airborne particulates during Asian dust and non-Asian dust periods in Daejeon, Korea[J]. Environmental Earth Sciences, 74(4): 3613-3628. DOI:10.1007/s12665-015-4425-4 |
Li H F, Li Z J, Qu J H, et al. 2017. Bacterial diversity in traditional Jiaozi and sourdough revealed by high-throughput sequencing of 16S rRNA amplicons[J]. LWT Food Science and Technology, 81: 319-332. DOI:10.1016/j.lwt.2017.04.007 |
李红梅, 白林, 姜冬梅, 等. 2015. 基于16S rDNA高通量测序方法检测猪舍空气微生物多样性[J]. 中国畜牧杂志, 51(3): 81-84. DOI:10.3969/j.issn.0258-7033.2015.03.019 |
Maki T, Kakikawa M, Kobayashi F, et al. 2013. Assessment of composition and origin of airborne bacteria in the free troposphere over Japan[J]. Atmospheric Environment, 74: 73-82. DOI:10.1016/j.atmosenv.2013.03.029 |
Maki T, Susuki S, Kobayashi F, et al. 2010. Phylogenetic analysis of atmospheric halotolerant bacterial communities at high altitude in an Asian dust (KOSA) arrival region, Suzu City[J]. Science of the Total Environment, 408(20): 4556-4562. DOI:10.1016/j.scitotenv.2010.04.002 |
Maki T, Kurosaki Y, Onishi K, et al. 2007. Variations in the structure of airborne bacterial communities in Tsogt-Ovoo of Gobi desert area during dust events[J]. Air Quality, Atmosphere & Health, 10(3): 249-260. |
Ma M J, Yang X H, He Q, et al. 2020. Characteristics of dust devil and its dust emission in northern margin of the Taklimakan Desert[J]. Aeolian Research, 44: 100579. DOI:10.1016/j.aeolia.2020.100579 |
Munday C, De Deckker P, Tapper N, et al. 2016. Characterizing bacterial assemblages in sediments and aerosols at a dry lake bed in Australia using high-throughput sequencing[J]. Aerobiologia, 32(4): 581-593. DOI:10.1007/s10453-015-9407-1 |
Puspitasari F, Maki T, Shi G, et al. 2016. Phylogenetic analysis of bacterial species compositions in sand dunes and dust aerosol in an Asian dust source area, the Taklimakan Desert[J]. Air Quality, Atmosphere & Health, 9(6): 631-644. DOI:10.1007/s11869-015-0367-y |
Perkins S. 2001. Dust the thermostat[J]. Science News, 160(13): 200-201. DOI:10.2307/4012776 |
Xu H, Cheng T H, Gu X F, et al. 2015. Spatiotemporal variability in dust observed over the Sinkiang and Inner Mongolia regions of Northern China[J]. Atmospheric Pollution Research, 6: 562-571. DOI:10.5094/APR.2015.063 |
肖汉玉, 王鹏, 刘君政, 等. 2019. 基于高通量测序的乐安江冬季细菌群落特征分析[J]. 微生物学报, 59(1): 182-194. |
Rosselli R, Fiamma M, Deligios M, et al. 2015. Microbial immigration across the Mediterranean via airborne dust[J]. Scientific Reports, 5(1): 16306. DOI:10.1038/srep16306 |
Soleimani Z, Parhizgari N, Rad H D, et al. 2015. Normal and dusty days comparison of culturable indoor airborne bacteria in Ahvaz, Iran[J]. Aerobiologia, 31(2): 127-141. DOI:10.1007/s10453-014-9352-4 |
孙丕海, 钱坤, 李晓丽, 等. 2017. 基于高通量测序分析海带表面细菌群落结构[J]. 大连海洋大学学报, 31(1): 7-12. |
Teruya M, Shinzi S, Fumihisa K, et al. 2008. Phylogenetic diversity and vertical distribution of a halobacterial community in the atmosphere of an Asian dust (KOSA) source region, Dunhuang City[J]. Air Quality, Atmosphere and Health, 1(2): 81-89. DOI:10.1007/s11869-008-0016-9 |
Thalib L, Al-Taiar A. 2012. Dust storms and the risk of asthma admissions to hospitals in Kuwait[J]. Science of the Total Environment, 433: 347-351. DOI:10.1016/j.scitotenv.2012.06.082 |
Teruya M, Yasunori K, Kazunari O, et al. 2017. Variations in the structure of airborne bacterial communities in Tsogt-Ovoo of Gobi desert area during dust events[J]. Air quality, atmosphere, & health, 10(3): 249-260. |
王悦, 杨贝贝, 王浩, 等. 2019. 不同种植模式下丹参根际土壤微生物群落结构变化[J]. 生态学报, 39(13): 4833-4843. |
王丹丹.2018.塔克拉玛干沙尘暴源区空气微生物多样性的研究[D].乌鲁木齐: 新疆大学
|
万盼, 胡艳波, 张弓乔, 等. 2018. 甘肃小陇山油松与柴胡栽培土壤细菌群落特征[J]. 生态学报, 38(17): 6017-6024. |
Weil T, De F C, Albanese D, et al. 2017. Legal immigrants:invasion of alien microbial communities during winter occurring desert dust storms[J]. Microbiome, 5(1): 32. DOI:10.1186/s40168-017-0249-7 |
Yu H, Chin M, Yuan T, et al. 2015. The Fertilizing Role of African Dust in the Amazon Rainforest:A First Multiyear Assessment Based on CALIPSO Lidar Observations[J]. Geophysical Research Letters, 42(6): 1984-1991. DOI:10.1002/2015GL063040 |
Yamaguchi N, Baba T, Ichijo T, et al. 2016. Abundance and community structure of bacteria on asian dust particles collected in Beijing, China, during the Asian Dust Season[J]. Biological & Pharmaceutical Bulletin, 39(1): 68-77. |
Yoo K, Han I, Ko K S, et al. 2019. Bacillus-dominant airborne bacterial communities identified during Asian Dust Events[J]. Microbial Ecology, 78(3): 677-687. DOI:10.1007/s00248-019-01348-0 |
Zahra S, Najmeh P, Hassan D R, et al. 2015. Normal and dusty days comparison of culturable indoor airborne bacteria in Ahvaz, Iran[J]. Aerobiologia, 31(2): 127-141. DOI:10.1007/s10453-014-9352-4 |
阎章才, 东秀珠. 2001. 微生物的生物多样性及应用前景[J]. 微生物学通报, 28(1): 96-102. DOI:10.3969/j.issn.0253-2654.2001.01.025 |
甄泉, 王雅晴, 冼超凡, 等. 2019. 沙尘暴对北京市空气细菌多样性特征的影响[J]. 生态学报, 39(2): 717-725. |
张阁, 孙翠丽, 彭永, 等. 2017. 16S rRNA基因高通量测序方法检测奶牛场常用干草表面微生物群落结构及多样性[J]. 微生物学通报, 44(12): 2847-2855. |
张亚丽.2014.贵州省仁怀地区茅台空气微生物的鉴定与分析[D].北京: 北京化工大学
|
 2021, Vol. 41
2021, Vol. 41


