近年来在水土环境中普遍存在硝酸盐氮和抗生素污染加重的问题, 有研究发现, 在畜牧养殖、污水排放及再生水利用地区, 硝酸盐氮污染总是与抗生素污染同时存在, 且二者具有一定的相关关系(Schaider et al., 2014).我国是抗生素生产和消费大国, 由于抗生素的不合理使用甚至滥用, 造成了大量的抗生素排泄到环境中.仅2013年, 全国喹诺酮类抗生素的使用量就达到27300 t, 超过了该年四环素类和磺胺类抗生素用量的总和(Zhang et al., 2015).水土环境中抗生素含量水平普遍较低(Costanzo et al., 2005), 各个国家地区环境水体中各类抗生素污染程度不同, 残留浓度一般在ng · L-1~μg · L-1级别不等(Lin et al., 2009;Klaus et al., 2009;Liu et al., 2018).喹诺酮类抗生素污染很常见, 在部分遭受污染的水体中浓度高达17 μg · L-1(崔亚丰等, 2015), Zou等(2019)探究了反硝化细菌对环境中典型抗生素的敏感性, 结果表明, 反硝化菌对喹诺酮类抗生素具有较强的敏感性, 在北京北部和西部山区及平原地区的19个地下水重点监测样中的检出率达到100%(陈卫平等, 2017).喹诺酮类抗生素是第三代人工合成的药物, 主要通过作用于DNA回旋酶、干扰细菌细胞的DNA复制而呈现杀菌作用, 因其具有广谱、高效、低毒等优点而被广泛使用(Li et al., 2020).
药敏试验旨在了解抗生素对病原微生物的抑菌效果, 以指导临床合理选用抗生素药物的微生物学试验.目前, 药敏试验的方法主要有纸片扩散法和微量肉汤稀释法.其中, 纸片扩散法简单易行、重复性好, 抗生素的选择较为灵活, 主要用于定性检测(Akers et al., 2010).微量肉汤稀释法用于定量测试抗菌药物对微生物的体外活性(倪语星等, 2009).通过药敏试验这种快速有效的手段测试细菌对抗生素的敏感性已在临床医学中有较多的应用.例如, Azevedo等(2011)采用纸片扩散法检测菌株对氟康唑和伏立康唑的敏感性, Pfaller等(2012)根据微量肉汤稀释法获得了念珠菌对抗真菌药物敏感性的最新进展, Zarkotou等(2012)通过3种药敏方法对比获得了抗生素对革兰阴性菌的抑菌效果, Sader等(2020)采用两种方法测定了纸片扩散法断点处分离菌株的最小抑菌浓度.临床上通过测定最小抑菌浓度确定用药剂量, 它表示抑制细菌生长的最低浓度, 对于水土环境中的反硝化过程而言, 这个浓度值的测定也具有一定的意义:当抗生素浓度达到最小抑菌浓度时将抑制反硝化作用的进行, 环境中的NO3--N无法通过反硝化途径去除, 会不断累积导致浓度升高.研究表明, 当多种抗生素共同作用时可能会加快抑制反硝化速率(Yin et al., 2017).有关抗生素对水土环境中反硝化作用的影响颇受关注, 由于反硝化是一种微生物介导过程, 抗生素对反硝化作用的影响主要体现在反硝化细菌上, 但目前对于二者之间的关系知之甚少(Zou et al., 2019).常规模拟实验耗时长且较为复杂, 为了快速获得抗生素对反硝化细菌的影响, 本研究以喹诺酮类5种典型的抗生素为例, 通过药敏试验从定性和定量的角度解释抗生素的抑菌效应, 以期为研究水土环境中抗生素对反硝化的影响提供参考.
2 材料与方法(Materials and methods) 2.1 实验材料及设备 2.1.1 抗生素的选择实验选择喹诺酮类药物中5种典型的抗生素, 分别为左氧氟沙星(Levofloxacin hydrochloride, OFL, 含量>98.0%)、诺氟沙星(Norfloxacin, NOR, 含量>98.0%)、环丙沙星(Ciprofloxacin, CIP, 含量>98.0%)、盐酸洛美沙星(Lomefloxacin hydrochloride, LOM, 含量>98.0%)、恩诺沙星(Enrofloxacin, ENR, 含量>98.0%), 以上抗生素药物均购置于上海麦克林生化科技有限公司.按照CLSI-2016标准将各抗生素配制成不同浓度的储藏液, 经0.22 μm滤膜过滤除菌后于-20 ℃保存备用.
2.1.2 药敏纸片来源用打孔器制作直径6 mm、厚1 mm的圆形滤纸片, 121 ℃灭菌30 min(0.11 MPa), 烘干后分装于小西林瓶中保存(50片·瓶-1).根据半饱和法制作药敏纸片:在无菌操作下, 将一定量的抗菌药液加入到装有滤纸片的西林瓶中, 无菌风吹扫10 min, 密封, 于-20 ℃冰箱中或阴暗干燥处.自制的药敏纸片的药物含量为10 μg ·片-1.进行质控实验的磺胺甲恶唑药敏纸片为英国OXOID公司产品, 含量为25 μg ·片-1.
2.1.3 菌液来源自然条件下反硝化细菌种类多样, 为契合自然环境, 购置上海甘度环境工程有限公司的反硝化菌剂进行实验.甘度反硝化细菌是萃取自然环境下的混合菌种, 适应于10~60 ℃、pH=6~9的环境.固体菌剂需活化后使用, 将适量菌剂于肉汤培养基中25 ℃恢复培养16~18 h, 接种于琼脂平板上于37 ℃下培养16~24 h, 待细菌长成菌落后备用(姜童童等, 2020).质控菌为粪肠球菌ATCC 29212, 购于上海鲁微科技有限公司.
2.1.4 培养基纸片扩散法使用美国临床和实验室标准协会(CLSI)推荐的Muller-Hinton Agar (MH-A琼脂培养基, 英国OXOID公司):琼脂浓度为1.0%~2.0%, pH为7.4, 厚度约为4 mm;微量肉汤稀释法使用Mueller Hionton Broth(MH-B肉汤培养基, 英国OXOID公司).
2.1.5 实验设备主要用到的实验仪器包括:高压灭菌锅(GI54TW, 致微(厦门)仪器有限公司)、超净工作台(AIRTECH, 苏州安泰空气技术有限公司)、智能光照培养箱(PGX-250, 宁波海曙赛福实验仪器厂)、麦氏比浊管(0.5McFarland-5McFarland, 温州康泰生物科技有限公司)、一次性培养皿(柏丞生物科技有限公司)、96孔板(上海晶安生物科技有限公司).
2.2 实验条件及测试方法纸片扩散法是将含有定量抗菌药物的药敏纸片贴在涂有细菌的琼脂表面, 过夜培养后会在纸片周围形成抑菌圈, 以NCCLS标准(表 1)判断抗菌药物的敏感性, 并根据抑菌图形判断抗菌作用.微量肉汤稀释法可用于定量测试抗菌药物对微生物的体外活性, 实验时抗菌药物的浓度经过lg2倍稀释, 能抑制待测菌肉眼可见生长的最低药物浓度为最小抑菌浓度(Minimum Inhibitory Concentration, MIC).纸片扩散法得到的抑菌圈直径和微量肉汤稀释法得出的MIC值都可以反映测试菌对药物的敏感程度, 二者呈负相关, 即抑菌圈越大, 则MIC越小, 受试菌对该药物越敏感.根据MIC值, 继续进行联合药敏试验, 将稀释好的抗菌药物按棋盘法设计两两组合, 过夜培养后计算部分抑菌浓度(Fractional Inhibitory Concentration, FIC)指数(式(1))(倪语星等, 2009).
| 表 1 稀释法与纸片扩散法药敏试验的解释标准(NCCLS标准) Table 1 Interpretation standard of dilution and paper diffusion methods (NCCLS) |
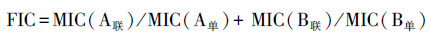
|
(1) |
式中, MIC(A联)为A药联合时的MIC, MIC(A单)为A药单测时的MIC, MIC(B联)为B药联合时的MIC, MIC(B单)为B药单测时的MIC.
2.2.1 反硝化细菌的鉴定为了验证选用的反硝化菌与水土环境中反硝化菌的种类和数量的一致性, 用高通量测序平台IlluminaMiSeq对扩增产物进行MiSeq高通量测序.MiSeq测序得到的PEreads首先根据barcode区分每个样本, 然后对序列质量进行质控和过滤, 再根据overlap关系进行拼接, 拼接后的序列再次进行质控和过滤, 最后得到的优化序列进行OTU聚类分析和物种分类学分析, 并计算群落Alpha多样性.共选取3份相同的菌液作为平行样品进行测试.
2.2.2 纸片扩散法反硝化菌对喹诺酮类中5种典型抗生素的敏感性测定:通过对喹诺酮类抗生素单一药物抑菌圈直径的测定来评估5种药物对反硝化菌的敏感性, 药敏纸片的药物含量为10 μg ·片-1, 每组设计3个平行样品.同时进行磺胺甲恶唑纸片对粪肠球菌ATCC 29212质控.根据试验规范要求, 挑取适量培养的菌落至0.9%氯化钠溶液中, 制成菌悬液, 将浊度调0.5麦氏单位, 15 min内使用.用无菌棉拭子蘸取接种液, 在管壁上挤压去掉多余菌液, 用棉拭子涂布在直径90 mm的平皿上, 室温放置3~5 min.用无菌镊子将纸片放在琼脂表面并轻压, 使纸片与琼脂表面完全接触, 纸片距培养皿边缘大于15 mm, 纸片贴好后将平皿倒置, 15 min内放入35 ℃孵箱, 在培养皿接口处缠绕封口膜, 同时将平皿装入密封袋, 35 ℃下厌氧培养16~18 h.置平皿在黑色无反射背景上并用反射光照明, 用游标卡尺量取抑菌圈直径(以整毫米数计), 以不见细菌明显生长为边界.根据NCCLS标准解释抑菌圈直径, 报告细菌对测试的抗菌药物的敏感性, 包括耐药(Resistant, R)、敏感(Sensitive, S)、中介(Intermediate, I).质控组应产生直径20 mm或以上的清楚明显的抑菌圈.
喹诺酮类5种典型抗生素的联合药敏试验:将5种药敏纸片两两组合进行联合抑菌实验, 共设计喹诺酮类5种抗生素的10个组合, 编号为1#~10#, 每组重复3次, 同时进行空白纸片对照组实验.药敏纸片药物含量为10 μg ·片-1, 空白纸片药物含量为0 μg ·片-1.将0.5麦氏单位的菌悬液用无菌棉拭子在平皿上均匀涂布后贴上药敏纸片, 将平皿以封口膜封装同时放入密封袋, 在35 ℃孵箱内厌氧培养16~18 h后读取抑菌图形报告, 并在偏光显微镜1.25倍镜下观察两抑菌圈交界处的成像.若两个抑菌圈交界角度>90°表明两种药物是累加或协同作用, 交界角度 < 90°表明两种药物相互无关, 两抑菌圈没有重叠表明两药相互拮抗.根据抗微生物敏感性试验规范及单一药物产生的抑菌圈大小确定两纸片在平皿上的位置:药物产生的抑菌圈直径为10~30 mm, 同时纸片中心相距大于24 mm、纸片距平皿边缘大于15 mm.根据以上原则确定两纸片中心间距为25 mm, 联合药敏试验中每组各药物产生的抑菌圈直径如表 3所示.
2.2.3 微量肉汤稀释法喹诺酮类5种典型抗生素的最小抑菌浓度测定:将5种抗菌药物以灭菌的MH-B倍比稀释成16个浓度, 分别为512、256、128、……、1、0 μg · mL-1, 取100 μL依次加入96孔细胞培养板, 再将0.5麦氏标准的菌悬液按1 : 10稀释后每孔加入5 μL, 盘孔内菌液的最终浓度为5×105 CFU · mL-1.将96孔板接口处缠绕封口膜并于35 ℃下厌氧培养16~20 h, 以肉眼观察每孔中液体的浊度变化.若阳性对照孔有菌生长而空白对照孔无细菌生长, 则以细菌生长有明显浊度、有一个直径≥2 mm的沉淀菌斑或多个小菌斑的分界浓度值为MIC.质控菌ATCC 29212对磺胺甲恶唑的MIC测定方法同上, 试验终点以没有生长或比对照(未添加抗生素孔)减少80%以上为MIC, 质控组MIC≤9.5 μg · mL-1是合适的.
喹诺酮类5种典型抗生素组合的部分抑菌浓度测定:将稀释好的抗菌药物按棋盘法设计, 根据最小抑菌浓度的测定, 最高浓度为单药MIC的2倍, 选择其中8个连续的药物浓度梯度作为联合药敏试验梯度, 横向、纵向分别是两种单药的降梯度方向.取相应梯度浓度的药物各50 μL两两组合加入相应孔中(第8列和第8行为空白对照), 再加入5 μL浓度为107 CFU · mL-1的菌悬液, 用封口膜封装后于35 ℃下培养18~24 h观察结果.计算FIC指数, 当FIC≤0.5时, 表明两药表现为累加作用;当1 < FIC≤2时, 表现为协同作用;当0.5 < FIC≤1时, 表现为无关作用;当FIC>2时, 表现为拮抗作用.
3 结果与讨论(Results and discussion) 3.1 反硝化细菌的鉴定结果采用高通量测序技术表征菌液中的微生物群落结构, 经质控过滤和拼接, 最终得到用于后续分析的有效优化序列共163484条, 通过OTU聚类分析实际观察到的OTU个数为571.由表 2可知, 样品中微生物的覆盖率均大于99.9%, 说明测序序列基本覆盖了细菌的多样性, 测序结果可以代表样本的真实情况.比较各样品的Alpha多样性指数, 其中, Chao和Ace指数用于衡量物种丰度即物种数量的多少, Shannon和Simpson指数用于衡量物种多样性, Shannon指数值越大, Simpson指数值越小, 说明样品的物种多样性越高(Kong et al., 2009).
| 表 2 反硝化菌Alpha多样性指数值 Table 2 Alpha diversity index of denitrifying bacteria |
3组样品OTU在门水平上的细菌群落结构及分布如图 1a所示.由图可知, 所有样品的细菌群落结构具有一定的相似性, 其相对丰度较高的菌群相同, 相对丰度较低的菌群有所差异, 且各类细菌菌群的相对丰度存在一定的区别.样品中Proteobacteria(变形菌门)为最主要的菌门, 相对丰度分别为80.6%、75.9%、61.1%.研究表明, Proteobacteria菌门与反硝化作用密切相关, 是反硝化细菌的常见菌种(Yang et al., 2013;陈谊等, 2010;郑林雪等, 2015;周石磊等, 2020).
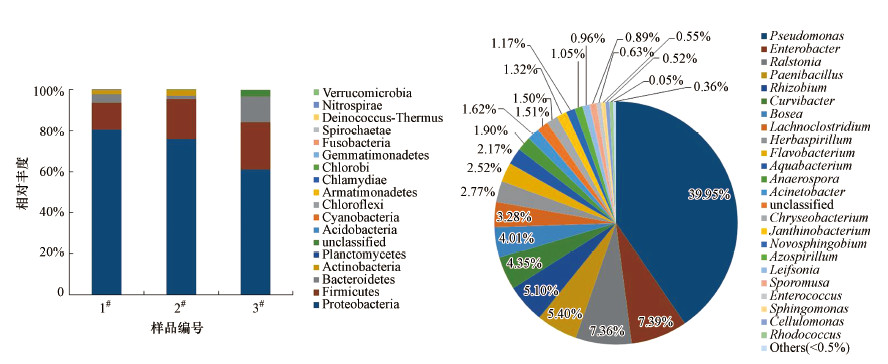 |
| 图 1 反硝化菌门(a)及属(b)水平的群落结构 Fig. 1 Community structure of denitrifying bacteria at phylum(a) and genus(b) level |
反硝化细菌在属水平的群落结构如图 1b所示.由图可知, 微生物菌属主要为Pseudomonas(假单胞菌属)、Enterobacter(肠杆菌属).假单胞菌属相对丰度达39.95%, 是典型的兼性厌氧反硝化细菌, 该菌属中有多个种类已被作为研究水土环境中反硝化过程的典型菌株, 且具有高效的反硝化作用(王弘宇等, 2009;Xia et al., 2010;Zou et al., 2018;肖晶晶等, 2019).由此可见, 本实验选用的菌种可以代表水土环境中的反硝化细菌.
3.2 纸片扩散法的测定结果 3.2.1 反硝化菌对喹诺酮类典型抗生素的敏感性每种抗生素的药敏纸片进行3次平行试验, 抗生素抑菌圈直径的平均值和标准误差如图 2所示.质控组抑菌圈直径为24 mm, 符合纸片扩散法药敏实验的要求.因为含有抗菌药物的纸片贴在琼脂上后会向四周扩散, 其浓度呈梯度递减, 过夜培养后在纸片周围一定距离内的细菌生长受到抑制.抑菌圈越大, 说明该菌对此抗生素敏感性越大, 反之越小.从图 2可知, 反硝化细菌对ENR最敏感, 抑菌圈直径为29 mm.LOM、OFL、NOR产生的抑菌圈直径相差不大, LOM的抑菌圈直径为21~22 mm, OFL产生的抑菌圈直径为21~23 mm, NOR产生的抑菌圈直径均为21 mm.在NOR产生的抑菌圈周围有一些细小的菌落存在, 说明混合菌种中的一些细菌在有NOR的环境下可以存活.5种抗菌药物的敏感性大小为:ENR>CIP>OFL≈LOM≈NOR.根据NCCLS标准(表 1)可知, 反硝化菌对喹诺酮类的5种典型抗生素均敏感(S).由此可见, 喹诺酮类抗生素会对反硝化菌的生长产生抑制作用, 这与Zou等(2019)的研究结果一致.Rosendahl等(2012)认为喹诺酮类药物对土壤中的氮素转化有抑制作用;Yi等(2017)在研究环丙沙星对废水中脱氮的影响时发现, 环丙沙星通过抑制亚硝酸还原酶的活性来抑制反硝化过程.
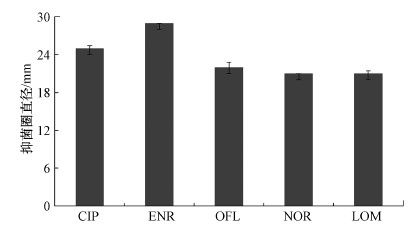 |
| 图 2 喹诺酮类5种典型抗生素的抑菌圈直径 (误差棒为3个平行样的标准差) Fig. 2 Diameter of bacteriostatic zone of quinolones |
将5种抗生素两两组合进行联合药敏试验, 各组组合后的测试结果如表 3所示.本实验中产生的抑菌图形有3种(图 3), 其中, 黑色背景图为实验产生的抑菌图形, 其下方对应此图形在偏光显微镜1.25倍镜下抑菌圈交界处的成像(500像素), 红色虚线为抑菌圈边界线.
| 表 3 纸片扩散法对5种药物组合的联合试验结果 Table 3 Results of the joint test of five drug combinations by the paper diffusion method |
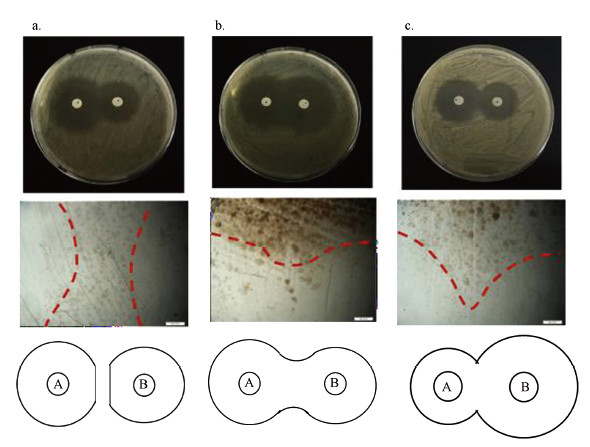 |
| 图 3 喹诺酮类5种抗生素联用的抑菌图形 (A、B为含有不同药物的药敏纸片)(a.拮抗作用, b.累加作用, c.无关作用, 空白纸片未产生抑菌圈) Fig. 3 The antibacterial graph of five antibiotics combined in quinolones (A and B are drug sensitive papers containing different drugs)(a.antagonism effect, b.additive antibacterial effects, c.irrelevant effect, the blank did not produce bacteriostatic ring) |
从定量的角度判断喹诺酮类药物对反硝化菌的抑制效果, 分别测定了喹诺酮类5种典型抗生素的最小抑菌浓度, 结果如图 4所示.质控组磺胺甲恶唑对粪肠球菌ATCC 29212的MIC为2 μg · mL-1, 符合稀释法药敏试验的要求.由NCCLS标准(表 1)可知, 5种抗生素的MIC值均在敏感(S)范围内, 说明稀释法与纸片扩散法对该反硝化菌的测试一致率较高.反硝化菌对5种抗生素的敏感性大小为:ENR>CIP>OFL>LOM>NOR.Noake等(2007)采用纸片扩散法和微量肉汤稀释法测定酵母菌的药物敏感性, 发现两种方法的结果一致, 也有学者发现当不同方法的结果存在差异时应以稀释法的结果为准(Rechenchoski et al., 2017).
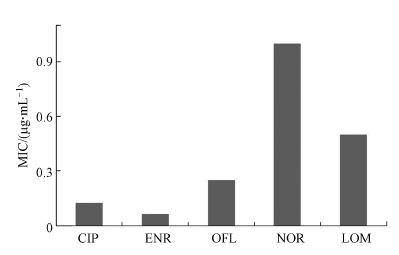 |
| 图 4 喹诺酮类5种典型抗生素的MIC Fig. 4 MIC of 5 typical antibiotics of quinolones |
将实验测得的MIC值与其他研究对比可以发现, 造成MIC值差异的主要原因为不同菌落对不同抗生素存在敏感性差异, 这在Alipour等(2014)的研究中有所体现, Rita等(2018)也认为抗菌药物具有种属特异性, 药物作用时具有物种特异性或菌株特异性.其次, 若选择混菌进行实验, 菌落的组成及菌属水平差异也会产生不同的结果, 如Zou等(2019)采用Etset试纸条测得恩诺沙星对反硝化菌的MIC为0.094 μg · mL-1, 本研究结果为0.0625 μg · mL-1, 这是因为Zou等进行实验的菌落在属水平主要有Pseudomonas(假单胞菌属)、Stenotrophomonas(寡养单胞菌属), 占比分别为46.17%、14.90%;本研究中菌落在属水平主要为Pseudomonas(假单胞菌属)、Enterobacter(肠杆菌属), 占比分别为39.95%、7.39%.同时, 采用混菌进行试验时得出的是混合菌种共同作用下的MIC值, 而将混菌分离成单菌进行实验得出的是每株菌的MIC值, 最终得到药物对该菌的MIC范围.第三, 选用的测试方法不同得出的结果也有所差异(蓝锴等, 2012).
3.3.2 喹诺酮类5种典型抗生素组合后的联合作用根据5种抗生素的MIC值, 测定抗生素组合后FIC值, 以此判断复合抗生素的联合抑菌效应.实验结果根据阳性对照孔有菌生长而空白对照孔无细菌生长进行判定, 目测每孔中液体的浊度变化, 各组结果如图 5所示.以颜色的深浅表示8×8孔内反硝化菌的生长情况, 格子颜色越深, 表示孔内细菌浊度越高.经计算可知(表 4), 图 5a中的抗生素组均为无关作用, 即两种药物联合使用的最终效果不超过联合用药中的较强者;图 5b中的抗生素组为拮抗作用, 即联合用药后作用效果减弱或抵消;图 5c中的抗生素组为累加作用, 即两种药物联用的最终效果是各药作用之和.
| 表 4 微量肉汤稀释法对5种药物组合的联合试验结果 Table 4 Results of the joint test of the micro-broth dilution method on five drug combinations |
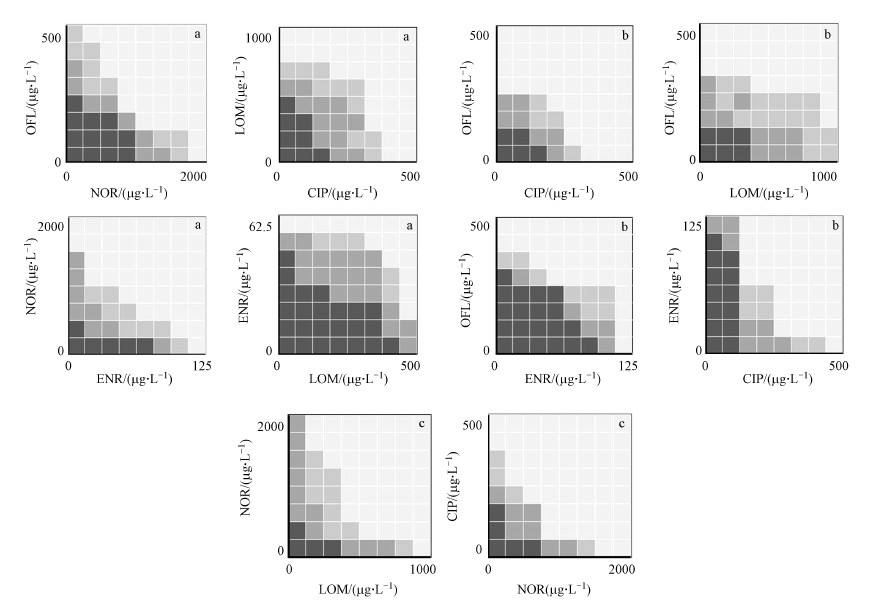 |
| 图 5 5种抗生素联用后反硝化菌在8×8孔内的生长情况 (a.无关作用, b.拮抗作用, c.累加作用) Fig. 5 Growth of denitrifying bacteria in 8x8 wells after combined use of five antibiotics (a.irrelevant effect, b.antagonism effect, c.additive antibacterial effect) |
根据测试结果可以发现, OFL、NOR在与其他4种药物联用时的MIC小于等于它们单独使用时的MIC;ENR、CIP与其他4种药物联用时的MIC大于等于它们单独使用时的MIC;LOM与其他药物联用后的MIC会大于、小于或等于单独使用时的MIC.推测可能与药物对反硝化菌的敏感性有关, 具体原因需要进一步实验证明.
综上, 两种方法对复合药物的测试结果有所差异(表 5), 推测产生该实验结果的主要原因可能是实验选用的反硝化菌是萃取自然环境下的混合菌种所造成的.Rita等(2018)在研究抗菌药物组合的种属特异性时发现药物作用具有物种特异性或菌株特异性, 这在Alipour等(2014)的研究中也有所体现.微量肉汤稀释法被认为是进行药敏试验的金标准, 因此, 药物测试的最终结果主要参考微量肉汤稀释法(Noake et al., 2007), 同时微量肉汤稀释法在评价其他药敏方法的测试结果时作为重要的参考依据(Espinel et al., 2007;Rechenchoski et al., 2017;Sader et al., 2020).
| 表 5 两种方法对5种药物组合的联合试验结果比较 Table 5 Comparison of the results of combined trials of 5 drug combinations by two methods |
分析微量肉汤稀释法的结果, 从喹诺酮类抗生素的抑菌机理—喹诺酮类药物通过作用于细菌的DNA回旋酶、干扰细菌细胞DNA复制而呈现杀菌作用, 做出如下推测:若喹诺酮类抗生素对反硝化菌作用点相同且阻碍同一环节可能产生拮抗作用或无关作用;若喹诺酮类抗生素对反硝化菌作用点不同或作用环节不同可产生累加作用或协同作用;以上猜想需通过环境模拟条件下的反应体系实验进一步证明.课题组前期研究认为, LOM对反硝化的抑制作用主要体现在NO3--N还原至NO2--N这一阶段, 且对反硝化过程的抑制作用在微生物数量与活性、群落结构、反硝化酶活性、功能基因及抗性基因的相对丰度都有响应.也有学者研究发现, 由于氯霉素与四环素阻碍蛋白质合成的不同环节, 联用时会产生协同或累加作用(崔笑博, 2014).陈会(2018)研究发现, 中草药提取物对副溶血弧菌细胞膜和细胞壁通透性有不同程度的影响, 抗生素与中草药提取物的协同抑菌作用与由质子供能的外排泵有关.张智琪(2018)认为左氧氟沙星和环丙沙星抑制铜绿假单胞菌生物膜的黏附能力有所差异;高浓度的环丙沙星会使它的氨基酸发生突变的时间提前, 同时对铜绿假单胞菌的MexA和MexE外排泵基因相对表达量有抑制作用, 对生物膜的调控会因药物浓度、药物作用时间或者实验环境的不同产生抑制或促进作用.Zou等(2019)发现相同浓度的5种喹诺酮类抗生素分别刺激反硝化菌会产生不同的作用效果, 在细菌生长迟滞期和稳定期的抑制率或促进率也不同.Davies等(2006)曾报道抗生素作为信号分子, 会触发转录过程的广泛变化, 从而调节菌体内的基因表达或对细胞的稳态产生干扰(Luisa et al., 2013).作用靶点的改变及DNA螺旋酶、拓扑异构酶Ⅳ的突变, 都会妨碍细菌DNA复制、转录, 最终产生的现象是多种机制协同表达的结果(魏树全等, 2009;刘春明, 2011).这些差异表达的基因会改变细菌生理过程, 如粘附、生物膜形成及酶和毒素产生, 从而产生不同的作用效果(Bahar et al., 2002;Ismaeel et al., 2005;Kumar et al., 2013;Andersson et al., 2014).由此来看, 抗生素对细菌的作用机制较为复杂, 同类抗生素的作用效果也可能会有所差别, 复合抗生素对反硝化菌的作用机理有待进一步研究.
水土环境中复合抗生素污染对反硝化作用的影响将因复合抗生素的种类差异变得更为复杂, 同时持续的抗生素暴露导致环境中微生物耐药性增强, 也会加剧抗生素经饮用水或食物链进入人体的潜在风险(代莎等, 2020;阮晓慧等, 2020).通过联合药敏试验这种简便有效的手段可为水土环境中复合抗生素污染对反硝化影响的快速判定提供一定的参考依据, 以采取防治措施降低抗生素对水土环境生态系统的危害.
4 结论(Conclusions)1) 以假单胞菌属为主要菌群的反硝化菌对喹诺酮类5种典型抗生素的敏感性大小为:ENR>CIP>OFL>LOM>NOR.同时, 采用微量肉汤稀释法得到了OFL、LOM、CIP、ENR、NOR的最小抑菌浓度(MIC), 分别为0.25、0.5、0.125、0.0625、1 μg · mL-1, 5种抗生素的MIC值均在敏感(S)范围.
2) 进行联合药敏试验时纸片扩散法与微量肉汤稀释法的结果有所差别, 以微量肉汤稀释法的结果为准.根据MIC计算抑菌浓度指数(FIC)判断联合抑菌效应, 结果显示, OFL与NOR表现为无关作用, 与CIP、LOM、ENR均表现为拮抗作用;NOR与CIP、LOM表现为累加作用, 与ENR表现为无关作用;CIP与LOM表现为无关作用, 与ENR表现为拮抗作用;LOM与ENR表现为无关作用.
3) 从喹诺酮类抗生素的抑菌机理分析微量肉汤稀释法的结果有以下推测:喹诺酮类抗生素联用时产生的不同作用效果可能是对反硝化菌作用点或作用环节有差异引起的.通过联合药敏试验探究复合抗生素的对反硝化菌的联合作用可为多种抗生素存在时水土环境反硝化能力的评价及污染防治提供参考依据.
Akers K S, Chaney C, Barsoumian A, et al. 2010. Aminoglycoside resistance and susceptibility testing errors in Acinetobacter baumannii-calcoaceticus complex[J]. Journal of Clinical Microbiology, 48(4): 1132-1138. DOI:10.1128/JCM.02006-09 |
Alipour F, Ahmadi M, Javadi S. 2014. Evaluation of different methods to detect methicillin resistance in Staphylococcus aureus (MRSA)[J]. Journal of infection and Public Health, 7(3): 186-191. DOI:10.1016/j.jiph.2014.01.007 |
Andersson D I, Hughes D. 2014. Microbiological effects of sublethal levels of antibiotics[J]. Nature Reviews.Microbiology, 12(7): 465-478. DOI:10.1038/nrmicro3270 |
Azevedo A C, Fernando C B, Matta D A D, et al. 2011. In vitro susceptibility of a large collection of Candida strains against fluconazole and voriconazole by using the CLSI disk diffusion assay[J]. Mycopathologia, 171(6): 411-416. DOI:10.1007/s11046-010-9387-1 |
Bahar I H, Dogan Y, Yulug N, et al. 2002. Effect of subminimal inhibitory concentrations of three fluoroquinolones on adherence of uropathogenic strains of Escherichia coli[J]. International Journal of Antimicrobial Agents, 19(1): 79-82. DOI:10.1016/S0924-8579(01)00469-1 |
Costanzo S D, Murby J, Bates J. 2005. Ecosystem response to antibiotics entering the aquatic environment[J]. Marine Pollution Bulletin, 51(1/4): 218-223. |
陈会.2018.中草药提取物与抗生素联用抑制副溶血弧菌机制研究[D].镇江: 江苏大学.30-31
|
崔笑博.2014.禽源大肠杆菌的分离鉴定, 耐药性分析及联合药敏试验的研究[D].泰安: 山东农业大学.13-15
|
陈谊, 孙宝盛, 张斌, 等. 2010. 不同MBR反应器中硝化菌群落结构的研究[J]. 中国环境科学, 30(1): 69-75. |
崔亚丰, 何江涛, 苏思慧, 等. 2015. 某市典型地段地表水及地下水中氟喹诺酮类抗生素分布特征[J]. 环境科学, 36(11): 4060-4067. |
陈卫平, 彭程伟, 杨阳, 等. 2017. 北京市地下水中典型抗生素分布特征与潜在风险[J]. 环境科学, 38(12): 5074-5080. |
代莎, 李彭, 彭五庆, 等. 2020. 抗生素对耐药型反硝化菌反硝化过程及微生物群落结构的影响[J]. 环境科学, 41(3): 1401-1408. |
Espinel-Ingroff A, Canton E, Gibbs D, et al. 2007. Correlation of neo-sensitabs tablet diffusion assay results on three different agar media with CLSI broth microdilution M27-A2 and disk diffusion M44-A results for testing susceptibilities of Candida spp.and Cryptococcus neoformans to amphotericin B[J]. Journal of Clinical Microbiology, 45(3): 858-864. DOI:10.1128/JCM.01900-06 |
高雅婷, 李晓霞, 康建邦, 等. 2017. 环丙沙星诱导对铜绿假单胞菌最低抑菌浓度的影响[J]. 中国临床药理学杂志, 33(2): 123-126, 135. |
Ismaeel A Y, Senok A C, Bindayna K M, et al. 2005. Effect of antibiotic sub inhibitory concentration on cytolethal distending toxin production by Campylobacter jejuni[J]. Journal of Infection, 51(2): 144-149. DOI:10.1016/j.jinf.2004.09.012 |
姜童童, 田桂杰, 李贤煜, 等. 2020. 基于微生物快速鉴定系统对金黄色葡萄球菌耐药性鉴定新评估方法的建立[J]. 中国实验方剂学杂志, 26(10): 128-135. |
Klaus K. 2009. Antibiotics in the aquatic environment - A review - Part I[J]. Chemosphere, 75: 417-434. DOI:10.1016/j.chemosphere.2008.11.086 |
Kong H H, Conlan S, Grice E A, et al. 2009. Topographical and temporal diversity of the human skin microbiome[J]. Science, 324(5931): 1190-1192. DOI:10.1126/science.1171700 |
Kumar A, Ting Y P. 2013. Effect of sub-inhibitory antibacterial stress on bacterial surface properties and biofilm formation[J]. Colloids and Surfaces, B.Biointerfaces, 111: 747-754. DOI:10.1016/j.colsurfb.2013.07.011 |
Li X H, Lu S Y, Liu S, et al. 2020. Shifts of bacterial community and molecular ecological network at the presence of fluoroquinolones in a constructed wetland system[J]. Science of the Total Environment, 708: 135156. DOI:10.1016/j.scitotenv.2019.135156 |
Lin Y C, Yu T H, Lin C F. 2009. Pharmaceutical contamination in residential, industrial, and agricultural waste streams:Risk to aqueous environments in Taiwan[J]. Chemosphere, 74(1): 131-141. |
Liu X H, Lu S Y, Guo W, et al. 2018. Antibiotics in the aquatic environments:A review of lakes, China[J]. Science of the Total Environment, 627: 1195-1208. DOI:10.1016/j.scitotenv.2018.01.271 |
Luisa L, Ivan M, Arnaud G. 2013. Bacterial responses and genome instability induced by subinhibitory concentrations of antibiotics[J]. Antibiotics, 2(1): 100-114. DOI:10.3390/antibiotics2010100 |
刘春明. 2011. 铜绿假单胞菌耐药机制的研究进展[J]. 中华医院感染学杂志, 21(21): 4634-4637. |
蓝锴, 张伟铮, 罗强, 等. 2012. 不同方法检测黏液型铜绿假单胞菌药物敏感性结果准确性探讨[J]. 检验医学, 27(7): 544-548. DOI:10.3969/j.issn.1673-8640.2012.07.005 |
Noake T, Kuriyama T, White P L, et al. 2007. Antifungal susceptibility of Candida species using the clinical and laboratory standards institute disk diffusion and broth microdilution methods[J]. Journal of Chemotherapy, 19(3): 283-287. DOI:10.1179/joc.2007.19.3.283 |
倪语星, 徐英春, 孙自镛. 2009. 抗微生物药物敏感性试验规范[M]. 上海: 上海科学技术出版社, 18-37.
|
Pfaller M A, Diekema D J. 2012. Progress in antifungal susceptibility testing of Candida spp.by use of clinical and laboratory standards institute broth microdilution methods, 2010 to 2012[J]. Journal of Clinical Microbiology, 50(9): 2846-2856. DOI:10.1128/JCM.00937-12 |
Rechenchoski D Z, Dambrozio A M L, Vivan A C P, et al. 2017. Antimicrobial activity evaluation and comparison of methods of susceptibility for Klebsiella pneumoniae carbapenemase (KPC)-producing Enterobacter spp.isolates[J]. Brazilian Journal of Microbiology, 48(3): 509-514. DOI:10.1016/j.bjm.2017.01.008 |
Rita B A, Anja T, Jacob B, et al. 2018. Species-specific activity of antibacterial drug combinations[J]. Nature, 559(7713): 259-263. DOI:10.1038/s41586-018-0278-9 |
Rosendahl I, Siemens J, Kindler R, et al. 2012. Persistence of the fluoroquinolone antibiotic difloxacin in soil and lacking effects on nitrogen turnover[J]. Journal of Environmental Quality, 41(4): 1275-1283. DOI:10.2134/jeq2011.0459 |
阮晓慧, 钱雅洁, 薛罡, 等. 2020. 四环素抗生素对污泥中四环素抗性基因丰度和表达水平的作用影响[J]. 环境科学, 41(2): 823-830. |
Sader H S, Rhomberg P R, Chandrasekaran S, et al. 2020. Correlation between broth microdilution and disk diffusion results when testing ceftazidime-avibactam against a challenge collection of enterobacterales isolates:Results from a multilaboratory study[J]. Journal of Clinical Microbiology, 58(4): e01757-19. |
Schaider L A, Rudel R A, Ackerman J M, et al. 2014. Pharmaceuticals, perfluorosurfactants, and other organic wastewater compounds in public drinking water wells in a shallow sand and gravel aquifer[J]. Science of the Total Environment, 468: 384-393. |
王弘宇, 马放, 杨开, 等. 2009. 两株异养硝化细菌的氨氮去除特性[J]. 中国环境科学, 29(1): 47-52. DOI:10.3321/j.issn:1000-6923.2009.01.010 |
魏树全, 赵子文. 2009. 泛耐药铜绿假单胞菌耐药机制研究进展[J]. 医学综述, 15(2): 261-265. DOI:10.3969/j.issn.1006-2084.2009.02.035 |
Xia S Q, Li J X, Wang R C, et al. 2010. Tracking composition and dynamics of nitrification and denitrification microbial community in a biofilm reactor by PeR-DGGE and combining FISH with flow cytometry[J]. Biochemical Engineering Journal, 49(3): 370-378. DOI:10.1016/j.bej.2010.01.013 |
肖晶晶, 郭萍, 霍炜洁, 等. 2019. 反硝化微生物在污水脱氮中的研究及应用进展[J]. 环境科学与技术, 32(12): 97-102. |
Yang X L, Zhou N, Chen M, et al. 2013. Analysis of microbial community structure in MBR with different ammonia concentrations using fluorescence in situ hybridization[J]. Journal of Southeast University(Natural Science Edition), 43(2): 380-385. |
Yi K, Wang D, Qi Y, et al. 2017. Effect of ciprofloxacin on biological nitrogen and phosphorus removal from wastewater[J]. Science of the Total Environment, 605-606: 368-375. DOI:10.1016/j.scitotenv.2017.06.215 |
Yim G, Davies J, Spiegelman G B. 2006. The world of subinhibitory antibiotic concentrations[J]. Current Opinion in Microbiology, 9(5): 445-453. DOI:10.1016/j.mib.2006.08.006 |
Yin G, Hou L, Liu M, et al. 2017. Effects of multiple antibiotics exposure on denitrification process in the Yangtze Estuary sediments[J]. Chemosphere, 171: 118-125. DOI:10.1016/j.chemosphere.2016.12.068 |
Zarkotou O, Pournaras S, Altouvas G, et al. 2012. Comparative evaluation of tigecycline susceptibility testing methods for expanded-spectrum cephalosporin- and carbapenem-resistant gram-negative pathogens[J]. Journal of Clinical Microbiology, 50(11): 3747-3750. DOI:10.1128/JCM.02037-12 |
Zhang Q Q, Ying G G, Pan C G, et al. 2015. Comprehensive evaluation of antibiotics emission and fate in the river basins of China:source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science & Technology, 49(11): 6772-6782. |
Zou H, He J T, He B N, et al. 2019. Sensitivity assessment of denitrifying bacteria against typical antibiotics in groundwater[J]. Environmental Science:Processes & Impacts, 21(9): 1570-1579. |
Zou Y, Lin M, Xiong W, et al. 2018. Metagenomic insights into the effect of oxytetracycline on microbial structures, functions and functional genes in sediment denitrification[J]. Ecotoxicology and Environmental Safety, 161: 85-91. DOI:10.1016/j.ecoenv.2018.05.045 |
郑林雪, 李军, 胡家玮, 等. 2015. 同步硝化反硝化系统中反硝化细菌多样性研究[J]. 中国环境科学, 35(1): 116-121. |
周石磊, 孙悦, 张艺冉, 等. 2020. 基于网络分析解析水源水库春季水体反硝化群落演变特征及驱动因素[J]. 环境科学, 41(4): 1666-1675. |
张智琪.2018.氟喹诺酮药物诱导铜绿假单胞菌生物膜及耐药机制研究[D].太原: 山西医科大学: 49-50
|
 2021, Vol. 41
2021, Vol. 41


