2. 中国科学院大学资源与环境学院, 北京 100049;
3. 厦门大学环境与生态学院, 厦门 361102;
4. 华侨大学化工学院, 厦门 361021
2. College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049;
3. College of Environment & Ecology, Xiamen University, Xiamen 361102;
4. College of Chemical Engineering, Huaqiao University, Xiamen 361021
城市供水短缺和水源污染的加剧, 使供水系统面临严峻挑战.为缓解用水供需矛盾, 改善水源水质, 杭州市拟实施长距离引水, 将千岛湖作为第二水源地(刘孔英, 2013).该配供水工程实施后, 千岛湖将成为杭州、嘉兴等地的优质饮用水源地, 惠及千万人口.
水源水是保障饮用水安全的重要一环.一方面, 水源水中病原微生物可能导致介水传染病爆发(曲良娇, 2016);另一方面, 水源水微生物安全性较差时, 水厂一般会加大消毒剂的使用量, 导致消毒副产物增加, 健康风险也随之增加(孙媛媛, 2014; Diana et al., 2019).此外, Han等(2020)研究表明, 49.73%±30.22%的龙头水细菌群落来自水源水, 水源水敏感型及耐受型类群的相对比例决定了影响龙头水细菌群落的能力, 这种潜在不利影响值得更多关注.目前, 针对千岛湖的研究多集中在生态系统服务功能评估和浮游植物特征等方面(周静, 2013; 俞焰等, 2017; 相晨等, 2019), 鲜有对其进行微生物安全方面的系统研究.
水源水微生物安全涉及方面众多, 包括微生物总数、病原微生物、水质生物稳定性等.国内外研究多用AOC、BDOC和BGP衡量水质生物稳定性(叶林等, 2007; Zhang et al., 2016).现行《生活饮用水卫生标准》(GB 5749—2006)以平板计数法测定菌落总数, 低估了细菌数量;以指示微生物指示病原菌, 缺乏针对性.目前并未形成评价水源水微生物安全性的既有标准.
基于此, 本研究综合现有评价指标, 针对千岛湖全年水质变化, 以金竹牌取水口水质为主要研究对象, 考察不同季节不同层深水体的理化性质、生物稳定性(BDOC和BGP)、微生物指标(菌落总数、指示微生物、病原微生物);此外, 由于夏季气温高, 微生物易滋长, 余氯消耗快, 本研究将重点关注其微生物群落结构.最后, 综合探讨千岛湖水体的水质时空差异, 系统评估其生物安全性, 以期为合理切换水源、保障饮用水安全提供依据.
2 材料和方法(Material and methods) 2.1 区域概况与采样点布设“千岛湖配水工程”输水路线和采样点布设如图 1所示.千岛湖位于浙江省杭州市淳安县境内, 取水口位于淳安县境淡水镇金竹牌村(119°10′E, 29°31′N), 富文湾的金竹牌半岛南端.金竹牌取水口最深约20 m, 采用三道闸门自重流的方式取水, 预计取水深度为0~10 m.基于此, 本研究在取水口垂直采样深度(0.5、2.5、5、7.5、10和17.5 m)设置采样点, 再在湖中心和岸边表层水体设置对照.采样时间为2018年8月(夏季)、2018年11月(秋季)和2019年3月(冬季).
 |
| 图 1 千岛湖采样位点分布图 Fig. 1 The distribution of sampling points |
使用5 L柱状采水器采集水样, 注入经次氯酸钠消毒的高密度聚乙烯塑料桶中, 每个采样点采集样品20 L, 尽快运回实验室, 48 h内进行分析.
溶氧(DO)、温度(T)、pH值、叶绿素a通过多参数水质分析仪(WTW Multi 3420, 德国)和便携式叶绿素检测仪(Amiscience Fluor Quick, 美国)进行现场检测;总氮(TN)、总磷(TP)、总有机碳(TOC)、氨氮(NH4+-N)等参数的检测在实验室中进行, 检测方法参照《生活饮用水标准检验方法》(GB 5750—2006)和《水和废水监测分析方法》(2002).
2.3 微生物安全相关指标测定 2.3.1 平板计数法菌落总数测定采用异养菌平板计数法(HPC), 水样用0.9%无菌生理盐水梯度稀释, 取100 μL涂布于培养基上, 进行菌落计数.所用培养基分别为NA(37 ℃, 2 d)和R2A(28 ℃, 5 d).采用滤膜法对总大肠菌群、耐热大肠菌群、大肠埃希氏菌、病原微生物进行检测.分别过滤10、50、100 mL水, 取滤膜贴附于选择性培养基上培养, 对可疑病原菌落进行后续PCR鉴定.每个平板设置3个平行, 有效计数区间为30~300个菌落.
2.3.2 可疑菌落PCR鉴定对可疑菌落分离纯化培养后, 挑取单菌落裂解, 然后取上清液作模板进行PCR扩增.正向引物27F:5′-AGAGTTTGATCMT GGCTCAG-3′;反向引物1492R:5′-TACGGTTA CCTTGTTACGACTT-3′.采用50 μL的PCR体系:25 μL 2×SuperMix, 10 μmol · L-1引物各2 μL, 1 μL模板DNA.PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1 min, 循环30次;72 ℃延伸10 min;4 ℃保存.用1%的琼脂糖凝胶电泳检测产物质量.PCR产物的纯化与测序由厦门铂瑞公司完成.根据测序结果, 确定可疑菌落种属.
2.3.3 生物稳定性指标检测方法采用静态培养法检测水体的生物稳定性.以靠近人类居住的岸边水样(细菌含量较多)中的土著微生物为接种液来源, 采用2 μm滤膜过滤后于180 r · min-1、20~25 ℃下培养5 d, 使细菌数量稳定, 即可得到接种液.接种液与水样体积比为1 : 100, 接种后的水样在20 ℃下培养5 d, 采用R2A培养基计数, 以细菌含量表示水样中的有机物支持细菌再生长的潜力(BGP).以土著菌接种后于20 ℃下培养3 d, 测定培养前后水样DOC, 并计算DOC差值, 即为BDOC3.研究表明, BDOC3可代替BDOC28, 占整个BDOC值的40%左右(刘文君等, 1999).
2.3.4 DNA提取、高通量测序和分析采用0.22 μm微孔滤膜过滤3~4 L水样, 使用试剂盒Fast DNA SPIN® Kit for soil(Bio101 Inc., USA)提取总DNA, 采用微量分光光度计检测DNA浓度.提取的基因组DNA置于-80 ℃冰箱中保存备用.
选用正向引物515F(5′-GTGCCAGCMGCCGC GGTAA-3′)和反向引物907R (5′-CCGTCAATTCC TTTGAGTTT-3′)对16S rRNA基因片段中的V4~V5区域进行扩增.采用30 μL的PCR体系:15 μL PCR Master Mix, 0.2 μmol · L-1引物, 约10 ng基因组DNA.PCR反应程序:98 ℃预变性1 min;98 ℃变性10 s, 50 ℃退火30 s, 72 ℃延伸30 s, 循环30次;72 ℃延伸5 min.
采用IonS5TMXL测序平台对PCR产物进行测序.对原始序列经拼接、过滤处理后得到优化序列.利用UPARSE软件对相似达97%的序列进行OUT聚类(Edgar, 2013), 得到不同水平上的微生物群落组成.使用Qiime软件计算α-多样性, 如Chao1、Shannon、Simpson指数.
3 结果和讨论(Results and discussion) 3.1 水体理化指标时空特征由图 2可知, 千岛湖水体属地表水Ⅱ~Ⅲ类水(TN除外), 所有水样均未检测到铁、锰.pH高值(8.17)出现在夏季, 这是因为藻类会消耗水中的CO2, 打破溶解平衡, 使水体呈弱碱性.夏季叶绿素a含量最高, 为0.9~1.4 μg · L-1, 水体富营养化程度低.
 |
| 图 2 千岛湖取水口各采样水层水体理化指标 Fig. 2 Environmental variables of water samples in Qiandao Lake |
TN(0.71~1.27 mg · L-1)、TP(0.02~0.13 mg · L-1)、TOC(1.05~2.04 mg · L-1)的变化趋于一致, 随深度的增加而降低.但TN和TP在底层偏高, 可能是由于底泥氮、磷的溶解释放所致(Conley et al., 2009).营养盐浓度出现季节性变化, TN、TP浓度高值出现在冬季, NH4+-N浓度高值出现在秋季(0.21~0.23 mg · L-1), 这与笪文怡等(2019)的研究相似.
由图 2e可知, 千岛湖BDOC普遍较低(0.10~0.44 mg · L-1), 大体随深度增加而下降.冬季取水口0.5 m深度处的BDOC偏高(1.38 mg · L-1), 可能是由于采样前降雨, 地表径流冲刷土壤使有机物增多.研究表明, 水厂常规处理工艺的BDOC平均去除率为30%, 生物活性炭滤池的去除率可达45%(李发站等, 2011; So et al., 2017).经水厂处理后, BDOC可以满足生物稳定性的要求.
由图 2j可知, BGP无明显垂向差异, 在4.4×104~3.4×105 CFU · mL-1范围内波动.Zhang等(2016)研究表明, BGP低于2.7×105 CFU · mL-1可以限制异养细菌的再生.综上可知, 千岛湖水体的营养物质(碳、磷、氮)含量低, 支持微生物再生长潜势小.
3.2 菌落总数与指示微生物不同季节千岛湖水样的菌落总数和指示微生物数量如表 1所示.全年NA培养基检出菌落数为3.3×101~8.0×102 CFU · mL-1, R2A培养基检出菌落数为1.3×102~3.3×103 CFU · mL-1.NA培养基的菌落检出量占R2A的2%~47%, 平均占比为27%, 这是由于R2A培养基提供的营养成分较为多样且营养程度高, 更适合水源水贫营养环境中细菌的生长.菌落总数(R2A培养基)呈现冬季>夏季>秋季, 可能原因为:①冬季采样前降雨, 降雨后菌落总数会增加1个数量级(商君阳等, 2016);②浮游细菌对原位温度的季节性变化具有适应性(Hall et al., 2009), 冬季的营养含量(TN、TP)较高, 成为驱动细菌生长的主要因素.考虑到水质整体为5~10 m深度处最优, 取水口5~10 m深度处菌落总数(R2A培养基)夏季较高, 因此, 水厂需在夏季加强对微生物的检测和控制.此外, 千岛湖菌落总数远低于杭州市现有水源水如钱塘江的1.2×106~4.2×106 CFU · mL-1(史雯沁等, 2016).
| 表 1 不同季节千岛湖菌落总数和指示微生物数量 Table 1 The total culturable bacteria and indicator bacteria counts in different seasons |
如表 1所示, 夏季和冬季取水口5~10 m深度处未检出耐热大肠菌群、大肠埃希氏菌, 秋季有少量检出.岸边表层水体指示微生物检出较多, 表明人类活动越频繁, 微生物风险越高.钱塘江杭州段、贴沙河等5个水源地总大肠菌群数量为2×102~1.4×104 MPN · L-1(史雯沁等, 2016), 千岛湖指示微生物数量较现有水源低1~2个数量级.吕萍萍(2017)研究表明, 感染性腹泻、伤寒和戊肝发病率与菌落总数和指示微生物数量相关.由此可知, 千岛湖水源相对于现有水源(钱塘江)在介水传播疾病方面更具安全性.
3.3 群落结构分析夏季微生物的多样性最高, 而且氯的残留量降低, 潜在的微生物风险变高(沈烽等, 2017), 因此, 需重点关注夏季微生物群落.由表 2可知, 直观检测到的物种数目(OTUs)呈现出10 m处> 5 m处> 0.5 m处.OTUs深层高于表层的可能原因为:深层营养物质含量较低, 贫营养条件更有利于低丰度细菌的生存(Wan et al., 2019).由Chao1指数的上升趋势也可以看出, 低丰度细菌的物种数有所增加, 导致细菌多样性上升, 均匀度下降.
| 表 2 各采样水层的生物多样性指数 Table 2 Diversity index of water samples |
门水平上, 群落结构无明显垂向变化(图 3a).放线菌门(Actinobacteria)、变形菌门(Proteobacteria)为主要优势类群, 拟杆菌门(Bacteroidetes)、产氧光细菌(Oxyphotobacteria)、浮霉菌门(Planctomycetes)和疣微菌门(Verrucomicrobia)次之, 这与东湖、丹江口水库、碧流河水库的群落结构相似(赵文等, 2018; Ji et al., 2019).变形菌门占比相对较高, 岸边表层水体、取样口0.5、5、10 m深度处水体中的相对丰度分别为42.2%、36.0%、41.3%、27.0%.放线菌门是水体中与嗅味相关的细菌类群(Jensen et al., 1994), 岸边表层水体、取样口0.5、5、10 m深度处水体中的相对丰度分别为36.1%、30.4%、27.2%、46.6%.
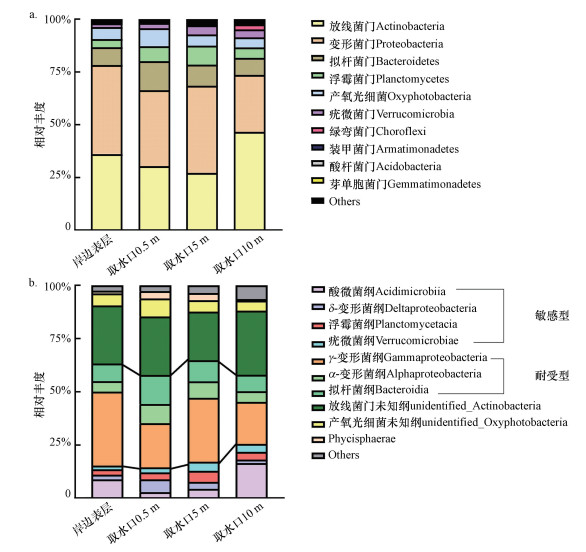 |
| 图 3 水源水样品群落结构组成 (a.门水平, b.纲水平) Fig. 3 Bacterial community composition at phylum(a), class(b) level |
Han等(2020)总结了饮用水处理和输送过程中细菌丰度的变化, 认为水源水能够影响龙头水微生物群落结构, 并提出敏感型和耐受型类群的划分.本研究中的敏感型类群包括Acidmicrobiae、δ-Proteobacteri、Planctomycetacia和Verrucomicrobiae;耐受型类群包括α-Proteobacteria、γ-Proteobacteria和Bacteroidia.敏感型和耐受型类群分布情况如图 3b所示, 取水口0.5、5、10 m深度处样品中敏感型类群的相对丰度分别为14.49%、17.13%、25.44%, 耐受型类群的相对丰度分别为43.37%、47.66%、32.56%.
Han等(2020)对46个城市的供水系统进行研究, 结果显示, 耐受型类群的相对丰度从84.99%(水源水)增至98.09%(龙头水).而千岛湖耐受型类群的平均占比为42.89%, 明显低于84.99%, 说明影响居民龙头水细菌群落的能力小, 切换水源后微生物失稳导致变色和生物膜脱落的可能性小.并且耐受型/敏感型比值随深度的增加而下降, 说明对龙头水细菌群落的潜在不利影响下降.水厂可适当调整消毒剂投加量, 通过保护水源来控制龙头水细菌群落, 保障用户用水安全.
3.4 病原微生物如表 3所示, 志贺氏菌、沙门氏菌均未检出, 夏季和秋季取水口检出少量铜绿假单胞菌.目前只有瓶装饮用水规定每250 mL不得检出铜绿假单胞菌.但该菌在水源中确实存在, 且平板法严重低估了其数量, 需加强对铜绿假单胞菌的检测.
| 表 3 不同季节典型病原微生物数量 Table 3 Typical pathogenic bacterial counts in different seasons |
如图 4所示, 病原微生物相关属包括黄杆菌属(Flavobacterium)、螺杆菌属(Helicobacter)和军团菌属(Legionella), 相对丰度均低于0.2%, 发生介水传播疾病的风险低.Chiao等(2014)和Jia等(2015)的研究证实, 黄杆菌属、军团菌属和铜绿假单胞菌对氯具有耐受性, 可能在管网中获得竞争优势, 实现再生长, 从而危及用户用水安全.
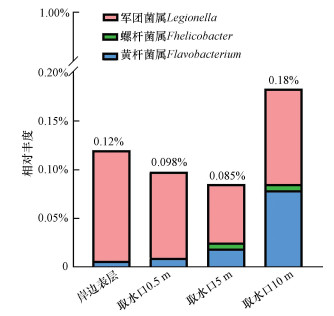 |
| 图 4 水源水样品病原微生物相关属的相对丰度 Fig. 4 Relative abundance of potential opportunistic pathogen at genus level |
1) 千岛湖取水口水体属于地表水Ⅱ~Ⅲ类水, 富营养化程度低.营养盐和BDOC垂向差异明显, 支持微生物生长的潜力小.菌落总数和指示微生物数量比杭州市现有水源水低1~2个数量级.
2) 夏季千岛湖各层水体微生物群落结构差异不大, 优势类群为放线菌门和变形菌门.取水口0.5、5、10 m深度处样品中耐受型类群的相对丰度分别为43.37%、47.66%、32.56%, 且耐受型类群占比随深度增加而下降, 对龙头水细菌群落的潜在不利影响下降.病原微生物相关属的总相对丰度低于0.2%, 发生介水传播疾病的概率极低.
3) 取水口5~10 m深度处的水体微生物安全性要优于0~5 m深度处, 建议取较深层的水体.
4) 水厂可加强对铜绿假单胞菌的检测.鉴于千岛湖水源水处于低微生物风险状态, 可通过调整工艺如减少消毒剂投加量来处理千岛湖新水源.
Chiao T H, Clancy T M, Pinto A, et al. 2014. Differential resistance of drinking water bacterial populations to monochloramine disinfection[J]. Environmental Science & Technology, 48(7): 4038-4047. |
Conley D J, Paerl H W, Howarth R W, et al. 2009. Ecology controlling eutrophication:nitrogen and phosphorus[J]. Science, 323(5917): 1014-1015. DOI:10.1126/science.1167755 |
笪文怡, 黎云祥, 朱广伟, 等. 2019. 水文气象过程对千岛湖氮磷变化的影响[J]. 水生态学杂志, 40(5): 9-19. |
Diana M, Felipe-Sotelo M, Bond T. 2019. Disinfection byproducts potentially responsible for the association between chlorinated drinking water and bladder cancer:A review[J]. Water Research, 162: 492-504. DOI:10.1016/j.watres.2019.07.014 |
Edgar R C. 2013. UPARSE:highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
国家环境保护总局《水和废水监测分析方法》编委会. 2002. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境科学出版社.
|
Han Z M, An W, Yang M, et al. 2020. Assessing the impact of source water on tap water bacterial communities in 46 drinking water supply systems in China[J]. Water Research, 172: 11. |
Hall E K, Dzialowski A R, Stoxen S M, et al. 2009. The effect of temperature on the coupling between phosphorus and growth in lacustrine bacterioplankton communities[J]. Limnology and Oceanography, 54(3): 880-889. DOI:10.4319/lo.2009.54.3.0880 |
Jensen S E, Anders C L, Goatcher L J, et al. 1994. Actinomycetes as a factor in odor problems affecting drinking-water from the north saskatchewan river[J]. Water Research, 28(6): 1393-1401. DOI:10.1016/0043-1354(94)90306-9 |
Ji B, Liang J C, Ma Y Q, et al. 2019. Bacterial community and eutrophic index analysis of the East Lake[J]. Environmental Pollution, 252: 682-688. DOI:10.1016/j.envpol.2019.05.138 |
Jia S, Shi P, Hu Q, et al. 2015. Bacterial community shift drives antibiotic resistance promotion during drinking water chlorination[J]. Environmental Science & Technology, 49(20): 12271-12279. |
李发站, 吕锡武, 朱晓超. 2011. 生物稳定性及生物稳定水制备工艺研究[J]. 水处理技术, 37(2): 59-64+68. |
刘孔英. 2013. 杭州城市水源地选择研究[J]. 中国水能及电气化, (4): 20-23+40. DOI:10.3969/j.issn.1673-8241.2013.04.006 |
刘文君, 吴红伟, 王占生, 等. 1999. 饮用水中BDOC测定动力学研究[J]. 环境科学, 20(4): 21-24. |
吕萍萍.2017.饮用水微生物指标与介水传染病相关性研究[D].北京: 中国疾病预防控制中心.13-41
|
曲良娇.2016.某省饮用水微生物安全状况与风险评估[D].武汉: 华中科技大学.10-12
|
商君阳, 周霜艳, 王中华, 等. 2016. 降雨对秦皇岛西浴场细菌总数和可培养菌群组成的影响[J]. 微生物学通报, 43(6): 1227-1234. |
沈烽, 赵大勇, 黄睿, 等. 2017. 南京玄武湖浮游细菌群落结构的季节变化及其与环境因子的关系[J]. 湖泊科学, 29(3): 662-669. |
史雯沁, 张仲阳, 钟丽珏, 等. 2016. 杭州市水源微生物及相关理化指标状况调查[J]. 中国卫生检验杂志, 26(4): 585-586+608. |
So S H, Choi I H, Kim H C, et al. 2017. Seasonally related effects on natural organic matter characteristics from source to tap in Korea[J]. Science of the Total Environment, 592: 584-592. DOI:10.1016/j.scitotenv.2017.03.063 |
孙媛媛.2014.预氯化对溴代消毒副产物的影响研究[D].天津: 天津大学.2-5
|
Wan K, Zhang M L, Ye C S, et al. 2019. Organic carbon:An overlooked factor that determines the antibiotic resistance in drinking water sand filter biofilm[J]. Environment International, 125: 117-124. DOI:10.1016/j.envint.2019.01.054 |
相晨, 严力蛟, 韩轶才, 等. 2019. 千岛湖生态系统服务价值评估[J]. 应用生态学报, 30(11): 3875-3884. |
叶林, 于鑫, 施旭, 等. 2007. 用细菌生长潜力(BGP)评价饮用水生物稳定性[J]. 给水排水, 33(11): 146-149. DOI:10.3969/j.issn.1002-8471.2007.11.042 |
俞焰, 刘德富, 杨正健, 等. 2017. 千岛湖溶解氧与浮游植物垂向分层特征及其影响因素[J]. 环境科学, 38(4): 1393-1402. |
Zhang J P, Li W Y, Wang F, et al. 2016. Exploring the biological stability situation of a full scale water distribution system in south China by three biological stability evaluation methods[J]. Chemosphere, 161: 43-52. DOI:10.1016/j.chemosphere.2016.06.099 |
赵文, 魏杰. 2018. 我国饮用水源水库微生物多样性研究述评[J]. 微生物学杂志, 38(4): 1-10. DOI:10.3969/j.issn.1005-7021.2018.04.001 |
中国疾病预防控制中心环境与健康相关产品安全所.2006.GB/T 5750-2006生活饮用水标准检验方法[S].北京: 中华人民共和国卫生部
|
周静.2013.千岛湖浮游生物16S(18S)rDNA指纹图谱分析及与环境因子的关系[D].上海: 上海海洋大学.11-19
|
 2021, Vol. 41
2021, Vol. 41


