纳米材料是指三维空间中至少有一维尺寸在1~100 nm或由它们为基本单元构成的材料, 目前已被广泛应用于工业和农业生产中.纳米材料在工业上可以通过生产、运输、使用和废弃的过程进入环境, 农业生产中纳米材料被用于杀虫剂递送、基因植物转化、生物杀虫剂、肥料及高活性农药的载体而进入环境.因此, 对于金属纳米材料的环境风险应给予高度关注.含铜(Cu)材料在农业中被用作杀菌剂、除草剂和肥料, 研究显示, 全球农药需求量达到66万t·a-1, 而绝大部分为含Cu农药(Keller et al., 2017).传统含铜杀菌剂如波尔多剂等, 由于其含铜量高但活性较低, 过多使用会造成植物毒性(Giannousi et al., 2013).近年来, 新型含铜农药和杀菌剂如氧化铜纳米颗粒(CuO NPs)被广泛运用(Tegenaw et al., 2015);此外, CuO NPs还被用于肥料及缓解植物干旱胁迫(Monreal et al., 2016;Yang et al., 2018).因此, 在农业生产中CuO NPs通过使用或意外泄露及随农田污水灌溉进入农田土壤, 从而对农田生态环境产生影响.研究显示, CuO NPs进入农田土壤后会改变土壤pH、Eh, 加速土壤有机质的降解或矿化(徐辰, 2016).CuO NPs还能促进纤维素降解菌生长并为铁还原菌提供碳源, 进而巩固铁还原菌成为优势菌种(Xu et al., 2015; Shi et al., 2018).此外, CuO NPs具有的“纳米效应”(Nano-effect)使其可以充当微生物与矿物质之间的电子供体或者电子传递导体, 通过提高微生物与矿物质之间的电子传递效率, 从而提高微生物胞外呼吸的效率, 促进矿物表面的氧化或还原过程(Kaweeteerawat et al., 2015).
砷(As)是一种广泛存在于环境中的有害类金属元素, 地壳运动和人为活动会使As进入农田土壤, 尤其是含As的畜牧粪肥的使用会加剧土壤As污染(邹丽娜, 2018).农田土壤中的As积累于作物体内, 并通过食物链传递危害人体健康(Gong et al., 2020).CuO NPs通过各种方式进入As污染农田中后可能会影响土壤中As的生物有效性.研究发现, 由于CuO NPs的高比表面积特性, 可以吸附水中的As(Ⅲ)(Razmara, 2018);被吸附的As(Ⅲ)可以在CuO NPs表面直接通过Cu(Ⅱ)和As(Ⅲ)间的电子传递或通过水中活性氧(ROS)被氧化成As(Ⅴ)(Zeng et al., 2018).同时, As的地球化学行为与铁(Fe)密切相关, 矿石中的As主要以砷黄铁矿、砷铁矿等含铁矿物的形式存在.含铁矿物被认为是有效的氧化土壤As(Ⅲ)的材料, 如在还原条件下, Fe2+与针铁矿共存时可通过活性铁(Ⅲ)中间体或次生铁矿物氧化As(Ⅲ)(Amstaetter et al., 2010), 但在铁化合物表面的氧化还原反应受到土壤环境的影响, 如氧化还原环境(Qiao et al., 2018)和土壤pH(Wu et al., 2019).此外, 土壤有机质(SOM)一方面利于腐殖质官能团对As进行吸附, 另一方面作为电子传递介质使电子从微生物传递到Fe(Ⅲ)矿物上, 促进了Fe(Ⅲ)和As(Ⅴ)的还原(Chen et al., 2017).而CuO NPs对土壤可溶性有机质的提高作用可能会促进As的生物有效性.
综上, CuO NPs在As污染农田土壤中的应用可能改变土壤环境因子, 而对As有效性的影响一方面可能通过吸附而减少As的生物有效性, 另一方面可能因土壤环境因子的变化而影响As的有效性.现有报道中有关CuO NPs对土壤环境因子与砷生物有效性的影响研究还较少.因此, 本研究选择两种不同类型土壤(安徽宿松黄棕壤和黑龙江海伦黑土), 探究CuO NPs进入土壤后对土壤环境因子和土壤中As有效性的影响, 以期为发展和明确CuO NPs在As污染农田中的实际应用和生态效应提供可靠的理论依据.
2 材料与方法(Materials and methods) 2.1 供试土壤供试土壤为安徽宿松黄棕壤(118°57′E, 30°45′N)和黑龙江海伦黑土(126°55′E, 46°40′N).土壤自然风干, 过100目筛后测定土壤基本理化性质(表 1).采用酸消解法(Shi et al., 2018)测定土壤中As、Fe和Cu的含量.
| 表 1 供试土壤基本理化性质 Table 1 Physical chemical properties of tested soil |
分别取两种土壤1.5 kg, 以NaAsO形式外源添加100 mg·kg-1 As, 混匀后备用.称取50 g混匀后的污染土壤于150 mL烧杯中, 淹水7 d后自然落干.称取1 g CuO NPs于1 L容量瓶, 加水定容后水浴超声30 min, 配制成1000 mg·L-1的CuO NPs母液.取CuO NPs母液, 配制100 mL不同梯度CuO NPs悬浮液, 加入装有污染土壤的烧杯内, 记录液面位置.CuO NPs处理设置3个梯度, 分别为0、100、1000 mg·kg-1.试验分为两个试验组, 宿松黄棕壤记为L组, 海伦黑土记为H组, 根据添加CuO NPs的浓度分为L0、L100、L1000和H0、H100、H1000共6个处理, 每个处理15个重复, 放置于人工气候室培养90 d, 温度为28 ℃, 光照强度为150 μmol·m-2·s-1, 光照时间为12 h·d-1, 水分管理为0~70 d淹水, 每2 d用去离子水补充水分损失, 70 d后落干.
2.3 采样及样品测定 2.3.1 土壤Fe(Ⅱ)含量在培养第0(12 h)、10、40、70、90 d进行破坏性采样.为保证取样具有代表性, 将烧杯内土壤混匀后取0.5 g鲜土于50 mL离心管中, 加入5 mL 0.5 mol·L-1 HCl溶液, 30 ℃下浸提24 h, 然后在2000 g下离心5 min.取1 mL上清液于25 mL比色管, 加入5 mL乙酸钠缓冲液和5 mL 0.1%的邻菲罗啉, 显色30 min后摇匀并于510 nm波长下测定吸光度.
2.3.2 土壤浸出液中铜和砷总量采用低速离心法(Xu et al., 2019)分离土壤和土壤浸出液, 其中, 土壤浸出液过0.22 μm滤器后用电感耦合等离子体质谱(ICP-MS)测定浸出液中As和Cu总量.
2.3.3 土壤有效态铜和有效态砷提取及测定采用EDTA和CaCl2提取态Cu来表征土壤中Cu的有效性.土壤于-4 ℃冷冻过夜后冷冻干燥, 准确称取冷干土壤2 g于50 mL离心管, 加入10 mL 0.01 mol·L-1 CaCl2提取液, 20 ℃下120 r·min-1振荡2 h, 4000 g离心后取上清液测定Cu含量.准确称取2 g冷干土壤于50 mL离心管, 加入10 mL 0.05 mol·L-1 EDTA提取液, 20 ℃下120 r·min-1振荡0.5 h, 4000 g离心后取上清液测定Cu含量.准确称取冷干土壤1 g于50 mL离心管, 加入25 mL 0.05 mol·L-1 NH4H2PO4, 20 ℃下120 r·min-1振荡16 h, 4000 g离心后取上清液测定As含量.
2.4 数据分析采用Excel 2010软件进行数据处理, SPSS 17.0软件进行相关性分析、单因素方差分析, 利用Origin 8.5做图.
3 结果与讨论(Results and discussion) 3.1 CuO NPs对土壤浸出液中Cu和As总量的影响不同类型土壤浸出液中Cu和As的总量测定结果如图 1所示.结果表明, 添加CuO NPs处理下土壤浸出液中Cu的含量在12 h时明显高于不添加组, 说明CuO NPs进入土壤后快速溶解产生Cu2+, 且Cu含量随着添加的CuO NPs浓度和培养时间的增加而增加.试验还发现CuO NPs在黄棕壤中的溶解更剧烈, 而在黑土中则较平稳.研究显示, 土壤有机质决定CuO NPs的溶解量, 而土壤pH影响CuO NPs的溶液速率常数(Gao et al., 2019).土壤浸出液中的As含量在淹水后提高, 但随着培养时间增加而逐渐降低.与不添加CuO NPs处理相比, 添加100 mg·kg-1 CuO NPs后两种土壤中0~10 d浸出液中As含量降低51.0%~66.6%, 添加高浓度CuO NPs处理下As含量降低了53.0%~82.5%.研究发现, CuO NPs可能通过形成内层络合物而在水中吸附砷酸盐, 降低As含量(Momeni et al., 2019).随着CuO NPs逐渐溶解, As含量逐渐提高.与黄棕壤相比, 40 d时黑土浸出液中As的含量仍然低于H0处理下的As含量, 表明CuO NPs对黑土浸出液中As的抑制作用时间更长.
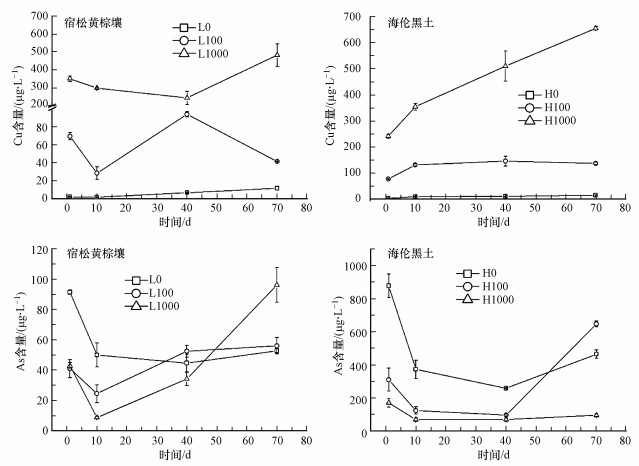 |
| 图 1 CuO NPs对土壤浸出液中Cu和As含量的影响 Fig. 1 Effects of CuO NPs on Cu and As concentrations in soil solution |
如图 2所示, 黄棕壤土壤pH值随着淹水时间的增加在10 d内急速提高, 而黑土pH随培养时间增加逐渐提高, 两种土壤在淹水期间均保持较高的土壤pH.添加CuO NPs在12 h内对两种土壤pH无显著影响, 但添加1000 mg·kg-1 CuO NPs时, 第10 d时黄棕壤和第10~70 d时黑土的pH降低.Liu等(2019)的研究也发现, 加入CuO NPs后土壤pH均有不同程度的降低.本研究结果发现, 在第0 d(12 h)时土壤浸出液Cu含量提高, 表明存在CuO NPs的溶解, 但此时的土壤pH并未显著提高, 因此认为土壤pH值变化并不是完全归因于CuO NPs的溶解.研究显示, CuO NPs在水溶液中Zeta电位为负值时pH升高, 而CuO NPs表面电荷接近零时则NPs趋向于团聚(Qiu et al., 2020).CuO NPs的团聚受到添加的CuO NPs浓度和有机质的影响.有机质对NPs的团聚效应受到离子强度的影响, 当离子强度低于临界聚沉浓度时有机酸的添加造成的空间位阻才会抑制NPs的团聚, 而离子强度高于临界聚沉浓度时有机酸会促进NPs的团聚(Zhu et al., 2014).因此, 在黄棕壤中高浓度CuO NPs的添加及黑土中较高的有机质含量均促进了CuO NPs的团聚.在黑土中CuO NPs更倾向于团聚且表面电荷更接近零可能是CuO NPs减缓pH升高的原因.
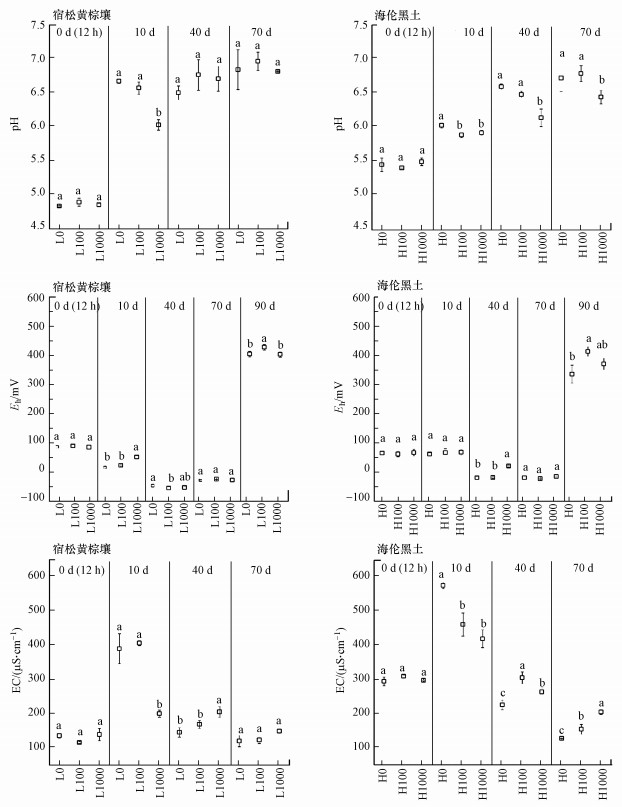 |
| 图 2 CuO NPs对不同类型土壤环境的影响 (图中不同小写字母表示同一时间下不同处理间差异显著, p < 0.05, 下同) Fig. 2 Effects of CuO NPs on pH, Eh and EC in different types of soil |
淹水条件下, 土壤氧气被好氧菌消耗, 因此, 土壤Eh随着淹水时间的增加而逐渐降低, 90 d落干时提高.添加CuO NPs可提高第10 d和第90 d时黄棕壤的土壤Eh, 但降低第40 d时的土壤Eh;CuO NPs提高了第40 d和第90 d时黑土的土壤Eh.Frenk等(2013)研究发现, 灭菌土壤添加CuO NPs后土壤Eh值上升, 表明土壤Eh值受生物和化学共同作用.本研究中淹水前期加入CuO NPs后和落干后微生物活动均受到抑制, 土壤氧气消耗速度降低, 落干后氧气充足, 造成土壤Eh值升高.
土壤浸出液中以离子形态存在的盐的总和可以用土壤电导率(EC)表示, 电导率越高, 土壤浸出液中离子含量越高.本研究结果表明, 土壤中的离子在0~10 d时由于水分加入而大量溶出, 土壤EC逐渐提高.随着土壤中的离子逐渐达到动态平衡, 第70 d时土壤EC低于第0 d.添加CuO NPs在培养第10 d时显著降低了土壤EC, 土壤溶液中的Cu2+在第10 d时也降低, 这可能是因为CuO NPs溶解出的Cu2+与土壤中的有机质、铁锰矿物结合从而降低土壤EC(Waalewijn-Kool et al., 2013).此外, CuO NPs的高比表面积特性(Qiu et al., 2020), 也可能使土壤中的离子被吸附而降低土壤EC.随着淹水时间增加和Cu2+的溶出, 在第40 d时CuO NPs处理显著提高了土壤EC.此外, 在第70 d时CuO NPs仍能显著提高黑土EC, 但对黄棕壤EC无显著影响, 表现出CuO NPs在黑土中作用时间更长.
3.3 CuO NPs在土壤中的有效性CaCl2提取态金属可以用来表征土壤重金属的可移动性, EDTA提取态则用于表征土壤中被生物利用的重金属(Brun et al., 2001).向不同类型土壤中加入CuO NPs均提高了土壤中有效态Cu的含量, 且随着添加浓度增加而提高(图 3).黄棕壤中添加100 mg·kg-1 CuO NPs后, CaCl2-Cu含量在0~10 d时升高, 10 d后随时间增加而逐渐降低, 而EDTA-Cu含量在0~40 d逐渐提高, 表明CuO NPs在0~10 d溶解后可能大部分以离子形态存在或被吸附于矿物表面.前期的研究发现, CuO NPs在浙江粉砂壤水稻土中淹水前期以CuO、针铁矿吸附态Cu和CuS形态存在, 随着淹水时间增加和落干, 土壤中Cu被还原或与有机质结合(徐辰, 2016).在黑土中, CaCl2-Cu含量在0~40 d逐渐升高, 而落干使其显著降低, EDTA-Cu含量则随着培养时间增加而逐渐提高.结果表明, 在黑土中Cu可能逐渐从可迁移态Cu向有机结合态Cu转变, 且不受到土壤落干的影响.前期研究也发现, 在黑龙江粉砂壤土中加入CuO NPs, 淹水后期和落干后胡敏酸结合态Cu分别占总量的64.1%和43.7%(Shi et al., 2018).添加CuO NPs后可迁移态Cu随培养时间增加逐渐向植物可利用态Cu转变, 而在黄棕壤中Cu的迁移性更大, 黑土中植物可利用态Cu含量更高.
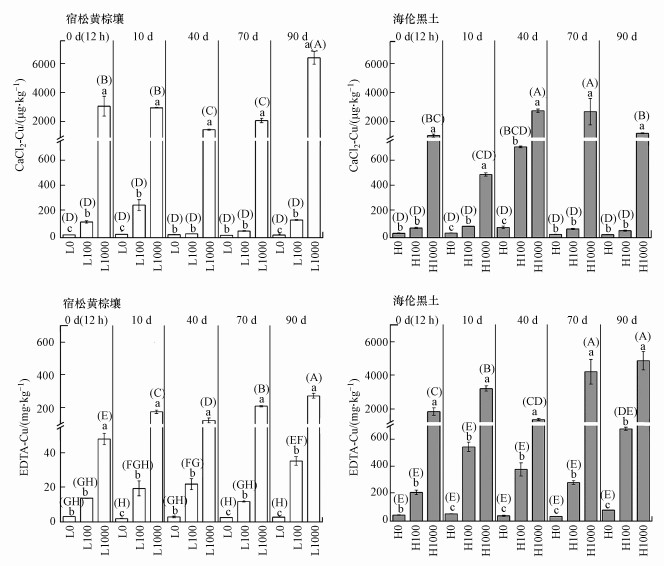 |
| 图 3 不同类型土壤中有效态Cu含量 Fig. 3 Concentrations of Cu extracted by CaCl2 and EDTA in different types of soil |
以0.05 mol·L-1 NH4H2PO4溶液提取的土壤As常被用来表征土壤As的生物有效性, 且可用于预测植物对As的吸收(Liu et al., 2015; Yu et al., 2017). 如图 4所示, 在添加CuO NPs后的12 h时, 两种土壤中NH4H2PO4-As含量均有不同程度下降, 黄棕壤和黑土中有效态As含量分别降低了15.4%~15.7%和13.4%~66.5%.研究显示, 随着土壤pH的提高和Eh的降低, 土壤As有效性呈指数增加(Shen et al., 2020). 而本研究中, pH和Eh在第0 d时无显著变化.因此, 有效态As含量的降低与CuO NPs对As吸附有关(Lata et al., 2016).随着培养时间的增加, 在第10 d后CuO NPs对黄棕壤中土壤As有效性的影响逐渐减弱.虽然CuO NPs可降低黑土pH, 提高Eh, 但CuO NPs在40 d后对As有效性无显著影响.而在第70 d和90 d时的宿松黄棕壤中, 添加1000 mg·kg-1 CuO NPs可降低9.34%~21.00%的有效态As含量.造成CuO NPs对As有效性效果差异的原因可能与CuO NPs在黑土中的团聚有关.Cu2+可以氧化As(Ⅲ), 产生Cu(Ⅰ)和As(Ⅴ)并降低植物As(Ⅲ)积累, CuO NPs则可能与As形成复合物从而降低As的有效性(Wang et al., 2019).CuO NPs在黑土中较低的溶解速率和CuO NPs表面反应位点的不断减少可能是造成As有效性变化不显著的原因.因此, CuO NPs在黑土中可能主要吸附土壤溶液中的可溶性As, 而在黄棕壤中CuO NPs较高的溶解速率使得培养后期仍然显著降低了土壤有效态As的含量.
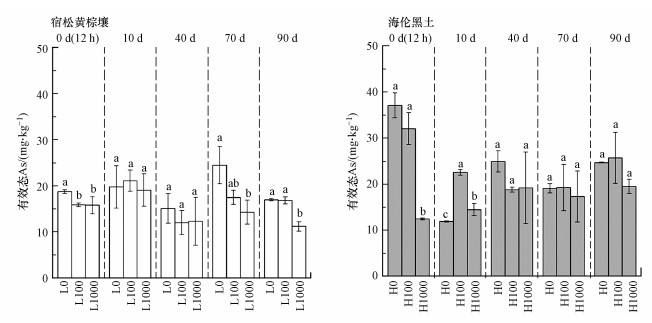 |
| 图 4 CuO NPs对土壤As有效性的影响 Fig. 4 Effects of CuO NPs on available As in different types of soil |
铁是土壤中的大量元素, 也是土壤环境中多种氧化还原反应的反应物.土壤中的铁通过还原微生物作用, 将Fe(Ⅲ)作为电子受体还原生成Fe(Ⅱ).土壤中As的氧化还原与Fe的氧化还原密切相关, 淹水土壤中还原微生物电子传递会提高Fe(Ⅲ)和As(Ⅴ)的还原(Chen et al., 2019).试验发现, CuO NPs在淹水时期(0~70 d)可降低土壤中Fe(Ⅱ)含量, 这可能与CuO NPs对土壤微生物的毒性从而降低了还原菌的生物活性有关(徐辰, 2006).而在落干时期, CuO NPs却显著提高了土壤Fe(Ⅱ)含量, 这可能与CuO NPs的“纳米效应”有关.在落干时期微生物作用减弱, CuO NPs溶解降低且可以充当电子导体实现远距离的胞外电子传递(Feng et al., 2016), 从而促进土壤中Fe(Ⅲ)的还原.在本试验中, CuO NPs对两种土壤中Fe(Ⅱ)含量的影响基本一致, 表明土壤中Fe的氧化还原除了受到淹水-落干环境的影响外, 微生物介导下的氧化还原是最重要的Fe氧化还原途径.
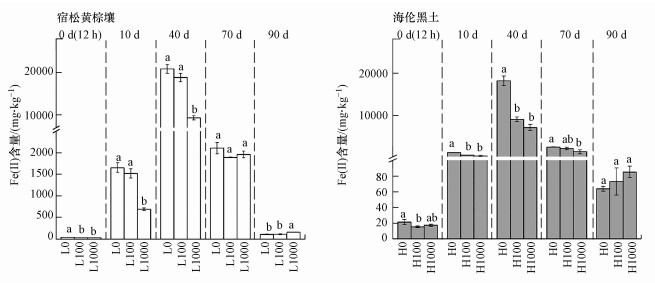 |
| 图 5 CuO NPs对土壤Fe(Ⅱ)含量的影响 Fig. 5 Effects of CuO NPs on Fe(Ⅱ) concentrations in different types of soil |
CuO NPs进入土壤后12 h内快速溶解产生Cu2+, 且在黄棕壤中的溶解更剧烈, 而在黑土中则较平稳.CuO NPs在短时间内可降低土壤pH, 提高土壤Eh, 降低土壤EC, 但随着培养时间增加和土壤落干, 土壤EC和Eh提高.CuO NPs对黑土土壤环境的影响时间较黄棕壤长.CuO NPs促进了Cu随培养时间增加逐渐向植物可利用态Cu的转变, 且在黄棕壤中Cu的迁移性更大, 黑土中植物可利用态Cu含量更高.添加CuO NPs后的0~10 d两种土壤中可溶性As含量降低了51.0%~82.5%, 且黑土中的降低效果更强.添加CuO NPs分别降低了黄棕壤和黑土中15.7%和66.5% 的NH4H2PO4提取态As含量, 且在黄棕壤中的降低效应持续时间更长.CuO NPs在两种土壤中均可减少淹水时Fe(Ⅱ)的还原.总之, CuO NPs在黄棕壤中具有急速效应, 使环境因子变化较快;而CuO NPs在黑土中更倾向于团聚, 使其对土壤环境和抑制可溶性As的效应时间较长, 且在土壤落干时期产生一定的“纳米效应”.
Amstaetter K, Borch T, Larese-Casanova P, et al. 2010. Redox transformation of arsenic by Fe(Ⅱ)-activated goethite (alpha-FeOOH)[J]. Environmental Science & Technology, 44: 102-108. |
Brun L A, Maillet J, Hinsinger P, et al. 2001. Evaluation of copper availability to plants in copper-contaminated vineyard soils[J]. Environmental Pollution, 111: 293-302. DOI:10.1016/S0269-7491(00)00067-1 |
Chen Z, Liu Y, Zhang C K, et al. 2019. Titanium dioxide nanoparticles induced an enhanced and intimately coupled photoelectrochemical-microbial reductive dissolution of As(Ⅴ) and Fe(Ⅲ) in flooded arsenic-enriched soils[J]. Acs Sustainable Chemistry & Engineering, 7: 13236-13246. |
Chen Z, Wang Y P, Jiang X L, et al. 2017. Dual roles of AQDS as electron shuttles for microbes and dissolved organic matter involved in arsenic and iron mobilization in the arsenic-rich sediment[J]. Science of the Total Environment, 574: 1684-1694. DOI:10.1016/j.scitotenv.2016.09.006 |
Feng H J, Liang Y X, Guo K, et al. 2016. Hybridization of photoanode and bioanode to enhance the current production of bioelectrochemical systems[J]. Water Research, 102: 428-435. DOI:10.1016/j.watres.2016.06.061 |
Frenk S, Ben-Moshe T, Dror I, et al. 2013. Effect of metal oxide nanoparticles on microbial community structure and function in two different soil types[J]. Plos One, 8(12): e84441. DOI:10.1371/journal.pone.0084441 |
Gao X Y, Rodrigues S M, Spielman-Sun E, et al. 2019. Effect of soil organic matter, soil pH, and moisture content on solubility and dissolution rate of CuO NPs in soil[J]. Environmental Science & Technology, 53: 4959-4967. |
Giannousi K, Avramidis I, Dendrinou-Samara C. 2013. Synthesis, characterization and evaluation of copper based nanoparticles as agrochemicals against Phytophthora infestans[J]. Rsc Advances, 3: 21743-21752. DOI:10.1039/c3ra42118j |
Gong Y, Qu Y, Yang S, et al. 2020. Status of arsenic accumulation in agricultural soils across China (1985-2016)[J]. Environmental research, 186: 109525-109525. DOI:10.1016/j.envres.2020.109525 |
Kaweeteerawat C, Ivask A, Liu R, et al. 2015. Toxicity of metal oxide nanoparticles in escherichia coli correlates with conduction band and hydration energies[J]. Environmental Science & Technology, 49: 1105-1112. |
Keller A A, Adeleye A S, Conway J R, et al. 2017. Comparative environmental fate and toxicity of copper nanomaterials[J]. Nanoimpact, 7: 28-40. DOI:10.1016/j.impact.2017.05.003 |
Lata S, Samadder S R. 2016. Removal of arsenic from water using nano adsorbents and challenges: A review[J]. Journal of Environmental Management, 166: 387-406. DOI:10.1016/j.jenvman.2015.10.039 |
Liu C P, Yu H Y, Liu C S, et al. 2015. Arsenic availability in rice from a mining area: Is amorphous iron oxide-bound arsenic a source or sink?[J]. Environmental Pollution, 199: 95-101. DOI:10.1016/j.envpol.2015.01.025 |
Liu J, Simms M, Song S, et al. 2018. Physiological effects of copper oxide nanoparticles and arsenic on the growth and life cycle of rice (Oryza sativa japonica 'Koshihikari')[J]. Environmental Science & Technology, 52: 13728-13737. |
Liu J, Wolfe K, Potter P M, et al. 2019. Distribution and speciation of copper and arsenic in rice plants (Oryza sativa japonica 'Koshihikari') treated with copper oxide nanoparticles and arsenic during a life cycle[J]. Environmental Science & Technology, 53: 4988-4996. |
Momeni S, Ahmadi R, Nabipour I. 2019. Arsenate removal from aqueous solutions by cuttlebone/copper oxide nanobiocomposite[J]. Environmental Science and Pollution Research, 26: 37162-37173. DOI:10.1007/s11356-019-06679-6 |
Monreal C M, DeRosa M, Mallubhotla S C, et al. 2016. Nanotechnologies for increasing the crop use efficiency of fertilizer-micronutrients[J]. Biology and Fertility of Soils, 52: 423-437. DOI:10.1007/s00374-015-1073-5 |
Qiao J T, Li X M, Hu M, et al. 2018. Transcriptional activity of arsenic-reducing bacteria and genes regulated by lactate and biochar during arsenic transformation in flooded paddy soil[J]. Environmental Science & Technology, 52: 61-70. |
Qiu Y H, Mu Z T, Wang N, et al. 2020. The aggregation and sedimentation of two different sized copper oxide nanoparticles in soil solutions: Dependence on pH and dissolved organic matter[J]. Science of the Total Environment: 731. |
Razmara Z. 2018. Synthesis, characterization and magnetic properties of bi-metallic copper complex, as a precursor for the preparation of CuO nanoparticles and its application for removal of arsenic from water[J]. Journal of Inorganic and Organometallic Polymers and Materials, 28: 1255-1262. DOI:10.1007/s10904-018-0793-z |
Shen B B, Wang X M, Zhang Y, et al. 2020. The optimum pH and Eh for simultaneously minimizing bioavailable cadmium and arsenic contents in soils under the organic fertilizer application[J]. Science of the Total Environment, 711: 135229. DOI:10.1016/j.scitotenv.2019.135229 |
Shi J Y, Ye J E, Fang H X, et al. 2018. Effects of copper oxide nanoparticles on paddy soil properties and components[J]. Nanomaterials, 8(10): 839. DOI:10.3390/nano8100839 |
Shi J Y, Wu Q H, Zheng C Q, et al. 2018. The interaction between particulate organic matter and copper, zinc in paddy soil[J]. Enviroment Pollution, 243: 1394-1402. DOI:10.1016/j.envpol.2018.09.085 |
Tegenaw A, Tolaymat T, Al-Abed S, et al. 2015. Characterization and potential environmental implications of select Cu-Based fungicides and bactericides employed in US markets[J]. Environmental Science & Technology, 49: 1294-1302. |
Waalewijn-Kool P L, Ortiz M D, van Straalen N M, et al. 2013. Sorption, dissolution and pH determine the long-term equilibration and toxicity of coated and uncoated ZnO nanoparticles in soil[J]. Environmental Pollution, 178: 59-64. DOI:10.1016/j.envpol.2013.03.003 |
Wang X X, Sun W J, Ma X M. 2019. Differential impacts of copper oxide nanoparticles and Copper(Ⅱ) ions on the uptake and accumulation of arsenic in rice (Oryza sativa)[J]. Environmental Pollution, 252: 967-973. DOI:10.1016/j.envpol.2019.06.052 |
Wu D L, Zong Y, Tian Z Y, et al. 2019. Role of reactive oxygen species in As(Ⅲ) oxidation by carbonate structural Fe(Ⅱ): A surface-mediated pathway[J]. Chemical Engineering Journal, 368: 980-987. DOI:10.1016/j.cej.2019.02.204 |
Xu C, Peng C, Sun L J, et al. 2015. Distinctive effects of TiO2 and CuO nanoparticles on soil microbes and their community structures in flooded paddy soil[J]. Soil Biology & Biochemistry, 86: 24-33. |
Xu Q, Ye B H, Mou X Y, et al. 2019. Lead was mobilized in acid silty clay loam paddy soil with potassium dihydrogen phosphate (KDP) amendment[J]. Environmental Pollution, 255: 113179. DOI:10.1016/j.envpol.2019.113179 |
徐辰. 2016. 氧化铜纳米颗粒对稻田土壤及微生物生态的作用机制[D]. 杭州: 浙江大学
|
Yang K Y, Doxey S, McLean J E, et al. 2018. Remodeling of root morphology by CuO and ZnO nanoparticles: effects on drought tolerance for plants colonized by a beneficial pseudomonad[J]. Botany, 96: 175-186. DOI:10.1139/cjb-2017-0124 |
Yu H Y, Wang X Q, Li F B, et al. 2017. Arsenic mobility and bioavailability in paddy soil under iron compound amendments at different growth stages of rice[J]. Environmental Pollution, 224: 136-147. DOI:10.1016/j.envpol.2017.01.072 |
Zhu M, Wang H T, Keller A A, et al. 2014. The effect of humic acid on the aggregation of titanium dioxide nanoparticles under different pH and ionic strengths[J]. Science of the Total Environment, 487: 375-380. DOI:10.1016/j.scitotenv.2014.04.036 |
邹丽娜. 2018. 硫肥和猪粪肥对土壤_水稻系统砷迁移转化的影响及微生物作用机制[D]. 杭州: 浙江大学
|
 2021, Vol. 41
2021, Vol. 41


