自20世纪70年代以来, 用于大田作物的除草剂草甘膦的数量在全球范围内增加了约100倍(Myers et al., 2016). 抗草甘膦除草剂的转基因种子的扩增, 更是导致草甘膦除草剂的生产和使用不断增加, 这在一定程度上增加了草甘膦的环境风险(Fanton et al., 2020).草甘膦除草剂喷洒于农田后, 只有少部分被利用, 大部分残留于土壤或迁移进入地下水中, 影响非靶标生物, 从而对环境造成潜在的负面影响(Myers et al., 2016; Ghisi et al., 2020).据报道, 一些地区土壤中草甘膦的最高含量为1.0~7.9 mg · kg-1(Niemeyer et al., 2018; Pochron et al., 2020).研究土壤草甘膦对非靶标生物(如蚯蚓)的毒性效应, 对于评价其陆生生态风险具有重要的实践应用价值.
一般而言, 在半数致死剂量(LC50)以下的剂量被认为是亚致死剂量(Moriarty, 1969).施用除草剂后, 几种非生物因素(如光照、雨水等)会导致土壤中除草剂降解, 含量会降低.因此, 土壤生物如蚯蚓通常暴露于亚致死剂量的除草剂中.尽管有些关于草甘膦对陆生非靶标生物—蚯蚓毒性效应的研究报道, 但结论存在分歧.有学者认为草甘膦纯品(剂量为26.3 mg · kg-1)显著抑制了蚯蚓的生长及繁殖, 而以草甘膦为主要有效成分的除草剂(草甘膦剂量为26.3 mg · kg-1)40 d暴露则对蚯蚓未见显著影响(Pochron et al., 2020);Salvio等(2016)则基于生长繁殖及抗氧化酶(过氧化氢酶(CAT)与谷胱甘肽硫转移酶(GST))的响应, 认为土壤中草甘膦除草剂含量低于1.0 mg · kg-1时, 28 d暴露对蚯蚓不能产生明显毒害作用.相反, Santadino等(2014)的结果则表明, 农业生产中草甘膦除草剂的常规使用(6 L · hm-2)显著抑制了蚯蚓的生长及繁殖.因此, 深入探讨亚致死剂量草甘膦对蚯蚓的毒性效应, 不仅要从生长繁殖或抗氧化酶指标, 还需适合于亚致死剂量的更加敏感的指标来进行.结合多指标体系, 进而精准判断土壤污染物的毒性效应.
细胞色素P450(Cytochrome p450, CYP)家族酶是重要的代谢解毒酶, 在内源性和外源性化合物代谢中起到重要作用.CYP1A2、CYP2C9和CYP3A4含量较高, 且能代谢市场上80%的药物, 是CYP家族重要的亚酶(Lahoz et al., 2007).研究表明, 土壤污染物暴露会显著诱导或抑制蚯蚓某些CYP亚酶活力, 这些CYP亚酶因此可作为土壤污染的生物标记物(Cao et al., 2017; Yang et al., 2019).但也有文献报道未检测到蚯蚓CYP1A2酶活力(Brown et al., 2004), 这可能是其采用的测定方法未能分离探针底物与代谢产物且荧光分光光度计灵敏度不够造成的.笔者的前期工作建立了液相色谱串联质谱联用仪(LC-MS/MS)通量测定蚯蚓CYP1A2、CYP2C9及CYP3A4酶活力的方法, 发现蚯蚓不同CYP亚酶可对敌敌畏污染土壤做出选择性响应(Yang et al., 2019; 杨晓霞等, 2019).据此推断蚯蚓的一些CYP亚酶可能会对土壤草甘膦做出响应, 但需要对这一假设进行进一步的验证.
代谢组学是研究细胞、组织或有机体中所有小分子代谢物随外因或内因变化的科学.近年来, 蚯蚓代谢组学在环境毒理学中的应用越来越广泛, 已然成为一种高通量和可重复的工具, 用于准确识别亚致死剂量或低剂量暴露的生物标记物, 并阐明不同污染物(多环芳烃类、纳米材料如C60、重金属)的毒性作用模式(Brown et al., 2004; Lankadurai et al., 2015; Chen et al., 2016).Liang等(2018)发现10 mg · kg-1 2, 2′, 4, 4′-四溴二苯醚(BDE-47)和十溴二苯醚(BDE-209)对蚯蚓的大多数小分子代谢物有显著影响, 推断它们的毒性作用模式与渗透调节、能量代谢、神经活动、三羧酸循环与氨基酸代谢有关.因此, 代谢组学分析可能为蚯蚓对亚致死剂量草甘膦的响应提供深入见解, 但需要进一步的验证.此外, 从目前发表的文献来看, 以蚯蚓为受试生物研究草甘膦的毒性效应, 采用的受试终点主要为致死率、生长抑制率、抗氧化酶活力等(Santadino et al., 2014; Salvio et al., 2016; 宋欣媛等, 2018), 尚未见以蚯蚓CYP亚酶及代谢组学(小分子代谢物)作为受试终点的研究报道.
鉴于以蚯蚓生长繁殖及抗氧化酶为指标对草甘膦的毒性效应研究的现状及存在的问题, 本研究根据预实验结果及草甘膦在土壤中的实际含量, 参照蚯蚓生态毒理实验研究中常采用的暴露周期, 将蚯蚓暴露于亚致死剂量的草甘膦(5、10、20、40 mg · kg-1)染毒土壤7 d, 采用多层次指标体系进行其毒性效应及致毒机制研究, 具体包括蚯蚓生长抑制率的监测, 以及蚯蚓CYP亚酶活力、代谢组学的测定及生物标记物的筛选.旨在研究亚致死剂量草甘膦能否引起CYP亚酶活力及代谢组学发生显著变化, 初步推断其毒性作用阈值, 筛选敏感生物标记物, 探讨其毒性作用机制.以期丰富草甘膦的陆生生态毒性效应数据库, 提升科学认知, 并为相关环境标准的制订提供基础科学依据.
2 材料与方法(Materials and methods) 2.1 仪器与试剂仪器:低温超速离心机(日立)、受控环境生长箱、液相色谱串联质谱联用仪(沃特世, 美国)、紫外分光光谱仪(岛津)、超纯水机(赛多利斯, 德国).
试剂:草甘膦除草剂(水型, 质量分数41%)购自重庆市九龙坡区某农资店, 色谱纯甲醇购自Merck公司, 色谱纯双氯芬酸钠、睾酮、非那西汀、甲酸、二硫苏糖醇(DTT)及三羟甲基氨基甲烷(Tris)均购自Sigma-Aldrich公司(中国上海), 对乙酰氨基酚、4′-羟基双氯芬酸(浓度为100 μg · mL-1)、NADPH反应系统购自BD genetest公司, 6β-羟基睾酮(浓度为1 mg · mL-1)购自英国Laboratory of the Government Chemist, 实验室超纯水由德国Sartorius Arium 611DI超纯水系统过滤, C18质谱柱购自美国Waters公司.
2.2 土壤暴露实验本研究中受试生物赤子爱胜蚓(Eisenia fetida)购于重庆附近的养殖商, 选用2~3月龄、体重300~400 mg带有环带的健康蚯蚓.在进行暴露试验前, 将蚯蚓培养于干净的土壤中.受试土壤来自重庆市农业科学院试验站, 为0~20 cm的表层清洁土壤, 风干后磨细过1 mm筛备用, 其理化性质见表 1.该土壤中未检测到草甘膦.
| 表 1 供试土壤的理化性质 Table 1 Physical and chemical properties of test soil |
在开展正式暴露试验前, 先进行预实验, 目的在于初步获得草甘膦的7 d半数致死剂量(LC50).草甘膦染毒方法如下:将一定浓度的草甘膦除草剂水溶液与500 g干净土壤充分混合, 使得土壤中草甘膦的有效含量分别为5、10、20、50、100、200、300、400 mg · kg-1, 加水至土壤最大持水量为20%.然后将染毒土壤转移到塑料培养盒中, 每个培养盒(18 cm×13 cm×7 cm, 装有500 g土壤)中放置10~12条蚯蚓, 另设一个对照组, 即不添加污染物, 每个处理组设置4个平行.蚯蚓培养方法参照OECD标准(1984), 将培养盒置于(20±2) ℃、湿度为80%的受控环境生长箱中光暗(16 h/8 h)交替培养.暴露7 d后, 采用Spearman-Karber法(Hamilton et al., 1977), 计算草甘膦对蚯蚓的LC50值, 为426.6 mg · kg-1.
根据草甘膦的LC50及其在土壤中的实际含量, 开展正式实验.设计草甘膦的暴露剂量梯度为5、10、20、40 mg · kg-1, 即分别大约为1/80 LC50、1/40 LC50、1/20 LC50、1/10 LC50, 另设一个对照组, 即未添加草甘膦, 每个剂量处理设置4个平行.正式实验中草甘膦的染毒操作及蚯蚓培养方法与预实验相同.暴露7 d后, 从培养盒中取出蚯蚓用超纯水冲洗后, 用滤纸吸干表体水分, 称重.之后于20 ℃下在湿润的滤纸上放置24 h, 使其排净体内的物质.其中4~6条蚯蚓提取微粒体, 用于蚯蚓CYP1A2、CYP2C9及CYP3A4酶活力的测定;其余蚯蚓在液氮中磨碎, 用于代谢组学的测定.
2.3 蚯蚓生长抑制率的计算暴露7 d后, 蚯蚓生长抑制率R采用式(1)计算.
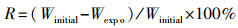
|
(1) |
式中, Wexpo为暴露7 d后蚯蚓的平均体重(g);Winitial为暴露实验前蚯蚓的平均体重(g).
2.4 蚯蚓CYP1A2、CYP2C9及CYP3A4酶活力的测定将空肠24 h后的4~6条蚯蚓置于4 ℃的20%(V/V)甘油溶液中浸泡5 min后, 迅速解剖内脏, KCl溶液(0.15 mol · L-1)清洗内脏后, 转移到装有4 mL匀浆缓冲液(250 mmol · L-1蔗糖, 50 mmol · L-1 Tris, 1 mmol · L-1 DTT, 1 mmol · L-1 EDTA, pH=7.5)的玻璃组织研磨器中使其均匀破碎, 并将最终匀浆体积定为6 mL.之后, 采用差速离心法提取微粒体:首先将匀浆液在低温(4 ℃)超速离心机上以15000×g离心15 min, 保留上清液;然后将上清液在低温超速离心机上以150000×g再次离心90 min, 将所得沉淀用3 mL保存缓冲液(50 mmol · L-1蔗糖, 50 mmol · L-1 Tris, 1 mmol · L-1 DTT, 1 mmol · L-1 EDTA, pH=7.5, 20%甘油)重新悬浮, 用于蛋白含量、CYP1A2、CYP2C9及CYP3A4酶活力的测定.其中, 微粒体悬浮液中蛋白含量采用Bradford方法(1976)测定, 以牛血清蛋白作为标准蛋白.
孵育反应:取2 mL的离心管, 加入650 μL孵育体系及250 μL探针底物混合溶液, 其中, 孵育体系包括590 μL缓冲液(pH=7.5, 0.1 mol · L-1的Tris)和60 μLNADPH产生系统(NADPH产生系统由A液和B液按体积比为5 ∶ 1组成, A液为葡萄糖-6-磷酸20 mg · mL-1、NADP 20 mg · mL-1、氯化镁13.3 mg · mL-1, B液为将葡萄糖-6-磷酸脱氢酶溶于5 mmol · L-1的柠檬酸钠溶液中至葡萄糖-6-磷酸脱氢酶的终浓度为40 U · mL-1).非那西汀、双氯芬酸钠与睾酮在混合溶液中的最终浓度分别为100、100、25 μmol · L-1.然后, 将100 μL蚯蚓微粒体蛋白悬浮液加离心管中, 升温至37 ℃, 启动酶促反应, 反应时间为20 min, 再向离心管中加入200 μL甲醇, 在15000×g的离心力下离心10 min, 保留上清液并通过0.22 μm膜过滤用于LC-MS/MS检测代谢产物对乙酰氨基酚、4′-羟基双氯芬酸及6β-羟基睾酮的生成量, 进而分别对应计算CYP1A2、CYP2C9及CYP3A4酶活力.
LC-MS/MS条件:①色谱条件:色谱柱为Acquity UPLC C18柱(2.1 mm×50 mm, 1.8 μm);流动相由A相和B相组成, A相为含1 mmol · L-1乙酸铵与体积分数为0.05%甲酸的水, B相为甲醇;梯度洗脱程序如下:0~0.6 min, 流动相B的比例为0, 0.6~6 min, 流动相B的比例由0上升至50%;6~8 min, 流动相B的比例由50%上升至95%;8~9 min, 流动相B的比例由95%降至0;柱温为40 ℃;流速为0.3 mL · min-1;自动进样室温度为4℃;进样体积为3 μL.②质谱条件:电喷雾正离子源(ESI+);电喷雾电压3 kV;去溶温度为500 ℃;去溶气体为氩气, 流速为1000 L · h-1;多反应离子监测模式其保留时间及质谱参数列于表 2.
| 表 2 各代谢产物的保留时间及MS/MS参数 Table 2 Retention time and MS/MS parameters of metabolites |
CYP亚酶活力的计算见式(2), 酶活力变化率(η)的计算见式(3).

|
(2) |
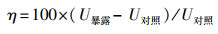
|
(3) |
式中, UCYP亚酶为CYP亚酶活力(pmol · μg-1);C产物为反应体系中代谢产物的浓度(ng · mL-1);M产物为代谢产物的摩尔质量(g · mol-1);C蛋白为反应体系中微粒体蛋白的终浓度(mg · mL-1);U暴露为污染物暴露下蚯蚓某酶的活力;U对照为对照组酶的活力.
2.5 蚯蚓代谢组学测定、数据预处理及统计分析代谢物提取:每100 mg蚯蚓粉末(于液氮中粉碎)加入1 mL冰甲醇(体积分数为80%, 4 ℃)漩涡5 min, 随后将混合物于15000×g离心10 min, 将上清液转移到2 mL离心管中冷冻干燥.随后加入0.4 mL甲醇-水溶液(体积比为1 ∶ 1), 4 ℃下溶解样品, 0.22 μm膜过滤后得到待测样品, 用于LC-MS/MS上机分析.
LC-MS/MS测定条件及数据预处理:色谱条件:采用ACQUITY UPLC HSS T3(2.1 mm×150 mm, 1.8 μm)色谱柱, 自动进样器温度设为4 ℃, 流速为0.25 mL · min-1, 柱温为40 ℃, 进样量为6 μL, 流动相为0.1%甲酸水(A)+0.1%甲酸乙腈(B).梯度洗脱程序:0~1 min, 2%B;1~9.5 min, 2%~50%B;9.5~14 min, 50%~98%B;14~15 min, 98%B;15~15.5 min, 98%B~2%B;15.5~17 min, 2%B.
质谱条件:电喷雾离子源(ESI), 正负离子电离模式, 正离子喷雾电压为3.5 kV, 负离子喷雾电压为2.5 kV, 鞘气为30 arb, 辅助气为10 arb.毛细管温度为325 ℃, 毛细管电压为15 V, 管透镜电压为50 V, 以分辨率60000进行全扫描, 扫描范围为50~1000, 并采用CID进行二级裂解, 碰撞电压为30 eV, 同时采用动态排除去除无必要的MS/MS信息, 动态排除时间设置为15 s.
通过Proteowizard软件将获得的原始数据转换为mz XML格式, 采用XC-MS软件进行峰值自动检测、保留时间校准与峰对齐, 获得包括质荷比、保留时间及峰面积在内的数据阵.偏最小二乘法判别分析(Partial Least Squares Discriminant Analysis, PLS-DA)在降维的同时, 结合回归模型, 可对回归结果进行判别分析, 是目前代谢组学数据分析中最常使用的一种分类方法(Lankadurai et al., 2015).因此, 数据阵被导入Simca-P(Version 13.0, Norway)后, 进行偏最小二乘法判别分析(PLS-DA), 用于识别组间差异.筛选p < 0.05且投影变量重要性(VIP)值大于1的代谢物, 作为小分子代谢物生物标记物.根据精确分子量进潜在行小分子代谢物标记物的鉴定确认(分子量误差为小于20×10-6 Da).根据自建标准品数据库, 对比MS/MS碎片模式, 并在Human Metabolome Database(http://www.hmdb.ca)、Metlin (http://metlin.scripps.edu)、Massbank(www.massbank.jp)数据库分析小分子代谢物标记物的生物学意义.
2.6 数据分析采用Kolmogornov-Smirnov检验数据是否符合正态分布, 采用Levene′s tests进行方差齐次性检验.所有数据集经检验后, 符合正态分布与方差齐次性, 采用单因素方差分析(One way ANOVA)分析相同暴露时间下, 暴露剂量对蚯蚓体重抑制率、CYP亚酶活力及小分子代谢物标记物的影响, p < 0.05视为显著差异.采用软件origin 8.0绘图.
3 结果与分析(Results and analysis) 3.1 蚯蚓生长抑制率暴露7 d后, 对照组蚯蚓体重略有下降, 生长抑制率为4.5%, 这可能是实验期间没有喂食所致.草甘膦暴露下, 蚯蚓体重抑制率在1.1%~2.9%间浮动, 略低于对照组, 但差异不显著.
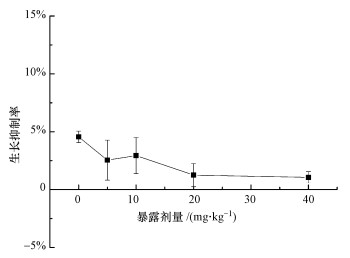 |
| 图 1 暴露草甘膦7 d后蚯蚓的生长抑制率 (数据表示为平均值±标准偏差(n=4), 下同) Fig. 1 Growth inhibition rate of earthworms after 7 days of glyphosate exposure(Data are expressed as the means±SD of quadruplicate analyses(n=4), the same below) |
由图 2可知, 蚯蚓CYP1A2、CYP2C9及CYP3A4酶活力对草甘膦的响应相似.5、10 mg · kg-1草甘膦处理下3组CYP亚酶活力略高于对照水平但差异不显著, 表现出低剂量草甘膦对蚯蚓体内CYP亚酶活力的诱导刺激效应;高剂量(20、40 mg · kg-1)暴露下, CYP1A2、CYP2C9及CYP3A4酶活力显著低于对照水平(p < 0.05), 表现出明显的抑制效应, CYP2C9酶活力变化率为-82.9%、-83.5%, CYP1A2酶活力变化率为-58.7%、-43.8%, CYP3A4酶活力变化率为-20.4%、-17.9%.
 |
| 图 2 草甘膦暴露7 d后蚯蚓CYP1A2、CYP2C9及CYP3A4酶活力变化率 (*表示与对照组存在显著差异, p < 0.05) Fig. 2 Change percent of CYP1A2, CYP2C9 and CYP3A4 activity of earthworms exposed to glyphosate compared with the control for 7 days(* indicates a significant difference from the control group, p < 0.05) |
本研究中, 对照组与草甘膦暴露组的PLS-DA模型方差检验p < 0.05, 表明模型合理, 其中, R2(X)为0.76, R2(Y)为0.56, 表明自变量数量的76%信息, 模型预测能力为56%.从PLS-DA样品分离得分图(图 3)可以看出, 草甘膦添加组与对照组间分离明显, 表明添加组与对照组间差异较大.在第一主成分(PC1)上, 草甘膦添加组(5~20 mg · kg-1)与对照组间的距离随着草甘膦暴露剂量的增加而增加;而20 mg · kg-1与40 mg · kg-1草甘膦处理组间距离较小, 表明差异较小.
 |
| 图 3 基于PLS-DA蚯蚓暴露于草甘膦7 d后的样品分离得分图 (n=4, 样品都处于95%置信区间内(Hotelling′s T2 Ellipse (95%)), A代表对照(CK), B1、B2、B3、B4分别代表草甘膦暴露剂量5、10、20、40 mg · kg-1) Fig. 3 The score plots of PLS-DA model for the extracts of earthworms exposed to 5 (B1), 10 (B2), 20 (B3), 40 (B4) mg · kg-1 glyphosate and the control soil (A) for 7 days |
基于LC-MS/MS的蚯蚓代谢组学, 鉴定并筛选出草甘膦暴露下的小分子代谢物生物标记物共有14个, 其变化率(相比对照组)如表 3所示.草甘膦的添加导致多数小分子代谢物标记物(除柠檬酸、α-酮戊二酸、琥珀酸外)均与对照组存在显著差异.柠檬酸、α-酮戊二酸、琥珀酸在10~40 mg · kg-1草甘膦处理下显著低于对照组.丙酮酸、赖氨酸、鸟氨酸、肌酸、甜菜碱水平随着草甘膦剂量的增加而降低, 最高暴露剂量下, 其减幅在39.5%~75.4%之间波动.草甘膦暴露导致蚯蚓尿酸与二十-羟-二十烷四烯酸(20-HETE)显著高于对照水平.相比20 mg · kg-1草甘膦处理, 40 mg · kg-1草甘膦导致蚯蚓1, 6-二磷酸果糖与β-D-果糖6-磷酸显著降低, 其余小分子代谢物标记物在这两个暴露剂量下未见显著差异.
| 表 3 小分子代谢物生物标记物的筛选及其变化率 Table 3 The screening of biomarkers for small molecule metabolites and their change rates |
从已发表的文献看, 当前关于草甘膦毒性效应的研究多数以水生生物作为研究对象(Myers et al., 2016; Iummato et al., 2018; Fanton et al., 2020).以蚯蚓作为受试生物, 开展草甘膦陆生生态毒性效应的研究相对较少, 且已有的研究以生长抑制率或抗氧化酶为受试终点, 所得结论也不一(Santadino et al., 2014; Pochron et al., 2020).本文采用生长抑制率、CYP亚酶和代谢组学作为多层次受试终点, 由表及里地研究亚致死剂量草甘膦除草剂对蚯蚓的毒性效应.根据之前一些文献报道, 以草甘膦为主要成分的除草剂(剂量1~40 mg · kg-1, 暴露28~40 d)暴露实验结束时, 草甘膦处理组的蚯蚓生长抑制率与对照组无显著差异, 表明生长抑制率作为受试终点, 尚不能对亚致死剂量草甘膦的毒性效应做出有效诊断(Salvio et al., 2016; Pochron et al., 2020), 这与之前的一些研究结果一致, 这也是本文采用7 d作为暴露周期的原因之一.推测出现这一结果可能是草甘膦除草剂中的惰性成分起到杀菌剂的作用, 而杀死的真菌可作为蚯蚓的食物.
细胞色素P450家族酶作为阶段Ⅰ代谢解毒酶, 通过非共价键结合的血红素中的铁离子传递电子氧化外源物质, 增强外源物质的水溶性, 使它们更容易排出体外, 进而起到解毒作用(Boudéne et al., 1976).从代谢功能及含量水平而言, CYP1A2、CYP2C9及CYP3A4是细胞色素P450家族的3个重要亚酶.由于不同生物生体内的不同CYP亚酶可能会对环境污染物做出选择性响应, 近年来关于CYP亚酶能否作为生物标记物诊断环境污染的研究报道数量有所增加(Oliva et al., 2014; Cao et al., 2017; Yang et al., 2019).本研究中, CYP1A2、CYP2C9与CYP3A4酶活力对草甘膦处理做出了不同程度的响应, 表明草甘膦可被蚯蚓体内这3种CYP亚酶催化(Fathi et al., 2020).高剂量草甘膦(20、40 mg · kg-1)处理组, 蚯蚓CYP1A2、CYP2C9与CYP3A4酶活力均被显著抑制, 这可能是相比低剂量处理, 高剂量下污染物或其降解产物的生物累积对蚯蚓产生了毒害作用, 进而抑制了上述CYP亚酶的活力(Yang et al., 2012; Oliva et al., 2014).类似地, 草甘膦除草剂(有效浓度为10 mg · kg-1)能显著抑制小鸡肝组织CYP1A2酶活力(Fathi et al., 2020)及人类肝细胞内CYP2C9酶活力(Abass et al., 2009).本研究中, 草甘膦相同暴露剂量下, 不同亚酶的响应变化幅度不同, 可能是由于不同亚酶的催化机理存在差异, CYP2C9主要催化支链羟基化、环氧化、杂原子脱烷化反应, 而CYP1A2和CYP3A4则主要催化去甲基化、N-脱烷基反应、杂原子氧化反应等(Lahoz et al., 2007; Abass et al., 2009; Kaisarevic et al., 2015).
1, 6-二磷酸果糖是糖代谢的重要中间产物.β-D-果糖6-磷酸在糖酵解中转化为1, 6-二磷酸果糖, 然后再分解供能.草甘膦暴露下, 蚯蚓体内的1, 6-二磷酸果糖与β-D-果糖6-磷酸均显著低于对照水平, 可能是糖酵解减弱所致(薛黎明等, 2020);1, 6-二磷酸果糖与β-D-果糖6-磷酸的变化趋势相似, 推测β-D-果糖6-磷酸转化为1, 6-二磷酸果糖的过程仍处于平衡状态(Liang et al., 2018).丙酮酸是糖酵解的终产物, 或在细胞浆中还原成乳酸供能, 或进入线粒体内氧化生成乙酰CoA, 进入三羧酸循环.草甘膦暴露导致蚯蚓丙酮酸含量显著低于对照水平, 证实糖酵解减弱(Yuk et al., 2011; 薛黎明等, 2020).柠檬酸、α-酮戊二酸、琥珀酸与延胡索酸均是三羧酸循环的重要中间产物, 草甘膦暴露(10~40 mg · kg-1)导致三者均显著低于对照水平, 表明蚯蚓三羧酸循环减弱, 有氧代谢过程放缓, 机体供能下降.
氨基酸可用于合成蛋白质, 也可被氧化成二氧化碳和水, 提供能量.本研究中, 草甘膦暴露下, 组氨酸、赖氨酸与鸟氨酸均显著低于对照水平, 可能是由于蚯蚓体内的葡萄糖代谢受损, 氨基酸氧化成为重要的替代能源, 1, 6-二磷酸果糖、β-D-果糖6-磷酸与丙酮酸的显著降低便是证明;也有可能是为了合成蛋白质试图降低草甘膦对蚯蚓的伤害(Lankadurai et al., 2015; Chen et al., 2016).另外, 鸟氨酸参与尿素循环, 对于体内氨态氮的排出具有重要作用.鸟氨酸的显著降低表明草甘膦对蚯蚓的尿素循环产生了显著影响(Hashim et al., 2019; Zhao et al., 2019; Caocci et al., 2020).蚯蚓体内的氨基酸类小分子代谢物经常被识别为生物标记物, 用于诊断环境污染, 如土壤C60纳米材料(300~3000 mg · kg-1)7 d暴露导致蚯蚓体内亮氨酸、异亮氨酸、缬氨酸与苯丙氨酸含量显著高于对照水平(Lankadurai et al., 2015);铅暴露则导致蚯蚓体内缬氨酸、酪氨酸与色氨酸含量显著降低(Chen et al., 2016).可见, 作为生物标记物, 氨基酸的种类及响应依赖于污染物.
肌酸是一种氨基酸衍生物, 参与嘌呤代谢.尿酸是体内嘌呤代谢的终产物, 尿酸水平显著提高是人类心脑血管疾病的标志性特征(Caocci et al., 2020).医学研究表明, 尿酸显著增加而肌酸显著降低是人体肾功能障碍的生物标记物(薛黎明等, 2020).草甘膦暴露下, 蚯蚓的肌酸水平显著低于对照, 尿酸水平却显著高于对照, 表明蚯蚓的嘌呤代谢紊乱(Zhao et al., 2019).甜菜碱的主要作用在于维持细胞渗透压, 保护有氧呼吸及能量代谢过程.20、40 mg · kg-1草甘膦暴露导致蚯蚓体内甜菜碱含量显著低于对照水平, 表明蚯蚓的细胞渗透调节功能受损.Lankadurai等(2015)研究发现, 300~3000 mg · kg-1 C60暴露下, 蚯蚓的甜菜碱含量水平显著降低, 认为C60对蚯蚓组织产生了毒害作用.还有一些研究发现, BDE-47、BDE-209与四溴双酚A可显著提高蚯蚓的甜菜碱水平, 进而维持细胞渗透压和保护酶活力, 增强其免疫功能(陈娟等, 2017; Liang et al., 2018).可见, 甜菜碱的响应仍然依赖于污染物种类.
20-HETE是CYP4A或CYP4F催化花生四烯酸ω-羟基化的代谢产物.20-HETE的生成被抑制, 可减轻脑出血损伤, 对人类具有保护作用(Ozen et al., 2018; Han et al., 2019);而脑血管病患者的脑脊液中20-HETE的生成显著增加(Fang et al., 2017).5~40 mg · kg-1草甘膦暴露下, 蚯蚓体内的20-HETE水平均显著高于对照组, 且随着暴露剂量的增加而不断增加, 这可能是CYP4A或CYP4F酶活力显著增加的结果, 并推测5 mg · kg-1草甘膦已对蚯蚓生长产生负面影响(Han et al., 2019), 这一结果同时也证实了草甘膦对蚯蚓的毒性作用机制与细胞色素P450代谢相关.而CYP1A2、CYP2C9与CYP3A4酶活力在20~40 mg · kg-1草甘膦暴露下显著低于对照水平, 似乎与CYP4A或CYP4F酶活力显著增加这一结果相悖, 但很多研究都有类似发现, 即同个生物体内不同CYP亚酶活力对暴露物的胁迫响应迥异.例如, 注射乙酰甲胺磷和长春新碱混合物后, 大鼠CYP3A1与CYP2B1酶活力显著增加, 而CYP1A2酶活力则显著降低(Canistro et al., 2008);草甘膦除草剂处理后, 鸡肝组织中CYP1A2、CYP1A4、CYP1B1的表达被显著抑制, 而CYP3A5、CYP1C1的表达显著增加(Fathi et al., 2020).这仍然可能是由于CYP亚酶的催化作用机理不同所致.上述结果也表明, 基于代谢组学筛选出的小分子标记物对亚致死剂量草甘膦的响应, 较CYP1A2、CYP2C9及CYP3A4酶活力更为敏感.
一些研究表明, 以草甘膦为主要成分的除草剂(剂量:1~40 mg · kg-1, 暴露28~40 d)未导致蚯蚓的生长繁殖发生显著变化;谷胱甘肽硫转移酶尽管能做出一定的响应, 但规律不明显(Salvio et al., 2016; Pochron et al., 2020).本文选用多层次受试终点, 7 d暴露实验结束时, 蚯蚓生长抑制率未见显著变化, 但CYP亚酶活力及代谢组学均做出了显著响应:10~20 mg · kg-1草甘膦导致3种CYP亚酶活力均受到显著抑制, 多数小分子代谢物标记物则在5~40 mg · kg-1草甘膦暴露下显著区别于对照.上述结果证实了多层次受试终点诊断亚致死剂量污染物毒性效应的优越性, 也证实代谢组学对污染物的响应更敏感, 是准确识别亚致死剂量暴露生物标记物及揭示毒性作用方式的高效工具.
综上, 基于代谢组学及CYP亚酶的响应, 5~40 mg · kg-1草甘膦导致蚯蚓糖酵解及三羧酸循环减弱, 氨基酸代谢受损, 嘌呤代谢紊乱, 细胞渗透功能受损, 对蚯蚓的正常生长产生明显毒副作用, 其致毒机制还与细胞色素P450酶代谢及尿素循环相关.多层次受试终点对草甘膦毒性效应的响应敏感度由高到低依次为蚯蚓小分子代谢物(代谢组学)、CYP亚酶活力、生长抑制率.建议代谢组学筛选出的生物标记物与CYP1A2、CYP2C9及CYP3A4酶活力作为联合生物标记物, 共同诊断土壤草甘膦污染, 会更为准确有效.
5 结论(Conclusions)本研究首次联合采用蚯蚓CYP亚酶(CYP1A2、CYP2C9及CYP3A4)及代谢组学指标作为受试终点, 探讨土壤亚致死剂量草甘膦对蚯蚓的毒性效应.结果显示, CYP1A2、CYP2C9与CYP3A4酶活力在高剂量草甘膦(20、40 mg · kg-1)处理下被显著抑制;而5~40 mg · kg-1草甘膦暴露导致9组小分子代谢物标记物(1, 6-二磷酸果糖、β-D-果糖6-磷酸、丙酮酸、组氨酸、赖氨酸、鸟氨酸、延胡索酸、肌酸、甜菜碱)显著低于对照水平, 2组小分子代谢物(尿酸与20-HETE)显著高于对照水平.这些研究结果充分表明5~40 mg · kg-1草甘膦对蚯蚓产生了明显的毒副作用, 主要与糖酵解、三羧酸循环、氨基酸代谢、嘌呤代谢、细胞渗透调节功能及细胞色素P450酶代谢相关.上述结果表明, 蚯蚓CYP1A2、CYP2C9与CYP3A4酶活力与小分子代谢物标记物可作为敏感生物标记物, 用于土壤草甘膦污染的精准诊断.
Abass K, Turpeinen M, Pelkonen O. 2009. An evaluation of the cytochrome P450 inhibition potential of selected pesticides in human hepatic microsomes[J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 44(6): 553-563. |
Boudéne C, Boisset M. 1976. Cytochrome P450.Its importance in toxicology.Ⅱ.Regulation of its biosynthesis and its activity.Activation and inhibition[J]. Annales De Biologie Clinique, 34(1): 1-40. |
Bradford M M. 1976. A Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 72(1/2): 248-254. |
Brown P J, Long S M, Spurgeon D J, et al. 2004. Toxicological and biochemical responses of the earthworm Lumbricus rubellus to pyrene, a non-carcinogenic polycyclic aromatic hydrocarbon[J]. Chemosphere, 57(11): 1675-1681. DOI:10.1016/j.chemosphere.2004.05.041 |
Canistro D, Pozzetti L, Sapone A, et al. 2008. Perturbation of murine liver cyp-superfamily of isoforms by different combinations of pesticide mixtures[J]. Food and Chemical Toxicology, 46(1): 34-42. DOI:10.1016/j.fct.2007.05.034 |
Cao X F, Bi R, Song Y F. 2017. Toxic responses of cytochrome P450 sub-enzyme activities to heavy metals exposure in soil and correlation with their bioaccumulation in Eisenia fetida[J]. Ecotoxicology and Environmental Safety, 144: 158-165. DOI:10.1016/j.ecoenv.2017.06.023 |
Caocci G, Deidda M, Noto A, et al. 2020. Metabolomic analysis of patients with chronic myeloid leukemia and cardiovascular adverse events after treatment with tyrosine kinase inhibitors[J]. Journal of Clinical Medicine, 9: 1180. DOI:10.3390/jcm9041180 |
陈娟, 史雅娟, 吕永龙, 等. 2017. 赤子爱胜蚓对不同浓度四溴双酚A代谢的急性与亚急性毒性响应[J]. 环境科学学报, 37(2): 747-754. |
Chen T, Liu Y, Li M H, et al. 2016. Integrated 1H NMR-based metabolomics analysis of earthworm responses to sub-lethal Pb exposure[J]. Environmental Chemistry, 13(5): 792-803. DOI:10.1071/EN15192 |
Fang J L, Cui L, Sun Y, et al. 2017. Targeted metabolomics reveals altered oxylipin profiles in plasma of mild cognitive impairment patients[J]. Metabolomics, 13: 8. DOI:10.1007/s11306-017-1249-0 |
Fanton N, Bacchetta C, Rossi A, et al. 2020. Effects of a glyphosate-based herbicide on the development and biochemical biomarkers of the freshwater copepod Notodiaptomus carteri (Lowndes, 1934)[J]. Ecotoxicology and Environmental Safety, 196: 110501. DOI:10.1016/j.ecoenv.2020.110501 |
Fathi M A, Han G F, Kang R F, et al. 2020. Disruption of cytochrome P450 enzymes in the liver and small intestine in chicken embryos in ovo exposed to glyphosate[J]. Environmental Science and Pollution Research, 27(14): 16865-16875. DOI:10.1007/s11356-020-08269-3 |
Ghisi N D, Zuanazzi N R, Fabrin T M C, et al. 2020. Glyphosate and its toxicology: A scientometric review[J]. Science of the Total Environment, 733: 15. DOI:10.1016/j.scitotenv.2020.139359 |
Hamilton M A, Russo R C, Thurston R V. 1977. Trimmed SPEARMAN-KARBER method for estimating median lethal concentration in toxicity bioassays[J]. Environmental Science and Technology, 11(7): 714-719. DOI:10.1021/es60130a004 |
Han X N, Zhao X C, Lan X, et al. 2019. 20-HETE synthesis inhibition promotes cerebral protection after intracerebral hemorrhage without inhibiting angiogenesis[J]. Journal of Cerebral Blood Flow and Metabolism, 39(8): 1531-1543. DOI:10.1177/0271678X18762645 |
Hashim N A A, Ab-Rahim S, Suddin L S, et al. 2019. Global serum metabolomics profiling of colorectal cancer[J]. Molecular and Clinical Oncology, 11(1): 3-14. |
Iummato M M, Sabatini S E, Cacciatore L C, et al. 2018. Biochemical responses of the golden mussel Limnoperna fortunei under dietary glyphosate exposure[J]. Ecotoxicology and Environmental Safety, 163: 69-75. DOI:10.1016/j.ecoenv.2018.07.046 |
Kaisarevic S, Dakic V, Hrubik J, et al. 2015. Differential expression of CYP1A1 and CYP1A2 genes in H4IIE rat hepatoma cells exposed to TCDD and PAHs[J]. Environmental Toxicology and Pharmacology, 39(1): 358-368. DOI:10.1016/j.etap.2014.11.031 |
Lahoz A, Donato M T, Picazo L, et al. 2007. Determination of major human cytochrome P450s activities in 96-well plates using liquid chromatography tandem mass spectrometry[J]. Toxicology in Vitro, 21(7): 1247-1252. DOI:10.1016/j.tiv.2007.03.022 |
Lankadurai B P, Nagato E G, Simpson A J, et al. 2015. Analysis of Eisenia fetida earthworm responses to sub-lethal C60 nanoparticle exposure using 1H-NMR based metabolomics[J]. Ecotoxicology and Environmental Safety, 120: 48-58. DOI:10.1016/j.ecoenv.2015.05.020 |
Liang R, Chen J, Shi Y, et al. 2018. Toxicological effects on earthworms (Eisenia fetida) exposed to sub-lethal concentrations of BDE-47 and BDE-209 from a metabolic point[J]. Environmental Pollution, 240: 653-660. DOI:10.1016/j.envpol.2018.04.145 |
Moriarty F. 1969. The sublethal effects of insecticides in insects[J]. Biological Reviews, 44(3): 321-357. DOI:10.1111/j.1469-185X.1969.tb01214.x |
Myers J P, Antoniou M N, Blumberg B, et al. 2016. Concerns over use of glyphosate-based herbicides and risks associated with exposures: A consensus statement[J]. Environmental Health. DOI:10.1186/s12940-016-0117-0 |
Niemeyer J C, de Santo F B, Guerra N, et al. 2018. Do recommended doses of glyphosate-based herbicides affect soil invertebrates? Field and laboratory screening tests to risk assessment[J]. Chemosphere, 198: 154-160. DOI:10.1016/j.chemosphere.2018.01.127 |
OECD.1984.Test No.207: Earthworm, Acute Toxicity Tests[S].Paris: OECD
|
Oliva M, Gravato C, Guilhermino L, et al. 2014. EROD activity and cytochrome P4501A induction in liver and gills of Senegal sole Solea senegalensis from a polluted Huelva Estuary (SW Spain)[J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 166: 134-144. |
Ozen N, Ulker S N, Ulker P, et al. 2018. Effect of 20-HETE inhibition on L-NAME-induced hypertension in rats[J]. Clinical and Experimental Hypertension, 40(3): 292-302. DOI:10.1080/10641963.2017.1368540 |
Pochron S, Simon L, Mirza A, et al. 2020. Glyphosate but not Roundup© harms earthworms (Eisenia fetida)[J]. Chemosphere, 241: 125017. DOI:10.1016/j.chemosphere.2019.125017 |
Salvio C, Menone M L, Rafael S, et al. 2016. Survival, reproduction, avoidance behavior and oxidative stress biomarkers in the Earthworm Octolasion cyaneum exposed to glyphosate[J]. Bulletin of Environmental Contamination and Toxicology, 96(3): 314-319. DOI:10.1007/s00128-015-1700-8 |
Santadino M, Coviella C, Momo F. 2014. Glyphosate sublethal effects on the population dynamics of the earthworm Eisenia fetida (Savigny, 1826)[J]. Water Air and Soil Pollution. DOI:10.1007/s11270-014-2207-3 |
宋欣媛, 吴培福, 吴博, 等. 2018. 草甘膦和扑草净对蚯蚓体内SOD和AChE酶活性的影响[J]. 江西农业大学学报, 40(2): 371-377. |
薛黎明, 金玉娥, 张素慧, 等. 2020. 基于核磁共振氢谱的氟咯草酮90 d染毒大鼠尿液特征代谢物研究[J]. 环境与职业医学, 37(3): 197-204. |
Yang X, Song Y, Kai J, et al. 2012. Enzymatic biomarkers of earthworms Eisenia fetida in response to individual and combined cadmium and pyrene[J]. Ecotoxicology and Environmental Safety, 86(4): 162-167. |
Yang X X, Gong J P, Kai J R, et al. 2019. Method for determining CYP2C9 activity in earthworms and its responses to benzo a pyrene or pyrene in soil[J]. Clean-Soil Air Water, 47: 10. DOI:10.1002/clen.201800460 |
Yang X X, Song Y F, Kai J R, et al. 2012. Enzymatic biomarkers of earthworms Eisenia fetida in response to individual and combined cadmium and pyrene[J]. Ecotoxicology and Environmental Safety, 86: 162-167. DOI:10.1016/j.ecoenv.2012.09.022 |
杨晓霞, 龚久平, 杨俊英, 等. 2019. 基于探针底物法的高效液相色谱-串联质谱法研究蚯蚓体内CYP1A2、CYP2C9与CYP3A4酶活力[J]. 理化检验(化学分册), 55(10): 1117-1125. |
杨晓霞, 龚久平, 张伟, 等. 2019. 基于代谢组学指标的土壤亚致死剂量汞对蚯蚓的毒性研究[J]. 环境科学学报, 39(3): 312-322. |
Yuk J, Simpson M J, Simpson A J. 2011. 1-D and 2-D NMR metabolomics of earthworm responses to sub-lethal trifluralin and endosulfan exposure[J]. Environmental Chemistry, 8(3): 281-294. DOI:10.1071/EN11033 |
Zhao H Z, Li H, Chung A C K, et al. 2019. Large-scale longitudinal metabolomics study reveals different trimester-specific alterations of metabolites in relation to gestational diabetes mellitus[J]. Journal of Proteome Research, 18(1): 292-300. |
 2021, Vol. 41
2021, Vol. 41


