海洋中的微塑料(粒径小于5 mm的塑料颗粒)污染越来越受到重视, 其按照来源主要分为两大类, 原生微塑料和次生微塑料(Cole et al., 2011).原生微塑料指直接生产的粒径小于5 mm的塑料颗粒, 海洋中的原生微塑料主要来源于工业及人类生产生活中的直接排放, 包括工业生产中添加的微塑料(Barnes et al., 2009), 清洁和化妆品中(尤其为去角质类护肤品)添加的塑料微珠(Fendall et al., 2009; Cole et al., 2011; Napper et al., 2015; 刘强等, 2017), 以及通过清洗衣物而排放入生活污水中的衣服纤维等(Carr et al., 2016; Napper et al., 2016).次生微塑料则是指环境中的大粒径塑料在物理、化学、生物或人为等外界因素作用下, 粒径减小至5 mm以下而形成的塑料颗粒(Browne et al., 2007).
由于微塑料的粒径较小, 当它进入到海洋环境中后, 可能被海洋中不同类型的生物误食(赵淑江等, 2009; Cole et al., 2013; Davidson et al., 2016; Rummel et al., 2016), 对生物的生长发育产生不同的影响.野外调查以及实验室研究发现, 小到浮游动物, 大到大型鱼类都可以摄入微塑料, 这些进入生物体内的微塑料可以在生物体组织之间富集转移, 同时也可能会通过食物链进行传递.摄入的微塑料可能对生物体产生物理损伤, 包括对生物体组织的损伤以及消化道的堵塞等, 进而引起生物体产生饥饿(Cole et al., 2013; Rummel et al., 2016), 摄食、繁殖能力下降(Lee et al., 2013; de Sá et al., 2015), 出现炎症(Besseling et al., 2013; Wright et al., 2013), 甚至死亡(Oliveira et al., 2013; Mazurais et al., 2015)等情况.除此之外, 塑料生产过程中添加的各种添加剂(增塑剂, 阻燃剂等)也可能会对生物体产生毒性, 例如增塑剂(PAEs和PBDE等)可能会对海洋生物产生诸如内分泌混乱等影响(Oehlmann et al., 2009).
海洋浮游植物作为海洋生态系统的重要生产者, 在海洋食物链中起着十分重要的作用, 它作为污染物在食物链中富集的起点, 微塑料的存在对其生长的影响对整个海洋生态系统至关重要.目前关于微塑料对各种藻类的影响的研究结果不尽相同, 主要发现微塑料使藻类光合作用效率下降, 对其生长产生抑制等(Sjollema et al., 2016; Zhang et al., 2017; 姜航等, 2019), 对微塑料对藻类产生不利影响的机理目前主要基于微塑料与藻细胞的吸附及团聚作用影响藻细胞的物质及营养交换(Bhattacharya et al., 2010; Zhang et al., 2017; 王素春等, 2019), 以及改变体系浊度同时发生吸附改变离子水平进而影响藻细胞的生长和光合作用等(Nolte et al., 2017), 另外微塑料的表面电荷也可能会抑制藻类的生长(Bergami et al., 2017).然而, 微塑料对藻类的影响及毒作用机理目前仍不十分清楚.本实验选用海洋中的一种常见藻类海洋小球藻(Chlorella sp.), 其同时是海水养殖中常用的饵料生物, 探究了两种常见的微塑料聚苯乙烯微塑料(PS)和聚氯乙烯微塑料(PVC)对其生长的影响, 以及可能对其产生影响的途径.
2 材料和方法(Materials and methods) 2.1 实验材料实验所用海洋小球藻(Chlorella sp.)购于上海光语生物科技有限公司, 随后在实验室条件中用f/2培养基培养.培养条件光暗比为12 h∶12 h, 光照强度为6000 lux, 培养温度为20 ℃, 摇床转速为110 r·min-1.
实验所用的聚苯乙烯微塑料(PS, d = 150~200 μm)和聚氯乙烯微塑料(PVC, d=1~2 μm)均购于上海冠步机电科技有限公司.
灭菌f/2培养液配置:称取350 g海盐(人工海水观赏鱼类;中盐工程技术研究院有限公司, 天津)溶于20 L反渗透纯净水中(盐度为15 ‰), 曝气24 h后, 高压灭菌锅(D1-30;北京发恩科贸有限公司, 中国)灭菌, 在生物安全柜(HFaafe-1200LC;Heal Force, 中国)中于无菌状态下加入相关微量元素和维生素, 并将pH调至7.6~7.8后备用.
2.2 实验方法 2.2.1 小球藻生长实验根据OECD(2006)水生生物毒性测试方法, 小球藻生长培养在6孔板(TCP-011-006;广州洁特生物过滤股份有限公司, 中国)中进行.实验前向6孔板的每个孔中对应加入不同质量的PS或PVC塑料小球后, 加入5 mL f/2培养液振荡, 再加入适量藻液, 使每个孔中藻细胞的初始浓度为2×104个·mL-1, 根据预实验结果, 微塑料浓度为0、200、500、1000、2500、5000 mg·L-1(确保找到最低效应浓度).用无菌封口膜将6孔板封口后置于摇床上在20 ℃, 110 r·min-1, 光暗比为12 h∶12 h的条件下培养.为避免藻细胞颗粒和塑料颗粒相互作用影响藻细胞计数, 本研究选择用叶绿素测量法来表征小球藻的生长情况.培养96 h后将处于对数生长期的藻液用高速离心机(SL 16R;Thermo, 美国)离心(3000 r·min-1, 15 min)后取出藻细胞, 加入80%丙酮在黑暗条件下振荡24 h, 提取叶绿素, 并用酶标仪(Synergy H4;BioTek, 美国)测量叶绿素提取液在其最大的吸收波长处(663 nm, 645 nm)的吸光度, 通过计算得到藻液中的叶绿素含量.每个处理组3个平行, 对照组仅加入培养液与藻液.所有的实验均在无菌条件下进行.
2.2.2 微塑料浸出液对小球藻生长影响实验实验在6孔板中进行, 向6孔板的每个孔中加入不同质量的PS或PVC塑料小球后, 加入5 mL f/2培养液, 使微塑料浓度为0、200、500、1000、2500、5000 mg·L-1.用无菌封口膜封口后置于摇床上, 在20 ℃, 1000 r·min-1, 光暗比为12 h∶12 h的条件下振荡4 d后将培养液取出, 过滤后加入适量藻液, 使每个孔中藻细胞的初始浓度为2×104个·mL-1, 再次封口后置于摇床上, 在相同条件下继续培养4 d后取出藻液, 同样用丙酮提取叶绿素后在相同条件下测定并计算藻液中叶绿素的含量(同2.2.1节).每个处理组3个平行.所有的实验均在无菌条件下进行.
2.2.3 微塑料对光的遮蔽效应实验向6孔板的6个孔中加入不同质量的PS或PVC塑料小球后, 加入5 mL f/2培养液, 使微塑料浓度为0、200、500、1000、2500、5000 mg·L-1.振荡一段时间后用酶标仪测定不同处理组在可见光波段(380~780 nm)下透光率的变化.由于在小球藻的活体吸收谱中, 小球藻在470 nm及681 nm处有两个吸收峰(毛安军等, 2008), 即小球藻对该波长的光的吸收效率最高, 而酶标仪的面扫模式以10 nm为间隔, 因此, 选取380~780 nm中的470 nm及680 nm波长处的透光率来代表微塑料存在时小球藻可以利用的光照强度.
2.2.4 微塑料与小球藻的团聚效应测定为了观察微塑料存在时小球藻是否会与微塑料产生吸附团聚作用从而影响小球藻的物质交换, 抑制小球藻的生长, 对微塑料与小球藻的团聚效应进行了测定.小球藻与微塑料混合培养4 d后(与毒性实验设置一致), 将藻细胞离心(3000 r·min-1, 10 min), 加入2.5%戊二醛常温放置4 h;随后用磷酸盐缓冲液(0.2 mmol·L-1, pH=7.4)清洗3次;再用30%、50%、70%, 80%、90%、100%的乙醇梯度脱水;风干后置于导电胶上, 氮吹并镀金后将处理好的藻细胞置于扫描电镜(SEM, S-3400N Ⅱ;Hitachi, 日本)下观察.
2.3 分析方法 2.3.1 藻液的叶绿素含量计算藻液的叶绿素含量按式(1)~(3)计算:
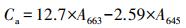
|
(1) |
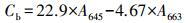
|
(2) |
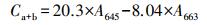
|
(3) |
式中, Ca为叶绿素a浓度;Cb为叶绿素b浓度;Ca+b为叶绿素浓度;A663为藻液在663 nm处的吸光度;A645为藻液在645 nm处的吸光度.
2.3.2 统计分析实验数据之间的显著性差异检验由SPSS 18.0(IBM公司, 美国)的ANOVA进行单因素方差分析, p < 0.05即为数据间具有显著性差异.
3 结果与讨论(Results and discussion) 3.1 微塑料对小球藻生长的影响实验结果表明低浓度条件下, PS(150~200 μm)和PVC(1~2 μm)微塑料都不会对小球藻的生长产生显著性抑制作用(图 1), 微塑料浓度在2500 mg·L-1及以下时, 不同处理组之间小球藻的生长状态相似并且与对照组没有显著性差异, 这说明微塑料对藻类产生毒性的最低浓度较高.当微塑料浓度增加到5000 mg·L-1时, PVC的存在才对小球藻的生长产生显著的抑制作用(p < 0.05), 抑制率达到30.65%, 而PS对小球藻生长抑制仍不显著, 且抑制率仅为9.07%. Sjollema等(2016)研究发现, 在微塑料浓度为250 mg·L-1时, 塑料粒径为50 nm的PS微塑料对杜氏盐藻(D. tertiolecta) 的生长产生抑制作用, 而粒径为0.5和6 μm的微塑料则没有产生显著影响;类似的, Besseling等(2014)研究结果显示, 纳米粒径的PS微塑料在浓度为44~1100 mg·L-1时会对藻类的生长产生抑制作用.本实验结果中表明当塑料粒径较大时(大于1 μm), 对藻类生长产生抑制作用不明显, 结合文献分析说明微塑料对藻类的抑制作用与微塑料的粒径有关.而在Zhang等(2017)的研究中, 低浓度PVC浓度(0~50 mg·L-1)也会对中肋骨条藻的生长产生显著性抑制, 文献中使用的PVC微塑料颗粒的粒径(1 μm)与本实验中相似, 这些差异可能与实验所用的藻的种类不同有关.由于微塑料污染具有聚集性且随洋流变化较大, 微塑料在海洋中的环境浓度范围较大, 不同海域的微塑料种类和浓度各不相同.在一定的范围内, 微塑料的浓度仍可能达到实验中所采用的高浓度(5000 mg·L-1), 因此, 实验中发现高浓度微塑料颗粒对小球藻的抑制作用仍具有一定环境意义.鉴于两种塑料种类的理化性质、结构、可能添加剂使用情况以及在水环境中的存在状态各有不同, 两种塑料对小球藻的生长的不同影响途径可能不同, 下文将对具体产生影响的途径进行进一步阐述.
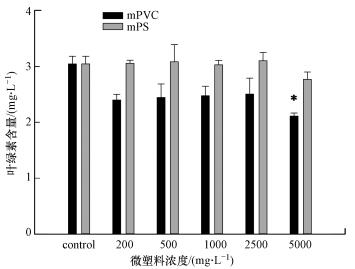 |
| 图 1 不同浓度微塑料暴露96 h后小球藻的叶绿素含量(*表示该实验组与control组有显著性差异(p < 0.05), 下同) Fig. 1 Chlorophyll content of Chlorella sp. after exposure to different concentrations of microplastics for 96 h(*indicating a significant difference between the experimental group and the control group (p < 0.05), the same below) |
小球藻生长实验结果表明, 微塑料对小球藻的毒性作用与塑料的种类以及浓度有关.微塑料对藻类产生毒性的原因可能包括物理损伤和化学毒性.物理损伤主要包括两个可能的方面:与小球藻发生吸附、团聚作用引起细胞的破裂;由于塑料颗粒的遮挡作用影响实验体系光强的变化.化学作用则主要由塑料在培养液中可能浸出的小分子物质或者塑料添加剂产生.本研究中分别对上述因素进行了探究.
3.2.1 微塑料浸出液的化学毒性两种微塑料的浸出液对小球藻的抑制作用与微塑料对小球藻的抑制作用相似, 在浓度低时没有明显的抑制作用, 只有当浓度为5000 mg·L-1时PVC(1~2 μm)处理组才显示出显著性的抑制作用(p < 0.05), 但是抑制作用仍然较弱(图 2).PVC微塑料浸出液对小球藻的抑制作用(11.05%)明显低于PVC微塑料对小球藻的整体毒性(30.65%), 而PS的浸出液毒性与PS的整体毒性相差不大(浸出液:7.92%, PS毒性:9.07%).这一结果表明PVC的毒性可能有一部分是由于微塑料浸出的有机物的化学毒性产生, 由于PVC塑料生产过程中常添加大量的添加剂, 例如最常见对生殖有影响的邻苯二甲酸酯增塑剂DEHP和其他两种常见的对水生生物有很强急性毒性的邻苯二甲酸二丁酯、苯二甲酸丁酯, 其含量明显高于PS (Lithner et al., 2011).由于添加剂通常不与聚合物基体结合, 且分子量小, 所以极易浸出和排放, 而添加剂通常为对生物体有害的物质, 如溴代阻燃剂, 邻苯二甲酸酯增塑剂和铅热稳定剂等, 现有的一些研究中也表明了这些塑料添加剂会对其他海洋生物体产生不利影响(Oehlmann et al., 2009).本实验的结果显示塑料添加剂的浸出可能是导致微塑料对藻类产生毒性的一个重要因素, 值得进一步进行探究.
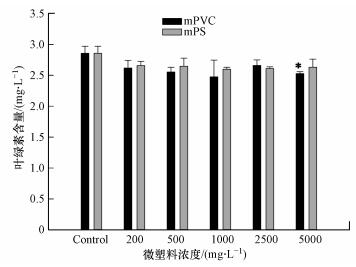 |
| 图 2 不同浓度微塑料浸出液暴露96 h后小球藻的叶绿素含量 Fig. 2 Chlorophyll content of Chlorella sp. after exposure to different concentrations of microplastics leach for 96 h |
实验发现, 由于其密度和表面化学性质差异, PS(150~200 μm)和PVC(1~2 μm)微塑料在实验体系中的存在状态有所不同, PS因其密度较低且粒径较大, 更倾向于漂浮在水面且由于表面张力作用聚集在水面中央.PVC则由于密度较大, 会部分悬浮或沉淀, 同时在水面会有一层薄膜形成, 且随着浓度的增加, 体系的浊度增大.不同的存在状态会直接影响微塑料对光的遮蔽效应, 这也可能是造成两种微塑料对小球藻毒性不同的原因.本实验中通过酶标仪测定小球藻主要吸收波段处(680 nm红光波段, 470 nm蓝光波段), 两种微塑料存在情况下光强的变化(图 3).结果表明, 随着PVC浓度的升高, 两个波长的光的透光率逐渐降低, 当PVC浓度达到2500 mg·L-1时, PVC的存在基本遮挡了所有光的通过;与此略有不同的是, 随着PS浓度的升高, 透光率有所下降, 但下降程度显著低于PVC, 在最高浓度(5000 mg·L-1)时, PS遮挡了51%(470 nm), 62%(680 nm)的光.这一结果说明, 微塑料对光的遮蔽也是其对小球藻生长产生抑制作用的一个因素, 尤其对于PVC而言, 这一影响可能更大. Shu等(2012)研究发现, 不同波长(蓝光, 红光)的光照射下, 小球藻的生长速率不同, 而PS和PVC对不同波段光的遮蔽作用不同, 这也可能导致其对小球藻生长的影响机制不同.如图 4所示, 在完全避光的状态下, 小球藻基本不生长, 说明高浓度的微塑料虽然在本实验体系中虽然能够基本完全遮挡垂直方向的直射光, 但生长过程中小球藻依然可以利用侧面获得的折射及反射光生长.目前已有的研究中, 遮蔽效应与藻类生长之间的关系研究较少.Zhang等(2017)研究表明浓度为0~50 mg·L-1时PVC的遮蔽效应对藻的生长没有影响.Sjollema等(2016)的研究中, 250 mg·L-1的微塑料使光强降低了34%, 藻的生长受到了抑制(降低45%).另外研究表明, 纳米材料的遮蔽效应也可能抑制藻类的生长(Schwab et al., 2011).本研究间接测定了微塑料存在时, 藻接触到的光强的变化, 在一定程度上证明了高浓度的微塑料对光有较强的遮蔽效应, 这对解释高浓度的微塑料对小球藻生长的抑制作用有一定的参考意义, 但除直射光以外, 研究同时也应考虑现实环境中广泛存在的折射光及散射光的存在, 以及微塑料对这些光源的影响.
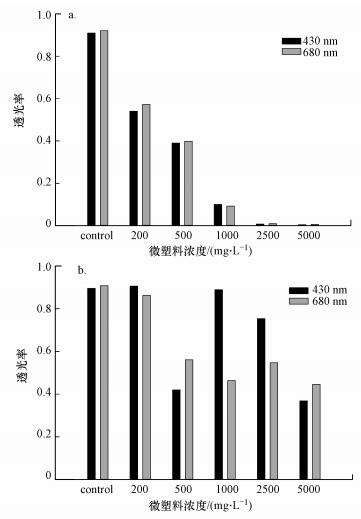 |
| 图 3 不同浓度的PVC(a)和PS(b)微塑料对光的遮蔽效应—以透光率作为指标 Fig. 3 The shading effect of different concentrations of PVC(a) and PS (b) microplastics— Take light transmittance as index |
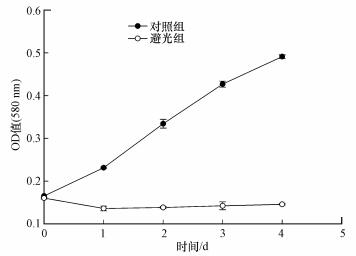 |
| 图 4 小球藻细胞浓度(OD值)随不同光处理组(未避光对照组和避光组)和光照时间(0~4 d)的变化 Fig. 4 The cell titer (OD value) of Chlorella sp. changed with different light treatment groups (control group and light-avoided group) and light time (0~4 d) |
当体系中加入PVC(1~2 μm)微塑料时, 在所有浓度组中都观察到了微塑料与藻细胞形成的异质团聚物(图 5), 但未观察到明显的浓度效应, 而PS(150~200 μm)组未观察到微塑料与藻细胞形成异质团聚物.这一结果可能由PVC塑料较小的粒径和较高的表面粘滞性共同影响造成.另外, 两种塑料的加入均未观察到藻细胞形态发生显著变化.这一结果显示, 高浓度的小粒径PVC(1~2 μm)对小球藻的生长抑制作用可能与异质团聚物的形成有关.Bhattacharya等(2010)的研究发现藻类(Chlorella和Scenedesmus)与纳米PS塑料间的吸附会阻碍藻类的光合作用, 促进其ROS的生成.Lagarde等(2016)的研究也发现, 20 d的暴露时间后, PP微塑料与藻类(Chlamydomas reinhardtii)以及藻类的胞外多糖形成了异质团聚物, 形成团聚物的藻类数量的增多与悬浮状态的藻细胞数量相对于对照组减少有直接关系.但是Long等(2017)的研究却发现, 虽然在藻类(Chaetoceros neogracile)处于稳定期时, PS微塑料与其生成了异质团聚物, 但这并没有抑制藻类的生长.这些结果表面微塑料与藻类形成异质团聚物是否会影响藻类的生长可能与藻和微塑料的种类有关.Bhattacharya等(2010)的研究发现, 由于纤维素中的羧基和硫酸盐基团的静电斥力使得带正电荷的PS对藻类的结合亲和力高于带负电荷的PS, 淡水小球藻与带正电荷的PS微塑料(20 nm)的吸附量随着浓度的增加而迅速增加, 而其对带负电荷的PS(20 nm)的吸附几乎可以忽略不计.这一结果与Bergami等的研究结果一致(Bhattacharya et al., 2010; Bergami et al., 2017), Nolte等(2017)的研究也发现, 藻类(P. subcapitata)与纳米PS微塑料(50~500 nm)的吸附作用与水硬度以及塑料表面电荷有关.异质团聚物的形成会影响藻细胞的物质和能量交换, 进而会影响相关的生理过程, 因此, 后续关于塑料种类和粒径大小对异质团聚物的形成及其对藻细胞生长及其机制值得进一步研究.
 |
| 图 5 微塑料作用下的小球藻SEM图(a.对照组;b.PS处理组;c, d.PVC处理组;e.PVC处理组局部放大图.白色箭头指向藻细胞, 黑色箭头指向微塑料) Fig. 5 SEM of Chlorella sp. with microplastics(a.Control group; b.PS treatment group; c, d. PVC treatment group; e. Partial enlargement of PVC treatment group. The white arrows point to the algal cells, the black arrows point to the microplastics) |
本实验通过探究PS(150~200 μm)和PVC(1~2 μm)微塑料对小球藻的毒性作用及其可能的影响途径, 揭示了高浓度的微塑料可能会通过释放可溶性物质, 对光产生遮蔽效应, 以及与藻细胞形成异质团聚物等途径对藻类的生长产生抑制.同时, 不同类型的微塑料对藻类的毒性不同, 其对小球藻生长产生影响的途径也有所差异:PS(150~200 μm)微塑料对小球藻的毒性主要来源于浸出的有机物质, 而粒径较小的PVC(1~2 μm)微塑料除浸出液造成毒性外, 对光较强的遮蔽效应以及形成的异质团聚物也是其对小球藻产生毒性的主要途径.本研究结果对理解微塑料对浮游植物的影响并进一步评价微塑料的环境风险有一定的参考价值.另外, 真实环境中微塑料由于其表面物理化学性质改变, 或者吸附环境中其他污染物导致其对藻类的毒性及作用机理的改变也值得进一步关注.
Barnes D K A, Galgani F, Thompson R C, et al. 2009. Accumulation and fragmentation of plastic debris in global environments[J]. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences, 364(1526): 1985-1998. DOI:10.1098/rstb.2008.0205 |
Bergami E, Pugnalini S, Vannuccini M L, et al. 2017. Long-term toxicity of surface-charged polystyrene nanoplastics to marine planktonic species Dunaliella tertiolecta and Artemia franciscana[J]. Aquatic Toxicology, 189: 159-169. DOI:10.1016/j.aquatox.2017.06.008 |
Besseling E, Wang B, Luerling M, et al. 2014. Nanoplastic affects growth of S. obliquus and reproduction of D. magna[J]. Environmental Science & Technology, 48(23): 14065-14065. |
Besseling E, Wegner A, Foekema E M, et al. 2013. Effects of microplastic on fitness and PCB bioaccumulation by the Lugworm Arenicola marina (L.)[J]. Environmental Science & Technology, 47(1): 593-600. |
Bhattacharya P, Lin S, Turner J P, et al. 2010. Physical adsorption of charged plastic nanoparticles affects algal photosynthesis[J]. Journal of Physical Chemistry C, 114(39): 16556-16561. DOI:10.1021/jp1054759 |
Browne M A, Galloway T, Thompson R. 2007. Microplastic-an emerging contaminant of potential concern?[J]. Integrated Environmental Assessment and Management, 3(4): 559-561. |
Carr S A, Liu J, Tesoro A G. 2016. Transport and fate of microplastic particles in wastewater treatment plants[J]. Water Research, 91(15): 174-182. |
Cole M, Lindeque P, Fileman E, et al. 2013. Microplastic ingestion by zooplankton[J]. Environmental Science & Technology, 47(12): 6646-6655. |
Cole M, Lindeque P, Halsband C, et al. 2011. Microplastics as contaminants in the marine environment: A review[J]. Marine Pollution Bulletin, 62(12): 2588-2597. DOI:10.1016/j.marpolbul.2011.09.025 |
Davidson K, Dudas S E. 2016. Microplastic ingestion by wild and cultured Manila Clams (Venerupis philippinarum) from Baynes Sound, British Columbia[J]. Archives of Environmental Contamination and Toxicology, 71(2): 147-156. DOI:10.1007/s00244-016-0286-4 |
de Sá L C, Luís L G, Guilhermino L. 2015. Effects of microplastics on juveniles of the common goby (Pomatoschistus microps): Confusion with prey, reduction of the predatory performance and efficiency, and possible influence of developmental conditions[J]. Environmental Pollution, 196: 359-362. DOI:10.1016/j.envpol.2014.10.026 |
Fendall L S, Sewell M A. 2009. Contributing to marine pollution by washing your face: Microplastics in facial cleansers[J]. Marine Pollution Bulletin, 58(8): 1225-1228. DOI:10.1016/j.marpolbul.2009.04.025 |
姜航, 丁剑楠, 黄叶菁, 等. 2019. 聚苯乙烯微塑料和罗红霉素对斜生栅藻(Scenedesmus obliquus)和大型溞(Daphnia magna)的联合效应研究[J]. 生态环境学报, 28: 1457-1465. |
Lagarde F, Olivier O, Zanella M, et al. 2016. Microplastic interactions with freshwater microalgae: Hetero-aggregation and changes in plastic density appear strongly dependent on polymer type[J]. Environmental Pollution, 215: 331-339. DOI:10.1016/j.envpol.2016.05.006 |
Lee K W, Shim W J, Kwon O Y, et al. 2013. Size-dependent effects of micro polystyrene particles in the marine copepod Tigriopus japonicus[J]. Environmental Science & Technology, 47(19): 11278-11283. |
Lithner D, Larsson A, Dave G. 2011. Environmental and health hazard ranking and assessment of plastic polymers based on chemical composition[J]. Science of the Total Environment, 409(18): 3309-3324. DOI:10.1016/j.scitotenv.2011.04.038 |
刘强, 徐旭丹, 黄伟, 等. 2017. 海洋微塑料污染的生态效应研究进展[J]. 生态学报, 37: 7397-7409. |
Long M, Paul-Pont I, Hégaret H, et al. 2017. Interactions between polystyrene microplastics and marine phytoplankton lead to species-specific hetero-aggregation[J]. Environmental Pollution, 228: 454-463. DOI:10.1016/j.envpol.2017.05.047 |
Mazurais D, Ernande B, Quazuguel P, et al. 2015. Evaluation of the impact of polyethylene microbeads ingestion in European sea bass (Dicentrarchus labrax) larvae[J]. Marine Environmental Research, 112: 78-85. DOI:10.1016/j.marenvres.2015.09.009 |
毛安君, 王晶, 林学政, 等. 2008. 光谱对小球藻和等鞭金藻生长的影响[J]. 光谱学与光谱分析, 28: 991-994. DOI:10.3964/j.issn.1000-0593.2008.05.008 |
Napper I E, Bakir A, Rowland S J, et al. 2015. Characterisation, quantity and sorptive properties of microplastics extracted from cosmetics[J]. Marine Pollution Bulletin, 99(1/2): 178-185. |
Napper I E, Thompson R C. 2016. Release of synthetic microplastic plastic fibres from domestic washing machines: Effects of fabric type and washing conditions[J]. Marine Pollution Bulletin, 112(1): 39-45. |
Nolte T M, Hartmann N B, Kleijn J M, et al. 2017. The toxicity of plastic nanoparticles to green algae as influenced by surface modification, medium hardness and cellular adsorption[J]. Aquatic Toxicology, 183: 11-20. DOI:10.1016/j.aquatox.2016.12.005 |
Oehlmann J, Schulte-Oehlmann U, Kloas W, et al. 2009. A critical analysis of the biological impacts of plasticizers on wildlife[J]. Philosophical Transactions of the Royal Society B-Biological Sciences, 364(1526): 2047-2062. DOI:10.1098/rstb.2008.0242 |
Oliveira M, Ribeiro A, Hylland K, et al. 2013. Single and combined effects of microplastics and pyrene on juveniles (0+group) of the common goby Pomatoschistus microps (Teleostei, Gobiidae)[J]. Ecological Indicators, 34: 641-647. DOI:10.1016/j.ecolind.2013.06.019 |
Rummel C D, L der M G J, Fricke N F, et al. 2016. Plastic ingestion by pelagic and demersal fish from the North Sea and Baltic Sea[J]. Marine Pollution Bulletin, 102(1): 134-141. DOI:10.1016/j.marpolbul.2015.11.043 |
Schwab F, Bucheli T D, Lukhele L P, et al. 2011. Are carbon nanotube effects on green algae caused by shading and agglomeration?[J]. Environmental Science & Technology, 45(14): 6136-6144. |
Shu C H, Tsai C C, Liao W H, et al. 2012. Effects of light quality on the accumulation of oil in a mixed culture of Chlorella sp. and Saccharomyces cerevisiae[J]. Journal of Chemical Technology & Biotechnology, 87(5): 601-607. |
Sjollema S B, Redondo-Hasselerharm P, Leslie H A, et al. 2016. Do plastic particles affect microalgal photosynthesis and growth?[J]. Aquatic Toxicology, 170: 259-261. DOI:10.1016/j.aquatox.2015.12.002 |
王素春, 刘光洲, 张欢, 等. 2019. 微塑料对微藻的毒性效应研究进展[J]. 海洋环境科学, 38: 192-197. |
Wright S L, Thompson R C, Galloway T S. 2013. The physical impacts of microplastics on marine organisms: A review[J]. Environmental Pollution, 178: 483-492. DOI:10.1016/j.envpol.2013.02.031 |
Zhang C, Chen X, Wang J, et al. 2017. Toxic effects of microplastic on marine microalgae Skeletonema costatum: Interactions between microplastic and algae[J]. Environmental Pollution, 220: 1282-1288. DOI:10.1016/j.envpol.2016.11.005 |
赵淑江, 王海雁, 刘健. 2009. 微塑料污染对海洋环境的影响[J]. 海洋科学, 3: 86-88. |
 2021, Vol. 41
2021, Vol. 41


