2. 华中农业大学微生物学国家重点实验室, 武汉 430070
2. State Key Laboratory of Agricultural Microbiology, Huazhong Agricultural University, Wuhan 430070
快速的城市化和工业化导致了环境污染, 其中农业土壤重金属污染已成为普遍存在的严重问题(Li et al., 2014; Zhang et al., 2015).人为活动, 例如采矿、冶炼、工业、污水灌溉、城市发展和施肥等人类活动是土壤重金属富集的主要来源(吴敏等, 2014; Lu et al., 2015).由于其高毒性, 镉(Cd2+)在土壤中是最受关注的.土壤重金属Cd2+污染会对土壤生态系统和持续生产力产生明显的负面影响(张红云, 2018).其次, 土壤中的镉可通过土壤-作物系统和食物链途径威胁人类健康(Aksoy et al., 2014; Meng et al., 2014).研究证明镉进入人体可以引起各种疾病, 例如骨骼病变, 肝肾功能和肺功能损害等(Chakravarty et al., 2010; Khan et al., 2016).因此, 对于土壤重金属污染的修复迫在眉睫.
研究发现利用微生物进行原位金属稳定化是在土壤Cd污染修复中非常有用的方法(Beesley et al., 2013; Marques et al., 2013; Ahmad et al., 2014).微生物, 如巨大芽胞杆菌Bacillus megaterium SR28C、根瘤菌属Neorhizobium huautlense T1-17和无色青霉菌Penicillium chrysogenum XJ-1已被用于降低土壤中的金属有效性并减少植物镉吸收(Rajkumar et al., 2013; Xu et al., 2015; Wang et al., 2016; Li et al., 2016).为了进一步提高重金属固定化效率, 研究人员已开发多种表面改性的生物吸附剂.改性的生物吸附剂具有更高的清除目标金属离子的能力.例如, 用戊二醛交联胱氨酸修饰后的酵母细胞显著提高了对重金属镉离子的吸附作用(Yu et al., 2007); 使用聚烯丙胺逐层育肥策略改良内生细菌, 构建了重金属镉和铜离子吸附能力强的新型生物吸附剂(Luo et al., 2014); 基于聚乙烯亚胺-聚枫改性的大肠杆菌显著增加了对酸性废水中Pb2+的吸附.然而, 此类化学修饰方法具有操作繁琐, 成本高昂等缺点, 其应用受到限制(Xu et al., 2017).假设在培养条件下仅需提供特定的盐, 便可以获得理想的生物吸附剂, 这将是一种简单, 环保且节能的方法.
拉乌尔菌Raoultella sp. X13是实验室前期从镉污染土壤中分离纯化出来的一株镉抗性菌株, 具有溶解无机磷、产吲哚乙酸及铁载体等促生特性和较强的Cd2+吸附能力(Xu et al., 2019).此外, 施加菌剂X13到Cd2+污染土壤中可以促进小白菜生长并提高了产量, 并降低了小白菜对Cd2+生物利用度(Xu et al., 2019).菌剂X13在Cd污染土壤原位修复以及可持续农业生产中有着潜在应用.因此, 本研究希望通过在菌剂X13培养过程中选择常见农业化肥作为替代盐提高其Cd2+吸附固定能力, 以期为重金属镉污染修复提供新的生物修复剂.
2 材料与方法(Materials and methods) 2.1 试剂及培养基试剂:无特殊说明, 本研究所用化学试剂都为分析纯.
LB培养基:蛋白胨10.00 g·L-1, 酵母粉5.00 g·L-1, NaCl 10.00 g·L-1, pH为7.0~7.2.固体LB则加入1.5%的琼脂粉.高压蒸汽灭菌121 ℃, 30 min, 备用.
Cd(NO3)2母液配制(104 mg·L-1):准确称取2.74 g Cd(NO3)2·4H2O溶解于双蒸水, 同时加入几滴2%的浓硝酸以防止沉淀产生, 容量瓶定容.最后用0.22 μm的无菌滤膜进行过滤除菌, 保存于4 ℃冰箱备用.
2.2 供试菌株及接种液的制备供试细菌Raoultella sp.X13是具有多种重金属(Cd2+、Cu2+、Mn2+、Zn2+、Pb2+、Co2+)耐受性的革兰氏阴性菌, 其16S rDNA序列已经提交到了NCBI GenBank, 序列号为MH645797.将菌株接种到LB中并在28 ℃, 180 r·min-1摇床培养12 h, 然后通过离心(8000 r·min-1, 15 min)收集细胞, 用灭菌去离子水洗涤3次, 并重悬于灭菌去离子水中使初始OD600为0.5.将该悬浮液作为细菌接种液用于随后的接种实验.
2.3 筛选增强菌株X13对Cd2+吸附的有效盐为了筛选能够增加菌株X13表面吸附能力的有效盐, 选择常见钾盐和铵盐, 包括KCl、K2SO4、(NH4)2SO4和NH4Cl替代LB培养基中的NaCl, 蛋白胨和酵母粉含量不变, 作为改进型LB培养基.改进型LB培养基各盐分含量计算如下:根据氯元素含量相同, 加入改进型LB培养基中KCl和NH4Cl分别为12.76 g·L-1和9.15 g·L-1; 同样地依据加入的钾和铵根离子的含量, K2SO4和(NH4)2SO4加入的含量分别为14.90 g·L-1和11.33 g·L-1.
随后将接种液按照1%分别接种至灭菌后典型LB和改进型LB培养基中, 在180 r·min-1和28 ℃下孵育48 h后收集生物量.通常, 培养在典型LB培养基中生物量收集过程如下:在4 ℃以8000 r·min-1离心15 min收获活细胞生物量, 同时在离心收集死细胞生物量之前先于121 ℃高压灭菌20 min (Huang et al., 2013).收集的细胞沉淀用蒸馏去离子水清洗3次, 洗去残留的培养基.把典型培养基LB中收集到的活吸附剂命名为R1-l, 死生物量命名为R1-d.按照上述方法, 分别从KCl、K2SO4、(NH4)2SO4和NH4Cl改进型LB培养基中培养和收集微生物吸附剂, 活吸附剂依次命名为R2-l、R3-l、R4-l和R5-l, 死吸附剂依次命名为R2-d、R3-d、R4-d和R5-d.活细胞和死细胞吸附剂均在4 ℃下保存备用.在用于生物吸附实验之前, 先用去离子水悬浮, 在80 ℃下干燥至恒重, 以克(干重)/毫升计算生物吸附剂的浓度(Xu et al., 2019).
为了证明添加的盐主要是通过代谢方式影响菌体的吸附能力, 制备了另一组生物吸附剂.具体做法如下:分别利用KCl、K2SO4、(NH4)2SO4和NH4Cl纯盐水溶液处理活吸附剂R1-l, 其浓度和添加到改性LB培养基浓度相同.按照上述方法收集生物量, 并分别命名为pR2-l、pR3-l、pR4-l、pR5-l和pR6-l.同时以10 g·L-1 NaCl盐溶液处理的活吸附剂R1-l, 作为对照, 命名为pR1-l.
通过吸附试验确定有效盐, 简言之, 1.00 g·L-1生物吸附剂添加到20.00 mL含1 mmol·L-1 Cd2+的水溶液中, 初始pH为7, 在28 ℃和180 r·min-1下振荡2 h, 以6000 r·min-1离心8 min收集上清液.使用原子吸收光谱仪(AAS)测定上清液中残留的Cd2+浓度.通过以下公式计算生物吸附容量和Cd2+去除率的值.

|
(1) |

|
(2) |
式中, qe为生物吸附剂上的平衡Cd2+浓度(mg·g-1干细胞), m为生物质浓度(g·L-1干细胞), C0和Ce分别为初始和平衡金属浓度(mg·L-1).
2.3 傅里叶变换红外光谱(FTIR)分析在确定添加NH4Cl可以显著提高X13对镉吸附后, 使用FTIR光谱法分析菌剂R1-l和R5-l的结构和组成特征.在FTIR分析之前, 首先样品进行真空冷冻干燥, 然后将干燥的样品与溴化钾(KBr, 光谱纯度)按照约∶100的比例混合, 并在玛瑙研钵中混合并彻底研磨(Drake et al. 1996).通过台式压力机在8吨压力下压制研磨材料制备的半透明片剂, 最后在红外光谱仪上4000~400 cm-1的范围内分析, 分辨率为4 cm-1.镉处理前后样品的结构和组成特征按照相同的方法进行FTIR光谱法分析.
2.4 批量吸附试验为了分析不同环境因素对生物吸附剂R5-l吸附Cd2+的影响, 探究了不同初始pH值、不同初始Cd2+浓度、接触时间和温度等影响因素.为了确定初始pH对Cd2+生物吸附的影响, 通过将1.00 g·L-1生物吸附剂与20 mL不同pH(4、5、6、7和8)的设置溶液混合, 进行批量生物吸附实验, Cd2+初始浓度为1 mmol·L-1, pH用0.10 mol·L-1 NaOH和0.10 mol·L-1 HCl调节.在28 ℃, 180 r·min-1摇床温育2 h后, 离心(6000 r·min-1, 8 min)收集上清液.使用原子吸收光谱仪(AAS)测定溶液中残留的Cd2+浓度.为了确定Cd2+浓度, 接触时间和不同温度对Cd2+生物吸附的影响, 分别研究不同初始金属浓度(0.25~4 mmol·L-1), 接触时间(5~300 min), 不同初始温度(15~40 ℃)的影响.所有实验均进行3个重复.
2.5 吸附热力学和吸附动力学拟合通常Langmuir或Freundlich吸附等温线用于描述生物吸附平衡(Masoudzadeh et al., 2011; Khadivinia et al., 2014).这些模型可以提供有关金属吸收能力以及金属与生物吸附剂之间亲和力的信息(Han et al., 2005).同时使用动力学模型分析数据研究吸附机理和限速步骤(Cordero et al., 2004).伪一级动力学和伪二级动力学模型经常被用于描述生物吸附动力学数据(Masoudzadeh et al., 2011).
2.6 评估去除废水中Cd2+的试验将采集自华中农业大学微生物学国家重点实验室的重金属废水用于评估吸附剂R5-l对Cd2+去除效果及其潜在应用.简而言之, 将2.00 g L-1吸附剂R5-l加入含有20.00 mL重金属污染的废水的三角锥形瓶中, 在28 ℃, 180 r·min-1振荡6 h, 取样离心(6000 r·min-1, 8 min)收集上清液.重金属废水及上清液中的金属离子使用电感耦合等离子体质谱法(ICP-MS)测定.所有实验均进行3个重复.
3 结果与讨论(Results and discussion) 3.1 特定盐的筛选图 1a显示的不同培养基条件下的生物吸附剂对Cd2+吸附能力.从图 1a可知, 对照组R1-l对Cd2+吸附量为45.00 mg·g-1, 和对照组R1-l相比, R2-l、R3-l、R4-l和R5-l对Cd2+吸附效果都有不同程度的增加.其中, R5-l对Cd2+吸附能力显著增加, 为66.40 mg·g-1, 增加了47.30%.这些结果表明, NH4Cl作为改性盐可以显著提高菌体X13对Cd2+的吸附效果.除此, 非灭活生物吸附剂对Cd2+吸附量都显著高于高压灭活后生物吸附剂(图 1a).先前研究已经发现高压灭菌处理影响细胞表面结构(Xu et al., 2019), 这可能影响其吸附特性.用纯试剂溶液处理的所有活生物吸附剂(pR1-l、pR2-l、pR3-l、pR4-l和pR5-l)对Cd2+吸附数据如图 1b所示, 其吸附量并没有显著性差异.这说明细胞通过代谢活性修饰细菌表面对增加其Cd2+吸附至关重要(Xu et al., 2017).基于上述结果, 选择吸附剂R5-l用于后续试验.
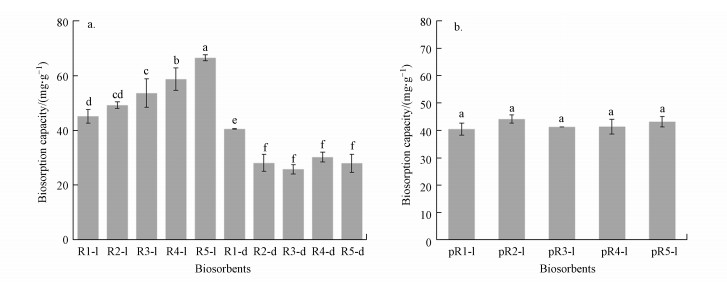 |
| 图 1 不同的盐改进型LB培养基中生长(a)和纯盐溶液处理(b)的拉乌尔菌X13的生物吸附能力 Fig. 1 Biosorption capacity of Raoultella sp. X13 (a) grown in different salt modified LB media and (b) immersed in pure salt solution |
图 2表示的是生物吸附剂R1-l和Cd2+处理前后R5-l的FTIR图.根据先前的报道分析和鉴定特征峰所对应的典型官能团(Xia et al., 2015).结果显示菌剂R1-l表面存在—OH(3315.05 cm-1)、—CH2(2929.13 cm-1)、CO(1659.23 cm-1)、N—H(1532.46 cm-1)、—COO(1392.06 cm-1)、—SO3 (1242.86 cm-1)、C—N(1073.52 cm-1)和磷酸盐或硫酸盐等官能团(668.76 cm-1).已有研究表明细胞表面官能团可以用来固定各种金属离子(Wei et al., 2006).同时, FTIR分析显示, 改性吸附剂R5-l图谱和对照R1-l图谱相比, 其红外光谱基本相似, 有着相似官能团.但在大约在3780 cm-1处增加了一个明显的投射峰(图 2), 主要是由细胞中碳水化合物中O—H键引起的.除此, 和对照组相比R1-l, 改性吸附剂R5-l表面—OH(3302.01 cm-1), —SO3(1239.17 cm-1)和磷酸盐或硫酸盐(538.28 cm-1)等官能团所对应的特征峰峰值显著降低, 而N—H(1543.71 cm-1)、—COO(1392.06 cm-1)、C—N(1083.25 cm-1)等处的峰值显著增加.这些结果表明引入NH4Cl改变了细胞表面微结构, 同时增加了改性吸附剂R5-l结合活性位点.这可能是改性吸附剂R5-l有强吸附能力的主要原因.
 |
| 图 2 生物吸附剂R1-l和Cd2+处理前后R5-l的红外光谱图 Fig. 2 FTIR spectra of biosorbents R1-l, R5-l, and R5-l treated Cd2+ |
为了明确参与Cd2+结合固定的官能团, 使用FTIR分析了Cd2+处理前后的吸附剂R5-l(图 2).图 2显示1 mmol·L-1或2 mmol·L-1 Cd2+处理后的R5-l的FTIR光谱形态和未经Cd2+处理R5-l图谱形态相似.然而, 由于重金属Cd2+的吸附, 在3302.01 cm-1处的峰值显着增加, 表明—OH基团参与Cd2+生物吸附.在1543.71、1401.78、1083.25和538.28 cm-1峰值显著降低, 表明官能团N—H、—COO、C—N和磷酸盐或硫酸盐基团参与参与Cd2+生物结合.此外, —CH2(2928.27 cm-1)、—SO3(1239.17 cm-1)基团的峰值略有变化, 也可能参与Cd2+吸附.峰值变化表明Cd2+生物吸附可能主要与官能团—OH、N—H、—COO、CN、磷酸盐或硫酸盐基团有关.
3.3 pH、初始镉浓度、接触时间和温度对生物吸附影响pH是影响重金属生物吸附过程的重要因素(Khadivinia et al., 2014).从图 3a可知, 初始溶液pH明显地影响吸附剂R5-l对Cd2+的去除.随着pH增加, 吸附剂R5-l对镉的吸附量逐渐增加, 在pH 6.0时吸附量达到最大, 为61.64 mg·g-1.随后随着pH继续增加, 吸附量急剧下降.其他研究者也发现微生物吸附剂对重金属离子的吸附能力随着pH的增加而增加, 在达到最大吸附容量后开始下降(Cordero et al., 2004; Huang et al., 2013b).
 |
| 图 3 环境因素pH(a), 接触时间(b), 初始Cd2+浓度(c)和温度(d)对生物吸附Cd2+的影响 Fig. 3 Effect of environmental factors on Cd2+ biosorption (a. pH, b. contact time, c. Cd2+ concentration, d. Temperature) |
接触时间对吸附剂R5-l在1 mmol·L-1 Cd2+初始金属浓度下对Cd2+的生物吸附的影响如图 3b所示.从图 3b可知, 在达到吸附平衡前存在两个明显的吸附过程, 首先是快速吸附阶段, 在30 min内Cd2+吸附量急剧增加; 其次是缓慢吸附阶段, 在此过程, Cd2+吸附缓慢增加, 直到120 min达到吸附平衡, 吸附量为51.64 mg·g-1.研究发现快速吸附过程不依赖于代谢, 主要通过物理吸收、离子交换和与生物质表面上的官能团的化学络合来实现(Zou et al., 2014).吸附达到平衡后, 吸附量并不会随接触时间增加而发生显着差异.类似的结果在其他微生物吸附剂, 包括细菌、真菌和藻类中也有发现(Zou et al., 2014; Zhu et al., 2016; Hang et al., 2016).
初始镉浓度对吸附剂吸附Cd2+的影响如图 3c所示.初始Cd2+浓度的增加导致金属Cd2+吸收的增加, 然而这种增加是不持续的, 在高的Cd2+浓度下达到吸附平衡.本研究中, 在高浓度Cd2+下, 吸附剂的最大生物吸附能力为71.82 mg·g-1.同时, 本试验评估了5种初始温度(15、20、25、30、35和40 ℃)下吸附剂R5-l对Cd2+吸附能力(图 3d).结果显示温度对Cd2+生物吸附没有显着影响(图 3d), 这表明吸附剂R5-l对Cd2+的生物吸附在一定温度范围内是稳定的.已有研究证实温度不是影响微生物吸附剂吸附Cd2+的主要因素(Masoudzadeh et al., 2011; Limcharoensuk et al., 2015), 这可能由于生物吸附过程主要是物理化学过程, 与能量无关(Zakeri et al., 2010).
3.4 吸附热力学和吸附动力学模型Langmuir和Freundlich等温模型用于分析本试验生物吸附Cd2+的数据, 其线性化等温线图如图 4所示.表 1列出了线性化Langmuir和Freundlich模型的各参数.通过比较相关系数R2值(表 1), 发现Langmuir线性化模型获得的R2值高于Freundlich模型获得的R2值, 表明R5-l生物物吸附Cd2+的过程更加符合Langmuir吸附模型.这证明对Cd2+的生物吸附可能是单层吸附.同时根据Langmuir等温模型, 预测的R5-l对Cd2+生物吸附的最大值(qmax)为76.92 mg·g-1.Langmuir模型方程见式(3)(Masoudzadeh et al., 2011).

|
(3) |
 |
| 图 4 Langmuir (a)和Freundlich (b)吸附等温线模型拟合图 Fig. 4 Adsorption isotherms (a) Langmuir and (b) Freundlich fitting plot |
| 表 1 Langmuir和Freundlich模型拟合生物吸附剂R5-l吸附Cd2+数据的相关常数 Table 1 Constants of the Langmuir and Freundlich models for Cd2+ biosorption using biosorbent R5-l |
式中, qe为在平衡浓度下吸附的金属离子的量(mg·g-1), qmax为每单位重量生物吸附剂在高Ce时表面上形成完整的单层的最大金属离子量, Ce为金属离子平衡浓度, 朗缪尔常数b(L·mg-1)代表被吸附物在生物吸附剂上结合位点的亲和力.在该Cd2+吸附试验中, 基于Langmuir模型方程计算出平衡吸附量qe为50.26 mg·g-1, 与实际测得平衡吸附量的值(51.64 mg·g-1)相差不大.因此, Langmuir模型可以准确的拟合本试验生物吸附Cd2+的数据.
除此, 无量纲常数分离因子(RL)用于评估Cd2+与生物吸附剂之间的亲和力.RL的值使用式(4)计算:
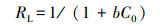
|
(4) |
式中, b为朗缪尔常数(L·mg-1), C0为初始金属浓度(mg·L-1).参数RL表示等温线的形状和生物吸附过程的性质(不可逆RL = 0, 有利0 < RL < 1, 线性RL = 1或不利RL> 1)(Won et al., 2010).
在本研究的初始浓度(0.25~4 mmol·L-1)下, RL值在0.07~0.55范围内, 这表明吸附剂R5-l对Cd2+具有良好的亲和力.
3.5 吸附动力学模型动力学模型伪一级动力学和伪二级动力学模型经常被用于描述生物吸附动力学数据(Khraisheh et al., 2016).从线性化图(图 5)发现生物吸附剂R5-l伪二级动力学模型获得的相关系数R2值(0.99)大于使用伪一阶模型得到的R2值(0.94), 说明伪二级动力学模型比伪一级动力学模型更符合获得的R5-l吸附数据.该结果表明, 吸附剂R5-l对镉的吸附效果依赖于官能团等活性结合位点.综上, 相对于对照组R1-l, 改进型的吸附剂R5-l显著增强了对Cd2+的吸附效果, 并且对Cd2+具有良好的亲和力.因此, 有必要进一步评估其在重金属污染废水中的应用潜力.
 |
| 图 5 Pesudo-first-order (a) and pseudo-second-order (b) 吸附动力学模型拟合图 Fig. 5 The plots of biosorption kinetic analysis (a) pesudo-first-order and (b) pseudo-second-order kinetics |
从测定的数据来看(表 2), 废水中含有多种重金属离子, 例如, Cd2+、Mn2+、Zn2+、Pb2+、Cu2+和Co2+.其中, Cd2+浓度最高为21.34 mg·L-1.从表 2可知, 吸附剂R5-l可以有效的去除废水中的多种金属离子. 在加入2.00 g·L-1吸附剂R5-l处理6 h后, 废水中85.01% Cd2+被有效去除.同时, 对于废水中Mn2+、Zn2+、Pb2+、Cu2+和Co2+, 去除率都超过了63.00%, 依次为75.39%、73.06%、92.73%、66.82%和63.72%.这些结果表明, 改性吸附剂R5-l是一种有前途的生物吸附剂, 可用于Cd2 +污染的生物修复.
| 表 2 生物吸附剂R5-l处理前后废水样品中金属含量及金属去除率 Table 2 The metal content in raw wastewater samples before and after adsorption by biosorbent R5-l and the corresponding metal removal efficiency |
前期的研究结果表明, 接种改性前的促生镉抗性菌株X13到Cd污染土壤中显著提高小白菜产量, 并减少了小白菜对Cd2+的吸收, 其主要通过生物矿化CdS将生物可利用的Cd转移为无机结合部分(Xu et al., 2019).在该研究中, 经NH4Cl改性的菌株X13显著提高了对重金属的吸附作用.因此, 本研究结果为菌株X13在Cd污染土壤原位修复提供了一种新的方法, 即在接种菌剂的X13同时配施化肥NH4Cl, 使其在促生和重金属稳定化起到锦上添花的作用.相关试验将在下一步研究中开展.
4 结论(Conclusions)本研究通过NH4Cl改进型培养基培养获得了新型改性吸附剂R5-l, 这种方法成本低廉, 操作简单.相比于R1-l, 改性吸附剂R5-l显著增强了对Cd2+的吸附能力.结果表明细胞代谢修饰细菌表面是增加Cd2+吸附的关键所在.生物吸附过程受pH、初始Cd2+浓度和接触时间的影响.R5-l对Cd2+的吸附数据符合Langmuir等温线模型, 吸附动力学符合伪二级动力学模型.R5-l生物吸附Cd2+的最大值(qmax)为76.92 mg·g-1.FTIR分析显示R5-l表面存在—OH、N—H、—COO、CN, 磷酸盐或硫酸盐基团等官能团, 并参与Cd2+离子的生物吸附.Cd2+的去除试验证明R5-l可以有效的处理废水中的Cd2+等多种金属离子.因此, 改性吸附剂R5-l可以作为重金属Cd2+的潜在微生物修复剂, 并在可持续农业生产中有着潜在应用.
Ahmad M, Rajapaksha A U, Lim J E, et al. 2014. Biochar as a sorbent for contaminant management in soil and water: A review[J]. Chemosphere, 99(3): 19-33. |
Aksoy E, Salazar J, Koiwa H. 2014. Cadmium determinant 1 is a putative heavy-metal transporter in Arabidopsis thaliana (617.4)[J]. The FASEB Journal, 28: 617-624. |
Beesley L, Marmiroli M, Pagano L, et al. 2013. Biochar addition to an arsenic contaminated soil increases arsenic concentrations in the pore water but reduces uptake to tomato plants (Solanum lycopersicum L.)[J]. Science of the Total Environments, 454-455(5): 598-603. |
Chakravarty P, Sarma N S, Sarma H P. 2010. Biosorption of cadmium(Ⅱ) from aqueous solution using heartwood powder of Areca catechu[J]. Chemical Engineering Journal, 162(3): 949-955. DOI:10.1016/j.cej.2010.06.048 |
Cordero B, Lodeiro P, Herrero R, et al. 2004. Biosorption of Cadmium by Fucus spiralis[J]. Environmental Chemistry, 1(3): 180-187. DOI:10.1071/EN04039 |
Drake L R, Lin S, Rayson G D, et al. 1996. Chemical modification and metal binding studies of datura innoxia[J]. Environmental Science & Technolog, 30(1): 110-114. |
Han R, Zhang J, Zou W, et al. 2005. Equilibrium biosorption isotherm for lead ion on chaff[J]. Journal of Hazardous Materials, 125(1): 266-271. |
Hang T T, Vu N D, Matsukawa M, et al. 2016. Heavy metal biosorption from aqueous solutions by algae inhabiting rice paddies in Vietnam[J]. Journal of Environmental Chemical Engineering, 4(2): 2529-2535. DOI:10.1016/j.jece.2016.04.038 |
Huang F, Dang Z, Guo C L, et al. 2013. Biosorption of Cd(Ⅱ) by live and dead cells of Bacillus cereus RC-1 isolated from cadmium-contaminated soil[J]. Colloids and Surfaces B: Biointerfaces, 107: 11-18. DOI:10.1016/j.colsurfb.2013.01.062 |
Khadivinia E, Sharafi H, Hadi F, et al. 2014. Cadmium biosorption by a glyphosate-degrading bacterium, a novel biosorbent isolated from pesticide-contaminated agricultural soils[J]. Journal of Industrial & Engineering Chemistry, 20(6): 4304-4310. |
Khan Z, Rehman A, Hussain S Z, et al. 2016. Cadmium resistance and uptake by bacterium, Salmonella enterica 43C, isolated from industrial effluent[J]. Amb Express, 6(1): 54. DOI:10.1186/s13568-016-0225-9 |
Khraisheh M A M, AI-Degs Y S, Allen S J, et al. 2016. Elucidation of controlling steps of reactive dye adsorption on activated carbon[J]. Industrial & Engineering Chemistry Research, 41(6): 1651-1657. |
Li Y, Pang H D, He L Y, et al. 2016. Cd immobilization and reduced tissue Cd accumulation of rice (Oryza sativa wuyun-23) in the presence of heavy metal-resistant bacteria[J]. Ecotoxicology & Environmental Safety, 138: 56. |
Li Z, Ma Z, Yuan Z, et al. 2014. A review of soil heavy metal pollution from mines in China: Pollution and health risk assessment[J]. Science of the Total Environment, 468-469: 843-853. DOI:10.1016/j.scitotenv.2013.08.090 |
Limcharoensuk T, Sooksawat N, Sumarnrote A, et al. 2015. Bioaccumulation and biosorption of Cd2+ and Zn2+ by bacteria isolated from a zinc mine in thailand[J]. Ecotoxicology and Environmental Safety, 122: 322-330. DOI:10.1016/j.ecoenv.2015.08.013 |
Lu Y, Song S, Wang R, et al. 2015. Impacts of soil and water pollution on food safety and health risks in China[J]. Environment International, 77: 5-15. DOI:10.1016/j.envint.2014.12.010 |
Luo S, Li X, Liang C, et al. 2014. Layer-by-layer strategy for adsorption capacity fattening of endophytic bacterial biomass for highly effective removal of heavy metals[J]. Chemical Engineering Journal, 239(1): 312-321. |
Marques A P, Moreira H, Franco A R, et al. 2013. Inoculating Helianthus annuus (sunflower) grown in zinc and cadmium contaminated soils with plant growth promoting bacteria——effects on phytoremediation strategies[J]. Chemosphere, 92(1): 74-83. DOI:10.1016/j.chemosphere.2013.02.055 |
Masoudzadeh N, Zakeri F, Lotfabad T, et al. 2011. Biosorption of cadmium by Brevundimonas sp. ZF12 strain, a novel biosorbent isolated from hot-spring waters in high background radiation areas[J]. Journal of Hazardous Materials, 197: 190-198. DOI:10.1016/j.jhazmat.2011.09.075 |
Masoudzadeh N, Zakeri F, Sharafi H, et al. 2011. Biosorption of cadmium by Brevundimonas sp. ZF12 strain, a novel biosorbent isolated from hot-spring waters in high background radiation areas[J]. Journal of Hazardous Materials, 197(6): 190-198. |
Meng X, Hadi P, Chen G, et al. 2014. Removal of cadmium ions from wastewater using innovative electronic waste-derived material[J]. Journal of Hazardous Materials, 273(3): 118-123. |
Rajkumar M, Ma Y, Freitas H. 2013. Improvement of Ni phytostabilization by inoculation of Ni resistant Bacillus megaterium SR28C[J]. Journal of Environmental Management, 128(128C): 973. |
Wang Q, Chen L, He L Y, et al. 2016. Increased biomass and reduced heavy metal accumulation of edible tissues of vegetable crops in the presence of plant growth-promoting Neorhizobium huautlense T1-17 and biochar[J]. Agriculture Ecosystems & Environment, 228: 9-18. |
Wei L, Yang X, Huang W. 2006. Catalytic properties of carboxylic acid functionalized-polymer microsphere-stabilized gold metallic colloids[J]. Journal of Colloid & Interface Science, 304(1): 160-165. |
Won S W, Mao J, Kwak I S, et al. 2010. Platinum recovery from ICP wastewater by a combined method of biosorption and incineration[J]. Bioresource Technology, 101(4): 1135-1140. DOI:10.1016/j.biortech.2009.09.056 |
吴敏, 王锐, 关旸, 等. 2014. 土壤重金属污染的微生物修复机理研究进展[J]. 哈尔滨师范大学自然科学学报, (3): 152-155. |
Xia L, Xu X, Zhu W, et al. 2015. A comparative study on the biosorption of Cd2+ onto Paecilomyces lilacinus XLA and Mucoromycote sp. XLC[J]. International Journal of Molecular Sciences, 16(7): 15670-15687. DOI:10.3390/ijms160715670 |
Xu S, Xing Y, Liu S, et al. 2019. Role of novel bacterial Raoultella sp. strain X13 in plant growth promotion and cadmium bioremediation in soil[J]. Applied Microbiology and Biotechnology, 103(9): 3887-3897. DOI:10.1007/s00253-019-09700-7 |
Xu X, Li H, Wang Q, et al. 2017. A facile approach for surface alteration of Pseudomonas putida I3 by supplying K2SO4 into growth medium: Enhanced removal of Pb(Ⅱ) from aqueous solution[J]. Bioresource Technology, 232(Complete): 79-86. |
Xu X, Xia L, Zhu W, et al. 2015. Role of Penicillium chrysogenum XJ-1 in the detoxification and bioremediation of cadmium[J]. Frontiers in Microbiology, 6: 1422. |
Yu J, Mi T, Sun X, et al. 2007. Cystine-modified biomass for Cd(Ⅱ) and Pb(Ⅱ) biosorption[J]. Journal of Hazardous Materials, 143(1): 277-284. |
Zakeri F, Noghabi K, Sadeghizadeh M, et al. 2010. Serratia sp. ZF03:an efficient radium biosorbent isolated from hot-spring waters in high background radiation areas[J]. Bioresource Technology, 101(23): 9163-9170. DOI:10.1016/j.biortech.2010.07.032 |
Zhang X, Zhong T, Liu L, et al. 2015. Impact of soil heavy metal pollution on food safety in China[J]. Plos One, 10(8): e0135182. DOI:10.1371/journal.pone.0135182 |
Zhu W, Xu X, Xia L, et al. 2016. Comparative analysis of mechanisms of Cd2+ and Ni2+ biosorption by living and nonliving Mucoromycote sp. XLC[J]. Geomicrobiology Journal, 33(3/4): 274-282. |
Zou H X, Li N, Wang L H, et al. 2014. Equilibrium and kinetic studies of Cd2+ biosorption by the brown algae Sargassum fusiforme[J]. Plos One, 9(4): e95242. DOI:10.1371/journal.pone.0095242 |
张红云. 2018. 土壤重金属镉污染及其修复技术分析[J]. 吉林农业, 427(10): 90-91. |
 2021, Vol. 41
2021, Vol. 41


