2. 山东省地矿局城市地质与地下空间资源重点实验室, 青岛 266071;
3. 青岛地矿岩土工程有限公司, 青岛 266071;
4. 中国海洋大学环境科学与工程学院, 海洋环境与生态教育部重点实验室, 山东省海洋环境地质工程重点实验室, 青岛 266100
2. Key Laboratory of Urban Geology and Underground Space Resources, Shandong Provincial Bureau of Geology and Mineral Resources, Qingdao 266071;
3. Qingdao Geology and Geotechnical Engineering Co., Ltd, Qingdao 266071;
4. Key Lab of Marine Environment and Ecology, Ministry of Education, Shandong Provincial Key Laboratory of Marine Environment and Geological Engineering, College of Environmental Science and Engineering, Ocean University of China, Qingdao 266100
根据我国环境年报, 氮素是地下水的主要超标指标, 其中, 硝态氮(NO3--N)往往是地下水中的主要氮污染物, 亚硝态氮(NO2--N)和铵态氮(NH4+-N)是较轻度的污染物(Gu et al., 2013; Zhang et al., 2015).在中国, 地下水中氮素污染的来源有农田、垃圾填埋场、工业废水与生活污水等(Gu et al., 2013), 其中, 农田施肥是主要面源, 工业污水和垃圾渗滤液是主要点源(Chen et al., 2014).在城市市区及周边, 地下水中氮素往往来自复合源, 而复合源比单一源的污染途径和氮素形态变化更复杂.为了更好地管理和控制复合源污染, 需要通过关注土壤和地下水双重介质来加强对复合污染源污染特征与途径的认知.
地下水的污染通常来自于地表垂向入渗和侧向补给(Foster et al., 2013; Clemens et al., 2020).地表淋失的污染物穿透深层包气带到达地下水, 该途径是造成地下水污染的一个主要途径(Guo et al., 2006), 同时侧向补给造成的地下水污染会随着毛细水上升和地下水位波动带的水位波动造成深层包气带污染物的累积(Klenk et al., 2002; Legout et al., 2007; Bai et al., 2013; Akbariyeh et al., 2018; Yin et al., 2019).因此, 深层包气带的污染分布特征对于判识地下水主要污染途径具有重要意义.但目前的研究多关注单纯表层土壤或者单纯地下水中污染物的分布, 而缺乏对包括深层包气带在内的非饱和带-饱和带系统的研究, 造成本身具有密切水力联系的土壤和地下水在研究中的割裂.近年来, 越来越多的研究开始关注这一点, 如Khalili等(2012)和Wang等(2019)均发现在深度0~100 cm土层中氮素含量随深度而减少;Yuan等(2019)发现NO3--N含量在深度2 m和10 m土层出现两个不同程度的峰值;Wu等(2019)发现NO3--N和DON含量随深度增加呈先增加再减少的趋势, NH4+-N含量则呈现一直减少的趋势.可见, 不同类型的氮素在不同深度土层的赋存特征存在明显差异并具有紧密联系.为了更全面地认识氮素在非饱和带-饱和带系统中的分布特征和传输途径, 有必要对非饱和带-饱和带全剖面进行取样分析.
氮素的分布受氮循环过程影响, 研究非饱和带-饱和带全剖面中的微生物学特征对于解析其氮素分布具有重要意义.已有研究发现微生物群落结构与氮素分布类似, 在深层包气带和表土中存在差异并体现出随深度逐渐演化的特征.例如, Sagova-Mareckova等(2016)发现在深度0~400 cm和0~425 cm的两个非饱和带剖面中, 细菌群落分布垂直变化显著;Eilers等(2012)对深度0~180 cm土层的微生物群落结构在非饱和带剖面上的分布变化进行了研究, 发现微生物群落组成受土壤深度的显著影响, 拟杆菌的相对丰度随着深度的增加而下降, 疣状菌的相对丰度在深度10~50 cm土层中达到峰值, 表层微生物群落组成区别最大, 深层的微生物群落较为相似;LaMontagne等(2003)也得出类似的结论, 表层和深层(1~4 m) 的微生物群落组成存在差异, 多样性随深度增加而减小, 说明群落功能可能会随着深度的变化而改变.周利等(2020)研究发现, 稻田NO3--N异化还原为NH4+-N(Dissimilatory Nitrate Reduction to Ammonium, DNRA)细菌群落结构的垂向分布与NH4+-N和NO3--N具有显著相关性.许明敏等(2016)研究表明, 秸秆层及其界面土壤的氮素含量与微生物群落结构具有相关性, 小麦秸秆在20 cm埋深下, NH4+-N、NO3--N与界面土层微生物群落具有相关性, 在40 cm埋深下, NH4+-N、NO3--N和微生物量碳与秸秆层微生物群落变异呈显著相关.微生物在非饱和带(Nelson et al., 2016)和饱和带(Griebler et al., 2009)中都有关键性作用, 然而, 目前缺少对非饱和-饱和带全剖面中微生物群落结构和氮循环功能微生物的研究.农田氮肥和垃圾填埋场渗滤液是我国地下水中氮素的两大来源, 因此, 本研究选择受这两种污染源复合影响的区域作为研究区域, 通过对垃圾填埋场周边多个点位的包气带土壤和地下水采样, 通过理化和生物学分析来表征垃圾填埋场周边地区非饱和-饱和带全剖面的氮素分布特征和微生物响应, 揭示该垃圾填埋场和农田施肥对非饱和-饱和带全剖面氮素形态分布的复合影响及作用途径.
2 材料与方法(Materials and methods) 2.1 研究区域概况研究区域为山东省青岛市某垃圾填埋场周边, 该区位于大沽河下游入海口附近海陆交互相冲-海积平原, 地势平坦, 高差起伏小.气候为受海洋影响的季风型大陆性气候, 春季气温回升缓慢;夏季湿热多雨, 但无酷暑;秋季天高气爽, 降水少, 蒸发强;冬季风大温低, 持续时间较长.多年平均气温为12.7 ℃, 全年8月最热, 平均气温为25.3 ℃, 1月最冷, 平均气温为-0.5 ℃.年平均降水量为662.1 mm, 春、夏、秋、冬四季雨量分别占全年降水量的17%、57%、21%、5%, 降水的年变率为62%.南和东南偏南为主风向, 年平均风速为3.6 m·s-1.垃圾填埋场周围有两条河流, 一条是位于场区南部边缘, 该河是20世纪50年代初人工开挖的河流, 流向是自东北至西南;另一条位于场区西部边界, 是人工开挖的排水渠, 一般在夏季丰水期水量较多, 其它季节基本无水.上述两条河流的底床标高均高于垃圾填埋场地下水稳定水位, 河水补给地下水.该区地下水属潜水类型, 局部为弱承压水.地下水位(稳定水位)总趋势为东北高、西南低, 地下水系呈东北-西南流向, 但研究区域内南部地势较高, 地下水水流自东南向西北.该区域的主要经济活动为农业和渔业, 包括果蔬种植业和水产养殖业等.
为考察垃圾填埋场对非饱和-饱和带氮素分布特征的影响, 根据地下水流向, 共布设6个点位(图 1), 包括一个上游背景点J0, 5个下游点J1、J2、J3、J4和J5.这6个点根据土地利用类型可以分为两类, J1和J2是林地, J0、J3、J4和J5是农田.为便于分析氮肥对氮素分布的影响, 根据我国生态县建设指标(化肥施用强度不得超过250 kg·hm-2), 按施肥量可以分为两类, J1、J2和J5为低施肥量采样点(J5已停耕), 施肥量为0~200 kg·hm-2·a-1, J0、J3和J4为高施肥量采样点, 施肥量大致为400~600 kg·hm-2·a-1.
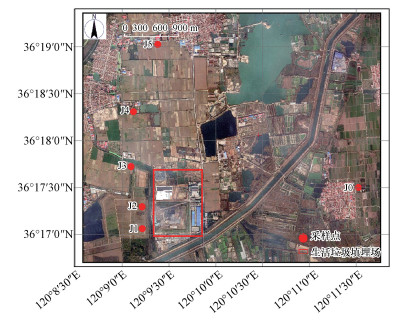 |
| 图 1 采样点示意图 Fig. 1 Distribution of sampling points in the study area |
于2019年6月23—26日在6个点位采集了土壤剖面和地下水样品.土壤样品用便携式取芯钻机(SD-1, Christie Engineering, 澳大利亚)采集, 采样深度为表层土壤至地下水面, 每20 cm土壤混合为一份.将采集的土壤样品分成两份, 一份放在4 ℃的冰箱中保存, 用于土壤理化性质分析;另一份用15 mL的无菌离心管收集置于-20 ℃冰箱中保存, 用于后续的高通量测序.土壤样品分析前, 从每个样品中剔除可见的石头、动植物残体、根系和垃圾.用于土壤理化性质的土壤样品分为两份, 一份用于氮素分析, 一份风干后用于土壤质地分析.地下水用手提式取水器采集, 每个点位采集2.5 L, 同样分为两份, 一份保存在4 ℃冰箱, 0.45 μm的玻璃滤膜过滤后用于理化性质测试, 另一份用0.22 μm的无菌滤膜过滤后, 将滤膜保存在-20 ℃冰箱, 用于高通量测序.
2.3 样品分析 2.3.1 理化指标分析NO3--N含量测定采用紫外分光光度法(2800 UV/VIS, ONICO, 澳大利亚, 下同), 亚硝态氮含量测定采用N-(1-萘基)-乙二胺比色法, 总溶解性氮(TDN)含量测定采用过硫酸钾氧化法, 土壤NH4+-N含量测定采用靛酚蓝比色法, 地下水NH4+-N浓度测定采用钠氏试剂分光光度法, DON用差减法得到: DON=TDN-(NO3--N+NH4+-N+NO2--N).土壤氮素指标测定时, 以0.5 mol·L-1 K2SO4为提取剂, 水土比为10 ∶ 1, 于25 ℃恒温振荡器(IS-RDD3, Crystal, America)在转速220 r·min-1下恒温振荡1 h, 浸提液用离心机离心(4000 r·min-1, 15 min), 过滤后得到的液体进行氮素指标测定.
土壤质地测定采用筛分法(>0.5 mm)和激光粒度分析仪(< 0.5 mm)相结合.土壤风干后过筛, 分别将粒径大于2.0 mm和0.5~2.0 mm的土称重, 粒径小于0.5 mm的土以水土比为2.5 ∶ 1混合后, 添加分散剂六偏磷酸钠过夜, 然后在转速220 r·min-1的25 ℃恒温振荡器中振荡1 h混匀, 混合液用激光粒度分析仪测定.最后基于美国土壤质地标准确定各样品土壤质地.
pH、电导率(EC)、氧化还原电位(ORP)和溶解氧(DO)用多参数水质测定仪进行测定(HQ40d, HACH, 美国).
2.3.2 高通量测序所有样品统一冷藏送往上海美吉生物医药科技有限公司进行高通量测序.根据制造商的说明, 使用土壤DNA快速提取试剂盒(MP Biomedicals, Cleveland, 美国)从0.5 g冻干土壤中提取DNA.使用全自动酶标仪(BioTek ELX 800, 美国)评估DNA提取液的质量和数量.DNA提取液的完整性通过1%琼脂糖凝胶电泳确认.选择高通量测序通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因的V3~V4高变区进行PCR扩增及荧光定量(Cui et al., 2018), 在Illimina Miseq测序平台进行高通量测序.每个样品大约产生60000个高质量序列, 序列的平均长度为413~427 bp.按照97%相似性对非重复序列(不含单序列)进行OTU聚类, 在聚类过程中去除嵌合体, 得到OTU的代表序列.每个OTU的代表性序列的分类注释通过与16S rRNA Silva数据(Release132 http://www.arb-silva.de)比对来确定.OTU聚类和分类注释在美吉云平台(https://cloud.majorbio.com/)上进行.
2.4 数据处理采用FAPROTAX.1.2.1数据库进行微生物功能预测(Louca et al., 2016).通过SPSS 25进行描述性统计、显著性检验和Spearman相关性分析;通过Canoco5进行基于距离的冗余分析(distance-based Redundancy Analysis, db-RDA);其余图形通过Origin 2019绘制.
3 结果与讨论(Results and discussion) 3.1 土壤和地下水样品基本理化性质根据美国土壤质地分类可知, 土壤样本质地以黏土为主(图 2), 土壤含水率为2.07%~36.72%.根据表 1中各点地下水位可知, J0的地下水位最浅(178 cm), 其它点位的地下水水位均超过400 cm.受限于钻机性能, 钻头在黏土层取土困难, 因此, J1和J2取样深度未及地下水位.
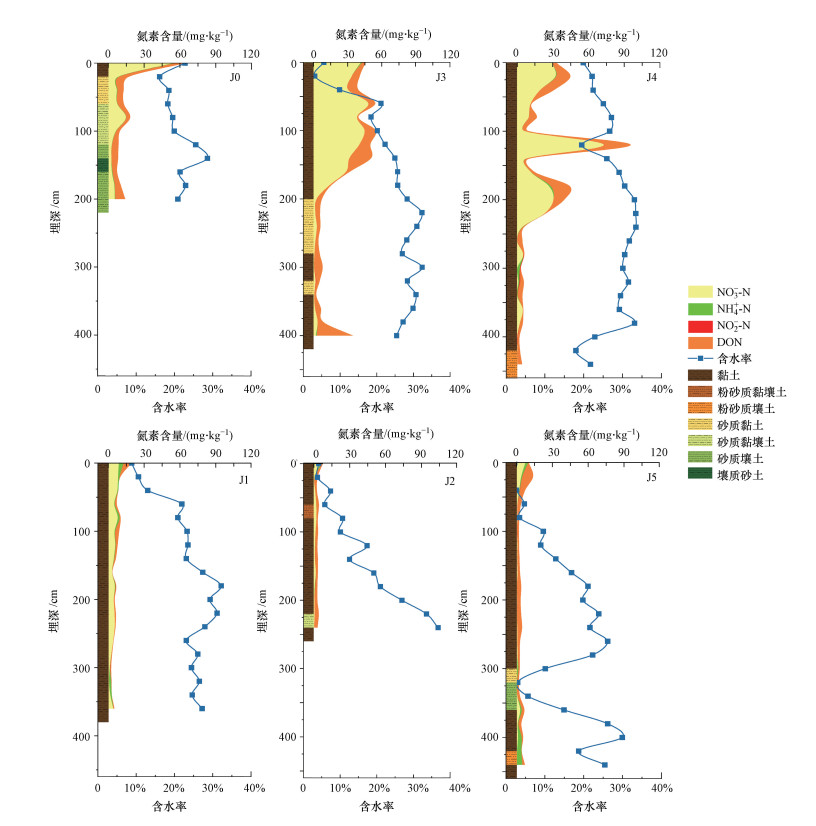 |
| 图 2 非饱和带中氮素含量分布示意图 (J0、J3和J4为高施肥量采样点, J1、J2和J5为低施肥量采样点) Fig. 2 Distribution of nitrogen content in the unsaturated zones |
| 表 1 各点位地下水理化性质 Table 1 Physicochemical properties of groundwater samples |
地下水样本的基本理化性质见表 1, 可知各点位地下水均呈弱碱性, 采样点J0由于水位浅而DO浓度较高达到6.44 mg·L-1, 采样点J1的DO浓度次之, 为2.92 mg·L-1, 其余采样点的DO浓度均低于2.00 mg·L-1.各采样点的EC均大于2.00 mS·cm-1, 点位J1和J2甚至超过20.00 mS·cm-1, 盐分含量极高.根据前人的研究(Cao et al., 2012; Dragon, 2013; Aksever et al., 2015; Perović et al., 2017) 可知, 地下水的EC一般不超过1.00 mS·cm-1, 而大沽河流域的地下水EC为1.00 mS·cm-1左右(Xiong et al., 2020).考虑到这个地区离海较近, 可能是海水入侵而导致地下水EC较高, J1和J2特别高可能是由于距离垃圾填埋场很近, 高盐分的渗滤液污染了地下水(Chen et al., 2014; Naveen et al., 2017).各点位ORP均低于-750 mV, 属于强还原环境, 尤其是点位J1和J2, 水样稀释3倍后分别测得ORP为-750~-800 mV和-1122~1125 mV(由于超出仪器检出限而采取稀释3倍测量).
3.2 非饱和带-饱和带全剖面中氮素的分布特征 3.2.1 非饱和带土壤中氮素含量的分布特征各点位的氮素含量范围、平均值、标准差、中位数和变异系数见表 2. 由表 2可知, NO3--N、NH4+-N、NO2--N、DON和TDN在各点位的含量分别为0~73.02、0~4.49、0~0.75、0.17~31.83和0.04~95.45 mg·kg-1. Nai等(2020)研究中大沽河流域农业区0~320 cm非饱和带土壤的NO3--N、NH4+-N和NO2--N、DON和TDN含量高于本研究结果, 分别为0.1~221.4、0.11~5.98、0.22~1.64、0.6~367.3和4.20~461.08 mg·kg-1, 这可能是因为农业区施肥量大导致氮素含量更高.NO3--N、NH4+-N、NO2--N、DON和TDN含量的变异系数分别为0.51~1.70、0.69~3.06、0.58~2.36、0.36~1.29和0.38~1.18, 属于中、强变异性(在0.1~1.0之间为中等变异性, 大于1.0为强变异性)(孙玉冰等, 2010).变异系数较大, 说明各点的氮素含量在非饱和带土壤剖面中垂向分布不均匀.各点位土壤氮素随深度的分布见图 2, 总体上看, 除J3和J4点位存在明显起伏波动外, 其余点位的TDN含量随深度增加呈先下降后稳定的趋势.结合表 3中氮素之间的相关性可知, NO3--N与TDN的相关系数最大为0.854, DON次之(相关系数为0.586), NO3--N和DON与TDN有类似的变化趋势, NH4+-N和NO2--N虽与TDN也显著相关, 但相关系数较小, 并无明显分布规律.
| 表 2 非饱和带中氮素含量的统计特征值 Table 2 Statistical eigenvalues of nitrogen content in the unsaturated zones |
| 表 3 非饱和带氮素含量、埋深和土壤颗粒之间的Spearman相关系数 Table 3 Spearman correlation coefficient between nitrogen content, burial depth and soil particles in the unsaturated zones |
从图 2可以发现, 各点位氮素含量分布差异与施肥量有关.高施肥量点在深度约0~200 cm范围内, DON与NO3--N有高积累量, 表 3中埋深与氮素的相关系数也印证了这点, NO3--N和TDN与土壤深度显著负相关, 这与Nai等(2020)得到的结果类似.同时, DON和NO3--N含量与粉粒和黏粒显著相关, Xu等(2018)的研究中也发现总氮含量与土壤细颗粒的含量呈正相关.NO3--N与黏粒和粉粒呈正相关, 这可能与NO3--N在细颗粒中容易积累、难以迁移有关(Bronswijk et al., 1995; Ju et al., 2017; 孔祥科等, 2017), 这与土壤剖面中, 尤其是在以黏土为主的J3和J4点土壤剖面中, NO3--N大量分布在深度0~240 cm(p < 0.05)的特征一致.商放泽等(2012)在田间实验中得到了类似的NO3--N积累结果.NH4+-N和NO2--N含量在各点的剖面上分布较不均匀, 变异系数也较大, NH4+-N含量在J1~J5点的变异系数均超过1.0, NO2--N含量在J0、J1、J3和J4点的变异系数均超过1.0.从图 2可以看出, NH4+-N在深度0~20 cm和400~460 cm范围内的含量更高(p < 0.05), Wang等(2017)的研究也得到了类似的结果, 该研究发现在农业区NH4+-N含量随深度降低后又小幅升高, 在1 m处可达近30 mg·kg-1, 在人为影响较小的区域中, NH4+-N含量在非饱和带剖面中变化较小且小于1.5 mg·kg-1, 说明氮肥是影响非饱和带土壤中NH4+-N分布的一个因素.考虑到NH4+-N易被土壤吸附(Huang et al., 2018), 当地下水水位上升, 地下水中的高浓度NH4+-N很可能会被土壤吸附(Li et al., 2020), 当地下水水位下降, 如果土壤吸附能力未饱和或水力梯度不大, NH4+-N向地下水迁移的可能性较小, 更容易积累(李翔等, 2013; Zhang et al., 2020).这表明地下水中NH4+-N可能随着地下水水位的波动被土壤吸附, 造成非饱和带土壤中NH4+-N在深层积累.因此, 非饱和带剖面上NH4+-N的分布差异可能受到了人为施肥和地下水的复合影响.
研究区域的氮素分布在平面空间上也有明显差异.根据表 2可知, 高施肥量点J0、J3和J4的TDN含量为2.19~95.45 mg·kg-1, NO3--N含量为0~73.02 mg·kg-1, DON含量为0.34~31.83 mg·kg-1, 明显比低施肥量点J1、J2和J5的TDN、NO3--N和DON含量高(p < 0.01).Wang等(2019)在研究施肥量对NO3--N淋溶的影响时发现, 无外加氮肥时, NO3--N含量为2.75 ~5.04 mg·kg-1, 施加400 kg·hm-2·a-1氮肥时, NO3--N含量为7.8 ~17.2 mg·kg-1, 施加600 kg·hm-2·a-1氮肥时, NO3--N含量为20.05~54.27 mg·kg-1.张宏威等(2013)在研究长期施肥处理对菜田土壤矿质氮和DON的影响时发现, 施肥处理显著提高了土壤0~180 cm土层氮素的含量, 说明农田土壤中高含量NO3--N和DON的主要来源往往是氮肥(Ascott et al., 2017; Ju et al., 2017).因此, NO3--N和DON分布的空间差异很可能是施肥量的差异导致的.
根据《地下水质量标准》(GB/T 14848—2017)中Ⅲ类水为标准(NH4+-N 0.5 mg·L-1, NO3--N 20 mg·L-1), 从表 4可知, 除点位J0外, 各点位的地下水NH4+-N均超标, 尤其是点位J1(1.17 mg·L-1)、J2(2.20 mg·L-1)和J3(2.82 mg·L-1), NO2--N均未超标, NO3--N仅点位J0超标(34.49 mg·L-1).
| 表 4 地下水各类氮素浓度及占TDN的百分比 Table 4 Concentration of NO3--N, NH4+-N, NO2--N and DON and their percentage of TDN in groundwater corresponding to profile sampling sites |
各点位地下水中NH4+-N浓度呈现出空间差异, 根据表 4中地下水中氮素浓度百分比可知, 垃圾填埋场上游点J0的地下水中, NH4+-N占比低(0.39%), 垃圾填埋场下游采样点中, NH4+-N占TDN的百分比均较大.赵丽等(2020)在垃圾填埋场地下水中同样发现NH4+-N占TDN的百分比大.采样点J0的NH4+-N百分比低, 可能是因为水位较浅, 导致施肥产生的大量NO3--N进入地下水, 同时DO浓度较高(6.44 mg·L-1), 进而抑制了地下水中的反硝化作用(Zhou et al., 2018; Kuypers et al., 2018), 导致NO3--N大量存在.随着地下水运移距离的增加, 水中NH4+-N浓度降低, 到J4点位, NH4+-N浓度已仅次于NO3--N, 结合地下水中NH4+-N浓度较高的情况, 可能是垃圾填埋场的渗滤液渗入了地下水, 造成地下水中NH4+-N浓度超标.周巧丽等(2019)在研究垃圾填埋场周围地下水污染状况时, 也发现垃圾填埋场下游地下水NH4+-N浓度均超标.而施肥量对地下水中NH4+-N浓度的空间分布无显著影响.因此, 垃圾填埋场渗滤液的渗漏可能是造成地下水中NH4+-N浓度空间差异的重要因素.
地下水中NO3--N与NH4+-N浓度的空间分布特征是不同的.地下水中NO3--N浓度大、占比高的采样点J0、J3和J4均是高施肥量点, 而施肥较少的采样点J1和J2的NO3--N浓度和百分比也均大于停耕采样点J5.这与各点位土壤剖面的NO3--N含量情况一致, 又考虑到地下水环境均是还原环境, 硝化作用受到抑制, 可以推断土壤NO3--N淋失是地下水中氮素的一个重要来源(Manevski et al., 2016).因此, 施肥量差异是导致地下水中NO3--N浓度空间分布差异的原因.
以上分析表明, 垃圾填埋场渗滤液和非饱和带氮素下渗是地下水中两个主要的氮素来源.为进一步佐证这一结论, 对各采样点地下水之间的关系进行了表征, 以地下水的各理化指标(包括NO3--N、NH4+-N、NO3--N、DON、TDN、DO、EC和ORP)作为个案数, 各理化指标作为各采样点地下水的等级数据, 将各采样点地下水简化为等级变量, 对各采样点地下水之间进行Spearman相关性分析, 结果见表 5.由表 5可知, 采样点J1、J2、J3、J4和J5的地下水之间的相关系数均达0.78以上, 且相关性显著, 说明J1~J5的地下水有相同的氮素污染来源.上游点J0地下水仅与采样点J3和J4的地下水有相关性, 说明J0、J3和J4的地下水也有相同的氮素污染来源.从空间位置来说, J0处于垃圾填埋场上游, J1~J5处于下游, 说明垃圾填埋场的渗滤液可能是下游氮素的污染源, 这与周巧丽等(2019)的研究结果一致.从土地利用型来说, J0、J3和J4都是高施肥量点, 说明施肥导致的氮素下渗也可能是污染源(Guo et al., 2006).
| 表 5 采样点地下水相关性分析 Table 5 Correlation analysis between the groundwater at the sampling sites |
NO3--N的分布与土壤质地和微生物作用紧密相关, 受人为施肥影响较大.NO3--N与土壤胶体同带负电荷, 不易被土壤颗粒吸附, 易随水下渗(商放泽等, 2012; 高太忠等, 2015; 孔祥科等, 2017), 造成地下水中NO3--N含量超标.若土壤颗粒较细, NO3--N的迁移速率较低(Bronswijk et al., 1995), 则会在土壤中出现如J3和J4点的高积累现象.NO3--N是氮循环的一部分, 微生物参与了NO3--N的产生与转化.在土壤施肥后, 由于复合肥和有机肥的施加, 有机肥中的DON经矿化变为NH4+-N(Lorite-Herrera et al., 2009), 与复合肥中的NH4+-N一起经硝化菌的硝化作用产生大量NO3--N, 随着深度增加, 土壤氧气含量降低, 硝化反应减弱, 反硝化反应增强(程雅楠等, 2013; Ju et al., 2017), NO3--N异化还原为NH4+-N的反应也增强(Wang et al., 2017), NO3--N被转化为气态氮、NO2--N和NH4+-N, 导致深层土壤中NO3--N含量降低, NH4+-N含量增加, 不过如果NO3--N过量, DNRA发生的可能性很低(Kuypers et al., 2018).
NH4+-N主要来自肥料和垃圾渗滤液, 0~40 cm深度土壤中的NH4+-N来自于肥料所产生的过量NH4+-N, 未全部经硝化作用变为硝酸盐, 其中一部分被土壤颗粒吸附积累在土壤中, 一部分以气态的形式挥发(Ju et al., 2017).在深度400~460 cm处, 一方面NO3--N和NO2--N的还原会产生NH4+-N, 使土壤中的NH4+-N含量升高;另一方面可能是地下水中的NH4+-N被土壤吸附而积累, 而地下水中高浓度的NH4+-N可能来自于NO3--N的异化还原和垃圾填埋场垃圾渗滤液的渗漏.
DON在非饱和带中也会随水下渗进入地下水(Lorite-Herrera et al., 2009; Connolly et al., 2020), 高施肥量点比低施肥量点更高含量的DON也很可能来自于有机肥, 除了被微生物利用的部分, 其余部分会在非饱和带中积累下来(Jones et al., 2004; Connolly, et al., 2020).NO2--N作为中间产物, 不稳定, 易在微生物作用下变为其它形式的氮(Kuypers et al., 2018), 因此, 在土壤和地下水中含量都很低.
3.3 微生物种群特征对非饱和-饱和带中氮素分布的响应 3.3.1 非饱和带土壤中微生物种群特征对氮素分布的响应对土壤样品的高通量数据进行分析、处理, 得到28个高质量样品的序列信息, 共获得1422919条序列, 这些序列可分属59个门、147个纲、407个目、685个科和1300个属.微生物群落主要由变形菌门(Proteobacteria, 9.44%~71.45%)、绿弯菌门(Chloroflexi, 6.29%~41.77%)、放线菌门(Actinobacteria, 2.63%~32.76%)、酸杆菌门(Acidobacteria, 2.18%~26.03%)、芽单胞菌门(Gemmatimonadetes, 0~8.02%)和Rokubacteria(0~15.67%)等构成.在科级水平上, 这些序列分属于Pseudomonadaceae(0~21.87%)、Micrococcaceae(0~ 27.52%)、Burkholderiaceae (0.19%~11.63%)和Sphingomonadaceae(0~10.50%)等科.
对各采样点的土壤微生物群落进行α多样性指数分析可知(图 3), Coverage指数为0.97~0.99, 说明测序结果可代表样本中微生物的真实情况.结合Shannon和Simpson指数可以发现, 总体上, 0~20 cm和100~120 cm深度土壤的微生物多样性最高, Shannon指数分别为5.68~6.61和5.95~6.39, Simpson指数均为0~0.01;100~120 cm深度土壤的微生物物种最多, Ace指数为2522.21~3216.75.随着深度增加, 微生物多样性和物种数量均降低, 这与已往研究所得结果一致(程雅楠等, 2013).
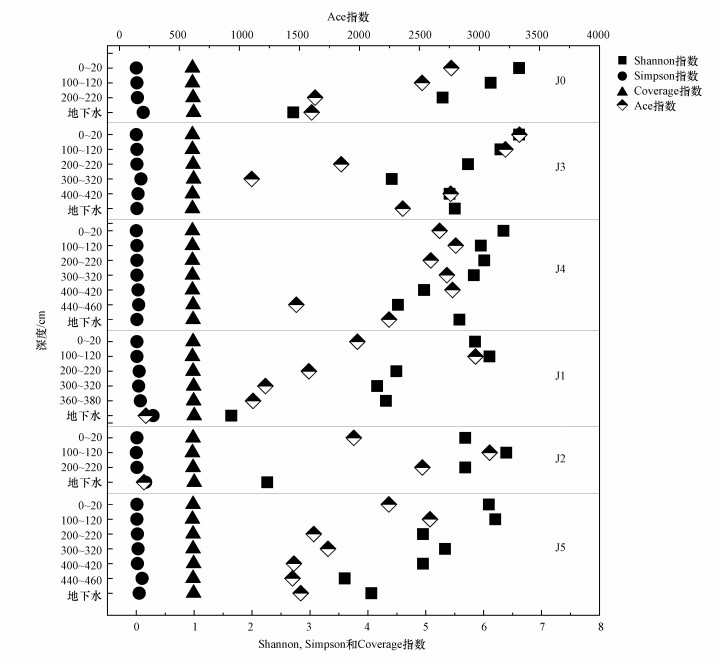 |
| 图 3 非饱和-饱和带微生物群落α多样性指数 Fig. 3 Alpha diversity indices of the microbial communities in the unsaturated and saturated zones |
功能预测结果显示可预测到的功能微生物群共有76种.参与功能预测的每条OTU序列, 有的归属于一种功能, 有的则可归属于多种功能, 表 6中列出了在门、科、属水平上所预测的氮循环功能菌所对应的微生物.将参与氮循环的功能微生物群单独分析, 得到如图 4所示的相对丰度图.除了采样点J1, 硝化菌是各采样点非饱和带土壤中的主要氮循环功能菌群, 尤其是在深度0~320 cm土壤中(p < 0.05), 相对丰度最高可达97.10%.在门水平上, 变形菌门(0~79.95%)和硝化螺旋菌门(0~50.71%)是主要的硝化菌, MND1(0~70.02%)和硝化螺菌属(0~50.71%)是对应的属水平上的主要硝化菌.反硝化菌在J1和J4处的丰度较高, 门水平上的Rokubacteria只分布在J4处, 变形菌门中丰度较高的副球菌属主要分布在J1(1.42%~94.00%)和J4(0.18%~81.44%).反硝化菌在有较高NH4+-N含量的J1中的相对丰度甚至达到了94.06%, 程雅楠等(2013)在NH4+-N高积累区域中同样发现反硝化菌占绝对优势.结合图 2可知, 反硝化菌的分布与NO3--N在非饱和带中的含量变化是一致的, 在J1和J4中, 反硝化菌在深度200~400 cm处大量存在, 对应了NO3--N在这一深度的低含量, 说明NO3--N的减少与反硝化作用有关.厌氧氨氧化菌和硝酸盐/亚硝酸盐氨化菌都是在缺氧条件下发挥功能的微生物, 因此更多的出现在深度200~400 cm处.采样点J3的非饱和带土壤中, 深度200~420 cm处的反硝化菌和硝酸盐/亚硝酸盐氨化菌同时大量存在, 这与NO3--N在这一深度的低含量也是一致的, 说明NO3--N的减少与反硝化作用和DNRA有关.
| 表 6 在门、科、属水平上所预测的氮循环功能菌 Table 6 Predicted nitrogen-cycle functional bacteria at the phylum, family and genus level |
 |
| 图 4 氮循环功能菌群相对丰度 Fig. 4 Relative abundance of nitrogen-cycling functional microorganisms |
为了确定氮循环功能菌群与环境因子的关系, 对氮循环功能微生物菌群与土壤理化性质(包括土壤颗粒、含水率、埋深和氮素含量)进行db-RDA分析, 采用Bray-curtis距离(下同), 去除自相关因子后的结果如图 5a所示.由图可知, 去除自相关之后的环境因子为粉粒、黏粒、埋深、含水率、DON、NO3--N、NO2--N和NH4+-N, 这些因子都是塑造微生物群落的重要影响因子.NH4+-N的解释度为14.0%, Cui等(2018)的研究也有类似的发现: NH4+-N对细菌群落的影响较大.NH4+-N仅与固氮菌正相关, 与硝化菌、厌氧氨氧化菌、硝酸盐/亚硝酸盐氨化菌和反硝化菌都呈负相关, 其中, 固氮菌和硝酸盐/亚硝酸盐氨化菌都是参与产生NH4+-N过程的微生物, 厌氧氨氧化菌是参与消耗NH4+-N过程的微生物(Kuypers et al., 2018).NH4+-N与固氮菌呈正相关, 说明固氮菌对于NH4+-N的积累有明显作用, 尤其是在低施肥量采样点J1和J5.硝酸盐/亚硝酸盐氨化菌与NH4+-N呈负相关, 与NO3--N和NO2--N均呈正相关, 说明硝酸盐/亚硝酸盐氨化菌可能受高积累量的NO3--N的影响而大量繁殖, 并将NO3--N转化为NO2--N, 仅将极少部分NO2--N转化为NH4+-N.NO3--N与反硝化菌是正相关, 说明土壤中NO2--N主要由反硝化菌产生.粉粒和黏粒的解释度分别为3.7%和6.9%, 已有研究表明(Gelsomino et al., 1999), 土壤质地可以影响土壤微生物的群落结构, 相似的土壤质地更可能有相似的土壤群落结构.
 |
| 图 5 土壤功能微生物菌群与环境因子(a) 及地下水功能微生物菌群与环境因子(b) 的db-RDA分析 (实心箭头代表环境因子, 空心箭头代表微生物群落, 符号代表采样点, 符号颜色代表深度) Fig. 5 db-RDA of soil nitrogen-cycling functional microorganisms and environmental variables(a) and groundwater nitrogen-cycling functional microorganisms and environmental variables(b) |
对地下水样品的高通量数据进行分析、处理, 得到6个高质量样品的序列信息, 共获得250900条序列, 这些序列可分属50个门、122个纲、320个目、519个科和901个属.微生物群落主要由变形菌门(Proteobacteria, 53.24%~81.23%)、拟杆菌门(Bacteroidetes, 2.71%~36.57%)、Patescibacteria(0~28.65%)和酸杆菌门(Acidobacteria, 0.32%~8.68%)等构成.在科级水平上, 这些序列分属于Burkholderiaceae(4.05%~36.19%)、Flavobacteriaceae(0.78%~31.98%)、Rhodocyclaceae(0~28.02%)、Marinobacteraceae(0~ 40.01%)、Rhodobacteraceae(0.97%~13.76%)和Moraxellaceae(0~8.26%)等科.
对各采样点的地下水微生物群落进行α多样性指数分析可知(图 3), Coverage指数为0.97~1.00, 说明测序结果可代表样本中微生物的真实情况.结合Shannon和Simpson指数可知, 采样点J0、J1、J2的地下水微生物多样性和物种数量都较低, Shannon指数分别为2.71、1.64、2.26, Simpson指数分别为0.12、0.29、0.16, Ace指数分别为1602.12、220.22、205.26.J0~J2深层非饱和带土壤的微生物多样性与物种数量都高于J0~J2地下水, 同时, J3与J4地下水的微生物多样性与物种数量都高于J0~J2地下水, 结合前文中提到的地下水理化性质, 微生物多样性和物种数量的减少很可能是由于垃圾填埋场的渗滤液污染.
功能预测结果显示可预测到的功能微生物群共有73种, 氮循环功能微生物群的相对丰度图见图 4, 固氮菌和厌氧氨氧化菌的丰度较低, 硝化菌和反硝化菌的丰度较高, 说明氮素主要以外源输入为主.在地下水中较为广泛存在的分别是硝化菌中的硝化螺旋菌门(0~43.64%)及变形菌门(0~77.03%)和反硝化菌中的变形菌门(1.40%~100%), 反硝化菌中的副球菌属在每个采样点均有分布(9.46%~100%).地下水功能微生物群落呈现出与地下水理化性质变化相似的空间变化, 即垃圾填埋场下游的各采样点, 随着与垃圾填埋场距离的增加, 反硝化菌的相对丰度逐渐减少, 硝化菌的相对丰度逐渐增加.采样点J5地下水中无法检出NO3--N, NO2--N浓度仅为0.123 mg·L-1, 反硝化菌缺少电子受体(Kuypers et al., 2018), 因此丰度很低.采样点J4虽然NO3--N浓度为1.62 mg·L-1, 但EC达到了5.08 mS·cm-1, 有研究表明(Rysgaard et al., 1999), 盐度增加对反硝化作用有抑制作用, 因而反硝化菌相对丰度也不高.此外, 仅在J3~J5处发现了丰度极低的硝酸盐/亚硝酸盐氨化菌, NH4+-N浓度极高的J1和J2处并未发现, 这进一步佐证了地下水中的高浓度NH4+-N来自垃圾填埋场渗漏的渗滤液.
地下水中氮循环功能微生物菌群的分布往往离不开环境因子的作用, 对氮循环功能微生物菌与地下水理化性质(包括pH、ORP、DO、EC和氮素浓度)进行db-RDA分析, 去除自相关因子(去除自相关之后的环境因子为ORP、EC、DON、NH4+-N和pH)后的结果如图 5b所示, ORP、EC、DON、NH4+-N和pH都是塑造微生物群落的重要影响因子.DON的解释度为33.2%, DON与反硝化菌、硝化菌、厌氧氨氧化菌、硝酸盐/亚硝酸盐氨化菌和固氮菌均为负相关, 这可能与已有研究(Ohno et al., 2014; Wu et al., 2018)中蛋白质、氨基酸和尿素等DON的生物利用性高有关.NH4+-N与DON、固氮菌和厌氧氨氧化菌无相关性, 与硝化菌和硝酸盐/亚硝酸盐氨化菌为负相关, 与pH、EC和反硝化菌为正相关, 说明地下水中的高浓度NH4+-N与氮循环功能微生物作用无关, 主要来自外源污染, 很可能是垃圾填埋场渗滤液.
4 结论(Conclusions)通过表征非饱和带-饱和带全剖面的氮素分布和微生物群落结构, 确定了氮素分布与氮循环功能微生物分布的一致性.非饱和带-饱和带全剖面中的氮素分布与氮循环功能微生物群落结构受到施肥和垃圾渗滤液渗滤的复合影响.在高施肥量点, 非饱和带土壤中的TDN、NO3--N和DON含量均显著高于低施肥量点(p < 0.01), 其中, NO3--N大量分布在深度0~240 cm土壤中(p < 0.05).NO3--N和DON是氮素的主要形态, 在剖面上总体呈先下降后稳定的趋势, 同时, 硝化菌和反硝化菌在剖面上的氮循环功能微生物中占比可达97.10%和94.06%, 部分淋失的氮素导致地下水中NO3--N浓度在TDN中占比为31.85%~84.70%, 硝化菌占比为27.08%~87.99%, 说明地表氮肥淋失是地下水NO3--N污染的主要来源.NH4+-N含量在非饱和带土壤中的分布表现为表层(0~20 cm)和深层(400~460 cm)的高积累(p < 0.05), 地下水中的高浓度NH4+-N主要受到垃圾填埋场渗滤液的影响, 深层包气带的NH4+-N积累可能是地表氮肥淋失和受垃圾渗滤液污染的地下水水位波动的综合结果.因此, NO3--N和NH4+-N是研究区域中主要的氮素污染形态, 这两种氮素也影响了微生物群落的分布.了解氮素在复合影响区中非饱和-饱和带全剖面上的分布, 有助于指导我们对复合影响区的污染评估和防控.
Akbariyeh S, Bartelt-Hunt S, Snow D, et al. 2018. Three-dimensional modeling of nitrate-N transport in vadose zone: Roles of soil heterogeneity and groundwater flux[J]. Journal of Contaminant Hydrology, 211: 15-25. DOI:10.1016/j.jconhyd.2018.02.005 |
Aksever F, Davraz A, Karagüzel R. 2015. Relations of hydrogeologic factors and temporal variations of nitrate contents in groundwater, Sandıklı basin, Turkey[J]. Environmental Earth Sciences, 73(5): 2179-2196. DOI:10.1007/s12665-014-3569-y |
Ascott M J, Gooddy D C, Wang L, et al. 2017. Global patterns of nitrate storage in the vadose zone[J]. Nature Communications, 8(1). DOI:10.1038/s41467-017-01321-w |
Bai S, Xi B, Jiang Y, et al. 2013. Water table fluctuation effects on fate and transport of nitrate in the subsurface[J]. Fresenius Environmental Bulletin, 22(10): 2929-2936. |
Bronswijk J J B, Hamminga W, Oostindie K. 1995. Rapid nutrient leaching to groundwater and surface water in clay soil areas[J]. European Journal of Agronomy, 4(4): 431-439. DOI:10.1016/S1161-0301(14)80095-6 |
Cao Y, Tang C, Song X, et al. 2012. Characteristics of nitrate in major rivers and aquifers of the Sanjiang Plain, China[J]. Journal of Environmental Monitoring Jem, 14(10): 2624-2633. DOI:10.1039/c2em30032j |
Chen J, Zhu A, Tang C, et al. 2014. Nitrogen aspects of hydrological processes: A case study in Likeng landfill, Guangzhou, China[J]. Environmental Science-Processes & Impacts, 16(11): 2604-2616. |
程雅楠, 关翔宇, 曲文龙, 等. 2013. 氨氮污染源区包气带剖面微生物生态分布特征的研究[J]. 岩矿测试, 32(2): 296-305. DOI:10.3969/j.issn.0254-5357.2013.02.019 |
Clemens M, Khurelbaatar G, Merz R, et al. 2020. Groundwater protection under water scarcity; from regional risk assessment to local wastewater treatment solutions in Jordan[J]. Science of the Total Environment, 706: 136066. DOI:10.1016/j.scitotenv.2019.136066 |
Connolly C T, Cardenas M B, Burkart G A, et al. 2020. Groundwater as a major source of dissolved organic matter to Arctic coastal waters[J]. Nature Communications, 11(1): 1479. DOI:10.1038/s41467-020-15250-8 |
Cui Y, Fang L, Guo X, et al. 2018. Responses of soil microbial communities to nutrient limitation in the desert-grassland ecological transition zone[J]. Science of the Total Environment, 642: 45-55. DOI:10.1016/j.scitotenv.2018.06.033 |
Dragon K. 2013. Groundwater nitrate pollution in the recharge zone of a regional Quaternary flow system (Wielkopolska region, Poland)[J]. Environmental Earth Sciences, 68(7): 2099-2109. DOI:10.1007/s12665-012-1895-5 |
Eilers K G, Debenport S, Anderson S, et al. 2012. Digging deeper to find unique microbial communities: The strong effect of depth on the structure of bacterial and archaeal communities in soil[J]. Soil Biology and Biochemistry, 50: 58-65. DOI:10.1016/j.soilbio.2012.03.011 |
Foster S, Hirata R, Andreo B. 2013. The aquifer pollution vulnerability concept: aid or impediment in promoting groundwater protection?[J]. Hydrogeology Journal, 21(7): 1389-1392. DOI:10.1007/s10040-013-1019-7 |
Gelsomino A, Keijzer-Wolters A C, Cacco G, et al. 1999. Assessment of bacterial community structure in soil by polymerase chain reaction and denaturing gradient gel electrophoresis[J]. Journal of Microbiological Methods, 38(1): 1-15. |
Griebler C, Lueders T. 2009. Microbial biodiversity in groundwater ecosystems[J]. Freshwater Biology, 54(4): 649-677. DOI:10.1111/j.1365-2427.2008.02013.x |
高太忠, 付海燕. 2015. 氮在河北平原包气带中的迁移转化机制[J]. 安全与环境学报, 15(1): 217-221. |
Gu B, Ge Y, Chang S X, et al. 2013. Nitrate in groundwater of China: Sources and driving forces[J]. Global Environmental Change, 23(5): 1112-1121. DOI:10.1016/j.gloenvcha.2013.05.004 |
Guo H, Li G, Zhang D, et al. 2006. Effects of water table and fertilization management on nitrogen loading to groundwater[J]. Agricultural Water Management, 82(1/2): 86-98. |
Huang P, Zhang J, Zhu A, et al. 2018. Nitrate accumulation and leaching potential reduced by coupled water and nitrogen management in the Huang-Huai-Hai Plain[J]. Science of the Total Environment, 610-611: 1020-1028. DOI:10.1016/j.scitotenv.2017.08.127 |
Jones D L, Shannon D, Murphy D V, et al. 2004. Role of dissolved organic nitrogen (DON) in soil N cycling in grassland soils[J]. Soil Biology and Biochemistry, 36(5): 749-756. DOI:10.1016/j.soilbio.2004.01.003 |
Ju X, Zhang C. 2017. Nitrogen cycling and environmental impacts in upland agricultural soils in North China: A review[J]. Journal of Integrative Agriculture, 16(12): 2848-2862. DOI:10.1016/S2095-3119(17)61743-X |
Khalili B, Nourbakhsh F. 2012. Vertical distribution of soluble organic nitrogen, nitrogen mineralization, nitrification, and amidohydrolase activities in a manure-treated soil[J]. Journal of Plant Nutrition and Soil Science, 175(2): 265-272. DOI:10.1002/jpln.201000046 |
Klenk I D, Grathwohl P. 2002. Transverse vertical dispersion in groundwater and the capillary fringe[J]. Journal of Contaminant Hydrology, 58(1): 111-128. |
孔祥科, 黄国鑫, 韩占涛, 等. 2017. 制革污泥堆存场地典型土壤剖面中污染物的垂向分布特征[J]. 南水北调与水利科技, 15(6): 96-100. |
Kuypers M M M, Marchant H K, Kartal B. 2018. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
Lamontagne M G, Schimel J P, Holden P A. 2003. Comparison of subsurface and surface soil bacterial communities in california grassland as assessed by terminal restriction fragment length polymorphisms of PCR-amplified 16S rRNA genes[J]. Microbial Ecology, 46(2): 216-227. DOI:10.1007/s00248-003-1006-y |
Legout C, Molenat J, Aquilina L, et al. 2007. Solute transfer in the unsaturated zone-groundwater continuum of a headwater catchment[J]. Journal of Hydrology, 332(3/4): 427-441. |
Li D, Zhou Y, Long Q, et al. 2020. Ammonia nitrogen adsorption by different aquifer media: An experimental trial for nitrogen removal from groundwater[J]. Human and Ecological Risk Assessment: 1-13. |
李翔, 杨天学, 白顺果, 等. 2013. 地下水位波动对包气带中氮素运移影响规律的研究[J]. 农业环境科学学报, 32(12): 2443-2450. DOI:10.11654/jaes.2013.12.018 |
Lorite-Herrera M, Hiscock K, Jiménez-Espinosa R. 2009. Distribution of dissolved inorganic and organic nitrogen in river water and groundwater in an agriculturally-dominated catchment, South-East Spain[J]. Water, Air, and Soil Pollution, 198(1/4): 335-346. DOI:10.1007/s11270-008-9849-y |
Louca S, Parfrey L W, Doebeli M. 2016. Decoupling function and taxonomy in the global ocean microbiome[J]. Science, 353(6305): 1272-1277. DOI:10.1126/science.aaf4507 |
Manevski K, Børgesen C D, Li X, et al. 2016. Optimising crop production and nitrate leaching in China: Measured and simulated effects of straw incorporation and nitrogen fertilisation[J]. European Journal of Agronomy, 80: 32-44. DOI:10.1016/j.eja.2016.06.009 |
Nai H, Xin J, Liu Y, et al. 2020. Distribution and molecular chemodiversity of dissolved organic nitrogen in the vadose zone-groundwater system of a fluvial plain, northern China: Implications for understanding its loss pathway to groundwater[J]. Science of the Total Environment, 723: 137928. DOI:10.1016/j.scitotenv.2020.137928 |
Naveen B P, Mahapatra D M, Sitharam T G, et al. 2017. Physico-chemical and biological characterization of urban municipal landfill leachate[J]. Environmental Pollution, 220: 1-12. DOI:10.1016/j.envpol.2016.09.002 |
Nelson M B, Martiny A C, Martiny J B H. 2016. Global biogeography of microbial nitrogen-cycling traits in soil[J]. Proceedings of the National Academy of Sciences, 113(29): 8033-8040. DOI:10.1073/pnas.1601070113 |
Ohno T, Parr T B, Gruselle M C I, et al. 2014. Molecular composition and biodegradability of soil organic matter: A case study comparing two new england forest types[J]. Environmental Science & Technology, 48(13): 7229-7236. |
Perović M, Obradović V, Kova č ević S, et al. 2017. Indicators of groundwater potential for nitrate transformation in a reductive environment[J]. Water Environment Research, 89(1): 4-16. DOI:10.2175/106143016X14733681696121 |
Rysgaard S, Thastum P, Dalsgaard T, et al. 1999. Effects of salinity on NH4+ adsorption capacity, nitrification, and denitrification in Danish estuarine sediments[J]. Estuaries, 22(1): 21-30. DOI:10.2307/1352923 |
Sagova-Mareckova M, Zadorova T, Penizek V, et al. 2016. The structure of bacterial communities along two vertical profiles of a deep colluvial soil[J]. Soil Biology and Biochemistry, 101: 65-73. DOI:10.1016/j.soilbio.2016.06.026 |
商放泽, 杨培岭, 李云开, 等. 2012. 不同施氮水平对深层包气带土壤氮素淋溶累积的影响[J]. 农业工程学报, 28(7): 103-110. DOI:10.3969/j.issn.1002-6819.2012.07.018 |
孙玉冰, 邓守彦, 李德志, 等. 2010. 崇明县土壤主要理化指标的空间分布与变异特征[J]. 生态与农村环境学报, 26(4): 306-312. DOI:10.3969/j.issn.1673-4831.2010.04.004 |
Wang S, Radny D, Huang S, et al. 2017. Nitrogen loss by anaerobic ammonium oxidation in unconfined aquifer soils[J]. Scientific Reports, 7(1). DOI:10.1038/srep40173 |
Wang S, Wang W, Zhao S, et al. 2019. Anammox and denitrification separately dominate microbial N-loss in water saturated and unsaturated soils horizons of riparian zones[J]. Water Research, 162: 139-150. DOI:10.1016/j.watres.2019.06.052 |
Wang S, Wei S, Liang H, et al. 2019. Nitrogen stock and leaching rates in a thick vadose zone below areas of long-term nitrogen fertilizer application in the North China Plain: A future groundwater quality threat[J]. Journal of Hydrology, 576: 28-40. DOI:10.1016/j.jhydrol.2019.06.012 |
Wu H, Song X, Zhao X, et al. 2019. Accumulation of nitrate and dissolved organic nitrogen at depth in a red soil Critical Zone[J]. Geoderma, 337: 1175-1185. DOI:10.1016/j.geoderma.2018.11.019 |
Wu X, Wu L, Liu Y, et al. 2018. Microbial interactions with dissolved organic matter drive carbon dynamics and community succession[J]. Frontiers in Microbiology, 9. DOI:10.3389/fmicb.2018.01234 |
Xiong G, An Q, Fu T, et al. 2020. Evolution analysis and environmental management of intruded aquifers of the Dagu River Basin of China[J]. Science of the Total Environment, 719: 137260. DOI:10.1016/j.scitotenv.2020.137260 |
Xu G, Cheng S, Li P, et al. 2018. Soil total nitrogen sources on dammed farmland under the condition of ecological construction in a small watershed on the Loess Plateau, China[J]. Ecological Engineering, 121: 19-25. DOI:10.1016/j.ecoleng.2017.09.005 |
许明敏, 冯金侠, 陈卫平, 等. 2016. 秸秆集中沟埋还田对土壤氮素分布及微生物群落的影响[J]. 农业环境科学学报, 35(10): 1960-1967. DOI:10.11654/jaes.2016-0533 |
Yin S, Xiao Y, Gu X, et al. 2019. Geostatistical analysis of hydrochemical variations and nitrate pollution causes of groundwater in an alluvial fan plain[J]. Acta Geophysica, 67(4): 1191-1203. DOI:10.1007/s11600-019-00302-5 |
Yuan H, Qin S, Dong W, et al. 2019. Denitrification rate and controlling factors for accumulated nitrate in the deep subsoil of intensive farmlands: A case study in the North China Plain[J]. Pedosphere, 29(4): 516-526. DOI:10.1016/S1002-0160(17)60472-7 |
Zhang D, Fan M, Liu H, et al. 2020. Effects of shallow groundwater table fluctuations on nitrogen in the groundwater and soil profile in the nearshore vegetable fields of Erhai Lake, southwest China[J]. Journal of Soils and Sediments, 20(1): 42-51. DOI:10.1007/s11368-019-02382-8 |
张宏威, 康凌云, 梁斌, 等. 2013. 长期大量施肥增加设施菜田土壤可溶性有机氮淋溶风险[J]. 农业工程学报, (21): 99-107. DOI:10.3969/j.issn.1002-6819.2013.21.013 |
Zhang Q, Sun J, Liu J, et al. 2015. Driving mechanism and sources of groundwater nitrate contamination in the rapidly urbanized region of south China[J]. Journal of Contaminant Hydrology, 182: 221-230. DOI:10.1016/j.jconhyd.2015.09.009 |
赵丽, 刘靖宇, 卫杰, 等. 2020. 某城市生活垃圾填埋场地下水"三氮"及溶解性有机质特征研究[J]. 河南理工大学学报(自然科学版), (3): 68-74. |
周利, 宋以萍, 周杰民, 等. 2020. 稻田硝酸盐异化还原成铵细菌群落结构的垂向分布特性[J]. 环境科学学报, 40(3): 1029-1039. |
周巧丽, 宋玉梅, 周漪波, 等. 2019. 广州市某生活垃圾填埋场空气及地下水污染状况分析[J]. 环境化学, 38(4): 760-769. |
Zhou W, Ma Y, Well R, et al. 2018. Denitrification in shallow groundwater below different arable land systems in a high nitrogen-loading region[J]. Journal of Geophysical Research: Biogeosciences, 123(3): 991-1004. DOI:10.1002/2017JG004199 |
 2021, Vol. 41
2021, Vol. 41


