2. 中国环境科学研究院, 北京 100012
2. Chinese Research Academy of Environmental Sciences, Beijing 100012
毒死蜱(O, O-二乙基-O-(3, 5, 6-三氯-2-吡啶基)硫代磷酸酯)是目前全球应用最广泛的杀虫剂之一(Kateryna et al., 2012; Teresa et al., 2012), 主要用于小麦、大豆、玉米等作物的害虫防治.研究表明, 毒死蜱在防治病虫害的同时可能通过径流、渗漏漂移等途径污染土壤和水环境, 影响生态环境(林玉珍等, 2012; John et al., 2015; 丛鑫等, 2020).土壤中毒死蜱的主要降解产物有O, O-二乙基硫代磷酸酯(DETP)和3, 5, 6-三氯-2-吡啶酚(TCP).DETP可直接被生物利用, 因而降解较快(Singh et al., 2004), 而TCP由于具有较强的抗菌活性, 降解较慢, 因此, 土壤中TCP残留较为常见(Baskaran et al., 2003).TCP比母体毒死蜱生物毒性更强, 且与母体存在毒性协同效应(Caceres et al., 2007; Wang et al., 2015), 土壤中毒死蜱及TCP的环境污染及生态环境风险日益受到重视(薛南冬等, 2017;Dar et al., 2019).
目前一些西方国家已明令禁止毒死蜱农药的使用, 如英国于2016年4月1日起禁止销售、使用毒死蜱产品(郝靓, 2016);欧盟以及美国的一些州也颁布了相关禁令(杨光, 2019; 范小燕, 2020);我国农业部(现为农业农村部)第2032号公告(2017年)规定禁止在蔬菜上使用毒死蜱.但由于毒死蜱具有虫害防治效果好、价格相对便宜等优点, 其应用广泛且施用量大.为降低毒死蜱造成的环境风险和潜在危害, 合理限制其使用量将是未来一段时期环境管理的必然选择.
推荐剂量是指一种农药经田间药效试验后, 提出的防治某种作物病、虫、草害的施药量(或浓度)(Johnson et al., 2015; Pouzou et al., 2019).推荐施用剂量的确定主要考虑作物害虫防治效果(顾中言等, 2020), 很少考虑农药的最大残留限量(MRL)、对动植物产品膳食摄入量的评估和食品安全等因素.毒死蜱农药的施用一般不应超过推荐施用剂量(有效成分0.60 kg·hm-2), 但由于集约农业的发展和经济利益的驱使, 施用频次却不断增加, 甚至常常会是推荐剂量的2倍或多倍施用.毒死蜱的施用特别是超过推荐施用剂量施用可能造成较严重的农业生态环境污染(魏沙平等, 2007; 赵擎等, 2020).因此为了保护农业生态环境, 基于农田中毒死蜱及TCP对生态环境风险, 研究毒死蜱施用限值具有非常重要意义.本研究通过开展田间试验, 研究在玉米、小麦和大豆3种作物中施加毒死蜱后, 土壤中毒死蜱及TCP的污染特征, 基于区域农田环境中毒死蜱及TCP的环境风险, 探讨旱地农田中毒死蜱的施用限值, 为农药合理使用及农业生态环境保护提供科学依据.
2 材料与方法(Materials and methods) 2.1 主要仪器与试剂高效液相色谱仪(LC-20AT, 日本岛津公司);TOC/TN分析仪(MultiN/C 3100, 德国耶拿分析仪器股份公司).
甲醇(色谱纯)和乙酸乙酯(色谱纯)等购自上海安谱科学仪器有限公司.标准品毒死蜱(纯度99.6%), 标准品TCP(纯度99.8%)均购自美国AccuStandard公司;40%毒死蜱乳油, 购自深圳诺普信农化股份有限公司.
2.2 田间试验设计田间试验布置在北京市顺义区白庙村(中国环境科学研究院野外实验基地内), 土壤类型为潮土, 实验地面积约为0.13 hm2.
田间试验方法:参照《农药残留试验准则》(NY/T 788—2004)采用随机区组设计, 按照毒死蜱农药推荐高剂量(有效成分0.60 kg·hm-2)的0.5、1、2、4和5倍(5个浓度水平)施用, 每个剂量3个重复, 设置小区面积为30 m2, 小区之间设过道和保护行.
玉米播种96穴·小区-1(12穴·行-1×8行), 每穴播种3粒, 播种深度为4~6 cm.大豆播种200穴·小区-1(20穴·行-1×10行), 每穴播种3粒, 播种深度为3~5 cm.小麦播种800粒·小区-1(80粒·行-1×10行), 播种深度3~4 cm.
在玉米心叶末期, 小麦拔节期和大豆苗期, 分别在各试验小区均匀喷施毒死蜱后, 在0、1、3、5、10、15、21、30和45 d时, 在每个小区分别采集土壤样品.在每个小区采集随机选取5个点, 采集耕作层(0~20 cm)土壤1~2 kg, 去杂质、混匀后用四分法留样0.5 kg(第5、10、21、30 d采样时, 分0~5、5~10、10~15、15~20 cm 4个层次取样), 样品于-20 ℃下保存, 备用.采集过的样点插有标识, 避免在之后采样中从同一点取样.
在田间试验区域没有施用毒死蜱的地块, 采集耕作层(0~20 cm)土壤, 自然风干后过2 mm筛, 测定土壤理化性质(表 1).土壤有机质含量、可溶性有机碳用MultiN/C 3100总有机碳/氮分析仪测定;微生物量碳采用氯仿熏蒸提取法测定;土壤铵态氮采用2 mol·L-1 KCl浸提靛酚蓝比色法测定;土壤硝态氮采用酚二磺酸比色法测定.
| 表 1 供试土壤理化特性 Table 1 Physical and chemical properties of test soils |
取15 g土壤样品于250 mL锥形瓶中, 加50 mL乙酸乙酯-乙酸-水混合液(V/V/V=98∶1∶1).振荡(200 r·min-1)1 h, 收集上清液, 合并滤液, 加入20 mL 20% NaCl溶液, 振荡(150 r·min-1)10 min, 静置20 min后取上层有机相经无水硫酸钠脱水, 浓缩至10 mL后转移至加有40 mg活性炭的50 mL离心管中.振荡、过滤、浓缩、定容, 过0.22 μm有机滤膜, 采用高效液相色谱仪测定毒死蜱和TCP.测定条件:流动相为甲醇/含有0.02%乙酸的超纯水(V/V=90∶10), 流速为1 mL·min-1, 检测波长为293 nm, 柱温为30 ℃, 进样体积为10 μL.
3 结果与讨论(Results and discussion) 3.1 毒死蜱在旱地土壤环境中残留旱地土壤中3种不同作物(小麦、大豆和玉米)按照5个浓度施用毒死蜱农药, 毒死蜱的主要消解产物TCP在土壤中的浓度从第21 d开始下降(表 2), 对第21 d的土壤样品中的毒死蜱残留进行测定结果见图 1, 玉米、大豆和小麦在0.5、1、2、4和5倍推荐剂量(即施用浓度为0.3、0.6、1.2、2.4和3 kg·hm-2), 施用后测得表层土壤(0~5 cm)中的毒死蜱残留量分别为:0.20、0.25、0.13, 0.41、0.32、0.32, 0.80、0.63、0.71, 1.06、1.11、0.91和3.51、3.21、3.41 mg·kg-1.可见毒死蜱施用浓度提高, 土壤中的农药残留量增大, 可能造成的环境风险就越大.施用相同剂量毒死蜱时, 种植玉米的土壤中毒死蜱的残留量整体上要多于种植大豆和小麦的土壤样品, 只有在0.5倍和4倍推荐剂量时大豆田土壤中的残留量多于种植玉米和小麦的土壤, 对比分析1倍、2倍和5倍推荐剂量时的测定结果, 种植玉米的土壤中的农药残留量分别比种植大豆的土壤增多0.09、0.17、0.34 mg·kg-1, 比种植小麦的土壤增加0.09、0.09、0.10 mg·kg-1, 这可能因为毒死蜱在3种作物上的附着率不同以及不同作物对毒死蜱的吸附能力不同(Rezk et al., 2018; Sapna et al., 2018; Wang et al., 2019), 有研究表明大豆和小麦对农药的吸附能力要强于玉米(Dong et al., 2016; 所凤阅, 2018).此外, 土壤中毒死蜱残留量差异也与作物覆盖度有关(张金虎等, 2009), 而玉米的覆盖度相对较低, 可见, 种植玉米的土壤中农药产生的潜在风险会大于大豆田和小麦田的.
| 表 2 施用不同浓度毒死蜱后小麦、大豆和玉米作物土壤中不同时期的TCP浓度 Table 2 Concentrations of TCP in wheat, soybean and corn soil at different stages after chlorpyrifos application |
 |
| 图 1 毒死蜱不同施用剂量对小麦、大豆和玉米田土壤中残留浓度的影响 Fig. 1 Effect of application of chlorpyrifos with different concentrations on its residues in soils of wheat, soybean and corn crops |
3种作物田在施用毒死蜱后21 d土壤中的残留、降解曲线方程、参数及TCP含量见表 3, 从中可以看出, 毒死蜱的施用剂量越大, 土壤中残留量降解曲线的K值就越大, 说明毒死蜱在农田土壤中的降解速率随着农药施用浓度的增加而提高.在施用0.5倍和1倍推荐剂量的毒死蜱时, 玉米田中残留量降解曲线的K值要大于大豆田和小麦田, 而在施用2倍、4倍和5倍推荐剂量的毒死蜱时, 小麦田中残留量降解曲线的K值则大于大豆田和玉米田的, 可见在低浓度施用剂量下玉米田中农药降解的速率较快, 而高浓度施用剂量时小麦田中农药的降解速率较快, 在判断不同作物的毒死蜱施用限值时可以考虑不同浓度下的降解速率.
| 表 3 施用不同浓度毒死蜱后小麦、大豆和玉米作物土壤中农药残留、降解曲线方程、参数及TCP含量 Table 3 Chlorpyrifos residue content, degradation curve equation, parameters and TCP content in the soils of wheat, soybean and corn crops with different concentrations |
3种作物田土壤中毒死蜱的主要降解产物TCP含量随着毒死蜱施用剂量的增加均有升高趋势, 见表 3.玉米、大豆和小麦在0.5、1、2、4和5倍推荐剂量施用后测得土壤环境中的TCP残留量分别为:0.11、0.15、0.14, 0.27、0.27、0.23, 0.47、0.53、0.49, 0.52、0.61、0.65和0.91、0.94、0.87 mg·kg-1.对比分析3种作物土壤在不同施用剂量下的TCP残留量可以发现, 相同施用剂量, 不同作物土壤中的TCP残留量近似相等, 这说明TCP在农田土壤中的残留量受作物种类的影响较小, 在旱地土壤中的降解主要与外界环境有关.比较作物土壤在不同农药施用剂量下的毒死蜱残留量与TCP残留量可以发现, 在0.5、1和2倍推荐剂量的低浓度范围内, 二者的残留量相差不大, 而在4倍和5倍的高浓度下农田土壤中的毒死蜱残留量要比TCP残留量多出许多, 可见二者在土壤中降解速率的差异随着农药施用浓度的增加而增大, 考虑到TCP有更强的抗降解能力, 其造成的生态环境风险更加不容忽视.
3.2 不同施用剂量下对土壤环境生态风险评估在3种作物田中分别施用0.5、1、2、4和5倍推荐剂量(对应浓度为0.3、0.6、1.2、2.4、3 kg·hm-2), 利用模型估算施用后可能产生的生态风险, 同时与农田土壤中毒死蜱实测值计算的风险值进行比较, 评价农田施用农药毒死蜱后对生态环境的潜在风险.计算公式见式(1).
土壤中农药的短期生态风险通过土壤环境中农药预测浓度(PECS)来估算(Zhan et al., 2012):
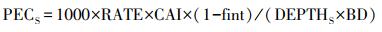
|
(1) |
式中, PECS为土壤环境中农药的预测浓度(mg·kg-1);DEPTHS为短期风险下的表层土壤深度(m);CAI为农药中有效成分含量;fint为农药被作物截留的系数;RATE为单位面积农药施用量(g·m-2);BD为土壤容重(kg·m-3);1000为单位换算系数.
土壤中农药的短期生态风险值(RVS):
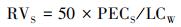
|
(2) |
式中, LCW为蚯蚓的急性半致死浓度(mg·kg-1);50为安全系数(土壤中可能存在其他对该农药更敏感的生物).
土壤长期生态风险估算方法(Beinat et al., 1996)见式(3).长期风险下土壤环境中农药的预测浓度(PECL)为:
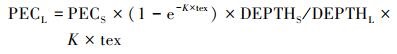
|
(3) |
式中, PECL为农药长期风险下土壤环境中的预测浓度(mg kg-1);DEPTHL为长期风险下的表层土壤深度(m);tex为慢性毒理实验暴露时间间隔(d), 默认值为21 d;K为土壤降解率常数(d-1).
农药的长期生态风险值(RVL)估算:
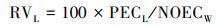
|
(4) |
式中, NOECW为蚯蚓慢性无作用浓度值(mg·kg-1);100为安全系数, 将这里的安全系数设定为短期风险时的两倍, 是考虑到长期风险更大的不确定性(He et al., 2019), 以及其他未知作用因素(如吸附、生物富集)可能造成土壤环境中该农药降解速度减缓或农药残留产生累积的情况.
比较RVS和RVL的值, 取其中最大的代表土壤中农药的生态风险估算值, 为了便于比较各RV值, 需要对该值进行标准化, 对所有得到的风险值进行对数转换, 使其绝大部分落在0~100之间(如果RS < 0, 则取RS=0), 见式(5).
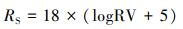
|
(5) |
以预测浓度与半致死浓度比值作为关注标准, 依据公式(5)转换, 得到风险值0~60、60~75、75~85和 > 85, 分别代表无风险、低风险、中等风险和高风险4个相对风险等级.
本研究中使用药剂为40%的毒死蜱乳油, 毒死蜱的特征参数主要参考PPDB农药数据库的典型实验数据(Zhan et al., 2012), 毒死蜱对蚯蚓的急性半致死浓度(LC50)为129 mg·kg-1, 慢性无作用浓度(NOECW)为12.7 mg·kg-1, 毒死蜱在砂土中的半衰期(DT50)为50 d.对不同农作物及其生长时期对喷(撒)施在其上农药的截留试验数据, 玉米、大豆和小麦的截留系数分别为:0.89、0.22和0.11(Padovani et al., 2004).潮土BD(土壤容重)为1390 kg·m-3, K取(ln2)/50.
图 2是不同毒死蜱施用剂量下的土壤环境预测生态风险与实测生态风险比较, 从中可以看出, 随着毒死蜱施用剂量的增加, 3种作物种植土壤短期和长期生态风险均升高, 在3种作物田中, 种植玉米的土壤预测和实际生态风险有明显差异, 而种植大豆和小麦的土壤环境风险的预测值与实际值较为接近.
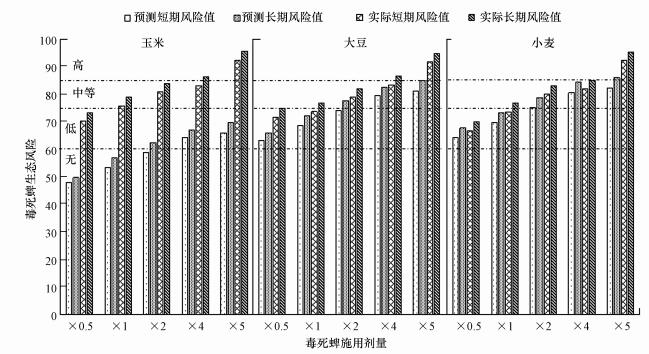 |
| 图 2 不同剂量毒死蜱施用后预测和实测生态风险值[×0.5, ×1, ×2, ×4, ×5 ] Fig. 2 Predicted and measured Ecological risk values in different doses of chlorpyrifos applied |
通过模型计算出的旱地土壤预测短期和预测长期生态风险结果显示, 当毒死蜱以推荐剂量施用到玉米、大豆和小麦田时, 土壤短期风险值分别为:53.34、68.66和69.69, 长期风险值分别为:57.01、72.32和73.35, 表明以推荐剂量施用毒死蜱时不同作物田土壤的生态风险有一定的差异, 玉米田处于无风险、大豆田和小麦田均处于低风险, 按0.5倍推荐剂量施用时3种作物田的生态风险等级未发生改变;当以2倍推荐剂量施用毒死蜱时, 玉米、大豆和小麦田土壤中的短期生态风险值分别为:58.76、74.08、75.11, 长期生态风险值分别为:62.43、77.74、78.77, 玉米田处于低风险、大豆田和小麦田均达到中等风险;4倍推荐剂量毒死蜱施用时, 玉米、大豆和小麦田的短期风险值分别为:64.19、79.50、80.53, 长期风险值分别为:66.90、82.60、84.36, 与2倍推荐剂量相比风险值均增大, 但二者风险等级相同;当以5倍推荐剂量施用毒死蜱到玉米、大豆和小麦田时, 短期风险值分别为:65.93、81.24、82.27, 长期风险值分别为:69.59、84.90、85.94, 预测结果表明此剂量下玉米田处于低风险、大豆田处于中等风险, 小麦田的短期生态风险为中等, 而三者长期生态风险均达到了高风险等级.
根据上式(1)~(5)可以推导, 当大豆、小麦和玉米施用毒死蜱剂量分别达1.262、1.1063和8.951 kg·hm-2时, 土壤短期风险值为75, 短期风险达到中等风险水平.当大豆、小麦和玉米的施用剂量分别达0.845、0.7406和5.9922 kg·hm-2时, 土壤长期风险值为75, 长期风险达到中等风险水平.由此可知, 按照推荐剂量0.6 kg·hm-2施用, 大豆、小麦、玉米土壤短期和长期风险均较低.基于本预测模型中长期环境风险不超过中等风险等级的考虑, 毒死蜱在玉米田中的施用限值为5.9922 kg·hm-2, 在小麦田中的施用限值为0.7406 kg·hm-2, 在大豆田中的施用限值为0.845 kg·hm-2.
对施用毒死蜱后的农田土壤中农药残留浓度进行测定并计算其实际短期和实际长期生态风险值, 从图 2可以看出, 3种作物田土壤的短期和长期生态风险均随施用剂量的增加而增加.当以0.5、1、2、4和5倍推荐剂量施用毒死蜱时, 玉米、大豆和小麦农田土壤中短期风险值分别为:70.11、71.73、66.74, 75.69、80.81、92.18, 73.74、78.96、92.40, 83.03、83.41、81.89和73.58、79.96、91.72, 长期风险值分别为:73.25、74.87、69.88, 78.83、76.88、76.72, 83.95、82.09、83.10, 86.17、86.54、85.03和95.53、94.86、95.32, 表明玉米田土壤在0.5倍推荐剂量施用毒死蜱时, 其实际短期风险属于低风险等级, 在1倍、2倍和4倍推荐剂量时为中等风险, 5倍推荐剂量时则达到了高风险等级;大豆和小麦农田土壤风险一致, 0.5倍和1倍推荐剂量施用毒死蜱时, 实际短期风险属于低风险等级, 在2倍和4倍推荐剂量时为中等风险, 5倍推荐剂量时达到高风险等级.玉米、大豆、和小麦种植土壤的实际长期生态风险较为一致, 当毒死蜱以0.5倍推荐剂量施用后, 3种作物田均为低风险等级, 1倍和2倍推荐剂量的毒死蜱施用时均为中等风险等级, 在4倍和5倍推荐剂量时均达到了高风险等级.
根据模型和不同剂量下农田土壤中的实际农药残留浓度可以推导, 当大豆、小麦和玉米施用毒死蜱剂量分别达0.7223、0.7652和0.6769 kg·hm-2时, 土壤实际短期风险值为75, 达到中等风险水平.当大豆、小麦和玉米施用剂量分别达0.5882、0.6373和0.5506 kg·hm-2时, 土壤实际长期风险值为75, 达到中等风险水平.由此可知, 按照推荐剂量0.6 kg·hm-2施用时, 玉米和大豆田的土壤实际长期风险超过了中等风险水平.通过对农田土壤中农药残留浓度进行实测并计算确定风险等级, 毒死蜱在大豆田中的施用限值为0.5882 kg·hm-2, 在小麦田中的施用限值为0.6373 kg·hm-2, 在玉米田中的施用限值为0.5506 kg·hm-2.
TCP是毒死蜱的主要消解产物, 具有水溶性较大, 抗降解能力较强, 易迁移的特点(Baskaran et al., 2003; 程娟等, 2016; Qiu et al., 2020), 对施用不同剂量毒死蜱后主要代谢产物TCP变化分析发现, TCP在0~20 d时浓度呈上升趋势, 20 d后TCP的浓度下降.种植3种作物土壤中TCP浓度变化趋势相似, 浓度大小也基本相同.施加毒死蜱的土壤中, 施用剂量越大其在土壤中消解后产物浓度越大, 土壤中TCP的持久性随着剂量率的增加而增加.因此, 需要进一步分析毒死蜱的活性产物TCP在土壤中短期风险值和长期风险.
按施用毒死蜱后的农田土壤中TCP残留实测浓度计算其短期和长期生态风险值.
土壤中TCP的短期生态风险值(RTS)计算方法见式(6).
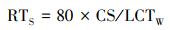
|
(6) |
式中, CS为农田土壤中残留实测浓度(mg·kg-1), LCTW为TCP对蚯蚓的急性半致死浓度(mg·kg-1);80为安全系数(土壤中可能存在其他对TCP更敏感的生物, 考虑到TCP比毒死蜱生物毒性更强, 故取更大的安全系数的值).
土壤中TCP的长期生态风险值(RVTL)估算见式(7).

|
(7) |
式中, CL为农田土壤中TCP残留实测浓度(mg·kg-1);NOECTW为TCP对蚯蚓慢性无作用浓度值(mg·kg-1);160为安全系数(考虑到长期风险更大的不确定性)
比较RVTS和RVTL的值, 取其中最大的代表土壤中农药的生态风险估算值, 为了便于比较各RVT值, 需要对该值进行标准化, 对所有得到的风险值进行对数转换, 使其大部分落在0~100之间(如果RS < 0, 则取RTS=0), 见式(8).

|
(8) |
依据风险值的评判标准:0~60、60~75、75~85和 > 85, 分别代表无风险、低风险、中等风险和高风险4个相对风险等级.参考相关研究(Rao et al., 2003; Silva et al., 2010; 徐冬梅等, 2015; 苏连水, 2016)取TCP对蚯蚓的急性半致死浓度(LCTW)为122 mg·kg-1, 慢性无作用浓度(NOECTW)12.5 mg·kg-1.
不同浓度毒死蜱对小麦、大豆和玉米作物种植土壤中毒死蜱与TCP的土壤环境短期和长期生态风险(预测值与实测值)见表 4.可以看出, 对于玉米田土壤的生态风险, 模型预测浓度计算的生态风险值较基于实测土壤中毒死蜱浓度计算的生态风险值偏低, 而大豆田和小麦田的预测结果与实测结果较为一致.玉米田土壤中实测浓度之所以偏高, 可能与作物对农药的吸附率有关.此外, 研究区内气候、土壤特性、灌溉等因素同样有可能影响预测结果的准确性.
| 表 4 不同浓度毒死蜱对小麦、大豆和玉米作物种植土壤中毒死蜱与TCP的短期和长期生态风险 Table 4 Short-term and long-term ecological risks of chlorpyrifos and TCP in wheat, soybean and corn crop-growing soils with different concentrations of chlorpyrifos |
TCP是土壤中毒死蜱主要消解产物且其生物毒性要高于毒死蜱, 不同剂量毒死蜱施用到3种作物农田后TCP的短期和长期生态风险见图 3, 从中可以看出, 随着毒死蜱施用剂量的增加, 3种作物种植土壤中TCP的短期和长期生态风险均表现出增大的趋势, 仅有大豆种植土壤在4倍推荐剂量下的生态风险有所降低.当毒死蜱以0.5、1、2、4和5倍推荐剂量分别施用到3种作物农田中, TCP在玉米、大豆和小麦农田土壤中短期风险值分别为:69.54、71.94、71.45, 76.34、76.48、75.30, 80.83、81.77、81.05, 81.61、76.74、83.29和85.93、86.21、85.64.长期生态风险值分别为:92.77、95.17、94.68, 99.57、99.71、98.53, 104.06、105.00、104.28, 104.83、99.97、106.52和109.15、109.44、108.87.利用TCP残留浓度计算生态风险值结果表明以0.5倍推荐剂量施用到3种作物田中其短期生态风险为低风险等级, 当施用1、2和4倍推荐剂量的毒死蜱后, 3种作物田中的短期风险均升高到中等水平, 5倍推荐剂量下都为高风险等级;3种作物田TCP的长期生态风险在5种剂量下均为高风险等级.
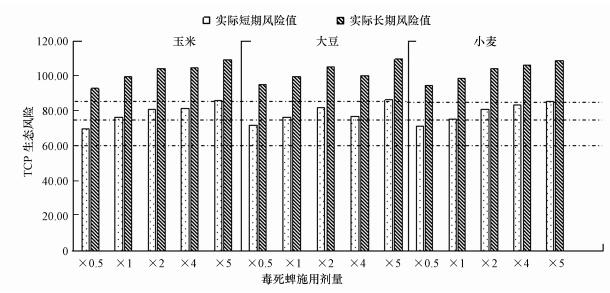 |
| 图 3 不同浓度毒死蜱施用后TCP短期和长期生态风险值[×0.5, ×1, ×2, ×4, ×5 ] Fig. 3 Short-term and long-term ecological risk values of TCP after application of chlorpyrifos at different concentrations |
根据式(6)~(8)可以推导, 当土壤中TCP浓度为0.2238 mg·kg-1, 土壤短期风险值为75, 达到中等风险水平, 当土壤中TCP浓度为0.0115 mg·kg-1, 土壤长期风险值为75, 也达到中等风险水平.考虑到模型计算出的土壤TCP长期生态风险值较大, 且依据TCP长期风险值不大于75时推导出的毒死蜱施用浓度为负值, 故基于土壤TCP短期风险在中等风险水平以下的标准, 推导出毒死蜱在大豆田中的施用限值为0.4412 kg·hm-2, 在小麦田中的施用限值为0.5034 kg·hm-2, 在玉米田中的施用限值为0.5487 kg·hm-2.
模型模拟预测结果表明TCP与毒死蜱的短期实际风险等级较为一致, 生态风险值相差不大, 只有1倍推荐剂量施用时, 大豆和小麦田中TCP的短期实际测定风险高于毒死蜱的, TCP的长期实际测定风险值均高于毒死蜱的, 可见超推荐剂量施用毒死蜱到农田中, TCP具有较高生态风险.综合考虑通过模型预测与根据土壤中的实际残留浓度计算出的生态环境风险, 由于土壤环境中毒死蜱农药和其代谢产物TCP共存, 且二者具有毒性协同作用, 一并考虑两种污染物潜在生态环境风险时, 应按照较严格的标准设定施用限值, 以两个指标计算出的风险均不超过中等水平为标准, 考虑降解速率及实际情况, 取根据模型推导出的较低的施用量为施用限值, 确定毒死蜱在大豆田中的施用限值为0.4412 kg·hm-2, 在小麦田中的施用限值为0.5034 kg·hm-2, 在玉米田中的施用限值为0.5487 kg·hm-2.
4 结论(Conclusions)1) 玉米、大豆和小麦农田土壤中的毒死蜱和TCP残留量均随着毒死蜱施用剂量的增加而增大.相同施用剂量下玉米田土壤中的毒死蜱残留量大于大豆田和小麦田.毒死蜱在农田土壤中的降解速率随着施用浓度的增加而提高, 毒死蜱和TCP在土壤中降解速率的差异随着农药施用浓度的增加而增大.
2) 随着毒死蜱施用剂量的增加, 小麦、大豆、玉米土壤中毒死蜱及TCP的短期和长期生态风险均增大.不同作物(小麦、大豆、玉米)土壤中毒死蜱及TCP的短期和长期生态风险均有差异, 相同施用剂量下大豆田土壤中生态环境风险高于玉米田和小麦田.TCP的生态环境风险值高于毒死蜱.
3) 基于模型预测和土壤中的毒死蜱与TCP残留计算出的环境风险, 计算旱地土壤中农药毒死蜱在大豆田中的施用最大限值为0.4412 kg·hm-2, 在小麦田中的施用限值为0.5034 kg·hm-2, 在玉米田中的施用限值为0.5487 kg·hm-2.
Baskaran S, Kookana R S, Naidu R. 2003. Contrasting behaviour of chlorpyrifos and its primary metabolite, TCP (3, 5, 6-trichloro-2-pyridinol), with depth in soil profiles[J]. Australian Journal of Soil Research, 41(4): 749-760. DOI:10.1071/SR02062 |
Beinat E, Den B R V. 1996. EUPHIDS, a decision-support system for the admission of pesticides[J]. National Institute of Public Health and the Environment, 3: 24-27. |
Caceres T, He W, Naidu R, et al. 2007. Toxicity of chlorpyrifos and TCP alone and in combination to Daphnia carinata: The influence of microbial degradation in natural water[J]. Water Research, 41(19): 4497-4503. DOI:10.1016/j.watres.2007.06.025 |
程娟, 万婷婷, 赵慧慧, 等. 2016. 毒死蜱对棉花根际土细菌群落多样性和结构的影响[J]. 中国生态农业学报, 24(5): 652-659. |
丛鑫, 王冬琦, 邓艳玲, 等. 2020. 水分调控下旱地土壤中毒死蜱的消解研究[J]. 环境科学研究, 33(3): 751-760. |
Dar M A, Kaushik G, Villarreal-Chiu J F. 2019. Pollution status and bioremediation of chlorpyrifos in environmental matrices by the application of bacterial communities: A review[J]. Journal of Environmental Management, 239: 124-136. |
Dong X F, Liang S X, Shi Z H, et al. 2016. Development of multi-residue analysis of herbicides in cereal grain by ultra-performance liquid chromatography-electrospray ionization-mass spectrometry[J]. Food Chemistry, 192: 432-440. DOI:10.1016/j.foodchem.2015.07.025 |
范小燕. 2020. 欧盟禁用毒死蜱和噻虫啉[J]. 现代农药, 19(2): 20. |
顾中言, 徐德进, 徐广春. 2020. 论农药雾滴的剂量及分布对害虫防治效果的影响及其与农药损失的关系[J]. 农药学学报, 22(2): 193-204. |
郝靓. 2016. 英国禁用毒死蜱[J]. 精细与专用化学品, 24(4): 13. |
He Y, Xiao S, Dong T, et al. 2019. Gold nanoparticles with different particle sizes for the quantitative determination of chlorpyrifos residues in soil by SERS[J]. International Journal of Molecular Sciences, 20(11): 2817. DOI:10.3390/ijms20112817 |
John E M, Shaike J M. 2015. Chlorpyrifos: Pollution and remediation[J]. Environmental Chemistry Letters, 13(3): 269-291. DOI:10.1007/s10311-015-0513-7 |
Johnson S, Khushboo S, Jain S K, et al. 2015. Evaluation of pesticide toxicity at their field recommended doses to honeybees, Apis cerana and A. mellifera through laboratory, semi-field and field studies[J]. Chemosphere, 119: 668-674. DOI:10.1016/j.chemosphere.2014.07.039 |
Kateryna B, Maureen D, Louis P, et al. 2012. Environmental exposure to organophosphorus and pyrethroid pesticides in South Australian preschool children: a cross sectional study[J]. Environment International, 48: 109-120. DOI:10.1016/j.envint.2012.07.007 |
林玉珍, 曾光明, 张娱, 等. 2012. 有机农药滴滴涕和毒死蜱生物降解机制的分子模拟研究[J]. 环境科学, 33(3): 1015-1019. |
Padovani L, Trevisan M, Capri E. 2004. A calculation procedure to assess potential environmental risk of pesticides at the farm level[J]. Ecological Indicators, 4(2): 111-123. DOI:10.1016/j.ecolind.2004.01.002 |
Pouzou J G, Kissel J, Yost M G, et al. 2019. Use of benchmark dose models in risk assessment for occupational handlers of eight pesticides used in pome fruit production[J]. Regulatory Toxicology and Pharmacology, 110: 104504. |
Qiu W, Liu J, Li B, et al. 2020. N2O and CO2 emissions from a dryland wheat cropping system with long-term N fertilization and their relationships with soil C, N, and bacterial community[J]. Environmental Science and Pollution Research International, 27(1). |
Rao V, Pavan S J, Madhavendra Y, et al. 2003. Toxic effects of chlorpyrifos on morphology and acetylcholinesterase activity in the earthworm, Eisenia foetida[J]. Ecotoxicology and Environmental Safety, 54(3): 296-301. DOI:10.1016/S0147-6513(02)00013-1 |
Rezk Mamdouh R, Abd El-Aleem Abd El-Aziz B, Khalile Shaban M, et al. 2018. Determination of residues of diazinon and chlorpyrifos in lavender and rosemary leaves by gas chromatography[J]. Journal of AOAC International, 101(2): 587-592. DOI:10.5740/jaoacint.17-0193 |
Sapna K, Kumar D J, Kumar P S, et al. 2018. Residue dynamics and risk assessment of Luna Experience® (fluopyram+tebuconazole) and chlorpyrifos on French beans (Phaseolus vulgaris L.)[J]. Environmental science and pollution research international, 25: 27594-27605. DOI:10.1007/s11356-018-2733-4 |
Silva P M C S D, Pathiratne A, Gestel C A M V. 2010. Toxicity of chlorpyrifos, carbofuran, mancozeb and their formulations to the tropical earthworm Perionyx excavatus[J]. Applied Soil Ecology, 44(1): 56-60. DOI:10.1016/j.apsoil.2009.09.005 |
Singh B K, Walker A, Morgan J A W, et al. 2004. Biodegradation of chlorpyrifos by enterobacter Strain B-14 and its use in bioremediation of contaminated soils[J]. Appl Environ Microbiol, 70(8): 4855-4863. DOI:10.1128/AEM.70.8.4855-4863.2004 |
苏连水. 2016. 三种农药和重金属镍对蚯蚓联合毒性效应研究[D]. 南京: 南京农业大学
|
所凤阅. 2018. 玉米秸秆生物炭的研制及其对水体中农药的吸附机制研究[D]. 沈阳: 沈阳农业大学
|
Teresa M M, Verónica I, Boris L, et al. 2012. Predictors of exposure to organophosphate pesticides in schoolchildren in the Province of Talca, Chile[J]. Environment International, 47: 28-36. DOI:10.1016/j.envint.2012.06.002 |
Wang H, Zheng L, Yu W, et al. 2019. Dissipation behavior of chlorpyrifos residues and risk assessment in sugarcane fields. [J]. Biomedical chromatography: BMC, 33(3): e4424
|
Wang J, Wang J, Zhu L, et al. 2014. The enzyme toxicity and genotoxicity of chlorpyrifos and its toxic metabolite TCP to zebrafishDanio rerio[J]. Ecotoxicology, 23(10): 1858-1869. DOI:10.1007/s10646-014-1321-8 |
魏沙平, 李红陵, 陈飞霞, 等. 2007. 土壤腐殖酸对毒死蜱的吸附[J]. 环境科学学报, 27(10): 1675-1680. DOI:10.3321/j.issn:0253-2468.2007.10.015 |
徐冬梅, 王彦华, 王楠, 等. 2015. 铜、毒死蜱单一与复合暴露对蚯蚓的毒性作用[J]. 环境科学, 36(1): 280-285. |
薛南冬, 刘寒冰, 杨兵, 等. 2017. 毒死蜱土壤环境行为研究进展[J]. 浙江大学学报(农业与生命科学版), 43(6): 713-726. |
杨光. 2019. 美国加州决定禁用毒死蜱生产商表示将尝试各种途径挑战该提案[J]. 农药市场信息, (13): 44. |
张金虎, 赵政阳, 梁俊, 等. 2009. 毒死蜱在苹果果实、叶片及果园土壤中的残留分析研究[J]. 中国农学通报, 25(1): 185-189. |
Zhan Y, Zhang M H. 2012. PURE: A web-based decision support system to evaluate pesticide environmental risk for sustainable pest management practices in California[J]. Ecotoxicology and Environmental Safety, 82: 104-113. DOI:10.1016/j.ecoenv.2012.05.019 |
赵擎, 张学维, 周润生, 等. 2020. 过一硫酸盐降解毒死蜱[J]. 环境科学学报, 40(4): 1214-1222. |
 2021, Vol. 41
2021, Vol. 41


