2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006;
3. 广东省固体废物污染控制与资源化重点实验室, 广州 510006
2. Key Laboratory of Pollution Control and Ecosystem Restoration in Industrial Clusters, Ministry of Education, Guangzhou 510006;
3. Guangdong Provincial Key Laboratory of Solid Wastes Pollution Control and Recycling, Guangzhou 510006
铬(Cr)是酸性矿山废水(Acid Mine Drainage, AMD)中常见的重金属污染物(Luo et al., 2020).自然水体中, 铬的存在价态主要为Cr(Ⅵ)和Cr(Ⅲ), 其中, Cr(Ⅵ)的毒性远大于Cr(Ⅲ).长期暴露在Cr(Ⅵ)污染环境中会极大损害人体的肝、肾、肺和内分泌系统(Wan et al., 2018).Galán等(2003)的调查研究表明, 在印度东北部Makum矿区, 受AMD污染河流沉积物中的Cr含量为100~386.1 mg·kg-1.在广东大宝山矿区, 受AMD污染河流的底泥中Cr污染物的含量为97~180 mg·kg-1, 其中, 在易还原矿物中的Cr含量约为68.01 mg·kg-1(谢莹莹, 2018).已有研究表明, 在AMD环境中, Cr的地球化学循环过程与铁硫酸盐次生矿物如黄钾铁矾的形成和转化密切相关(Xie et al., 2017; 李君菲等, 2018; Wan et al., 2018).
黄钾铁矾(KFe3(SO4)2(OH)6)是AMD环境中常见的铁硫酸盐次生矿物之一(王红梅等, 2015; 曹丽娜等, 2019).已有研究表明, 黄钾铁矾的比表面积为1.4~4.0 m2·g-1(Baron et al., 1996; Gao et al., 2019), 其结构中的K+能够被Pb2+、Tl+等离子取代, Fe3+点位能够被Cr3+和Cu2+占据, SO42-能够被AsO43-替换(Lengauer et al., 1994; Smith et al., 2006).另外, CrO42-和SO42-具有相同的电荷数和相近的离子半径(CrO42-为0.24 nm, SO42-为0.23 nm), CrO42-也能够取代黄钾铁矾结构中的SO42-, 形成负载Cr的黄钾铁矾类矿物(Baron et al., 1996; 2002;李君菲等, 2018).研究发现, 黄钾铁矾能够通过吸附或共沉淀固定水体中的重金属和类金属等污染物(刘奋武等, 2013).然而, 黄钾铁矾为亚稳态晶型结构, 环境条件变化容易导致黄钾铁矾溶解或发生相转变为其他更稳定的铁矿物, 使得之前固定去除的污染物如CrO42-重新释放进入水体.研究表明, 影响黄钾铁矾稳定性的因素有很多, 其中, 除pH、温度、有机质等物理化学因素外, 微生物活动也是引起黄钾铁矾溶解和相转变的重要原因(Smith et al., 2006; Ouyang et al., 2014; 唐苑君等, 2020).
铁还原菌是AMD环境中一类常见的还原型微生物, 常见的菌属有希瓦氏菌(Shewanella)、地杆菌(Geobacter)和地发菌(Geothrix)等(包艳萍, 2018).研究表明, 希瓦氏菌(Shewanella)能够通过与铁矿物直接接触、纳米导线、分泌螯合剂和电子穿梭体等电子传递途径还原铁矿物中的Fe(Ⅲ)(Shi et al., 2016).同时, 希瓦氏菌对黄钾铁矾的稳定性和负载Cr的迁移转化特性有重要影响(Ouyang et al., 2014).研究微生物还原溶解黄钾铁矾过程中Cr的迁移再分配规律对进一步理解AMD环境中Fe、S、Cr等元素的地球化学循环过程有重要意义.
因此, 本研究拟在实验室条件下, 合成纯的黄钾铁矾和负载Cr的黄钾铁矾, 研究Cr负载对黄钾铁矾稳定性的影响; 同时, 活化富集实验室已有的Shewanella oneidensis MR-1(S. oneidensis MR-1), 研究厌氧条件下S. oneidensis MR-1菌还原溶解黄钾铁矾过程中Cr的迁移再分配规律.
2 材料与方法(Materials and methods) 2.1 合成矿物参考Baron等(1996)的方法合成纯的黄钾铁矾和负载Cr的黄钾铁矾.其中, 纯黄钾铁矾的合成步骤为:在250 mL烧杯中分别加入100 mL去离子水、17.2 g Fe2(SO4)3·5H2O和5.6 g KOH; 用锡箔纸密封烧杯, 并置于95 ℃油浴锅中, 恒温搅拌4 h; 通过“静止沉淀-弃上清液-加去离子水搅拌”将矿物悬浮液洗涤3~5次后; 冷冻干燥, 过200目筛, 保存在厌氧箱内备用.为便于表述, 将纯黄钾铁矾命名为“0Cr-J”.
负载Cr黄钾铁矾的合成方法与纯黄钾铁矾类似.本实验中合成了两种不同Cr负载量的黄钾铁矾, 在合成负载Cr黄钾铁矾矿物过程中, 将去离子水分别替换为1.0 g·L-1和10.0 g·L-1的K2CrO4溶液, 分别将两种负载Cr的黄钾铁矾命名为“1.0Cr-J”和“10.0Cr-J”.矿物合成后, 检测分析矿物的晶型结构特征; 利用王水将矿物完全消解, 测定矿物中K、Fe、S和Cr元素的含量.
2.2 培养富集微生物实验所用微生物为实验室已有S. oneidensis MR-1菌(ATCC 700500) (Li et al., 2016).从平板中挑取少量S. oneidensis MR-1菌, 转移至营养肉汤中进行好氧培养; 生长至对数期后, 高速离心菌液(10000 r·min-1, 4 ℃, 10 min); 用无氧的碳酸氢钠缓冲液(2.5 g·L-1 NaHCO3, 2.5 g·L-1 NaCl, pH=7.0)洗涤微生物2~3次, 定容(Ouyang et al., 2014).
2.3 实验设置以“0Cr-J”、“1.0Cr-J”和“10.0Cr-J”为研究对象, 设置3组微生物还原实验.每组微生物还原实验均设置无菌对照组, 分别用“0Cr-J无菌”、“1.0Cr-J无菌”和“10.0Cr-J无菌”表示.所有实验组均设置3个平行.
实验用培养基参照DM培养基(Myers et al., 1988; Ouyang et al., 2014).培养基的组成成分为:2.94 mmol·L-1 KH2PO4、18.70 mmol·L-1 NH4Cl、0.49 mmol·L-1 CaCl·2H2O、1.05 mmol·L-1 MgCl2、15 mmol·L-1乳酸钠; 将培养的pH调至~7.0.
分别称取0.5 g的“0Cr-J”、“1.0Cr-J”和“10.0Cr-J”, 加入相应的钳口瓶, 并向每个钳口瓶加入100 mL配制好的DM培养基; 曝N2除氧(30 min)后, 立即用丁甲基橡胶塞密封钳口瓶, 并用铝盖固定; 高温高压灭菌(121 ℃, 0.12 MPa, 30 min)后转移至超净台冷却.利用无菌注射器向每个有菌组的钳口瓶注入1 mL的S. oneidensis MR-1菌液, 所有有菌瓶内加入的菌液量相同, 加入菌液后的钳口瓶内微生物浓度约为107 cells·mL-1; 向无菌对照组的钳口瓶中注入1 mL碳酸氢钠缓冲液.将所有钳口瓶转入恒温摇床培养(30 ℃, 150 r·min-1).利用无菌注射器定期取样, 检测水质参数和矿物固相参数.
2.4 分析检测采用邻菲罗啉显色法检测溶液中的Fe2+浓度, 紫外分光光度计(UV-160A, Shimadzu, Japan)的波长设置为510 nm; 采用火焰原子吸收法测定溶液中K+和总Cr的浓度(Optima 5300DV Perkin-Elmer, San Diego, USA); 采用离子色谱仪(Dionex ICS-1500, USA)测定溶液中SO42-的浓度; 利用高效液相色谱仪(HPLC, Angilent LC 1260, USA)测定溶液中乳酸盐和醋酸盐的浓度(Wan et al., 2018; Gao et al., 2019).测样过程中均以去离子水作空白; 所有标准物质分别为硫酸亚铁铵(优级纯)、GSB04-1733-2004(K)、GSB04-1723-2004(Cr)、GSB04-1773-2004(SO42-)、乳酸钠(优级纯)和醋酸钠(优级纯); 每组实验均取3个平行反应瓶的均值作为最终数据, 以3组平行数据的相对偏差作为分析误差.
采用X射线衍射光谱仪(X-ray powder diffraction, XRD, D8 ADVANCE, Bruker)测定矿物的晶型结构特征; 采用傅里叶红外光谱仪(FTIR, VERTEX 33, Bruker)检测矿物的官能团结构; 通过扫描电镜(Scanning electron microscope, SEM, Carl Zeiss Microscopy, Germany)观察矿物的形貌特征; 通过X射线光电子能谱(X-ray photoelectron spectroscopy, XPS, ULVAC-PHI, Japan)测定二次矿物表面Cr元素的形态和价态(Xie et al., 2017).
采用连续萃取法提取固相中各形态的Cr(Li et al., 2016; Xie et al., 2017).利用1 mol·L-1的MgCl2溶液萃取矿物中可交换态的Cr(F1), 萃取时间为1 h; 利用0.1 mol·L-1的HCl萃取矿物表面吸附态Cr(F2), 萃取时间为0.5 h; 利用0.2 mol·L-1的草酸铵(pH=3.0)萃取不定型铁结合态Cr(F3), 萃取时间为4 h; 通过HNO3/HCl/HClO4完全消解矿物提取残渣态的Cr(F4).测得Cr的回收率为83.55%~106.10%.
3 结果与讨论(Results and discussion) 3.1 合成矿物的特征实验中合成了纯的黄钾铁矾和两种不同Cr负载量的黄钾铁矾, 合成后的3种矿物均为赭黄色粉末状, Cr负载没有明显改变矿物的颜色.将合成后的矿物分别过200目筛后, 通过XRD检测合成矿物的晶型结构, 并与标准矿物的PDF卡片(PDF#22-0827)对比, 结果表明, 本实验中合成的3种矿物均为黄钾铁矾类矿物(图 1).在XRD图谱中, 纯的黄钾铁矾在2θ=14.9°、15.5°、17.4°、24.3°、28.6°、29.0°、30.1°、31.5°、35.3°、39.7°、45.8°和49.8°的位置表现出了12个较强的特征衍射峰, 这些特征衍射峰分别对应黄钾铁矾的{101}、{003}、{012}、{110}、{021}、{113}、{202}、{006}、{024}、{107}、{303}和{220}晶面(Baron et al., 1996; Smith et al., 2006).Cr负载没有明显改变黄钾铁矾的晶型结构, 与纯的黄钾铁矾相比, 负载Cr黄钾铁矾的XRD图谱中没有增加任何新的衍射峰, 两种不同Cr负载量的黄钾铁矾均呈现出黄钾铁矾的特征衍射峰.
 |
| 图 1 纯黄钾铁矾和负载Cr黄钾铁矾的XRD图谱 Fig. 1 XRD patterns of synthetic pure jarosite and Cr-bearing jarosite |
分别称取0.1 g矿物, 完全消解后定容, 测定3种合成矿物中的Cr含量, 结果表明, 在0Cr-J、1.0Cr-J和10.0Cr-J中Cr含量分别为0、0.06%和0.48%(表 1).通过BET测定合成矿物的比表面积, 结果表明, 0Cr-J、1.0Cr-J和10.0Cr-J的比表面积分别为2.1、2.8和4.4 m2·g-1.
| 表 1 合成矿物的组成成分和比表面积 Table 1 The composition and specific surface area of synthetic minerals |
在本实验的培养基体系中没有投加特定的pH缓冲溶剂(如MOPS、PIPES等), 因此, 溶液pH是反映微生物还原溶解黄钾铁矾过程的重要参数.在有菌实验组中, 溶液的pH均表现为先下降后上升的变化趋势(图 2a).反应初期, pH下降可能是由于黄钾铁矾矿物发生溶解所致.黄钾铁矾的溶解过程是一个释放H+的反应过程, 会降低周围溶液中的pH(Smith et al., 2006); 另外, 实验所用的黄钾铁矾矿物是在酸性环境中合成, 矿物合成后, 虽然利用去离子水洗涤了3~5次, 加入培养基后, 仍有可能向周围溶液中释放一定的酸度(宋永伟等, 2016; Gao et al., 2019); 在反应的第20 d, 各有菌实验组中的pH均开始升高, 反应结束时, 0Cr-J、1.0Cr-J和10.0Cr-J实验组的pH分别升高至5.78、6.15和6.09.反应后期溶液pH升高可能是由于微生物活性增强.研究表明, 微生物的生长过程是一个产生碱度的反应过程, 能够增大反应溶液的pH(Karnachuk et al., 2002; Senko et al., 2009; Xia et al., 2019).在各无菌对照组中, 溶液的pH均呈略微下降的趋势.
 |
| 图 2 各实验组溶液中pH(a)、乳酸盐(b)、醋酸盐(c)、溶解态Fe2+(d)、SO42-(e)、K+(f)的变化曲线 Fig. 2 Variations of pH(a), lactate(b), acetate(c), aqueous Fe2+(d), SO42-(e) and K+(f) under different conditions |
S. oneidensis MR-1菌是典型的铁还原菌, 其能够利用乳酸盐作为电子供体, 还原环境中的Fe(Ⅲ), 并同时将乳酸盐不完全氧化为醋酸盐(Ouyang et al., 2014).S. oneidensis MR-1菌利用乳酸盐作为电子供体还原Fe(Ⅲ)的反应过程可用式(1)表示(Zachara et al., 2002; Burton et al., 2019).在本实验中, 由于S. oneidensis MR-1的氧化利用, 有菌组溶液中乳酸盐浓度不断降低(图 2b); 相应的, 醋酸盐的浓度不断增大(图 2c).在有菌实验组中, 各实验组中乳酸钠浓度减小的速率和醋酸盐增加的速率均为表现出明显差异, 这表明Cr负载没有对有菌组中的微生物活性造成明显影响.在无菌对照组中, 乳酸盐和醋酸盐的浓度均未出现明显变化.

|
(1) |
研究表明, S. oneidensis MR-1能够通过多种电子传递路径如直接接触、纳米导线、分泌电子穿梭体和螯合促溶等与矿物中的Fe(Ⅲ)进行电子交换, 将矿物中的Fe(Ⅲ)还原为Fe(Ⅱ)(Shi et al., 2016; 吴云当等, 2016).在本实验各有菌组中, 由于S. oneidensis MR-1的作用, 矿物发生了明显的还原溶解, 溶液中的Fe2+、SO42-和K+浓度均有明显升高(图 2d~2f).在反应结束时(50 d), 0Cr-J、1.0Cr-J和10.0Cr-J实验组的溶解性Fe2+浓度分别升高至1.78、1.70和1.54 mmol·L-1(图 2d), SO42-浓度分别增大至6.29、5.65和5.03 mmol·L-1 (图 2e), K+浓度分别增大至5.64、5.34和5.19 mmol·L-1(图 2f).溶液中K+浓度的增长速率能够反映黄钾铁矾矿物的溶解速率(Ouyang et al., 2014; Gao et al., 2020).根据实验过程中溶解态K+浓度的增大量, 计算各有菌组矿物中K+的释放速率, 结果表明, 在0Cr-J、1.0Cr-J和10.0Cr-J实验组中, K+的平均释放速率分别为(112.8±0.8)、(106.8±2.8)和(103.8±2.8) μmol·L-1·d-1, 有菌组中矿物的溶解速率大小顺序为0Cr-J > 1.0Cr-J > 10.0Cr-J.Cr负载能够降低矿物的溶解速率, 增强黄钾铁矾矿物的稳定性.
在各反应的无菌对照组, 溶液中的Fe2+、SO42-和K+浓度均未出现明显变化, 这表明在不添加微生物时, 矿物能够保持相对稳定; 有菌组中矿物的还原溶解主要是由于S. oneidensis MR-1的活动引起的.已有的研究表明, 黄钾铁矾的稳定性与周围溶液的pH密切相关, 在接近中性条件下, 黄钾铁矾能够发生明显溶解, 增大溶液中的K+和SO42-浓度(Smith et al., 2006; Madden et al., 2012).而在本实验的无菌对照组中, 黄钾铁矾始终保持相对稳定, 没有明显释放K+和SO42-, 这一结果可能与培养基中添加了KH2PO4有关.KH2PO4能够为微生物生长提供磷源, 然而, PO43-也能与黄钾铁矾表面发生络合反应, 增强铁矿物的稳定性(Schoepfer et al., 2019; Gao et al., 2020).
3.3 矿物相转变特征 3.3.1 矿物晶型结构变化特征实验过程中, 通过XRD检测分析了各有菌实验组中矿物的晶型结构演替特征, 结果如图 3所示.在S. oneidensis MR-1的作用下, 各有菌实验组中的黄钾铁矾矿物均发生了明显的相转变.在0Cr-J实验组, 黄钾铁矾矿物中没有添加Cr, 在反应的第20 d, 黄钾铁矾开始相转变为蓝铁矿(Fe3(PO4)2·8H2O)(图 3a), 蓝铁矿的形成与培养基中添加的PO43-有关, S. oneidensis MR-1还原黄钾铁矾产生的Fe2+能够与PO43-结合沉淀, 并形成蓝铁矿(式(2))(Rothe et al., 2016); 在反应的第50 d, 除蓝铁矿外, 黄钾铁矾相转变的二次矿物中还含有一定量的针铁矿(α-FeOOH).

|
(2) |
 |
| 图 3 0Cr-J(a)、1.0Cr-J(b)和10.0Cr-J(c)实验组原始矿物和二次矿物的XRD图谱 Fig. 3 XRD patterns of the jarosite minerals and precipitations of 0Cr-J(a), 1.0Cr-J(b) and 10.0Cr-J treatments(c) |
在1.0Cr-J实验组, 黄钾铁矾中含有少量的Cr, 在反应的第20 d, 二次矿物中同样检测到了蓝铁矿的形成; 与0Cr-J实验组相比, 1.0Cr-J实验组中的矿物相对较稳定, 反应至50 d时, 1.0Cr-J实验组中的二次矿物仍然只是蓝铁矿(图 3b).在10.0Cr-J实验组, 黄钾铁矾中Cr含量最高, 矿物最稳定, 在反应的前20 d, 矿物没有发生明显的相转变; 直到第50 d时, 才检测到蓝铁矿的形成(图 3c).
XRD检测结果表明, Cr负载能够明显抑制黄钾铁矾的相转变过程, 增强黄钾铁矾的生物稳定性.结合已有的文献推测, 这可能是由于负载Cr的黄钾铁矾结构中Fe—O—CrO2—O—Fe的键能较强, 与Fe—O—SO2—O—Fe相比, 破坏Fe—O—CrO2—O—Fe需要的能量相对较高(Regenspurg et al., 2005).此外, 负载的Cr有可能占据黄钾铁矾的活性位点, 阻挡S. oneidensis MR-1和Fe2+等对黄钾铁矾的攻击, 降低黄钾铁矾的溶解速率.
3.3.2 矿物的官能团结构检测实验过程中, 采用FTIR检测分析了黄钾铁矾类矿物和有菌实验组中二次矿物的官能团结构组成, 结果如图 4所示.在0Cr-J的FTIR图谱中(图 4a), 位于~1636 cm-1处的伸缩振动特征峰是H—O—H; 1187 cm-1和1087 cm-1处对应的是SO42-分子内三重简并反对称伸缩振动宽峰v3(SO4); 668 cm-1和628 cm-1处对应的是SO42-分子内三重简并面外弯曲振动的特征峰v4(SO4); 575、513和477 cm-1处特征峰对应的是FeO6八面体结构(Paikaray et al., 2010; Forray et al., 2014); 在1.0Cr-J和10.0Cr-J中负载Cr, 因此, 在1.0Cr-J和10.0Cr-J的FTIR图谱中, 除检测到SO42-和FeO6等官能团外, 在~877 cm-1处也检测到了CrO4(Fan et al., 2019).
 |
| 图 4 黄钾铁矾类矿物(a)和有菌实验组中二次矿物(b)的FTIR图谱 Fig. 4 FTIR spectra of the synthetic jaroiste(a) and the secondary minerals in the biotic treatments(b) |
XRD检测结果表明, 反应结束时, 各有菌实验组的二次矿物中仍然含有较多的黄钾铁矾特征峰.FTIR检测结果表明, 反应后的矿物中仍含有v3(SO4)、v4(SO4)和FeO6官能团结构(图 4b), 这一结果与XRD检测结果一致, 即矿物相转变的产物仍存在大量的黄钾铁矾.另外, 反应结束时, 在各有菌组中~800 cm-1处均出现了Fe—O—H的特征峰, 这表明均有针铁矿形成(Smith et al., 2006; 唐苑君等, 2020).但XRD分析未在1.0Cr-J和10.0Cr-J实验组中检测到针铁矿, 这可能是由于1.0Cr-J和10.0Cr-J实验组中产生的针铁矿的量较小, 低于XRD的检测限所致.
3.3.3 矿物形貌变化特征通过SEM观测黄钾铁矾和二次矿物的形貌特征, 结果如图 5所示.通过水热法合成的纯黄钾铁矾和负载Cr黄钾铁矾均为球状聚集型(图 5a~5c).其中, 0Cr-J的单个晶体大小为1.0~1.5 μm(图 5a); 1.0Cr-J的单个晶体大小约为1 μm(图 5b); 而10.0Cr-J的单个晶体大小为0.5~1.0 μm (图 5c).随着Cr负载量的增大, 矿物的晶体逐渐变小, 推测这可能是由于CrO42-能够作为黄钾铁矾的生长点, 竞争吸附K+和Fe3+, 抑制黄钾铁矾晶胞的生长.
S. oneidensis MR-1菌能够通过直接接触等电子传递途径还原黄钾铁矾矿物中的Fe(Ⅲ)(Ouyang et al., 2014; Shi et al., 2016).在反应的第3 d, 各有菌组的矿物表面上均能够观察到杆状的S. oneidensis MR-1 (图 5d~5f).S. oneidensis MR-1的还原溶解作用能够明显改变铁矿物的形貌特征(Ouyang et al., 2014; Wan et al., 2018).在反应结束时, 各有菌组矿物中均检测到块状晶体的形成(图 5g~5i).根据形貌特征推测, 这些块状晶体主要为蓝铁矿(Rothe et al., 2016; Gao et al., 2019).另外, 各有菌实验组中, 也均能观察到残存的球形黄钾铁矾, 其中, 0Cr-J实验组中球形矿物表面有较多的腐蚀坑(图 5g); 而1.0Cr-J和10.0Cr-J实验组残存的球形矿物表面上, 腐蚀坑的数量相对较少(图 5h~5i).
 |
| 图 5 实验过程中各反应组中矿物的SEM图 Fig. 5 SEM of samples: different morphologies can be observed after different reaction time |
另外, 在各无菌对照组中, 矿物表面腐蚀坑的数量也呈现出类似的规律(图 5j~5l).其中, 在0Cr-J无菌实验组中, 矿物表面出现了较多的腐蚀坑(5j); 而1.0Cr-J无菌实验组的矿物表面上出现的腐蚀坑数量相对较少(图 5k); 10.0Cr-J无菌实验组的矿物表面则没有出现明显的腐蚀坑(图 5l).这些结果进一步表明Cr负载能够增强黄钾铁矾矿物的稳定性, 并且Cr负载量越大, 黄钾铁矾矿物的稳定性越强.
3.4 Cr的迁移再分配规律 3.4.1 矿物表面Cr的价态变化特征在合成负载Cr黄钾铁矾过程中添加的Cr为K2CrO4, 是Cr(Ⅵ), 因此, 在有菌组中形成的Cr(Ⅲ)均是由S. oneidensis MR-1菌直接或间接还原产生.本研究通过XPS检测二次矿物表面Cr元素的形态和价态特征.电子结合能在570~595 eV的峰位置对应Cr的Cr 2p能谱(Xie et al., 2017).研究表明, 在电子结合能579.4、588.2和589.0 eV附近对应的峰位为Cr(Ⅵ), 而电子结合能576.6、577.9和586.6 eV附近对应的峰位为Cr(Ⅲ) (Xie et al., 2017; Fan et al., 2019).XPS检测结果表明, 在反应结束时, 在1.0Cr-J(图 6a)和10.0Cr-J(图 6b)实验组的矿物表面均检测出Cr(Ⅲ)的特征峰.这一结果表明, S. oneidensis MR-1菌在还原溶解负载Cr黄钾铁矾的过程中, 能够将矿物表面的Cr(Ⅵ)还原为Cr(Ⅲ).已有研究表明, S. oneidensis MR-1菌能够直接利用Cr(Ⅵ)作为电子受体进行厌氧呼吸, 将环境中的Cr(Ⅵ)还原为Cr(Ⅲ)(Hossain et al., 2005; Yan et al., 2013); 另外, S. oneidensis MR-1菌还原Fe(Ⅲ)产生的Fe(Ⅱ), 也能够将Cr(Ⅵ)还原为Cr(Ⅲ)(Xu et al., 2015).由于Cr(Ⅵ)的毒性远大于Cr(Ⅲ), 因此, 在S. oneidensis MR-1菌还原负载Cr黄钾铁矾过程中将Cr(Ⅵ)还原为Cr(Ⅲ), 能够降低Cr对环境的危害(李君菲等, 2018).
 |
| 图 6 反应结束时二次矿物的XPS谱图(a.1.0Cr-J的Cr 2p; b.10.0Cr-J的Cr 2p) Fig. 6 XPS spectra of the secondary minerals at the end of the experiment(a.Cr 2p for 1.0Cr-J; b.Cr 2p for 10.0Cr-J) |
图 7所示为1.0Cr-J和10.0Cr-J实验组溶液中Cr浓度和矿物中不同形态Cr的变化情况.由于溶液中的Cr含量相对较低, 为便于观察分析实验过程中溶解态Cr浓度的变化趋势, 在图中单独设置了“溶液中Cr浓度”的纵坐标.
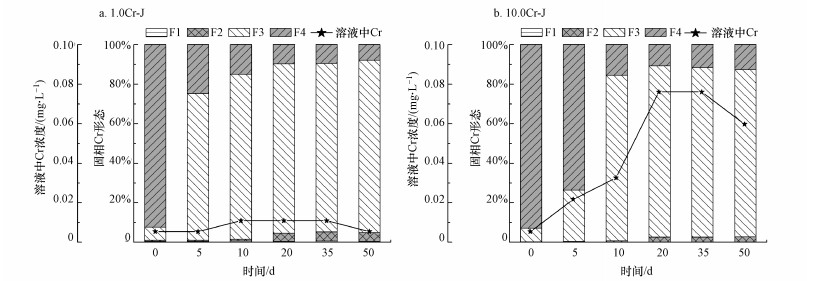 |
| 图 7 溶解态Cr浓度和矿物中各形态Cr所占比例的变化情况(a.1.0 Cr-J; b.10.0 Cr-J; F1:可交换态Cr; F2:矿物表面吸附态Cr; F3:不定型铁结合态Cr; F4:残渣态Cr) Fig. 7 Aqueous Cr and percentage variation of different Cr species as a function of reaction time(a.1.0 Cr-J; b.10.0 Cr-J; F1:exchangeable phase; F2: iron oxide surface-bound phase; F3: amorphous iron oxide-bound phase; F4: crystalline iron oxide-bound phase) |
1.0Cr-J(图 7a)和10.0Cr-J(图 7b)实验组中的溶解态Cr浓度均呈现先上升后下降的变化趋势.反应前期, 溶液中Cr浓度升高是由于黄钾铁矾在S. oneidensis MR-1菌的作用下发生了还原性溶解; 反应后期, 溶液中Cr浓度下降可能是由于溶液中的Cr被重新吸附固定于二次矿物中.由于10.0Cr-J实验组中黄钾铁矾矿物的Cr含量相对较高, 实验过程中, 10.0Cr-J实验组中的溶解态Cr浓度增加量也相对较大.
如图 7a和7b所示, 反应开始时(0 d), 黄钾铁矾中的Cr主要以残渣态形态(F4)存在, Cr在固相中比较稳定; 随着反应的进行, 残渣态的Cr(F4)所占比例逐渐降低, 不定型铁结合态的Cr(F3)所占比例不断升高.这一结果表明, S. oneidensis MR-1菌还原溶解负载Cr黄钾铁矾会导致固相中Cr的迁移性增强, Cr释放的风险增大.
4 结论(Conclusions)Cr负载会减小黄钾铁矾的晶体尺寸, 增强矿物的稳定性, 但对黄钾铁矾的晶型结构没有明显影响.S. oneidensis MR-1菌还原溶解负载Cr黄钾铁矾过程中, 矿物中部分的Cr(Ⅵ)被还原为Cr(Ⅲ), Cr的环境毒性降低.此外, S. oneidensis MR-1菌还原溶解负载Cr黄钾铁矾过程中, 矿物中残渣态Cr逐渐转变为不定型铁结合态Cr, 固相中Cr的释放风险增大.在本研究中, 虽然检测到矿物中的Cr(Ⅵ)被还原为Cr(Ⅲ), 但是, 研究结果未能辨别出Cr(Ⅵ)是直接被微生物还原, 还是被产生的Fe(Ⅱ)还原.因此, S. oneidensis MR-1菌还原溶解负载Cr黄钾铁矾过程中, Cr(Ⅵ)和Fe(Ⅲ)还原的优先顺序, 以及Cr(Ⅵ)还原的电子传递路径还有待进一步研究.
Baron D, Palmer C D. 1996. Solubility of jarosite at 4~35℃[J]. Geochimica Et Cosmochimica Acta, 60(2): 185-195. DOI:10.1016/0016-7037(95)00392-4 |
Baron D, Palmer C D. 2002. Solid-solution aqueous-solution reactions between jarosite (KFe3(SO4)2(OH)6) and its chromate analog[J]. Geochimica Et Cosmochimica Acta, 66(16): 2841-2853. DOI:10.1016/S0016-7037(02)00880-3 |
Baron D, Palmer C D, Stanley J T. 1996. Identification of two iron-chromate precipitates in a Cr(Ⅵ)-Contaminated Soil[J]. Environmental Science & Technology, 30(3): 964-968. |
包艳萍. 2018. AMD污染河流铁硫循环微生物多样性及其对铁硫酸盐次生矿物相转变的影响[D]. 广州: 华南理工大学
|
Burton E D, Hockmann K, Karimian N, et al. 2019. Antimony mobility in reducing environments: The effect of microbial iron(Ⅲ)-reduction and associated secondary mineralization[J]. Geochimica et Cosmochimica Acta, 45: 278-289. |
曹丽娜, 陈炳辉, 苟习颖, 等. 2019. 不同条件下形成的黄钾铁矾微形貌对比研究[J]. 高校地质学报, 25(3): 333-340. |
Fan C, Guo C, Zeng Y, et al. 2019. The behavior of chromium and arsenic associated with redox transformation of schwertmannite in AMD environment[J]. Chemosphere, 222: 945-953. DOI:10.1016/j.chemosphere.2019.01.142 |
Forray F L, Smith A M L, Navrotsky A, et al. 2014. Synthesis, characterization and thermochemistry of synthetic Pb-As, Pb-Cu and Pb-Zn jarosites[J]. Geochimica et Cosmochimica Acta, 127: 107-119. DOI:10.1016/j.gca.2013.10.043 |
Galán E, Gómez-Ariza J L, González I, et al. 2003. Heavy metal partitioning in river sediments severely polluted by acid mine drainage in the Iberian Pyrite Belt[J]. Applied Geochemistry, 18(3): 409-421. DOI:10.1016/S0883-2927(02)00092-6 |
Gao K, Hu Y, Guo C, et al. 2020. Effects of adsorbed phosphate on jarosite reduction by a sulfate reducing bacterium and associated mineralogical transformation[J]. Ecotoxicology and Environmental Safety, 202: 110921. DOI:10.1016/j.ecoenv.2020.110921 |
Gao K, Jiang M, Guo C, et al. 2019. Reductive dissolution of jarosite by a sulfate reducing bacterial community: Secondary mineralization and microflora development[J]. Science of the Total Environment, 690(10): 1100-1109. |
Hossain M A, Alam M, Yonge D, et al. 2005. Finite element modeling of Cr(Ⅵ) reduction by Shewanella oneidensis MR-1 employing the dual-enzyme kinetic model[J]. Computers & Geoences, 31(10): 1286-1292. |
Karnachuk O, Kurochkina S, Tuovinen O. 2002. Growth of sulfate-reducing bacteria with solid-phase electron acceptors[J]. Applied Microbiology & Biotechnology, 58(4): 482-486. |
Lengauer C L, Giester G, Irran E. 1994. KCr3(SO4)2(OH)6: synthesis, characterization, powder diffraction data, and structure refinement by the Rietveld technique and a compilation of alunite-type compounds[J]. Powder Diffr, 9(4): 265-271. DOI:10.1017/S0885715600018984 |
Li C, Yi X, Dang Z, et al. 2016. Fate of Fe and Cd upon microbial reduction of Cd-loaded polyferric flocs by Shewanella oneidensis MR-1[J]. Chemosphere, 144(1): 2065-2072. |
李君菲, 谢莹莹, 党志, 等. 2018. 酸性矿山废水中铜在含铬施氏矿物上的吸附及其对矿物溶解与相转变的影响[J]. 环境科学学报, 38(8): 3138-3145. |
刘奋武, 王敏, 卜玉山, 等. 2013. 酸性硫酸盐环境中菌密度对生物成因次生铁矿物形成的影响[J]. 环境科学学报, 33(11): 3025-3031. |
Luo C, Routh J, Dario M, et al. 2020. Distribution and mobilization of heavy metals at an acid mine drainage affected region in South China, a post-remediation study[J]. Science of the Total Environment, 724: 138122. DOI:10.1016/j.scitotenv.2020.138122 |
Madden M E E, Madden A S, Rimstidt J D, et al. 2012. Jarosite dissolution rates and nanoscale mineralogy[J]. Geochimica Et Cosmochimica Acta, 91: 306-321. DOI:10.1016/j.gca.2012.05.001 |
Myers C R, Nealson K H. 1988. Microbial reduction of manganese oxides: Interactions with iron and sulfur[J]. Geochimica Et Cosmochimica Acta, 52(11): 2727-2732. DOI:10.1016/0016-7037(88)90041-5 |
Ouyang B, Lu X, Liu H, et al. 2014. Reduction of jarosite by Shewanella oneidensis MR-1 and secondary mineralization[J]. Geochimica Et Cosmochimica Acta, 124: 54-71. DOI:10.1016/j.gca.2013.09.020 |
Paikaray S, Peiffer S. 2010. Dissolution kinetics of sulfate from schwertmannite under variable pH conditions[J]. Mine Water and the Environment, 29(4): 263-269. DOI:10.1007/s10230-010-0118-0 |
Regenspurg S, Peiffer S. 2005. Arsenate and chromate incorporation in schwertmannite[J]. Applied Geochemistry, 20(6): 1226-1239. DOI:10.1016/j.apgeochem.2004.12.002 |
Rothe M, Kleeberg A, Hupfer M, et al. 2016. The occurrence, identification and environmental relevance of vivianite in waterlogged soils and aquatic sediments[J]. Earth Science Reviews, 158: 51-64. DOI:10.1016/j.earscirev.2016.04.008 |
Schoepfer V A, Burton E D, Johnston S G, et al. 2019. Phosphate loading alters schwertmannite transformation rates and pathways during microbial reduction[J]. Science of the Total Environment, 657: 770-780. DOI:10.1016/j.scitotenv.2018.12.082 |
Senko J M, Zhang G, Mcdonough J T, et al. 2009. Metal reduction at low pH by a desulfosporosinus species: Implications for the biological treatment of acidic mine drainage[J]. Geomicrobiology Journal, 26(2): 71-82. DOI:10.1080/01490450802660193 |
Shi L, Dong H, Reguera G, et al. 2016. Extracellular electron transfer mechanisms between microorganisms and minerals[J]. Nature Reviews Microbiology, 14(10): 651-662. DOI:10.1038/nrmicro.2016.93 |
Smith A M L, Hudson-Edwards K A, Dubbin W E, et al. 2006. Dissolution of jarosite[KFe3(SO4)2(OH)6] at pH 2 and 8:Insights from batch experiments and computational modelling[J]. Geochimica Et Cosmochimica Acta, 70(3): 608-621. DOI:10.1016/j.gca.2005.09.024 |
宋永伟, 王鹤茹, 梁剑茹, 等. 2016. 温度和pH对生物成因羟基硫酸铁矿物的综合影响研究[J]. 环境科学学报, 36(10): 3683-3690. |
唐苑君, 谢莹莹, 叶翰, 等. 2020. 草酸盐介导下含As(Ⅴ)黄钾铁矾的相转化过程与As(Ⅴ)的再分配行为[J]. 环境科学学报, 40(7): 2458-2467. |
Wan J, Guo C, Tu Z, et al. 2018. Microbial reduction of Cr (Ⅵ)-loaded schwertmannite by Shewanella oneidensis MR-1[J]. Geomicrobiology Journal, 35(9): 727-734. DOI:10.1080/01490451.2018.1455767 |
王红梅, 刘烁, 刘邓. 2015. 硫酸盐还原菌及异化铁还原菌对黄钾铁矾还原作用的对比[J]. 地球科学-中国地质大学学报, 40(2): 305-316. |
吴云当, 李芳柏, 刘同旭. 2016. 土壤微生物-腐殖质-矿物间的胞外电子传递机制研究进展[J]. 土壤学报, 53(2): 277-291. |
Xia D, Yi X, Lu Y, et al. 2019. Dissimilatory iron and sulfate reduction by native microbial communities using lactate and citrate as carbon sources and electron donors[J]. Ecotoxicology and Environmental Safety, 174: 524-531. DOI:10.1016/j.ecoenv.2019.03.005 |
Xie Y, Lu G, Ye H, et al. 2017. Fulvic acid induced the liberation of chromium from CrO42--substituted schwertmannite[J]. Chemical Geology, 475: 52-61. DOI:10.1016/j.chemgeo.2017.10.031 |
谢莹莹. 2018. 溶解性有机质介导下酸性矿山废水中施氏矿物的转化机制及对重金属环境行为的影响[D]. 广州: 华南理工大学
|
Xu S C, Pan S S, Xu Y, et al. 2015. Efficient removal of Cr(Ⅵ) from wastewater under sunlight by Fe(Ⅱ)-doped TiO2 spherical shell[J]. Journal of Hazardous Materials, 283: 7-13. DOI:10.1016/j.jhazmat.2014.08.071 |
Yan F F, Wu C, Cheng Y Y, et al. 2013. Carbon nanotubes promote Cr(Ⅵ) reduction by alginate-immobilized Shewanella oneidensis MR-1[J]. Biochemical Engineering Journal, 77: 183-189. DOI:10.1016/j.bej.2013.06.009 |
Zachara J M, Kukkadapu R K, Gorby Y A, et al. 2002. Biomineralization of poorly crystalline Fe(Ⅲ) oxides by dissimilatory metal reducing bacteria[J]. Geomicrobiology Journal, 19: 179-207. DOI:10.1080/01490450252864271 |
 2021, Vol. 41
2021, Vol. 41


