多溴联苯醚(PBDEs)是一类广泛应用于纺织、电气设备、建筑和塑料材料等领域的良好阻燃剂(La Guardia et al., 2006).由于其与产品基质主要通过物理结合而非化学结合, 因此, PBDEs很容易进入各种环境介质中(Yin et al., 2020).在水生态系统中, 沉积物中PBDEs的浓度远高于水相, 因此, 沉积物中高浓度的PBDEs是水生态系统的重要风险源(陈社军等, 2005; Luo et al., 2007; Yang et al., 2009; Moon et al., 2012; Sun et al., 2013).在PBDE同系物中, 2, 2′, 4, 4′-四溴联苯醚(BDE-47)占有较高的比例, 由于其高脂溶性和高毒性, 可在水生食物链中富集、转移并对水生生物的健康构成很大的威胁, 因此, 沉积物中BDE-47的污染及其潜在生态风险持续受到人们的关注(de Wit, 2002; 刘佳等, 2012; Wang et al., 2015; 龚双姣等, 2015; Yin et al., 2020).
采用低能耗、高效率和对环境干扰小的修复技术对污染沉积物进行原位修复是保护水生态系统健康的重要手段.通常, 对污染沉积物修复的主要目标是最大程度地降低污染物的生物有效性和生态毒性.生物炭是一种重要的新型碳材料, 目前被认为是一种重要的绿色环境吸附剂, 在环境修复中发挥重要的作用(Ahmad et al., 2014), 将生物炭应用于污染沉积物的原位修复具有很大的潜力(Rakowska et al., 2012; Sun et al., 2012; Jia et al., 2014).目前关于生物炭对水土环境污染修复的研究主要关注生物炭对污染物生物有效性的控制效果(Cao et al., 2009; Wang et al., 2013).但就污染沉积物而言, 沉积物取食性底栖动物是沉积物生态风险的关键指示生物, 因为它们不仅从间隙水中摄取污染物, 还从沉积物中摄取污染物(McLeod et al., 2008; Sun et al., 2009; Janssen et al., 2010; Diepens et al., 2015).因此, 在判断生物炭对污染沉积物的修复效力时仅依据污染物生物有效性的控制效果往往是不够的, 必须同时结合底栖动物对污染物的生物积累进行综合评判.沉积物取食性底栖动物从沉积物和间隙水中摄取污染物的通量的变化可以采用有底栖动物的特有生理参数和沉积物与间隙水的化学参数来进行预测(McLeod et al., 2008; Janssen et al., 2010).经过验证的污染物生物积累动力学预测模型可以作为污染沉积物生态风险评估的重要补充手段.目前关于沉积物中污染物生物积累动力学预测模型的研究, 前人主要采用淡水滤食性的河蚬(Corbicula fluminea)(McLeod et al., 2008)和海洋多毛类沙蚕(Neanthes arenaceodentata)(Janssen et al., 2010)等底栖动物, 而基于其它取食方式的淡水底栖动物的生物动力学模型研究则未见报道.铜锈环棱螺(Bellamya aeruginosa)是腹足纲田螺科的淡水软体动物, 为淡水生态系统中的关键类群, 其取食方式主要为刮食.该物种在我国淡水环境中广泛分布, 是一种典型的沉积物栖居型底栖动物, 被认为是评价淡水沉积物质量和环境吸附剂对污染物生物有效性及风险影响的最佳指示生物(Ma et al., 2010; 田斌等, 2018; 向静等, 2020).
本研究以铜锈环棱螺为测试生物, 考察铜锈环棱螺对沉积物颗粒的摄取速率、从水和沉积物中摄取BDE-47的效率, 以及在BDE-47污染沉积物中添加玉米秸秆生物炭后对这些生理学参数和间隙水中BDE-47平衡浓度的影响.构建基于铜锈环棱螺摄取和消除BDE-47的相关生理学参数和沉积物化学参数的生物动力学预测模型, 并评价该模型预测BDE-47生物积累的效力.以期为淡水沉积物生态毒性风险评价和利用生物炭进行污染沉积物原位修复效果评估提供重要的参考手段.
2 材料与方法(Materials and methods) 2.1 仪器与试剂主要仪器:真空气氛炉(GR.TF 80/11, 上海贵尔)、气相色谱-质谱联用仪(Shimadzu GCMS-QP2010plus)、7500a型电感耦合等离子体质谱仪(ICP-MS)(Agilent technologies, USA).
试剂:稳定同位素65Cu(99.4%)和106Cd(96.5%)购自美国剑桥同位素实验室; 2, 2′, 4, 4′-四溴联苯醚(BDE-47, 分子式C12H6Br4O, CAS# 5436-43-1, 纯度98.5%)、BDE-47标样(50 μg·mL-1)购自AccuStandard公司; 定量内标13C12-PCB138(40 μg·mL-1)购自美国剑桥同位素实验室; 正己烷、二氯甲烷、丙酮、甲醇为国产农药残留级; 正壬烷、异辛烷购自上海阿拉丁生化科技公司, 均为国产GCS级.
2.2 玉米秸秆生物炭的制备玉米秸秆生物炭(CSB)采用高纯氩气保护炭化法进行制备.先将玉米秸秆置于烘箱中烘干, 粉碎, 然后装填在管式真空气氛炉的石英炉管中.炭化前, 先对炉管抽真空, 然后通入高纯氩气, 重复3次后, 持续通入氩气, 待管内压力高于1.5个标准大气压后, 打开排气口, 控制出气量, 使管内压力在整个炭化过程中不低于1个标准大气压.根据预实验结果设定炭化温度为500 ℃, 炭化时间为8 h.将所制得的生物炭用去离子水反复淋洗至浸出水呈中性, 然后于85 ℃烘干至恒重, 取出研磨, 过150 μm尼龙筛, 保存备用.经分析, 在CSB样品中未检测到BDE-47.
2.3 沉积物的收集与表征实验所用沉积物为采自湖南吉首市德夯自然保护区内无污染的自然沉积物(Ma et al., 2010).用塑料铲采集表层沉积物样品(0~10 cm厚度), 然后用孔径0.15 mm的尼龙筛现场过筛, 去除杂物和粗颗粒, 静置, 倒掉上覆水, 并将所采集的多个沉积物样品充分混合均匀, 装入聚乙烯塑料袋中, 于4 ℃储存备用.分析表明, 该沉积物由淤泥和粘土组成, 分别占33.64%和66.36%, 总有机碳(TOC)为4.48%, pH为7.78, 总氮(TN)为1064 mg·kg-1, 总磷(TP)为1215 mg·kg-1.沉积物中BDE-47的背景值为(0.81 ± 0.06) ng·g-1.
2.4 测试生物采用实验室人工培养的铜锈环棱螺作为测试生物(Ma et al., 2010), 选取个体大小一致的健康成体(壳长为(18.62±1.24) mm, 体重为(1.66±0.16) g)用于沉积物暴露测试.
2.5 铜锈环棱螺对沉积物的摄食率测定采用稳定同位素标记的周从生物膜对铜锈环棱螺的摄食实验测定摄食率.周从生物膜的培养参考Liu等(2018)的方法并进行修改:从吉首市德夯风景区无污染溪流的岩石上收集天然周从生物膜, 作为在实验室培养周从生物膜的初始接种体.批量采集取样点的水样作为周从生物膜培养用水, 并测定水质参数(pH、总氮、总磷等).模拟自然溪流的理化条件, 在温室里建立人工溪流(4 m×0.3 m×0.3 m), 流速控制在0.12 m·s-1, 循环流动, 在底部放置若干规格为5 cm×5 cm×1 mm的玻璃片作为周从生物膜生长的基质, 接种天然周从生物膜.每周进行理化和生物学测定, 并适量补充WC培养基(Liu et al., 2018), 以维持正常的营养水平.至少培养2个月以上, 以获得稠密而成熟的周从生物膜(厚度约5 mm).按照Janssen等(2010)的方法将周从生物膜(连同玻璃片)于65Cu(99.4%)和106Cd(96.5%)溶液中暴露24 h以富集稳定同位素.用去离子水将富集稳定同位素的周从生物膜充分洗净, 沥干水, 取部分样品, 在50 ℃下干燥24 h, 测定同位素含量, 其它生物膜全部用作螺的食物.挑选10只健康的成年螺, 先放置到去离子水中充分清肠直到肉眼看不见排出的粪便, 然后将螺放入含有生物膜(5片, 保证足量)的玻璃缸中, 摄食5 h后, 将螺取出并用去离子水充分清洗, 然后将每只螺单独放入预先准备的含有去离子水的1 L烧杯中清肠24 h, 烧杯上覆盖尼龙网防逃.清肠结束后, 将烧杯中的水全部过滤以收集每只螺排出的粪便, 在50 ℃下干燥24 h.将螺逐一解剖, 取出内脏团, 在50 ℃下干燥3 d.采用ICP-MS测定上述干燥的周从生物膜、粪便和内脏团样品中的稳定同位素含量, 然后计算稳定同位素的累积量.由于周从生物膜代表了全部的有机质, 因此, 周从生物膜的摄食率就相当于有机质摄食率.利用沉积物中有机质的百分含量对周从生物膜的摄食率进行归一化来估算铜锈环棱螺对沉积物的摄食率.
2.6 BDE-47的水暴露实验采用接近沉积物间隙水中BDE-47的浓度(320 ng·L-1)进行水暴露实验以考察铜锈环棱螺对水中BDE-47的摄取效率.选取个体大小一致的健康成年螺30只, 放入体积为10 L的BDE-47水溶液中, 连续暴露12 h, 期间不喂食, 每隔2 h取5只螺, 测定内脏团中BDE-47的含量.
2.7 BDE-47加标沉积物的生物积累实验根据我国水体沉积物中BDE-47的环境相关水平设定BDE-47的加标浓度为500 ng·g-1干重(陈社军等, 2005).根据向静等(2020)的研究将CSB添加水平设定为4%.实验包括BDE-47单独处理组和BDE-47与CSB复合处理组, 每个处理组设3个重复.先添加BDE-47, 再添加CSB.具体的加标方法如下:为每个处理组称取500 g干沉积物, 加到4 L玻璃测试缸中, 按沉积物与去离子水为1∶1的体积比加入去离子水, 搅拌后得到湿沉积物, 在室温下稳定24 h.用DMSO配制浓度为5 mg·mL-1的BDE-47储备液, 然后将所需用量的BDE-47逐滴加入到沉积物中, 在室温下连续搅拌24 h, 然后平衡30 d(Simpson et al., 2004).对于BDE-47与CSB复合处理组, 添加所需数量的CSB, 均匀混合, 在室温下连续搅拌24 h.将所有测试缸在室温下再平衡30 d, 以确保沉积物和间隙水之间的化学平衡.在暴露实验前, 从每个测试缸中取50 mL沉积物, 在2500 r·min-1下离心10 min, 上清液过0.22 μm滤膜得到间隙水, 剩下的沉积物经冷冻干燥后研细, 然后过100目筛, 将所得间隙水和沉积物样品于4 ℃保存备测.
采用沉积物-底栖动物模拟体系测定铜锈环棱螺对沉积物和水中BDE-47的摄取随时间的变化.按沉积物与上覆水1∶4的体积比加入去离子水, 然后将所有测试缸置于一个水浴控温水槽中, 静置3 d.在每个测试缸中随机放入12只螺, 保持光照周期为12 h(白昼)∶12 h(黑暗), 水温为(24 ± 1) ℃, 充气增氧, 暴露28 d, 对每个测试缸加盖尼龙网, 中间留一个直径为5 cm的圆孔, 方便喂食.按每只螺每天16 mg的量投喂食料(Ma et al., 2010).每周更换1/3的上覆水, 由于BDE-47的疏水性, 因此, 换水对系统中BDE-47的稀释作用可以忽略不计.在整个暴露期间, 每个测试缸中实验螺的存在率都在90%以上, 符合沉积物生物测试标准要求.在暴露7、14、21和28 d时对实验螺取样.在每个取样时间点从每个处理中取3只实验螺, 用去离子水清洗螺的表面以去除沉积物颗粒, 放入装有去离子水的洁净玻璃缸中清肠24 h(以消除肠道中存留的BDE-47对BDE-47生物积累的影响), 然后分离出全部的内脏团, 冷冻干燥后, 研碎, 保存于-20℃冰箱中, 用于BDE-47的分析.
2.8 BDE-47分析按照刘佳等(2012)的方法对冷冻保存的内脏团样品、间隙水样和沉积物样品进行前处理.以PCB-209作为回收率指示物标样, 以13C12-PCB138作为定量内标.在Shimadzu GC/MS-QP2010 plus上采用程序升温的方法进行测定.色谱柱升温程序为:初始温度110 ℃保持1 min, 以8 ℃·min-1升温至180 ℃保持1 min, 以2 ℃·min-1升温至240 ℃保持5 min, 以2 ℃·min-1升温到280 ℃保持6 min.质谱条件:采用EI离子源进行电离, 离子源温度为230 ℃, 电子能量70 eV, 灯丝电流0.7 mV, 离子扫描模式为SIM模式, 接口温度为300 ℃.全过程采用方法空白、加标空白、基质加标和基质加标平行样进行质量控制.样品中PCB-209的加标回收率为71%~96%, 在允许的分析范围(60%~120%)内, 符合分析要求.仪器对BDE-47的检测限为1.03 ng·mL-1. 采用内标法和校正因子对BDE-47进行定量分析计算.
3 结果与讨论(Results and discussion) 3.1 铜锈环棱螺对沉积物的摄食率根据周从生物膜摄食率实验计算的铜锈环棱螺对周从生物膜的摄食率为(0.51±0.08) g·g-1·d-1.由于周从生物膜代表了全部的有机质, 因此, 铜锈环棱螺对周从生物膜的摄食率实际就是对有机质的摄食率, 而有机质(C5H7O2N)中含有53.09%的有机碳(OC).因此, 将铜锈环棱螺对周从生物膜的摄食率转换为有机碳摄食率即为(0.2708±0.0500) g·g-1·d-1.本实验采用的沉积物有机碳含量为4.48%, 因此, 铜锈环棱螺对沉积物的摄食率为6.04 g·g-1·d-1.
3.2 铜锈环棱螺对水中BDE-47的摄取效率由图 1可知, 在恒定水暴露浓度(320 ng·L-1)连续暴露12 h的情况下, 铜锈环棱螺体内BDE-47的积累量随暴露时间的延长呈线性增长趋势(R2=0.989), 斜率为5.1214, 亦即摄取速率为5.1214 ng·g-1·h-1, 由此计算铜锈环棱螺对水中BDE-47的摄取速率为5.1214×24/320 = 0.3841 L·g-1·d-1, 亦即摄取效率为38.41%.
 |
| 图 1 BDE-47(320 ng·L-1)水暴露12 h期间铜锈环棱螺体内BDE-47含量的变化 Fig. 1 BDE-47 burden in the visceral mass of Bellamya aeruginosa during aqueous exposure at 320 ng·L-1 of BDE-47 for 12 h |
在BDE-47单独处理组中, 沉积物和间隙水中BDE-47的平均平衡浓度分别为0.40 μg·g-1和0.31 μg·L-1; 添加CSB(4%)后, 沉积物和间隙水中BDE-47的平均平衡浓度分别为0.47 μg·g-1和0.063 μg·L-1, 因此, CSB可以显著降低间隙水中BDE-47的浓度, 降幅约为81%, 也就是说, 添加CSB导致间隙水中81%的BDE-47通过传质运动转移到CSB上.McLeod等(2008)的研究显示, 在PCB污染沉积物中添加2.5%的活性炭后可以将间隙水中PCB的平衡浓度减少97%.因此, 不同的吸附剂对疏水性有机化合物的吸附容量是不同的, 活性炭要优于生物炭.
3.4 BDE-47生物积累的变化在BDE-47加标沉积物和添加CSB的BDE-47加标沉积物中暴露后, BDE-47在铜锈环棱螺内脏团中的生物积累随时间的变化如图 2所示.随暴露时间的延长, 不同处理组的BDE-47生物积累总体上呈指数上升趋势.在BDE-47单独处理组中, 在暴露14 d后, BDE-47生物积累量((509.11±41.38) ng·g-1)已经超过沉积物中的浓度; 暴露28 d后, BDE-47生物积累达到(959.94±65.74) ng·g-1.28 d生物积累测试显示, 铜锈环棱螺对BDE-47的摄取表现为持续增加, 这说明生物积累没有达到稳定状态.添加CSB后, 在不同暴露时间, BDE-47生物积累量均显著低于相应的BDE-47单独处理组; 暴露28 d后, 与BDE-47单独处理组相比, BDE-47生物积累下降了66%.
 |
| 图 2 暴露于未添加CSB和添加CSB的沉积物后铜锈环棱螺内脏团中BDE-47含量随时间的变化 Fig. 2 Change in BDE-47 burden in the visceral mass of Bellamya aeruginosa exposed to sediments with and without CSB amendment |
BDE-47的生物积累随暴露时间(d)的变化取决于铜锈环棱螺对沉积物及间隙水中BDE-47的摄取与体内BDE-47的消除及生长稀释的质量平衡过程.本研究采用铜锈环棱螺的成年个体进行28 d暴露, 由于暴露时间短, 个体生长的影响可以忽略不计.因此, 参照前人的研究(McLeod et al., 2008; Janssen et al., 2010), 采用如下模型来描述BDE-47在铜锈环棱螺体内的生物积累动力学规律:

|
(1) |
式中, Csnail为铜锈环棱螺体内BDE-47的浓度(μg·g-1); t为暴露时间(d); IR为铜锈环棱螺对沉积物颗粒的摄食率(g·g-1·d-1); AEs为铜锈环棱螺从沉积物中摄取BDE-47的效率; Cs为沉积物中BDE-47的浓度(μg·g-1); AEw为铜锈环棱螺从间隙水中摄取BDE-47的效率; Cw为间隙水中BDE-47的浓度(μg·L-1); ke为铜锈环棱螺体内BDE-47的消除速率常数(g·g-1·d-1).在上述模型中, Csnail和t为变量, 其它参数为常数.
该模型综合了沉积物的地球化学特性和铜锈环棱螺的生物学属性(沉积物取食者), 可以区分铜锈环棱螺从沉积物和间隙水中摄取BDE-47的相对重要性.进一步对上式进行积分得下式:

|
(2) |
根据3.1、3.2、3.3和3.4节可以直接得到Cs、Cw、Csnail(t)、AEw和IR, 具体见表 1; 参数ke参考刘佳等(2012)的研究结果.在模型中其它参数已知的条件下, 利用28 d生物积累测试中获得的BDE-47浓度Csnail(t)对式(2)求解得到式(3), 即可求得铜锈环棱螺从沉积物中摄取BDE-47的效率(AEs)随暴露时间的动态变化.

|
(3) |
| 表 1 用于描述BDE-47在铜锈环棱螺体内积累的生物动力学模型参数值 Table 1 Values of biodynamic model parameters used to describe BDE-47 accumulation in Bellamya aeruginosa |
根据28 d生物积累测试结果, 通过式(3)计算得到的铜锈环棱螺从未添加CSB的沉积物和添加CSB的沉积物中摄取BDE-47的效率(AEs)随暴露时间的变化如图 3所示.可以看出, 铜锈环棱螺对两种沉积物中BDE-47的摄取效率随暴露时间的变化均表现为显著的对数增长模式.暴露21 d后, 摄取效率基本达到稳定值, 分别为17.4%和5.6%.有研究指出, 寡毛类夹杂带丝蚓(Lumbriculus variegates)对沉积物中PCBs的摄取效率可在较短时间(7 d)内达到稳定值20%(Sun et al., 2007); 而多毛类沙蚕(N. arenaceodentata)对沉积物中PCBs的摄取效率则至少需要70 d才能达到稳定值25%(Janssen et al., 2010).这说明不同底栖动物对沉积物中疏水性有机物污染物的摄取效率达到稳定状态所需时间存在很大的差异, 主要与物种类别和沉积物性质相关.
 |
| 图 3 铜锈环棱螺从未添加CSB和添加CSB的沉积物中摄取BDE-47的效率(AEs) Fig. 3 Assimilation efficiencies (AEs) of Bellamya aeruginosa from sediments with and without CSB amendment |
为了检验模型对输入参数变化的敏感性, 采用对每个参数平均值增加10%而其它参数保持不变的方法估算铜锈环棱螺的28 d生物积累量.采用参数平均值预测的铜锈环棱螺对未添加CSB和添加CSB的沉积物中BDE-47的28 d积累量分别为985.36 ng·g-1和319.03 ng·g-1.表 2给出了参数增加10%后计算的28 d生物积累量相对于采用表 1中参数平均值预测的28 d生物积累量的变化情况.结果显示, 在两种沉积物中, 28 d生物积累量对沉积物颗粒摄食率(IR)、从沉积物中摄取BDE-47的效率(AEs)、沉积物中BDE-47的浓度(Cs)和BDE-47的消除速率常数(ke)等4个参数的响应表现出较好的敏感性(变化幅度接近10%), 而28 d生物积累量对从间隙水中摄取BDE-47的效率(AEw)和间隙水中BDE-47的平衡浓度(Cw)的响应表现出相对较差的敏感性(变化幅度远低于10%), 这说明铜锈环棱螺主要从沉积物中摄取BDE-47, 这与Janssen等(2010)的研究结果基本一致.
| 表 2 生物动力学模型对参数的敏感性 Table 2 Biodynamic model sensitivity to parameters used to describe BDE-47 accumulation in Bellamya aeruginosa from sediments with and without CSB amendment |
根据模型参数的经验值范围(表 1)分别计算在不同暴露时间(7、14、21和28 d)内铜锈环棱螺内脏团中BDE-47生物积累的预测值范围并与实测值(均以干重计)进行比较, 结果显示, 无论在未添加CSB的沉积物还是在添加CSB的沉积物中, BDE-47生物积累的实测值均在模型预测范围内(图 4), 说明该模型对沉积物中BDE-47生物积累具有很好的预测能力, 而且当沉积物中添加CSB后, 模型具有更好的预测效力.但值得注意的是, 本模型的参数是基于铜锈环棱螺成体的28 d暴露测试的结果, 因此, 在超出本研究的暴露时间跨度情况下或利用不同生长阶段的铜锈环棱螺应用此模型进行BDE-47生物积累预测时需要谨慎考虑.
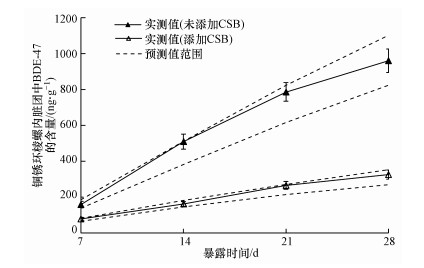 |
| 图 4 铜锈环棱螺对未添加CSB的沉积物和添加CSB的沉积物中BDE-47生物积累的实测值和模型预测值范围的比较 Fig. 4 Comparison of measured values and predicted range of BDE-47 burden in the visceral mass of Bellamya aeruginosa from sediments with and without CSB amendment |
1) 虽然在BDE-47加标沉积物中添加4%的CSB可以将间隙水中BDE-47的浓度降低至少80%, 而且间隙水中疏水性有机污染物浓度的减少也往往与生物积累的降低相关.但生物动力学模型显示, 铜锈环棱螺对BDE-47的生物积累主要来自对沉积物颗粒的摄取.经计算, 暴露28 d后, 铜锈环棱螺从未添加CSB的沉积物中摄取的BDE-47占总积累量的80%, 而从添加CSB的沉积物中摄取的BDE-47占总积累量的比例更高, 达到87%.因此, 铜锈环棱螺对沉积物中BDE-47摄取量的减少才是导致生物积累降低的关键原因.
2) 本研究所建立的生物动力学模型具有重要的环境意义, 只要模型的参数得以量化和验证, 在已知沉积物和间隙水中BDE-47浓度的情况下, 可以利用该模型有效地预测铜锈环棱螺体内BDE-47的积累量, 从而极大地降低沉积物生态毒性风险评价和原位修复效果评估的不确定性.
Ahmad M, Rajapaksha A U, Lim J E, et al. 2014. Biochar as a sorbent for contaminant management in soil and water: a review[J]. Chemosphere, 99: 19-33. DOI:10.1016/j.chemosphere.2013.10.071 |
Cao X, Ma L, Gao B, et al. 2009. Dairy-manure derived biochar effectively sorbs lead and atrazine[J]. Environmental Science & Technology, 43(9): 3285-3291. |
陈社军, 麦碧娴, 曾永平, 等. 2005. 珠江三角洲及南海北部海域表层沉积物中多溴联苯醚的分布特征[J]. 环境科学学报, 25(9): 1265-1271. DOI:10.3321/j.issn:0253-2468.2005.09.021 |
de Wit C A. 2002. An overview of brominated flame retardants in the environment[J]. Chemosphere, 46(5): 583-624. DOI:10.1016/S0045-6535(01)00225-9 |
Diepens N J, Van den Heuvel-Greve M J, Koelmans A A. 2015. Modeling of bioaccumulation in marine benthic invertebrates using a multispecies experimental approach[J]. Environmental Science & Technology, 49(22): 13575-13585. |
龚双姣, 王萌, 龙奕, 等. 2015. 沉积物中人工纳米颗粒对BDE-47生态毒性的影响[J]. 农业环境科学学报, 34(11): 2089-2096. DOI:10.11654/jaes.2015.11.008 |
Janssen E M L, Croteau M-N, Luoma S N, et al. 2010. Measurement and modeling of polychlorinated biphenyl bioaccumulation from sediment for the marine polychaete Neanthes arenaceodentata and response to sorbent amendment[J]. Environmental Science & Technology, 44(8): 2857-2863. |
Jia F, Gan J. 2014. Comparing black carbon types in sequestering polybrominated diphenyl ethers (PBDEs) in sediments[J]. Environmental Pollution, 184: 131-137. DOI:10.1016/j.envpol.2013.08.009 |
刘佳, 彭巾英, 马陶武, 等. 2012. 沉积物中2, 2', 4, 4'-四溴联苯醚(BDE-47)在铜锈环棱螺体内的毒代动力学及其繁殖毒性[J]. 生态毒理学报, 7(3): 259-267. |
La Guardia M J, Hale R C, Harvey E. 2006. Detailed polybrominated diphenyl ether (PBDE) congener composition of the widely used penta-, octa-, and deca-PBDE technical flame-retardant mixtures[J]. Environmental Science & Technology, 40(20): 6247-6254. |
Liu S, Wang C, Hou J, et al. 2018. Effects of silver sulfide nanoparticles on the microbial community structure and biological activity of freshwater biofilms[J]. Environmental Science: Nano, 5(12): 2899-2908. DOI:10.1039/C8EN00480C |
Luo Q, Cai Z W, Wong M H. 2007. Polybrominated diphenyl ethers in fish and sediment from river polluted by electronic waste[J]. Science of the Total Environment, 383(1): 115-127. |
Ma T, Gong S J, Zhou K, et al. 2010. Laboratory culture of the freshwater benthic gastropod Bellamya aeruginosa (Reeve) and its utility as a test species for sediment toxicity[J]. Journal of Environmental Sciences, 22(2): 304-313. DOI:10.1016/S1001-0742(09)60109-1 |
McLeod P B, Luoma S N, Luthy R G. 2008. Biodynamic modeling of PCB uptake by Macoma balthica and Corbicula fluminea from sediment amended with activated carbon[J]. Environmental Science & Technology, 42(2): 484-490. |
Moon H B, Choi M, Yu J, et al. 2012. Contamination and potential sources of polybrominated diphenyl ethers (PBDEs) in water and sediment from the artificial Lake Shihwa, Korea[J]. Chemosphere, 88(7): 837-843. DOI:10.1016/j.chemosphere.2012.03.091 |
Rakowska M I, Kupryianchyk D, Harmsen J, et al. 2012. In situ remediation of contaminated sediments using carbonaceous materials[J]. Environmental Toxicology and Chemistry, 31(4): 693-704. DOI:10.1002/etc.1763 |
Simpson S L, Angel B M, Jolley D F. 2004. Metal equilibration in laboratory-contaminated (spiked) sediments used for the development of whole-sediment toxicity tests[J]. Chemosphere, 54(5): 597-609. DOI:10.1016/j.chemosphere.2003.08.007 |
Sun J L, Chen Z X, Ni H G, et al. 2013. PBDEs as indicator chemicals of urbanization along an urban/rural gradient in South China[J]. Chemosphere, 92(4): 471-476. DOI:10.1016/j.chemosphere.2013.01.036 |
Sun K, Gao B, Ro K S, et al. 2012. Assessment of herbicide sorption by biochars and organic matter associated with soil and sediment[J]. Environmental Pollution, 163: 167-173. DOI:10.1016/j.envpol.2011.12.015 |
Sun X, Ghosh U. 2007. PCB bioavailability control in Lumbriculus variegatus through different modes of activated carbon addition to sediments[J]. Environmental Science & Technology, 41(13): 4774-4780. |
Sun X, Werner D, Ghosh U. 2009. Modeling PCB mass transfer and bioaccumulation in a freshwater oligochaete before and after amendment of sediment with activated carbon[J]. Environmental Science & Technology, 43(4): 1115-1121. |
田斌, 王萌, 陈环宇, 等. 2018. 活性污泥生物炭对沉积物中镉生态毒性的影响[J]. 生态与农村环境学报, 34(2): 161-168. |
Wang H, Tang X, Sha J, et al. 2015. The reproductive toxicity on the rotifer Brachionus plicatilis induced by BDE-47 and studies on the effective mechanism based on antioxidant defense system changes[J]. Chemosphere, 135: 129-137. DOI:10.1016/j.chemosphere.2015.03.090 |
Wang Y, Wang L, Fang G, et al. 2013. Enhanced PCBs sorption on biochars as affected by environmental factors: humic acid and metal cations[J]. Environmental Pollution, 172: 86-93. DOI:10.1016/j.envpol.2012.08.007 |
向静, 米盈, 田斌, 等. 2020. 玉米秸秆生物炭对沉积物中BDE-47生态毒性的影响[J]. 生态毒理学报, 15(2): 180-189. |
Yang Z Z, Zhao X R, Qin Z F, et al. 2009. Polybrominated diphenyl ethers in mudsnails (Cipangopaludina cahayensis) and sediments from an electronic waste recycling region in South China[J]. Bulletin of Environmental Contamination and Toxicology, 82(2): 206-210. DOI:10.1007/s00128-008-9600-9 |
Yin H, Tang Z, Meng T, et al. 2020. Concentration profile, spatial distributions and temporal trends of polybrominated diphenyl ethers in sediments across China: Implications for risk assessment[J]. Ecotoxicology and Environmental Safety, 206: 111205. DOI:10.1016/j.ecoenv.2020.111205 |
 2021, Vol. 41
2021, Vol. 41


