2. 《河南师范大学学报》编辑部, 新乡 453007;
3. 中国科学院水生生物研究所, 武汉 430072
2. Journal of Henan Normal University, Xinxiang 453007;
3. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072
近年来, 全球塑料年产量达到3.48亿t, 且持续增长, 塑料制品的大量使用和不合理处理导致其在海洋和淡水生态系统中大量积累, 进而对水生态环境造成严重威胁.长期的滞留和环境的分解作用, 使得塑料制品被分化成粒径小于5 mm的塑料颗粒, 也就是人们现在所称的微塑料(Zhang et al., 2017).常见的聚合物包括低密度聚乙烯(Low density polyethylen, LDPE)、高密度聚乙烯(High density polyethylen, HDPE)、聚丙烯(Polypropylene, PP)、聚苯乙烯(Polystyrene, PS)、聚乙烯对苯二甲酸酯(Polyethylene terephthalate, PET)和聚氯乙烯(Polyvinyl chloride, PVC), 以及其他聚合物如尼龙、丙烯酸、聚氨酯、聚乳酸、聚碳酸酯及其他生物降解塑料(贾静, 2018).随着采样和监测技术的进步, 在河流、湖泊、河口、海洋、冰川等生境中均发现了微塑料的分布(Wu et al., 2019).由于体积小、比表面积大等特点, 由微塑料所产生的环境污染问题已引起全世界的广泛关注(Imhof et al., 2017), 越来越多的证据表明, 微塑料进入食物链后会产生广泛而有害的影响, 成为威胁生物个体生存、种群繁衍的重要原因之一.
研究发现, 漂浮在海水上的塑料垃圾是有害致病菌和藻类的良好栖息地(Yang et al., 2018), 误食微塑料的海洋生物常常因为难以消化或肠道磨损而死亡(Suman et al., 2020).同时, 作为多聚物, 微塑料的化学性质使得其危害效应更加复杂(Ajith et al., 2020), 其吸附的污染物会对水生生物产生内分泌干扰效应, 影响酶的活性, 诱导氧化应激甚至产生基因毒性, 从而进一步引发细胞炎症, 损伤机体的免疫系统.还有研究发现, 微塑料在形状、尺寸、化学性质及暴露浓度等方面的差异均会对其毒性产生影响.最近的研究预测, 预计到2050年, 海洋塑料的积累将超过13亿t.此外, 在淡水生态系统中也有报道, 微塑料在我国河流、湖泊等淡水水体中普遍存在, 其丰度可达107个·km-2, 比海洋环境中检测到的微塑料丰度更高(Wu et al., 2018).新的研究还发现, 微塑料也越来越多地出现在人类食物系统中, 其对人类健康的影响还需要进一步研究(Winnie et al., 2020).
枝角类是淡水生态系统中物质循环和能量流动中的重要环节, 它们对毒物有很强的敏感性.因此, 国内外科研人员广泛使用枝角类来评价化学产品的毒性、进行水污染监测及制定各种水质标准, 其中, 大型溞(D. magna)已成为国际公认的标准试验模式生物.塑料降解过程产生的一系列的胁迫因子不可避免地会对大型溞产生影响, 研究微塑料对大型溞的毒性对评价微塑料的生态效应具有重要的意义.现代生态环境风险评价中安全阈值的确定己经不再局限于传统的毒理学研究指标, 而是更多地注重于环境胁迫对生物体在细胞水平、分子水平上的可观测变化.因此, 本试验以淡水模式生物大型溞为受试对象, 研究2 μm PVC微粒对大型溞繁殖的影响.同时, 在分子水平上检测PVC微塑料对大型溞体内超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)、血红蛋白(Hemoglobin, DHB)、α-酯酶(α-esterase, EST)、热休克蛋白70(Heat-shock protein 70, HSP 70)和精氨酸激酶(Arginine kinase, AK)基因表达的影响, 以期为微塑料对淡水水生生物的生态风险评价提供理论依据.
2 材料与方法(Materials and methods) 2.1 材料与试剂PVC微球(粒径2 μm)购自东莞市静天塑胶原料有限公司;RNAiso Plus购自Takara;HiFi-Script cDNA第一链合成试剂盒和UltraSYBR Mixture购自康为世纪生物科技有限公司.
2.2 试验动物及培养大型溞(D. magna)购自中国科学院水生生物研究所.大型溞培养在含400 mL脱氯自来水的玻璃烧杯中, 培养密度保持在20只/400 mL水以下, 培养液每周更换2次.培养条件为光暗比为16 h∶8 h, 温度为(24±1) ℃.每日喂食小球藻, 投喂密度为5.0×105 cell·mL-1.
2.3 急性毒性试验参考OECD方法, 根据预实验, 将经过超声波水浴24 h的400 mg·L-1的PVC微塑料悬浮液, 依次稀释为0、10、20、40、80和160 mg·L-1等系列浓度.每个浓度设置4个重复, 在含有80 mL不同浓度PVC的烧杯中放入10只出生6~24 h的幼溞.试验中不喂食, 不换液.48 h后, 统计每组个体的死亡率, 计算PVC对大型溞48 h的LC50.
2.4 慢性毒性试验参照OECD 21 d慢性毒理试验, 根据急性毒性试验结果, 选择0、2.56、5.125和10.25 mg·L-1 PVC进行慢性毒性试验.PVC在试验前超声水浴24 h, 然后配制各浓度PVC溶液.将新生幼溞(6~24 h)转移到含有30 mL含不同浓度PVC的玻璃烧杯中, 每个烧杯中放一只幼溞, 每个浓度组10个平行.以小球藻作为食物, 投喂密度为5.0×105 cell·mL-1.试验中每天更换培养液并观察大型溞的生长繁殖情况, 同时记录产第一胎时间、第一胎产幼溞数、总胎数和产幼溞总数.
2.5 SOD、CAT酶活和GSH、MDA含量的测定参考张楠等方法(2018), 将新生幼溞(6~24 h)置于不同浓度PVC溶液组(0、2.56、5.125、10.25 mg·L-1)处理48 h.试验期间不喂食, 不换试验用液.48 h后将大型溞取出, 吸干水分后称重, 加入86%的生理盐水后置冰上用匀浆器匀浆;然后在10000 g、4 ℃下离心10 min, 收集上清液, 分装后于-80 ℃冰箱中保存备用.SOD和CAT酶活力及GSH和MDA含量测定试剂盒购自上海碧云天生物技术有限公司.
2.6 基因表达检测基因表达检测试验浓度同慢性毒性试验, 将新生幼溞(6~24 h)转移到含400 mL不同浓度PVC的烧杯中, 每个烧杯放20只幼溞, 每个浓度4个平行.每天更换培养液并投喂小球藻.暴露48 h后取样, 置-80 ℃冰箱保存备用.RNA提取和荧光定量检测方法参照文献(Lyu et al., 2013).试验用引物和管家基因β-actin序列见表 1.
| 表 1 荧光定量PCR分析所用引物序列 Table 1 Primer sequence used for quantitative real-time PCR |
所有数据均采用平均数±标准误的方法进行表述, 通过统计软件SPSS20.0对数据进行单因素方差分析(One-Way ANOVA), p < 0.05表示差异显著.
3 结果(Results) 3.1 急性毒性试验急性毒性试验表明, PVC微塑料对大型溞48 h的LC50为20.5 mg·L-1, 95%置信区间为12.242~32.674 mg·L-1.
3.2 慢性毒性试验PVC对大型溞的慢性毒性结果见图 1.与对照组相比, 10.25 mg·L-1 PVC处理组产第一胎时间明显推迟(图 1a), 同时, 5.125和10.25 mg·L-1处理组第一胎产幼溞数显著下降(图 1b).试验还发现, 2.56和5.125 mg·L-1 PVC导致大型溞总胎数稍微下降, 而10.25 mg·L-1处理组总胎数却显著增加(图 1c).但所有处理组产幼溞总数与对照组相比均显著下降(图 1d).试验结果表明, PVC明显延迟了大型溞的生殖时间, 降低了大型溞的繁殖量.
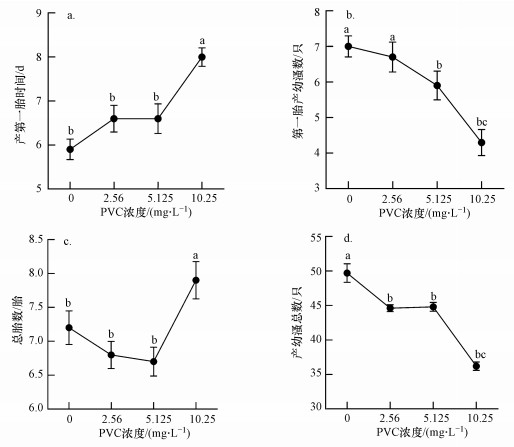 |
| 图 1 PVC对大型溞产第一胎时间(a)、第一胎产幼溞数(b)、总胎数(c)和产幼溞总数(d)的影响 Fig. 1 Effect of PVC on days to first brood(a), number of first-brood offspring(b), total number of broods(c) and total number of offspring(d) of D. magna |
PVC暴露大型溞48 h后的SOD和CAT酶活性及GSH和MDA含量变化情况如图 2.与对照组相比, 所有PVC处理组SOD酶活性均显著上升(图 2a), 而5.125和10.25 mg·L-1处理组CAT酶活性显著升高(图 2b).同时, 所有处理组MDA含量(图 2c)与对照组相比均显著升高, 而GSH含量明显降低(图 2d).
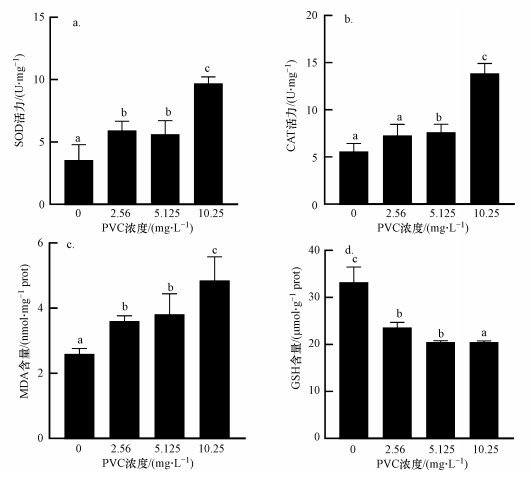 |
| 图 2 PVC对大型溞SOD(a)、CAT(b)酶活力及MDA(c)和GSH(d)含量的影响 Fig. 2 Effect of PVC on the activity of SOD(a) and CAT(b) and the content of MDA(c) and GSH(d) in D. magna |
由图 3可知, PVC暴露48 h后, 所有PVC处理组SOD、EST和AK基因表达量与对照组相比显著升高(图 3a、3c、3d);而5.125和10.25 mg·L-1处理组也明显上调CAT基因表达量(图 3b).由图 3e可知, 2.56和10.25 mg·L-1 PVC暴露大型溞48 h后HSP70表达量显著上升;而5.125和10.25 mg·L-1处理组DHB基因表达量与对照组相比明显升高(图 3f).
 |
| 图 3 PVC对大型溞SOD(a)、CAT(b)、EST(c)、AK(d)、HSP70(e)和DHB(f)基因表达的影响 Fig. 3 Effect of PVC on the expressions of SOD(a), CAT(b), EST(c), AK(d), HSP70(e) and DHB(f) in D. magna |
研究表明, 微塑料在海洋、湖泊、河流等水环境中广泛存在.因此, 作为一种新的污染源, 微塑料污染已引起人们的普遍关注(Li et al., 2019).溞类是水生态系统的初级消费者, 同时还是鱼虾类等生物的饵料, 在水生态系统中具有重要的地位.同时, 生长周期短、易培养和对水体污染物敏感等特性使溞类毒性试验已经被广泛应用于水体环境污染物的危害性评价中(Zhi et al., 2018).
繁殖指标是大型溞遭受生态胁迫或化学毒性的经典指示指标(Zhi et al., 2018).本试验发现所有PVC处理组均显著降低了大型溞产幼溞总数, 表明PVC长期暴露能降低大型溞种群数量.大型溞是一种滤食生物, 它在“滤水”的同时能摄入水中尺寸为0.4~4 μm的物质, 本实验采用的PVC微塑料粒径为2 μm, 能够被大型溞直接吞食.被吞食的PVC积累在大型溞的消化道中, 很可能造成消化道的堵塞, 从而阻止大型溞的正常摄食, 造成能量供应不足, 因此, 没有足够的能量投入到繁殖方面, 导致种群数量大量减少(Tu et al., 2018).
试验还发现, 10.25 mg·L-1 PVC显著延长了产第一胎时间, 表明PVC延缓了个体的成熟时间, 抑制了个体的生长发育.同时, 10.25 mg·L-1处理组显著增加了大型溞总胎数, 但产幼溞总数明显下降.原因可能是大型溞对环境的适应性反应.种群生态学上认为, 当外界环境恶化(但不严重)时, 母体会通过增加繁殖次数同时减少单次繁殖输出使种群维持在一定的水平(Lyu et al., 2013).
除了消化道堵塞, 氧化损伤也被认为是PVC对大型溞的可能致毒途径之一.SOD和CAT是生物体内两种重要的抗氧化酶, 其中, SOD可以特异性地将O2-催化分解为H2O2和O2, CAT可以催化H2O2分解为无毒的H2O和O2, 从而将活性氧(ROS)保持在较稳定的水平, 保护生物体免受ROS的损害(Hu et al., 2015).当ROS的量超过抗氧化清除能力时, 会对机体造成氧化损伤, 如脂质过氧化.MDA是脂质过氧化的主要产物.生物体内SOD和CAT活力及MDA含量的变化能够阐明污染物的毒性机制.本研究结果表明, PVC会使大型溞体内SOD和CAT活力及MDA含量升高;同时, 在基因水平上, PVC暴露上调了大型溞SOD和CAT基因表达.Xia等(2017)用含10%、20%和30%PVC微塑料的饲料喂食鲤鱼60 d后显著改变了鲤鱼肝、肠和鳃中抗氧化酶基因表达.研究还表明, 聚苯乙烯微塑料暴露诱导轮虫SOD酶活性(Jeong et al., 2017)及斑马鱼肠道SOD和CAT酶活性也同样被显著上调(Ru et al., 2019).Zhi等(2018)报道, 0.1~2 mg·L-1聚苯乙烯微塑料暴露蚤状溞(Daphnia pulex)后低浓度诱导了SOD和CAT基因表达, 而高浓度则抑制其表达.这些实验结果表明, 微塑料暴露可引起水生生物体内ROS升高, 而SOD和CAT酶在机体抵抗微塑料诱导的氧化应激中起重要的保护作用.
还原型谷胱甘肽(GSH)是机体内最重要的非酶性抗氧化物, 是一种低分子清除剂, 同时也是组织中主要的非蛋白质巯基化合物, 还是谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)和谷胱甘肽S-转移酶(glutathione S-transferase, GST)两种酶的底物, 在维持生物体内适宜的氧化酶系统中有着重要的作用.张楠等(2018)发现低质量浓度的Zn2+可使大型溞体内的GSH含量降低.本实验中, PVC暴露下大型溞体内GSH含量下降, 低浓度的PVC可能诱导以GSH为底物的酶表达, 同时GSH也参与亲电自由基的去除, 消耗了大量的GSH, 导致大型溞体内GSH含量下降.
除了抗氧化系统外, 生物体还合成一些特殊蛋白来应对环境胁迫.热休克蛋白家族(Heat-shock proteins, HSPs)参与维持蛋白质结构的稳定性, 被认为是环境污染胁迫的生物标志物(Jae-Sung et al., 2009).Mikulski等(2009)发现高温会促使大型溞HSP70蛋白表达上升.Haap等(2009)报道重金属Cd暴露会上调大型溞HSP70基因表达.本试验结果表明, PVC暴露也诱导了大型溞的HSP70基因表达, 这与Zhi等(2018)报道的结果相似, 他们发现1和2 mg·L-1聚苯乙烯纳米塑料暴露21 d时会诱导蚤状溞HSP70表达上调.结果说明微塑料胁迫可能导致细胞内多种蛋白失去原有的正确结构, 而HSP70参与了修复蛋白折叠的过程(Mayer et al., 2005).
能量预算表示生物体的发育(即身体生长)所消耗的能量.生物体为应对各种外部胁迫, 需要大量额外的能量供应, 因此, 能量的产生是非常重要的(Tang et al., 2019).脂肪是动物体内重要的能量储存形式, 前期研究表明, 在污染物暴露期间机体通过消耗脂肪含量来维持体内能量平衡(Coen et al., 2010).Kim等(2009)发现紫外线照射会上调大型溞的EST基因表达.本试验也发现PVC暴露后大型溞EST基因表达量明显升高.EST酶的增多能为大型溞提供更多能量(Soetaert et al., 2017).AK是调节无脊椎动物能量代谢的重要酶, 在调节磷酸精氨酸与ATP之间的能量平衡过程中具有重要作用(Lu et al., 2015).Brillant等(2002)的研究表明, 摄取缺乏营养价值的聚苯乙烯微塑料可能会影响海扇贝的营养吸收.本试验发现, PVC暴露后大型溞AK基因表达显著上调.PVC进入大型溞肠道可能会影响其营养吸收(Brillant et al., 2002), 而且PVC滞留在肠道可能会导致虚假的饱腹感, 从而减少能量储备(Wright et al., 2013).因此, AK表达的增加可能是大型溞在能源限制的情况下对更多ATP需求产生的补偿反应(Tang et al., 2019).
DHB广泛分布于真核生物和原核生物中, 是生物体氧气运输系统的重要组成部分(Beers et al., 2010).研究表明, DHB基因转录水平受各种环境污染物的调控(Le et al., 2010).而且, 溞类DHB能为淡水生态系统的一般健康状况评价提供有用的信息, 可作为生态毒性监测的生物标志物(Ha et al., 2010).本试验中PVC暴露下大型溞DHB表达量和对照组相比显著升高.DHB的升高可能有助于大型溞通过加速代谢反应, 积极而迅速地清除有毒物质(Giraudo et al., 2015).
5 结论(Conclusions)在21 d的实验中, PVC暴露可影响大型溞产第一胎时间、第一胎产幼溞数、总胎数和产幼溞总数, 导致大型溞繁殖能力下降.同时, 本试验还发现PVC能使大型溞体内SOD和CAT活力及MDA含量升高, 上调大型溞抗氧化基因(SOD和CAT)、应激蛋白基因(HSP70)、能量相关基因(EST和AK)和DHB基因的表达水平, 这些基因的改变干扰了大型溞内稳态, 可能最终导致大型溞繁殖量下降.本试验从繁殖、氧化应激、基因表达3个方面对PVC的致毒机制进行研究, 有助于预测PVC微塑料对水生生物的毒性作用, 并对PVC微塑料水生生态系统风险评价提供数据支撑.
致谢(Acknowledgement): 感谢河南师范大学新联学院商璐、李菁两位同学在数据整理方面给予的帮助, 感谢中国科学院水生生物研究所陈联国研究员和埃及国家研究中心海洋毒素实验室Yousef Sultan副教授在英文摘要修改方面给予的建议, 感谢中国科学院水生生物研究所熊雄副研究员在文章修改过程中给予的建议.
Ajith N, Arumugam S, Parthasarathy S, et al. 2020. Global distribution of microplastics and its impact on marine environment-A review[J]. Environmental Science and Pollution Research, 27(21): 25970-25986. DOI:10.1007/s11356-020-09015-5 |
Beers J M, Borley K A, Sidell B D. 2010. Relationship among circulating hemoglobin, nitric oxide synthase activities and angiogenic poise in red- and white-blooded Antarctic notothenioid fishes[J]. Comparative Biochemistry and Physiology.Part A, Molecular & Integrative Physiology, 156(4): 422-429. |
Brillant M G S, MacDonald B A. 2002. Postingestive selection in the sea scallop (Placopecten magellanicus) on the basis of chemical properties of particles[J]. Marine Biology, 141(3): 457-465. DOI:10.1007/s00227-002-0845-2 |
Coen W M D, Janssen C R. 2010. The missing biomarker link: relationships between effects on the cellular energy allocation biomarker of toxicant-stressed Daphnia magna and corresponding population characteristics[J]. Environmental Toxicology & Chemistry, 22(7): 1632-1647. DOI:10.1002/etc.5620220727 |
Giraudo M, Douville M, Houde M. 2015. Chronic toxicity evaluation of the flame retardant tris (2-butoxyethyl) phosphate (TBOEP) using Daphnia magna transcriptomic response[J]. Chemosphere, 132: 159-165. DOI:10.1016/j.chemosphere.2015.03.028 |
Ha M H, Choi J. 2009. Effects of environmental contaminants on hemoglobin gene expression in Daphnia magna: a potential biomarker for freshwater quality monitoring[J]. Archives of Environmental Contamination & Toxicology, 57(2): 330-337. |
Haap T. 2009. Cadmium tolerance in seven Daphnia magna clones is associated with reduced hsp70 baseline levels and induction[J]. Aquatic Toxicology, 94(2): 131-137. DOI:10.1016/j.aquatox.2009.06.006 |
Hu C W, Wang Q, Zhao H T, et al. 2015. Ecotoxicological effects of graphene oxide on the protozoan Euglena gracilis[J]. Chemosphere, 128: 184-190. DOI:10.1016/j.chemosphere.2015.01.040 |
Imhof H K, Jakub R, Michaela T, et al. 2017. Do microplastic particles affect Daphnia magna at the morphological, life history and molecular level?[J]. Plos One, 12(11): e0187590. DOI:10.1371/journal.pone.0187590 |
Jae-Sung R, Sheikh R, Kyun-Woo L, et al. 2009. Heat shock protein (Hsp) gene responses of the intertidal copepod tigriopus japonicus to environmental toxicants[J]. Comparative Biochemistry & Physiology Part C, Toxicology & Pharmacology, 149(1): 104-112. |
Jeong C B, Won E J, Kang H M, et al. 2016. Microplastic size-dependent toxicity, oxidative stress induction, and p-JNK and p-p38 activation in the Monogonont Rotifer (Brachionus koreanus)[J]. Environmental Science & Technology, 50(16): 8849-8857. |
贾静. 2018. 微塑料在水生食物链中的富集及毒性效应研究[D]. 大连: 大连海事大学
|
Kim J, Park Y, Choi K. 2009. Photo toxicity and oxidative stress responses in Daphnia magna under exposure to sulfathiazole and environmental level ultraviolet B irradiation[J]. Aquatic Toxicology, 91(1): 87-94. DOI:10.1016/j.aquatox.2008.10.006 |
李爱峰, 李方晓, 邱江兵, 等. 2019. 水环境中微塑料的污染现状、生物毒性及控制对策[J]. 中国海洋大学学报(自然科学版), 49(10): 88-100. |
Le T H, Lim E S, Lee S K, et al. 2010. Effects of glyphosate and methidathion on the expression of the Dhb, Vtg, Arnt, CYP4 and CYP314 in Daphnia magna[J]. Chemosphere, 79(1): 67-71. DOI:10.1016/j.chemosphere.2009.12.067 |
Li Z H, Zlabek V, Grabic R, et al. 2010. Modulation of glutathione-related antioxidant defense system of fish chronically treated by the fungicide propiconazole[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 152(3): 392-398. |
Lu K, Zhang L, Zhu X, et al. 2015. Arginine kinase in the cladoceran Daphnia magna: cDNA sequencing and expression is associated with resistance to toxic Microcystis[J]. Aquatic Toxicology, 160: 13-21. DOI:10.1016/j.aquatox.2014.12.023 |
Lyu K, Cao H, Chen R. 2013. Combined effects of hypoxia and ammonia to Daphnia similis estimated with life-history traits[J]. Environmental Science & Pollution Research, 20(8): 5379-5387. |
Lau W W Y, Shiran Y, Bailey R M, et al. 2020. Evalution scenarios toward zero plastic pollution[J]. Science, 369(6510): 1455-1461. DOI:10.1126/science.aba9475 |
Mayer M, Bukau B. 2005. Hsp70 chaperones: Cellular functions and molecular mechanism[J]. Cellular and Molecular Life Sciences, 62: 670-684. DOI:10.1007/s00018-004-4464-6 |
Mikulski A, Grzesiuk M, Kloc M, et al. 2009. Heat shock proteins in Daphnia detected using commercial antibodies: description and responsiveness to thermal stress[J]. Chemoecology, 19(2): 69-72. DOI:10.1007/s00049-009-0010-1 |
Ru X, Qi ao, Cheng. 2019. Microplastics induce intestinal inflammation, oxidative stress, and disorders of metabolome and microbiome in zebrafish[J]. Science of the Total Environment, 662: 246-253. DOI:10.1016/j.scitotenv.2019.01.245 |
Soetaert A, Vandenbrouck T, Ven K V D, et al. 2007. Molecular responses during cadmium-induced stress in Daphnia magna: integration of differential gene expression with higher-level effects[J]. Aquatic Toxicology, 83(3): 212-222. DOI:10.1016/j.aquatox.2007.04.010 |
Suman T Y, Jia P P, Li W G, et al. 2020. Acute and chronic effects of polystyrene microplastics on brine shrimp: First evidence highlighting the molecular mechanism through transcriptome analysis[J]. Journal of Hazardous Materials, 400: 123220. DOI:10.1016/j.jhazmat.2020.123220 |
Tang J, Wang X, Yin J, et al. 2019. Molecular characterization of thioredoxin reductase in waterflea Daphnia magna and its expression regulation by polystyrene microplastics[J]. Aquatic Toxicology, 208: 90-97. DOI:10.1016/j.aquatox.2019.01.001 |
Tu Y N, Ling H B, Wu C X, et al. 2018. Ingestion and effects of microplastics on freshwater zooplankton[J]. Environmental Science & Technology, 41(11): 1-8. |
Wright S L, Rowe D, Thompson R C, et al. 2013. Microplastic ingestion decreases energy reserves in marine worms[J]. Current Biology, 23(23): 1031-1033. DOI:10.1016/j.cub.2013.10.068 |
Wu P, Tang Y, Jin H, et al. 2020. Consequential fate of bisphenol-attached PVC microplastics in water and simulated intestinal fluids[J]. Environmental Science and Ecotechnology, 2: 100027. DOI:10.1016/j.ese.2020.100027 |
吴辰熙, 潘响亮, 施华宏, 等. 2018. 我国淡水环境微塑料污染与流域管控策略[J]. 中国科学院院刊, 33(10): 1012-1020. |
Xia X, Sun M, Zhou M, et al. 2020. Polyvinyl chloride microplastics induce growth inhibition and oxidative stress in Cyprinus carpio var. larvae[J]. Science of the Total Environment, 716: 136479. DOI:10.1016/j.scitotenv.2019.136479 |
Yang Y S. 2018. Earth Ecology Changed by Plastics[J]. Ecological Economy, 34(8): 2-5. |
Zhang C, Chen X H, Wang J T, et al. 2017. Toxic effects of microplastic on marine microalgae Skeletonema costatum: Interactions between microplastic and algae[J]. Environmental Pollution, 220: 1282-1288. DOI:10.1016/j.envpol.2016.11.005 |
张楠, 张清靖, 贾成霞, 等. 2017. 重金属锌对大型溞SOD、CAT酶活性和GSH含量的影响[J]. 西北大学学报, 39(1): 70-75. |
Zhi Q, Liu P. 2019. Polystyrene nanoplastic exposure induces immobilization, reproduction, and stress defense in the freshwater cladoceran Daphnia pulex[J]. Chemosphere, 215(1): 74-81. |
 2021, Vol. 41
2021, Vol. 41


