2. 中国科学院生态环境研究中心环境水质学国家重点实验室, 北京 100085
2. State Key Laboratory of Environmental Aquatic Chemistry, Research Center of Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
生物质磷(Biogenic Phosphorus, Biogenic-P)与生物的新陈代谢密切相关, 是沉积物磷的重要组成部分之一, 组分复杂, 主要包括磷酸单酯(Phosphate Monoesters, Mono-P)、DNA磷(Deoxyribonucleic Acid, DNA-P)、磷脂(Phospholipids, Lipids-P)等有机磷化合物和焦磷酸盐(Pyrophosphate, Pyro-P)、多聚磷酸盐(Polyphosphates, Poly-P)等无机磷化合物(Ahlgren et al., 2005; Zhang et al., 2014b).Biogenic-P主要通过浮游植物、腐殖质和细菌沉淀累积形成初代磷储蓄库, 从而参与到磷的循环过程.相关研究表明, 在磷的内源负荷中, Biogenic-P矿化释放的正磷酸盐会影响水体整体生产力(Ahlgren et al., 2006).Biogenic-P的存在受到土壤/沉积物的理化特性、微生物活性和扰动等诸多因素的影响.土壤/沉积物pH通过影响土壤微生物群落、有机质的分解与酶的活性等影响Biogenic-P.Trasar-Cepeda等(1989)研究表明, 在酸性土壤中, 磷酸单酯与自由Fe离子、pH呈显著负相关.土壤湿度增加会降低土壤微生物群落丰富度和多样性, 进而降低土壤有机磷的分解速率(Tate et al., 1982; Neilson et al., 2017).船运和渔业带来的扰动会影响浅水型湖泊沉积物-水界面的氧化还原电位和微生物群落, 从而影响Mono-P、DNA-P和Pyro-P的转化速率, 如Zhang等(2015)在研究巢湖生物质磷时发现, DNA-P和Lipids-P受扰动的影响从而矿化为正磷酸盐被水生生物所利用.Biogenic-P活性较高, 环境因子变化更易引起其赋存形态的变化.
水陆交错区常被称作为岸边带、水陆交错带, 是陆地和水生群落的过渡带, 也是河流及湿地的天然防护屏障, 因其独特的空间结构和生境条件, 在蓄洪、抗旱和维持生物多样性等方面有着重要贡献(Lane et al., 2016; Zhang et al., 2016).水陆交错区一般为浅层生态系统, 其对水文条件变化的响应特别敏感, 除人为扰动外, 自然环境的改变也可能对水陆交错区Biogenic-P累积和转化产生较大的影响, 如水位波动导致土壤的干湿交替, 季节性引起的温度变化等.Turner等(2001)指出干燥后的土壤重新湿润会使得土壤下层的渗透压改变, 导致微生物细胞发生分解, 从而使得有机磷矿化.周期性的水位上升会导致氧化还原条件改变, 被铁铝等金属氧化物所吸附的磷会再次释放到水体中(Surridge et al., 2012).此外, 水陆交错区不同区域有机质含量和矿化的差异性同样也会直接或间接地影响磷循环过程(Salas et al., 2003).
白洋淀沟壕系统发达, 约3700条沟壕将全淀分成143个大小不等的淀泊.沟壕系统拥有发达且发育良好的岸边带, 生物质磷在淀区沟壕系统岸边带中的形态特征及迁移转化过程亟需探究, 以满足雄安新区建设对白洋淀水质提升和水生态修复的要求.为此, 本研究选择淀区发育良好的沟壕系统水陆交错带为研究对象, 利用液相核磁共振技术(Solution Phosphorus Nuclear Magnetic Resonance, 31P-NMR), 探究水陆交错区中生物质磷的形态特征及其与环境因子的关系, 以期为深入研究草型浅水湖泊磷循环过程及其控制措施提供支撑.
2 材料与方法(Materials and methods) 2.1 研究区域概况白洋淀(38°43′~39°02′N, 115°38′~116°07′E)位于河北省中东部, 是华北平原内最大的淡水浅湖型湿地, 有“华北明珠”之称等(李月丛等, 2000; Ji et al., 2019).白洋淀形成历史悠久, 有超过上亿年的历史.古白洋淀形成于新生代以来差异性断陷的冀中凹陷之中, 东邻沧县, 西抵太行山, 其地貌属于古谷盆地地貌, 在海河水系、滦河水系及古黄河的作用下在山前形成冲积-洪积扇群, 致使扇与扇之间出现洼地与淀泊(王会昌, 1983; 李月丛等, 2000).白洋淀区域属于温带大陆季风气候, 冬季寒冷干燥, 夏季炎热多雨, 多年平均气温为7.3~12.7 ℃, 年平均降雨量为563.9 mm(吕婷婷等, 2020).淀内主要由烧车淀、白洋淀、八大淀、石侯淀、金龙淀、藻苲淀等大小不等的143个淀泊和9400 hm2的芦苇台田组成.淀泊全年平均水深为2 m, 年水位波动在1.5 m左右, 淀区地形复杂, 在整个白洋淀内, 以芦苇植被等为主要景观特征的水陆交错区约占36%(Wang et al., 2019), 是研究草型湖泊磷循环的理想区域.
2.2 样品采集与样品分析 2.2.1 样点布设在淀区不同的位置选取发育较好的岸边带, 结合历史水文条件与环境因素等, 最终选择3个采样区域(S1、S2和S3), 其中, S1是未经人为干扰的芦苇台田沟壕区域, S2是15年前退耕还林的沟壕区域, S3是靠近村落的沟壕区域.每个区域均采集4个点, 分别为A、B、C、D, 其中, A点为水陆交错区沉积物, B点为水陆交错区界面土壤(浸湿), C点为水陆交错区边缘土壤(未浸湿), D点为水陆交错区中间土壤.采样区域及采样点分布如图 1所示.于2020年8月采集柱状沉积物3根, 柱状土壤9根.为了获得具有代表性的样品, 将每个区域所采集的A、B、C、D 4根柱子分别按照奇数层混合均匀, 如S1A、S2A和S3A, 按照1、3、5、7、9、11层的顺序, 将其混合成一个具有代表性的样品A, 所有样品混合完成后分别为A、B、C、D样品.
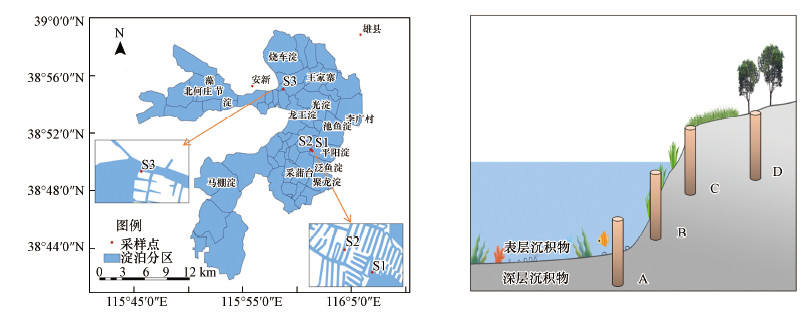 |
| 图 1 研究区域及采样点分布图 Fig. 1 Study area and locations of sampling sites |
利用彼得森重力采样器(Corer 60, Uwitec, Austria)采集沟壕柱状沉积物样品, 水陆交错区土壤使用柱状土壤采样器采集, 采样深度为15~30 cm.现场将样品采集后每2 cm分一层, 以隔氧保存法将样品装入可密封的聚乙烯塑料袋中并立即于4 ℃密封保存, 使用车载冰箱运回实验室.运回实验室后, 将样品冷冻并使用LGJ10冷冻干燥机冷干48 h, 研磨过100目筛后, 以四分法取沉积物与土壤样品密封低温保存待用.
2.2.3 样品分析沉积物及土壤样品分析指标包括pH、总有机质(Organic matter, OM)、总磷(Total Phosphorus, TP)、总碳(Total Carbon, TC)、总氮(Total Nitrogen, TN)、总硫(Total Sulfur, TS)和有机磷(Organic Phosphorus, OP).具体分析方法如下:pH测定:去CO2水与过20目筛的沉积物或土壤样品以水土比2.5∶1混合后, 利用pH计(FE28, 梅特勒)测定(Bai et al., 2009);TP和OP的测定:分别称取沉积物或土样品2份, 每份0.2 g, 一份样品置于马弗炉(SXL-1008, 上海精宏)中450 ℃灰化3 h, 待样品冷却至常温后使用3.5 mol·L-1的HCl提取16 h, 另一份直接使用1 mol·L-1的HCl提取16 h, 提取结束后使用离心机在2000 g的条件下离心15 min, 取上清液稀释后使用紫外分光光度计(UV2700i, 日本岛津)测得TP及无机磷(Inorganic Phosphorus, IP), 沉积物OP为TP和IP的差值(Ruban et al., 2001);OM通过烧失法表征:除去水分和其他杂物的样品置于马弗炉中550 ℃灼烧3 h以上, 灼烧前后的烧失量值即为总有机质的含量(Heiri et al., 2001);TC、TN和TS的测定:称取150~180 mg过200目筛沉积物或土壤样品, 利用CHNS元素分析仪(vario MACRO cube, 德国Elementar)分析其中的TC、TN和TS.
2.3 有机磷的提取与液相31P-NMR分析本研究中选择目前土壤/沉积物有机磷方面使用较多的浸提比例, m(土壤/沉积物)∶V(浸提液)=1 g∶10 mL, 浸提时间为16 h, 浸提液选择EDTA和NaOH的混合溶液.具体操作步骤如下:精确称取3.00 g过100目筛的土壤/沉积物样品于50 mL离心管中, 加入30 mL 0. 25 mol·L-1 NaOH和50 mmol·L-1 EDTA的混合溶液, 在室温下浸提16 h.使用冷冻离心机在4 ℃下离心30 min, 过滤后将提取液使用冷冻干燥机冷干至粉末.取冷冻干燥粉末300 mg于2 mm离心管中, 加入0.6 mL D2O和0.1 mL 10 mol·L-1 NaOH溶液使其重新溶解, 并在溶液中按2%(V∶V)加入BD溶液(0.11 mol·L-1 NaHCO3 + 0.11 mol·L-1 Na2S2O4)以减少提取液中顺磁性离子干扰(Fe3+、Mn2+等).将重新溶解的粉末在室温下超声振荡30 min后平衡5 min(观察是否混合均匀).将混合均匀的2 mm离心管在16873×g(RCF)条件下高速离心15 min后保留上清液并转移至5 mm核磁管, 用于北大核磁共振中心的31P-NMR分析.核磁共振仪选用瑞士BRUKER公司的BRUKER AV400, 采用BRUKER标准腔5 mm的BBO探头, 31P谱的脉冲P1=12.00 μs, 脉冲功率PL1=3.00 dB, 31P-NMR的共振频率为129.534 Hz, 循环延迟dl=5.0 s, 扫描4000次左右, 测定温度为20 ℃(Zhang et al., 2013; 张文强等, 2013).将所获图谱进行解析, 所有31P化学键位移均参照85%的正磷酸盐进行偏移, 根据参照文献中主要磷形态峰值的位移确定其组成, 分别为正磷酸盐(Ortho-P:6~7 ppm)、磷酸单酯(Mono-P:4~6 ppm)、磷脂(Lipids-P:1~3 ppm)、DNA磷(DNA-P:0 ppm)、焦磷酸盐(Pyro-P:-3.5~-4.5 ppm)、膦酸盐(Phon-P:18~20 ppm)和多聚磷酸盐(Poly-P:-19~-21 ppm)(Turner et al., 2005).最后对沉积物及土壤有机磷不同组分图谱进行积分, 根据不同组分所占比例及TP含量, 计算其中不同组分磷含量.
2.4 统计学分析使用SPSS 22.0(IBM, New York, NY, USA)对数据进行Pearson相关性分析和主成分分析(PCA), 判断沉积物及土壤生物质磷与其理化性质之间的关联;使用Origin9.0(Origin Lab, Northampton, MA, USA) 软件对数据进行绘图, 以获得沉积物及土壤生物质磷垂向含量特征;使用ArcGIS 10.4(ESRI, Redlands, CA, USA)绘制研究区域采样点分布图.
3 结果与讨论(Results and discussion) 3.1 水陆交错区土壤及沉积物基本理化特征水陆交错区土壤及沉积物基本理化性质见表 1.TP和OM等基本理化指标变化较大, 水陆交错区沉积物和土壤的TP含量为1342.81~2444.90 mg·kg-1, 平均值为1706.68 mg·kg-1, 远高于全国土壤平均含量500 mg·kg-1, 也高于该地区的背景值545 mg·kg-1(伦知颍等, 2015).TP含量最高值出现在水陆交错区中间土壤表层(0~2 cm), 为2444.90 mg·kg-1, 最低含量出现在水陆交错区中间土壤32~34 cm处.
| 表 1 水陆交错区土壤理化性质 Table 1 Physical and chemical properties of aquatic-terrestrial ecotone |
A、D区域TP最大值和平均值高于B、C区域, 这是因为B、C区域属于水陆交错带靠近水体的土壤, 受到水位波动的影响使土壤呈现出干湿交替的现象, 研究表明, 土壤的干湿循环能有效地促进土壤中水溶性磷的释放(Turner et al., 2001).沉积物和土壤的pH保持在8左右, 平均值为8.12, Jin等(2006)研究指出, 磷的释放速率在碱性条件下会增加.OM通过烧失量来反映, 沉积物和土壤OM含量分别为8.13%~13.89%和3.17%~7.58%, 且pH低的介质中OM含量较高, 沉积物OM含量远高于土壤.沉积物和水陆交错区中间土壤的OM含量呈现随深度增加而降低的趋势, 而在靠近水陆交错区界面及边缘土壤OM含量与深度并无关系, 可能是由于界面土壤受到水位波动的影响导致有机颗粒与水体植物死亡后残体向下堆积.全国表层沉积物TC和TN的平均值分别为2.22%和0.17%, A、D区域的TC和TN平均含量均高于全国平均值, 而B和C区域则与此相反, 同样表明水陆交错区界面及边缘土壤受水位波动的影响较大.碳磷元素比(C/P)通常是辨识土壤与沉积物中OM来源及其降解程度的重要指标之一(Meyers, 1994).C/P比值较高意味着磷的损失较大, 其中, OP会随着OM的降解而降解, C/P比值低意味着人类活动导致磷过量输入使沉积物磷大量累积.沉积物的C/P比值显著高于土壤C/P比值, 表明沉积物中磷损失较土壤高, 原因在于白洋淀属于浅水型湖泊, 来往船只使得表层沉积物因扰动而发生再悬浮.最新研究表明, 风浪及人为干扰所带来的扰动能够诱导浅水湖泊沉积物中碱性磷酸酶和磷的释放, 增强碱性磷酸酶的活性, 从而加快磷的生物地球化学循环过程(Zhang et al., 2015; Zhou et al., 2021).
3.2 液相31P-NMR分析土壤及沉积物生物质磷含量水陆交错区沉积物及土壤样品磷化合物含量和核磁共振图谱分别见图 2和图 3, 应用31P-NMR技术在NaOH-EDTA提取液中检测到7种磷化合物, 分别为Phon-P、Ortho-P、Mono-P、Lipids-P、DNA-P、Pyro-P、Poly-P, 其中, Biogenic-P由Mono-P、Lipids-P、DNA-P、Pyro-P、Poly-P和Phon-P组成.
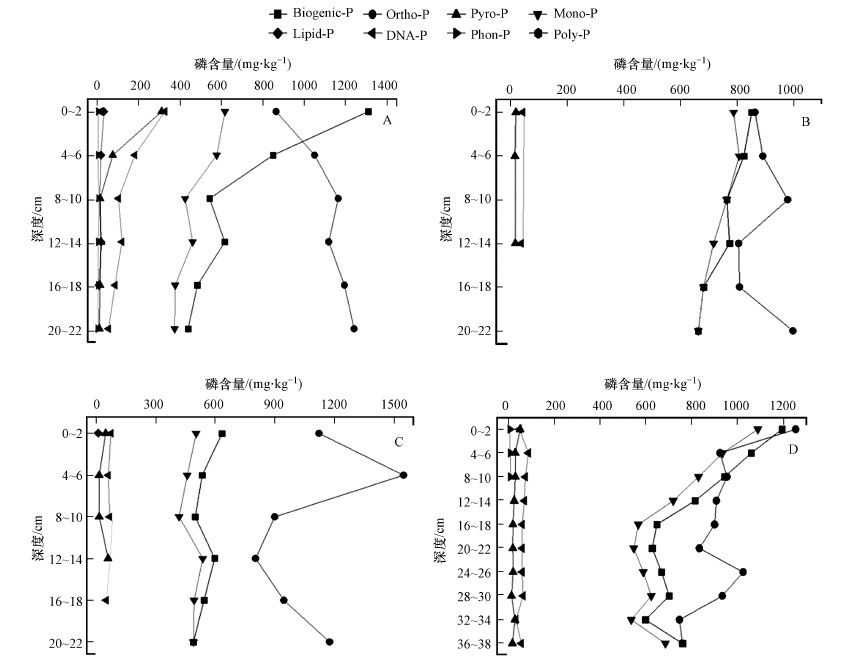 |
| 图 2 通过液相31P-NMR检测的NaOH-EDTA提取液中磷化合物的含量 (A.水陆交错区沉积物, B.水陆交错区界面土壤(浸湿), C.水陆交错区边缘土壤(未浸湿), D.水陆交错区中间土壤) Fig. 2 Concentrations of P compounds in NaOH-EDTA extracts determined by solution31P-NMR (A.sediment from aquatic-terrestrial ecotone, B.wet soil from aquatic-terrestrial ecotone, C.dry soil from aquatic-terrestrial ecotone, D.soil from the middle of aquatic-terrestrial ecotone) |
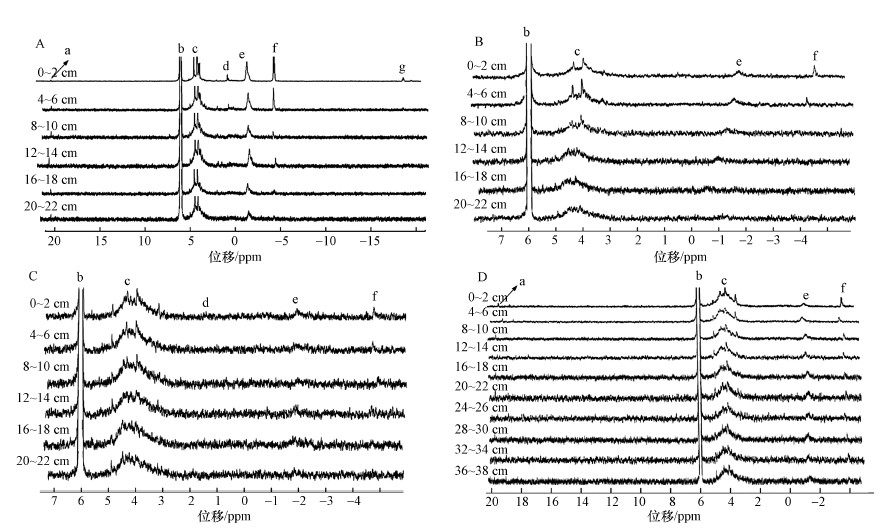 |
| 图 3 水陆交错区沉积物及土壤液相31P-NMR图谱 (a.膦酸盐, b.正磷酸盐, c.磷酸单酯, d.磷脂, e.DNA磷, f.焦磷酸盐, g.多聚磷酸盐;A:水陆交错区沉积物, B:水陆交错区界面土壤(浸湿), C:水陆交错区边缘土壤(未浸湿), D:水陆交错区中间土壤) Fig. 3 31P-NMR spectra of the sediments and soil in aquatic-terrestrial ecotone (a.Phon-P, b.Ortho-P, c.Mono-P, d.Lipids-P, e.DNA-P, f.Pyro-P, g.Poly-P; A: sediment from aquatic-terrestrial ecotone, B: wet soil from aquatic-terrestrial ecotone, C: dry soil from aquatic-terrestrial ecotone, D: soil from the middle of aquatic-terrestrial ecotone) |
Biogenic-P是TP的重要组成部分, 含量为437.65~1309.20 mg·kg-1, 占TP含量的25.62%~60.26%, 而Mono-P是Biogenic-P的主要组成成分, 含量为372.94~1086.96 mg·kg-1, 占TP含量的22.04%~47.13%.Mono-P是一大类有机磷化合物, 通常由肌醇磷酸、单核苷酸和部分核糖核酸的降解产物等组成(Reitzel et al., 2007).如图 2所示, 4个区域的Mono-P含量随着深度的增加而降低, 原因在于表层处于好氧状态, 深度增加后, 好氧逐渐变为厌氧, 在厌氧条件下, Mono-P在微生物的作用下矿化成Ortho-P(Suzumura et al., 1993; Golterman, 1997).D区域Ortho-P含量随着深度的增加显著下降, 而其他3个区域的Ortho-P含量则表现出相反的趋势, 可能是因为风浪扰动造成水位波动, 致使B、C区域土壤呈现干湿交替状态.有研究表明, 风浪等扰动会诱导沉积物中碱性磷酸酶的释放并提高其活性, 从而加速OP矿化为Ortho-P(Cardoso et al., 2009; Chao et al., 2017; Zhou et al., 2021).值得注意的是, 在A区域Mono-P和Ortho-P含量随深度的增加呈现明显反比关系, 可能是A区域受风浪扰动和微生物群落的影响使得Mono-P加速矿化为Ortho-P.
DNA-P是Biogenic-P的另外一种主要组成成分, 通常来源于细菌等微生物分解和水生植物的腐解.A区域的DNA-P含量均值是其余区域的2倍左右, 其表层0~2 cm处的DNA-P含量更是高达324.98 mg·kg-1, 随深度的增加含量逐渐降至与其余区域DNA-P含量的平均值相近.分析出现此结果的原因可能是由于A区域水生植物或藻类生长茂盛, 大量水生植物腐解后使得DNA-P累积.进一步研究发现, DNA-P含量可以指示沉积物微生物的丰度(Watts et al., 2002).Paraskova等(2014)研究表明, 对于沉积物而言, 随着深度的增加, DNA-P和Lipids-P的转化速率慢于磷含量降低的速率, 表明DNA-P可能是湖泊等沉积物磷的主要内源.Lipids-P仅在少数样品中检测出, 占TP含量的0.43%~1.42%, 可能与其含量较少且在浸提过程中发生分解有关.Watts等(2002)在研究Lipids-P时发现, 沉积物中的Lipids-P与微生物群落的变化趋势一致, 与水体溶解态磷的变化相反, 这表明Lipids-P可视作短期性水生态系统及水环境健康的指示物.
Pyro-P是Biogenic-P中活性较强的一种有机磷化合物, 可以直接被水生植物利用, 化学性质不稳定, 半衰期仅为2.0~6.0年(Reitzel et al., 2007).4个区域的Pyro-P含量均随着深度的增加而降低, 其中, A区域的Pyro-P含量在表层(0~2 cm)处高达309.50 mg·kg-1, 在底层降至8.56 mg·kg-1, 且从图 2可以看出, A区域的Pyro-P在0~2 cm至2~4 cm处变化速率显著高于其余区域.Poly-P也是一种活性极高的有机磷化合物, 会以极快的速度矿化, 在4个区域中, 仅有A区域0~2 cm处检测到了Poly-P, 含量为24.76 mg·kg-1, 占总磷的1.14%, 其他样点均未检测出Poly-P, 这可能是由于其他区域的Poly-P含量较低或者在提取过程中Poly-P发生水解.Phon-P被视为原生动物的代谢产物, 其碳原子和磷原子直接相连, 化学性质稳定, 不易参与到磷在水体及沉积物中的循环, 但在环境中通常含量较低.Kittredge等(1969)在土壤、海底底泥及富营养化的湖泊中检测出了少量的Phon-P.本次研究中, 仅在A和D区域检测到Phon-P, 且含量较低, 仅占TP含量的0.14%~0.43%.
3.3 水陆交错区生物质磷形态特征及其影响因素水陆交错区是陆地和水生生态系统的过渡区域, 也是河流和湖泊生态系统的重要组成部分.当外源性磷得到有效控制后, 内源性磷就成为潜在的风险源, 而水陆交错区所处的特殊位置可导致磷的积累, 在地表径流的驱动下, 对水体造成污染.水陆交错区土壤/沉积物理化性质与生物质磷形态之间的相关性研究是揭示其土壤/沉积物磷释放的关键之一.
对水陆交错区生物质磷的形态特征及其与该区域的理化特性进行研究, 结果表明(表 2), TP与Biogenic-P相关性显著(r=0.688, p < 0.01), 且Biogenic-P占TP的比例在A区域表层(0~2 cm)高达60.26%, 表明Biogenic-P可能成为磷主要来源的另一种形态.Biogenic-P与DNA-P(r=0.544, p < 0.01)和Pyro-P(r=0.632, p < 0.01)显著正相关.DNA-P是Biogenic-P的主要组成成分之一, A区域的DNA-P含量均值是其余区域的2倍左右, 且随深度的增加而降低.相关研究表明, 对于沉积物而言, 随着深度的增加, DNA-P的转化速率慢于磷含量降低的速率, 表明DNA-P可能会成为沉积物磷的主要内源之一;Pyro-P占TP含量的0.51%~14.25%, 可由藻类和微生物在氧化条件下合成, 半衰期仅为2.0~6.0年, 通常被认为是磷化合物中最不稳定的物质.Lipids-P与Biogenic-P呈显著正相关(r=0.970, p < 0.01), 被视为有机质转化的生物标记物(Meyers et al., 1993).DNA-P、Pyro-P和Lipids-P是Biogenic-P中活性较强的磷化合物, 均与Biogenic-P呈现显著正相关(p < 0.01), 表明当外源性磷得到有效控制时, Biogenic-P的矿化将可能会对水体富营养化产生影响.
| 表 2 不同形态磷含量与理化因子间的相关性 Table 2 Pearson correlation results between various phosphorus fractions and physical and chemical properties of the sediments and soils |
通常认为C/P是辨识土壤与沉积物中OM来源及其降解程度的重要指标之一(Meyers, 1994).本研究中C/P较一般沉积物高, 较高的C/P意味着磷的损失, DNA-P(r=0.748, p < 0.01)和Pyro-P(r=0.514, p < 0.05)与C/P表现出显著的正相关关系, 而Mono-P与C/P的相关性则与此相反, 当较为稳定的Mono-P含量增加时, 活性较强的DNA-P和Pyro-P含量减少, 表明DNA-P和Pyro-P是有机磷损失的主要来源.OM与DNA-P(r=0.799, p < 0.01)和Pyro-P(r=0.0.652, p < 0.01)显著正相关, OM含量的增加会使得易分解的DNA-P和Pyro-P含量增加.
如图 2所示, A、B、C区域Mono-P在总体趋势上随深度的增加呈衰减的趋势, 而Ortho-P则与此趋势相反, 原因在于厌氧情况下, Mono-P发生转化释放出Ortho-P(Suzumura et al., 1993).Ortho-P被认为是可溶解性TP中最易被生物利用的磷化合物, D区域Mono-P与Ortho-P的含量随深度的增加其趋势表现出一致性, 与A、B、C区域显著不同, 可能是因为水陆交错区中间土壤微生物活性低于其他区域和受水位波动的影响较小, 使得OP矿化速率低于其他区域.TC(r=0.500, p < 0.01)、TN(r=0.591, p < 0.01)与TP相关性显著, 说明水陆交错区土壤/沉积物磷的生物地球化学循环与有机物有着密切联系, 同时也证明土壤/沉积物中的TC、TN与TP具有一定程度的同源性(Bai et al., 2009).
对Biogenic-P的形态特征及其理化特性进行主成分分析, 图 4结果显示, 各因子之间具有较强的相关性, 通过主成分分析计算全部信息可由3个主成分反映95.46%, 即对这3个主成分进行分析已经能够反映全部数据的大部分信息.Pyro-P、DNA-P、TC、TN、OM和C/P为主成分1, 占50.28%, 且各个因子之间相互呈显著正相关.Pyro-P和DNA-P活性较强, 且与OM呈显著正相关, OM含量增加会使得Pyro-P和DNA-P含量增加.白洋淀属于浅水型湖泊, 沉积物表层极易被扰动, 扰动会影响Pyro-P和DNA-P的转化速率, 使其矿化为Ortho-P从而被水生生物利用(Zhang et al., 2015).Biogenic-P、TP、OP、Phon-P和Mono-P为主成分2, 占35.76%.Phon-P和Mono-P稳定性较强不易被生物所利用, 本次研究中在仅在A和D区域检测到Phon-P.Biogenic-P占TP含量的25.62%~60.26%, 表明Biogenic-P可能成为TP来源的另外一种磷形态.Ortho-P、C/N和pH为主成分3, 占9.42%.pH通过影响酶的活性、金属离子的吸附顺序等从而影响Biogenic-P矿化为Ortho-P(Groot et al., 1993).
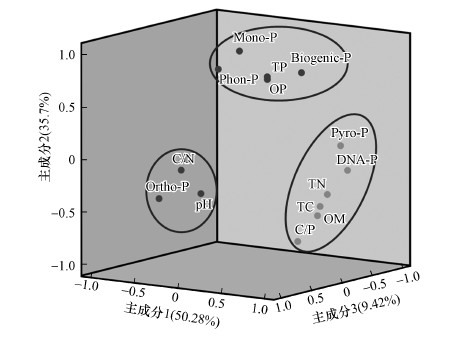 |
| 图 4 水陆交错区沉积物与土壤主成分分析图 Fig. 4 Principal component analysis of the sediments and soil in aquatic-terrestrial ecotone |
沟壕系统水陆交错区, 沉积物A区域的OM含量显著高于其它区域, 原因在于水底区域水生植物和藻类生长茂盛, 大量植物和藻类死亡腐解后, 会导致OM大量积累.图 5表明不同区域的Biogenic-P与OM呈现反比关系, B到A区域, OM含量升高, Biogenic-P含量降低.B区域属于水陆交错区界面土壤, 岸边悬浮颗粒物及界面土壤的植物死亡后腐解会受到水位波动的影响, 从而向A区域累积.此外, 沟壕系统相较于航道或开阔水面, 表层沉积物受到的扰动会更小, 使得OM更加容易累积.B到A区域, Biogenic-P与Mono-P含量降低, 且Mono-P是Biogenic-P的主要成分, 在厌氧条件下会矿化为Ortho-P, 造成Biogenic-P下降.B到C区域, 水陆交错区土壤呈现干湿交替现象, 使得Biogenic-P发生分解, OM含量升高可能是因为C区域边缘土壤植物死亡后腐解累积造成.B区域OP含量最低, 可能是B区域受到频繁的风浪扰动诱导表层沉积物OP发生矿化(Cardoso et al., 2009; Jian et al., 2017).如图 5所示, OM与OP含量从A到D区域变化趋势一致, 且OM与OP呈显著正相关(r=0.566, p < 0.01).Bai等(2009)研究发现, 大量OP会吸附在OM表面, OP会伴随着OM的降解而发生降解.A区域到D区域OP含量变化趋势与IP含量变化趋势相反, 表明水陆交错区土壤/沉积物OP发生矿化分解时会增加IP含量, 进而影响上覆水水质.进一步研究发现, 土壤/沉积物Biogenic-P会被酶水解为Ortho-P, 而酶活性与OM含量有关(Muhammad et al., 2008; Zhang et al., 2014a).Zhang等(2014a)的实验研究表明, 碱性磷酸酶活性始终与OM含量显著相关(p < 0.05), 且OM通过pH、TN等间接影响酶活性.Muhammad等(2008)的研究指出, OM在磷酸酶合成过程中扮演着一个“前体”的角色, 在酶的稳定性方面起着关键作用.因此, 可推测水陆交错区水位变化频繁, 理化指标变化与微生物释放酶活性的不同会共同作用于Biogenic-P, 这些作用将协同加速Biogenic-P的矿化, 从而使沟壕系统水陆交错带将成为上覆水中活性反应磷的来源释放热区.
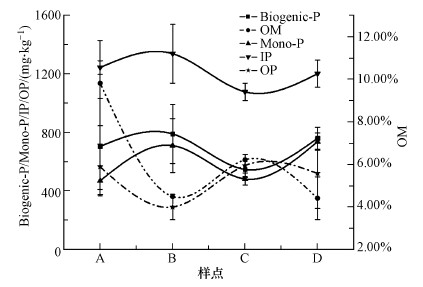 |
| 图 5 水陆交错区不同区域Biogenic-P、Mono-P、OP、IP、OM含量(均值)对比图 (A:水陆交错区沉积物;B:水陆交错区界面土壤(浸湿);C:水陆交错区边缘土壤(未浸湿);D:水陆交错区中间土壤) Fig. 5 Comparison of Biogenic-P, Mono-P, OP, IP and OM average concentrations in different areas of aquatic-terrestrial ecotone (A: sediment from aquatic-terrestrial ecotone; B: wet soil from aquatic-terrestrial ecotone; C: dry soil from aquatic-terrestrial ecotone; D: soil from the middle of aquatic-terrestrial ecotone) |
1) 白洋淀水陆交错区沉积物土壤偏碱性, TP含量与OM含量较一般土壤高, 其中, 水陆交错区中间土壤界面TP含量最高为1342.81~2444.90 mg·kg-1.水陆交错区TP平均值为1706.68 mg·kg-1, 高于全国土壤磷平均含量的3.41倍, 水陆交错区沉积物的OM含量显著高于其他区域.
2) 基于31P-NMR分析技术, 在A、B、C、D这4个区域中检测到的生物质磷包括磷酸单酯(Mono-P, 22.04%~47.13%)、DNA磷(DNA-P, 1.97%~14.96%)、膦酸盐(Phon-P, 0.14%~0.43%)、磷脂(Lipids-P, 0.43%~1.42%)、焦磷酸盐(Pyro-P, 0.51%~14.25%)、多聚磷酸盐(Poly-P, 1.14%), 其中, Mono-P是生物质磷的主要成分.
3) TP与Biogenic-P相关性显著, 且Biogenic-P占TP的比例在A区域表层0~2 cm处高达60.26%, 表明Biogenic-P可能成为磷主要来源的另一种磷形态.
4) 白洋淀沟壕系统水陆交错区, OM是影响Biogenic-P含量变化的主要因素, 不同区域OM变化趋势与Biogenic-P含量变化趋势相反.水陆交错区OM含量的差异性会影响土壤/沉积物中酶的活性, 而风浪扰动等环境因素的变化会加速Biogenic-P的矿化.因此, 推测水陆交错区理化特性的变化与微生物酶活性的变化将协同作用于Biogenic-P的矿化, 从使得沟壕系统水陆交错区成为上覆水活性反应磷的释放热区.
Ahlgren J, Reitzel K, Tranvik L, et al. 2006. Degradation of organic phosphorus compounds in anoxic Baltic Sea sediments: A 31P nuclear magnetic resonance study[J]. Limnology and Oceanography, 51: 2341-2348. DOI:10.4319/lo.2006.51.5.2341 |
Ahlgren J, Tranvik L, Gogoll A, et al. 2005. Sediment depth attenuation of biogenic phosphorus compounds measured by 31P NMR[J]. Environmental Science & Technology, 39: 867. |
Bai X, Ding S, Fan C, et al. 2009. Organic phosphorus species in surface sediments of a large, shallow, eutrophic lake, Lake Taihu, China[J]. Environmental Pollution, 157: 2507-2513. DOI:10.1016/j.envpol.2009.03.018 |
Cardoso L D S, Marques D D M. 2009. Hydrodynamics-driven plankton community in a shallow lake[J]. Aquatic Ecology, 43: 73-84. DOI:10.1007/s10452-007-9151-x |
Chao J Y, Zhang Y M, Kong M, et al. 2017. Long-term moderate wind induced sediment resuspension meeting phosphorus demand of phytoplankton in the large shallow eutrophic Lake Taihu[J]. Plos One, 12: e0173477. DOI:10.1371/journal.pone.0173477 |
Golterman H, Paing J, Serrano L, et al. 1997. Presence of and phosphate release from polyphosphates or phytate phosphate in lake sediments[J]. Hydrobiologia, 364: 99-104. DOI:10.1023/A:1003212908511 |
Groot C J D, Golterman H L. 1993. On the presence of organic phosphate in some Camargue sediments: Evidence for the importance of phytate[J]. Hydrobiologia, 252: 117-126. DOI:10.1007/BF00000133 |
Heiri O, Lotter A F, Lemcke G. 2001. Loss on ignition as a method for estimating organic and carbonate content in sediments: reproducibility and comparability of results[J]. Journal of Paleolimnology, 25: 101-110. DOI:10.1023/A:1008119611481 |
Ji Z, Zhang Y, Zhang H, et al. 2019. Fraction spatial distributions and ecological risk assessment of heavy metals in the sediments of Baiyangdian Lake[J]. Ecotoxicology and Environmental Safety, 174: 417-428. DOI:10.1016/j.ecoenv.2019.02.062 |
Jin X, Wang S, Pang Y, et al. 2006. Phosphorus fractions and the effect of pH on the phosphorus release of the sediments from different trophic areas in Taihu Lake, China[J]. Environmental Pollution, 139(2): 288-295. DOI:10.1016/j.envpol.2005.05.010 |
Jin X, Wang S, Pang Y, et al. 2006. Phosphorus fractions and the effect of pH on the phosphorus release of the sediments from different trophic areas in Taihu Lake, China[J]. Environmental Pollution, 139: 288-295. DOI:10.1016/j.envpol.2005.05.010 |
Kittredge J S, Roberts E. 1969. A carbon-phosphorus bond in nature[J]. Science, 164: 37-42. DOI:10.1126/science.164.3875.37 |
Lane C R, Autrey B C. 2016. Phosphorus retention of forested and emergent marsh depressional wetlands in differing land uses in Florida, USA[J]. Wetlands Ecology & Management, 24: 45-60. DOI:10.1007/s11273-015-9450-2 |
李月丛, 王洪根, 张翠莲, 等. 2000. 白洋淀地区古环境变迁与史前文化[J]. 同济大学学报(社会科学版), (4): 22-27, 33. |
伦知颍, 程志中, 严光生, 等. 2015. 中国不同景观区水系沉积物中39种元素的背景值[J]. 地学前缘, 22: 226-230. |
吕婷婷, 李林森, 朱世峰, 等. 2020. 近30a来白洋淀土地利用变化规律及驱动力分析[J]. 水利水电技术, 51(3): 37-44. |
Meyers P A. 1994. Preservation of elemental and isotopic source identification of sedimentary organic matter[J]. Chemical Geology, 114: 289-302. DOI:10.1016/0009-2541(94)90059-0 |
Meyers P A, Ishiwatari R. 1993. Lacustrine organic geochemistry-an overview of indicators of organic matter sources and diagenesis in lake sediments[J]. Organic Geochemistry, 20: 867-900. DOI:10.1016/0146-6380(93)90100-P |
Muhammad S, Mueller T, Joergensen R G. 2008. Relationships between soil biological and other soil properties in saline and alkaline arable soils from the Pakistani Punjab[J]. Journal of Arid Environments, 72: 448-457. DOI:10.1016/j.jaridenv.2007.06.016 |
Neilson J W, Califf K, Cardona C, et al. 2017. Significant impacts of increasing aridity on the arid soil microbiome[J]. mSystems, 2(3): e00195-00116. |
Paraskova J V, Sjöberg P J, Rydin E. 2014. Turnover of DNA-P and phospholipid-P in lake sediments[J]. Biogeochemistry, 119: 361-370. DOI:10.1007/s10533-014-9972-3 |
Reitzel K, Ahlgren J, Debrabandere H, et al. 2007. Degradation rates of organic phosphorus in lake sediment[J]. Biogeochemistry, 82: 15-28. DOI:10.1007/s10533-006-9049-z |
Ruban V, Lopezsanchez J F, Pardo P, et al. 2001. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments-A synthesis of recent works[J]. Fresenius Journal of Analytical Chemistry, 370: 224-228. DOI:10.1007/s002160100753 |
Salas A M, Elliott E T, Westfall D G, et al. 2003. The role of particulate organic matter in phosphorus cycling[J]. Soil Science Society of America Journal, 67: 181-189. DOI:10.2136/sssaj2003.1810a |
Surridge B W J, Heathwaite A L, Baird A J. 2012. Phosphorus mobilisation and transport within a long-restored floodplain wetland[J]. Ecological Engineering, 44: 348-359. DOI:10.1016/j.ecoleng.2012.02.009 |
Suzumura M, Kamatani A. 1993. Isolation and determination of inositol hexaphosphate in sediments from Tokyo Bay[J]. Geochimica et Cosmochimica Acta, 57: 2197-2202. DOI:10.1016/0016-7037(93)90561-A |
Tate K R, Newman R H. 1982. Phosphorus fractions of a climosequence of soils in New Zealand tussock grassland[J]. Soil Biology and Biochemistry, 14: 191-196. DOI:10.1016/0038-0717(82)90022-0 |
Trasar-Cepeda M C, Gil-Sotres F, Zech W, et al. 1989. Chemical and spectral analysis of organic P forms in acid high organic matter soils in Galicia (N.W.Spain)[J]. science of the Total Environment, 81: 429-436. |
Turner B L, Haygarth P M. 2001. Phosphorus solubilization in rewetted soils[J]. Nature, 411: 258-258. |
Turner B L, Cade-Menun B J, Condron L M, et al. 2005. Extraction of soil organic phosphorus[J]. Talanta, 66: 294-306. DOI:10.1016/j.talanta.2004.11.012 |
Wang S, Wang W, Zhao S, et al. 2019. Anammox and denitrification separately dominate microbial N-loss in water saturated and unsaturated soils horizons of riparian zones[J]. Water Research, 162: 139-150. DOI:10.1016/j.watres.2019.06.052 |
Watts E, Dean P, Martin R. 2002. 31P nuclear magnetic resonance study of sediment microbial phospholipids[J]. Canadian Journal of Analytical Sciences and Spectroscopy, 47: 127-133. |
王会昌. 1983. 一万年来白洋淀的扩张与收缩[J]. .地理研究, (3): 8-18. |
Zhang W Q, Shan B Q, Zhang H, et al. 2015. Characteristics of phosphorus compounds and their effects in sediments of an eutrophic Chaohu Lake, China[J]. CLEAN- Soil, Air, Water, 43: 544-550. DOI:10.1002/clen.201300254 |
Zhang W Q, Shan B Q, Zhang H, et al. 2013. Assessment of preparation methods for organic phosphorus analysis in phosphorus-polluted Fe/Al-Rich Haihe River sediments using solution 31P-NMR[J]. Plos One, 8: e76525. DOI:10.1371/journal.pone.0076525 |
Zhang M, Chen F, Chen S, et al. 2016. Effects of the seasonal flooding on riparian soil seed bank in the Three Gorges Reservoir Region: a case study in Shanmu River[J]. Springerplus, 5: 492. DOI:10.1186/s40064-016-2121-9 |
Zhang T B, Kang Y, Liu S H, et al. 2014a. Alkaline phosphatase activity and its relationship to soil properties in a saline-sodic soil reclaimed by cropping wolfberry (Lycium barbarum L.) with drip irrigation[J]. Paddy and Water Environment, 12: 309-317. DOI:10.1007/s10333-013-0384-0 |
Zhang W, Shan B, Zhang H, et al. 2014b. Phosphorus-31 nuclear magnetic resonance assignments of biogenic phosphorus compounds in sediment of an artificial Fuyangxin River, China[J]. Environmental Science Pollution Research, 21: 3803-3812. DOI:10.1007/s11356-013-2322-5 |
Zhou J, Han X, Qin B, et al. 2021. Responses of alkaline phosphatase activity to wind-driven waves in a large, shallow lake: Implications for phosphorus availability and algal blooms[J]. Journal of Environmental Sciences, 99: 143-150. DOI:10.1016/j.jes.2020.06.022 |
张文强, 单保庆. 2013. 基于液相31P核磁共振(NMR)技术的巢湖沉积物中有机磷形态研究[J]. 环境科学学报, 33(7): 1967-1973. |
 2021, Vol. 41
2021, Vol. 41


