2. 中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008;
3. 安徽省农业科学院土壤肥料研究所, 安徽养分循环与资源环境省级实验室, 合肥 230031;
4. 安徽师范大学化学与材料科学学院, 分子基材料安徽省重点实验室, 芜湖 241003
2. State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Science, Nanjing 210008;
3. Anhui Provincial Key Laboratory of Nutrient Recycling, Resources and Environment, Soil and Fertilizer Research Institute, Anhui Academy of Agricultural Sciences, Hefei 230031;
4. Anhui Laboratory of Molecule-Based Materials, School of Chemistry and Materials Science, Anhui Normal University, Wuhu 241003
磷(P)是水生植物重要的营养元素, 同样也是水体富营养化的主要限制性因子(Liu et al., 2020).在外源性磷输入被阻断的情况下, 沉积物的内源释放是湖泊磷的主要来源(Li et al., 2020).如何减少沉积物中的磷并抑制其向上覆水释放, 是富营养化湖泊生态修复过程中面临的难题之一.影响沉积物磷释放的主要因素有温度、pH、溶解氧(DO)、氧化还原电位(Eh)、硝态氮、硫酸盐、微生物活性及水文条件等(Jin et al., 2006; Cheng et al., 2020).此外, 沉积物中磷的赋存形态也会对磷释放产生影响(Jiao et al., 2018).因此, 在评估内源性磷负荷时, 不仅要考虑沉积物中的总磷(TP), 还要分析磷的不同形态组分.
沉水植物作为湖泊生态系统的重要组成之一, 占据着湖泊生态系统的关键界面, 对湖泊(特别是浅水湖泊)生态系统的生产力、物质循环和能量流动起着重要的调控作用(Wang et al., 2018).当前关于沉水植物对沉积物磷循环影响的文献有很多, 例如, 探究沉水植物降低沉积物氮、磷营养盐浓度的综合效应(Lin et al., 2020), 对沉积物中磷赋存形态(吴强亮, 2014)及“水-沉积物”之间迁移转化的影响(王立志等, 2012), 以及沉水植物在衰亡期对磷的释放和再分配的影响(陈默等, 2020)等, 这些研究为富营养化湖泊生态修复提供了很好的理论指导.
在实际的水体修复过程中, 沉水植物品种的选择直接关系到修复效率.具有不同形态特征的沉水植物可以从上覆水、间隙水或沉积物中汲取磷(Rattray et al., 1991; Zhang et al., 2015).如黑藻(Hydrilla verticillata R.)和金鱼藻(Ceratophyllum demersum L.)无固定根, 主要从上覆水中吸收磷(Wang et al., 2008b), 而菹草(Potamogeton crispus L.)根系较发达, 可同时利用上覆水和沉积物中的磷(Cao et al., 2018).此外, 沉水植物的根系分泌物、光合作用和呼吸作用可以影响沉积物和水体中DO、Eh和pH等环境因子, 进而影响磷在“沉积物-水-沉水植物”系统中的迁移转化(Peng et al., 2007; Wang et al., 2018).因此, 不同根系特征的沉水植物对沉积物磷(特别是垂直剖面上不同形态的磷)的影响应该有所差异, 但目前相关研究还相对较少, 尤其是针对具有富磷特征的巢湖沉积物中各形态磷垂直空间分布的相关研究比较有限.
探明不同根系特征沉水植物对沉积物磷的影响特征, 有助于在富营养化湖泊生态修复过程中选择合适的生物材料、预估修复效果及制定合理的修复策略.鉴于此, 本文选取根系差异明显的狐尾藻和金鱼藻, 以巢湖富磷沉积物为底泥, 建立“沉积物-水-沉水植物”微宇宙实验, 研究两种沉水植物对沉积物垂直剖面上各形态磷的影响, 以期为同类富营养化湖泊生态修复提供参考.
2 材料与方法(Materials and methods) 2.1 试验材料巢湖为中国典型的富营养化浅水湖泊, 呈富磷地质背景, 沉积物中TP、无机磷(IP)和有机磷(OP)含量分别为493.34~1071.84、330.97~866.54和162.37~205.3 mg·kg-1(Zan et al., 2011).本研究采用彼得森采泥器(Peterson sampler, 面积为0.0625 m2)采集巢湖东部湖区(31°33′49.29″ N, 117°43′36.46″ E)表层10 cm的沉积物, 并同时采集原位湖水.按照沉水植物根系特点的不同, 从宿迁市苏北环保水体生态修复基地购买根系发达的狐尾藻(Myriophyllum spicatum L.)和无固定根的金鱼藻(Ceratophyllum demersum L.)作为试验材料.
2.2 试验方法实验时间为2019年5—8月.实验室阳光房距离采样点约65 km, 实验过程中不额外提供光照, 以保证模拟实验中光照强度和时间尽量接近真实情况.培养管中水温控制在15~25 ℃, 各管间水温差异小于2 ℃.在去除动植物残体及其它粗粒杂质后, 充分混匀沉积物, 以确保不同剖面各种形态磷的分布一致.依据采样处沉积物高度与上覆水深之比设置本实验的泥水比值.倒入经过5%的HCl溶液清洗过的透明圆形管(顶直径×底直径×高=15 cm×15 cm×85 cm), 沉积物平均厚度为15 cm.将采集的湖水缓慢注入管内, 沉积物和湖水总高度为80 cm.为模拟真实情形, 管下部放入黑箱以避免阳光照射.所有沉水植物都经过驯化培养后, 用蒸馏水冲洗干净, 以避免附着生物的影响, 并选择性状(鲜重、株高、根长等)均一的幼苗种植于试验管中.
本研究共设狐尾藻(每个试验管种植4株, 共6 g鲜重)、金鱼藻(每个试验管种植6株, 共6 g鲜重)、空白对照(即无沉水植物)3个处理, 每个处理设置5个重复.实验期间定期在上覆水中添加去离子水, 补充蒸发消耗的水, 维持水位恒定.
2.3 样品采集及分析于实验培养的第0 d和90 d采集样品.使用虹吸管分别抽取10~30、30~50和50~70 cm处的上覆水, 混匀, 经连续流动分析仪(Technician Auto Analyzer II, Skalar′s Headquarters, Netherlands)检测其TP含量, 并检测上覆水pH(上海雷磁pHSJ-3F)和DO(上海雷磁JPB-607A).沉积物各形态磷的测定方法:将上覆水抽干, 小心地将植物移除, 置于实验室低温冷冻冰箱内冷冻24 h, 冷冻后沉积物高12 cm, 按每层2 cm分层切割, 风干磨碎后过100目筛, 充分混匀, 使用SMT(Standards Measurements and Testing)法分析沉积物中各形态磷(Loh et al., 2020).上覆水和沉积物起始物化性质如表 1所示.
| 表 1 试验初始状态上覆水和沉积物物化指标 Table 1 Physicochemical characteristics of the overlying water and sediment in the initial state |
实验所得数据采用SPSS 19.0统计软件分析, 利用one-way ANOVA法分析不同处理间的差异显著性.各形态磷的去除率R计算公式如式(1)所示.
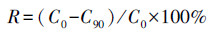
|
(1) |
式中, C0和C90分别为第0 d和90 d时各形态磷的浓度.
3 结果(Results) 3.1 实验结束时两种沉水植物的主要性状及富集磷量试验第90 d时, 狐尾藻已生长出发达根系(表 2).尽管试验起始阶段两种沉水植物的鲜重相同, 但试验结束时狐尾藻的总干重和磷的富集量均显著高于金鱼藻, 分别为后者的1.44倍和1.31倍.
| 表 2 试验第90 d沉水植物主要性状及磷富集量 Table 2 Submerged macrophytes′ main characters and accumulating amount of P on the 90th day of the experiment |
与实验初始值相比, 实验第90 d对照组沉积物不同剖面的各形态磷含量出现不同幅度的下降(图 1).两种沉水植物处理下的各形态磷在大部分剖面中低于试验初始值和对照组.狐尾藻和金鱼藻对沉积物磷的影响特征则有所不同, 在大部分深度中, 狐尾藻对TP、IP和NaOH提取磷(NaOH-P)的减少幅度明显高于金鱼藻处理(图 1a、1b和1d); 狐尾藻处理下TP、IP、OP、NaOH-P和HCl提取磷(HCl-P)含量随着深度增加整体呈先下降后上升趋势, 并均在6 cm深度处出现最低值, 此处含量与实验初始值相比分别降低102.95、79.56、14.2、48.18和9.1 mg·kg-1, 而金鱼藻处理下的沉积物未呈现此特征.
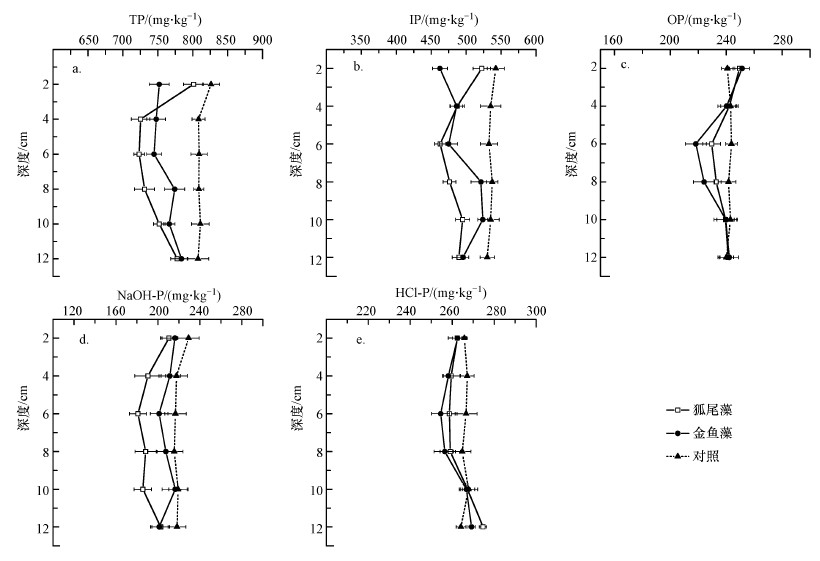 |
| 图 1 不同处理下沉积物剖面各种形态磷的变化(均值±标准误, n=5) Fig. 1 P fractions and their vertical distribution in sediments under different treatments (Mean± SE, n=5) |
为进一步整体评价两种沉水植物对沉积物磷总的去除效果, 分别对3种处理下各形态磷的差异进行显著性分析(表 3).结果表明, 与对照相比, 两种沉水植物均能显著减低沉积物中TP、IP和NaOH-P的含量, 其中, 狐尾藻对这3种形态磷的去除率分别为9.0%、9.8%和15.7%, 而金鱼藻处理下的去除率分别为7.8%、8.8%和8.7%.狐尾藻对NaOH-P的去除效果显著优于金鱼藻, 两种沉水植物对OP和HCl-P的影响不显著.
| 表 3 试验第90 d不同处理下沉积物各形态磷的平均含量 Table 3 Average concentrations of various P fractions in the sediment on the 90th day of the experiment |
为探究两种沉水植物作用下各形态磷间的关系, 分别对TP、IP、OP、NaOH-P和HCl-P在沉积物垂直分布上的含量变化进行了Pearson相关分析.结果表明, 狐尾藻处理下沉积物中TP与IP和NaOH-P呈显著正相关, 与OP和HCl-P相关性不显著(表 4).沉积物中IP和OP构成TP, 说明IP的变化是导致沉积物TP含量空间差异的主要原因.沉积物中IP与NaOH-P呈显著正相关, 与HCl-P相关性不显著.金鱼藻处理下不同形态P间的相关性不显著(表 5).
| 表 4 狐尾藻处理下沉积物各形态磷之间相关关系矩阵 Table 4 Matrix of correlation coefficients among various P fractions in the sediment profiles under the Myriophyllum spicatum L.treatment |
| 表 5 金鱼藻处理下沉积物各形态磷之间相关关系矩阵 Table 5 Matrix of correlation coefficients among various P fractions in the sediment profiles under the Ceratophyllum demersum L.treatment |
与初始值相比, 实验第90 d时3种处理下(对照、狐尾藻和金鱼藻)的上覆水pH值没有显著变化, 且3种处理间的pH也没有差异(图 2a).狐尾藻处理下上覆水DO从7.52 mg·L-1上升至9.13 mg·L-1, 金鱼藻处理下上覆水DO增加到9.24 mg·L-1(图 2b).狐尾藻和金鱼藻处理下, 上覆水TP没有显著变化, 但对照组中出现了明显的沉积物磷向上覆水释放的现象, TP增加了0.076 mg·L-1(图 2c).
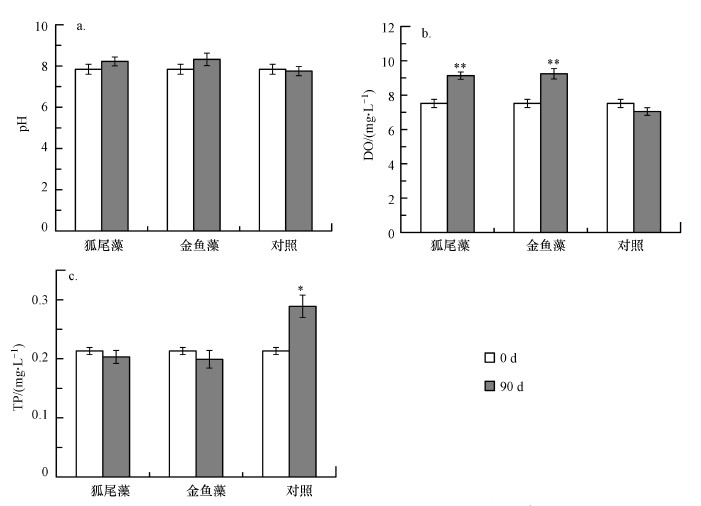 |
| 图 2 试验前后上覆水pH、DO、TP的变化 (均值±标准误, n=5, *和**分别代表差异显著水平p < 0.05和p < 0.01) Fig. 2 Changes of pH, DO, and TP in the overlying water during the experiment(Mean±SE, n=5, * and ** indicate significant differences at p < 0.05 and p < 0.01, respectively) |
沉水植物需要吸收磷用以合成蛋白质、酶、核酸等活性大分子有机物, 从而满足自身生理需求(Lin et al., 2020).本试验系统相对封闭, 没有外源性磷的输入, 因此, 两种沉水植物在生长过程中富集的磷只能来自于水-沉积物系统内部, 这解释了两种沉水植物处理下沉积物磷浓度下降的现象(表 3).不同形态特征的沉水植物吸收营养盐的主要途径可能存在差异(Zhang et al., 2015).本实验中, 狐尾藻处理下的沉积物剖面中4~10 cm处的TP、IP和NaOH-P明显低于对照, 并在6 cm处达到最低值, 这应该是因为狐尾藻根系发达, 可以直接从沉积物中吸收同化磷.而无固定根的金鱼藻以直接吸收上覆水中磷的方式间接吸收沉积物中的磷, 这可能是金鱼藻处理下的沉积物剖面磷未出现上述特征的原因.
沉积物中的NaOH-P主要为与铁、铝氧化物或氢氧化物等结合的磷, 这部分磷较易释放, 且更易为沉水植物所利用(Yuan et al., 2020).狐尾藻对NaOH-P的去除效果要优于金鱼藻(表 3), 这是因为狐尾藻根系更为发达, 能够直接吸收沉积物中的NaOH-P, 另外一个原因可能是狐尾藻能够富集更多的磷于体内(表 2).沉积物中的HCl-P主要以磷灰石形态存在, 化学性质比较稳定, 不易释放, 很难被植物所利用(Jin et al., 2013), 因此, 对照及两种沉水植物处理下该形态的磷在实验前后均没有显著变化(表 3).通常, 沉积物IP主要由NaOH-P和HCl-P组成.本研究中, 沉积物中超过90%的IP由NaOH-P和HCl-P构成(表 3), 而狐尾藻处理下IP和NaOH-P呈显著性正相关系, 说明狐尾藻对NaOH-P的吸收是导致IP降低的主要原因, 而IP的降低进一步导致了TP含量的下降(表 4).
NaOH-P的易释放性使其通常被当作评价磷释放风险的一个重要参数(Gao et al., 2006), 而IP的另外一个主要组分HCl-P具有相对稳定性, 因此, NaOH-P与IP的比率(NaOH-P∶IP)与湖泊富营养化程度相关, 通常当该比率为5%~70%时富营养化情况较严重(Penn et al., 1995; Kaiserli et al., 2002).例如, 滇池作为中国另外一个典型富营养化湖泊, 其NaOH-P含量为360.38~645.32 mg·kg-1, NaOH-P/IP接近30%(Li et al., 2012).在本研究中, 狐尾藻和金鱼藻均能显著降低沉积物中的NaOH-P和NaOH-P∶IP, 表明两种沉水植物能在富营养化浅水湖泊的生态修复过程中起到一定积极作用.考虑到狐尾藻对NaOH-P的去除效果更好(NaOH-P从229.14 mg·kg-1降低至193.06 mg·kg-1, NaOH-P∶IP从42.2% 降低至39.5%), 因此, 在高NaOH-P背景湖泊中, 如中国三大富营养化湖泊太湖(Jin et al., 2006)、巢湖(Huang et al., 2005)和滇池(Li et al., 2012), 作为世界广布种的狐尾藻应具有更好的水体修复潜能.
沉积物中OP多数以磷酸酯(包括肌醇六磷酸)、磷脂、核酸、磷蛋白和磷酸糖类及一些未知的化合物等形态出现, 同样具有部分释放潜能(Ni et al., 2019), 而微生物的矿化作用是引发OP从沉积物向水体释放的主要生物驱动因素(Joshi et al., 2015).本研究前后OP含量差异不显著, 说明实验期间微生物的矿化作用较缓慢, 这与其他研究结果类似(Jiang et al., 2008).
本研究未评估沉水植物在衰亡期间对沉积物和水体的影响, 而沉水植物在死亡腐解后, 植物体内富集的磷可能会被重新释放并进入水环境, 沉水植物由系统中磷的“汇”转变为“源”, 进而成为二次污染源, 引起水质恶化(Li et al., 2014; Wang et al., 2018).在生态修复过程中, 避免衰亡沉水植物造成的二次污染、减少磷的内循环是保障修复效果、提高修复速率的核心要点.对沉水植物采取合理管理措施, 如适时适量收割打捞植物体、合理搭配适应不同季节温度的水生植物种(即利用生长期的植物A来消除衰亡期植物B分解带来的二次污染)等, 能够减少或避免这部分磷的再释放(王立志等, 2020).
大型水生植物特别是沉水植物, 对水环境条件如pH和DO等都有重要影响.其中, 上覆水的pH值能够影响P与Fe、Al和Ca等金属的结合, 是沉积物磷释放或吸附的主要影响因素之一(Kim et al., 2003).低pH值会导致CaCO3结合态磷再溶解, 因此HCl-P趋向于释放(Huser et al., 2016).NaOH-P对高pH较敏感, 这主要是由于在配体交换反应下OH-可以取代正磷酸盐, 有研究指出在pH值从8升高到12时, NaOH-P的释放会显著增加(Jin et al., 2006).本研究中, 两种沉水植物对上覆水pH没有显著影响(图 2a), 因此, 两种沉水植物不会通过改变水体酸碱度来影响沉积物磷的释放.
通常沉水植物的光合作用能够增加水体DO, 而DO往往与氧化还原电位和pH值相关, 是影响沉积物磷释放的另外一个主要因素(Wang et al., 2008a).较低的DO值往往会促进沉积物磷的释放, 而较高的DO值会产生抑制作用(Zhang et al., 2019).一项在太湖开展的研究表明, 在好氧处理下(DO>8.6 mg·L-1)沉积物磷的释放得到有效抑制(Wang et al., 2008a).本研究中两种沉水植物均能够通过增加上浮水中DO的含量来抑制沉积物磷的释放(图 2b).但需要指出的是, 本结论是在室内培养实验的基础上得出的, 而如果拓展到更大尺度, 比如湖泊中, 水体的DO会受到更多因素的影响(比如沉水植物种类和丰度、水体温度和浊度、水文动力、水华等), 因此, 在实际条件下狐尾藻和金鱼藻对水体DO的影响程度可能低于本研究.
由于没有外源性磷的输入, 对照组中上覆水增加的磷来自于沉积物内源性释放的磷(图 2c).而两种沉水植物处理下上覆水TP含量没有显著, 这可能是因为: ①沉水植物对上覆中有效态磷的吸收; ②沉积物释放性磷(NaOH-P)的减少和上覆水DO的上升抑制了沉积物磷向上覆水迁移.
4 结论(Conclusions)狐尾藻和金鱼藻均能抑制上覆水中TP的上升.两种沉水植物均能显著减少沉积物中TP、IP和NaOH-P的含量, 其中, 狐尾藻处理下TP的减少主要是由IP降低造成的, 而IP降低是由NaOH-P减少引起的.狐尾藻对沉积物NaOH-P的去除效果优于金鱼藻.
Cao X, Wan L, Xiao J, et al. 2018. Environmental effects by introducing Potamogeton crispus to recover a eutrophic Lake[J]. Science of the Total Environment, 621: 360-367. DOI:10.1016/j.scitotenv.2017.11.267 |
陈默, 张雅庆, 焦一滢, 等. 2020. 温度对湖泊沉积物中沉水植物残体厌氧分解的影响[J]. 环境科学学报, 40(8): 3013-3019. |
Cheng X, Huang Y, Li R, et al. 2020. Impacts of water temperature on phosphorus release of sediments under flowing overlying water[J]. Journal of Contaminant Hydrology, 235: 103717. DOI:10.1016/j.jconhyd.2020.103717 |
Gao L, Zhou J M, Yang H, et al. 2006. Phosphorus fractions in sediment profiles and their potential contributions to eutrophication in Dianchi Lake[J]. Environmental Geology, 49: 792-792. DOI:10.1007/s00254-005-0131-y |
Huang Q H, Wang Z J, Wang D H, et al. 2005. Origins and mobility of phosphorus forms in the sediments of lakes Taihu and Chaohu, China[J]. Journal of Environmental Science and Health Part a-Toxic/Hazardous Substances & Environmental Engineering, 40: 91-102. |
Huser B J, Egemose S, Harper H, et al. 2016. Longevity and effectiveness of aluminum addition to reduce sediment phosphorus release and restore lake water quality[J]. Water Research, 97: 122-132. DOI:10.1016/j.watres.2015.06.051 |
Jiang X, Jin X, Yao Y, et al. 2008. Effects of biological activity, light, temperature and oxygen on phosphorus release processes at the sediment and water interface of Taihu Lake, China[J]. Water Research, 42: 2251-2259. DOI:10.1016/j.watres.2007.12.003 |
Jiao Y, Yang C, He W, et al. 2018. The spatial distribution of phosphorus and their correlations in surface sediments and pore water in Lake Chaohu, China[J]. Environmental Science and Pollution Research, 25(26): 25906-25915. DOI:10.1007/s11356-018-2606-x |
Jin X, He Y, Kirumba G, et al. 2013. Phosphorus fractions and phosphate sorption-release characteristics of the sediment in the Yangtze River estuary reservoir[J]. Ecological Engineering, 55: 62-66. DOI:10.1016/j.ecoleng.2013.02.001 |
Jin X C, Wang S R, Pang Y, et al. 2006. Phosphorus fractions and the effect of pH on the phosphorus release of the sediments from different trophic areas in Taihu Lake, China[J]. Environmental Pollution, 139: 288-295. DOI:10.1016/j.envpol.2005.05.010 |
Joshi S R, Kukkadapu R K, Burdige D J, et al. 2015. Organic matter remineralization predominates phosphorus cycling in the mid-bay sediments in the Chesapeake Bay[J]. Environmental Science & Technology, 49: 5887-5896. |
Kaiserli A, Voutsa D, Samara C. 2002. Phosphorus fractionation in lake sediments-Lakes Volvi and Koronia, N.Greece[J]. Chemosphere, 46: 1147-1155. DOI:10.1016/S0045-6535(01)00242-9 |
Kim L H, Choi E, Stenstrom M K. 2003. Sediment characteristics, phosphorus types and phosphorus release rates between river and lake sediments[J]. Chemosphere, 50: 53-61. DOI:10.1016/S0045-6535(02)00310-7 |
Li C, Wang B, Ye C, et al. 2014. The release of nitrogen and phosphorus during the decomposition process of submerged macrophyte (Hydrilla verticillata Royle) with different biomass levels[J]. Ecological Engineering, 70: 268-274. DOI:10.1016/j.ecoleng.2014.04.011 |
Li H, Wang Y, Shi L Q, et al. 2012. Distribution and fractions of phosphorus and nitrogen in surface sediments from Dianchi Lake, China[J]. International Journal of Environmental Research, 6: 195-208. |
Li Y, Wang L, Yan Z, et al. 2020. Effectiveness of dredging on internal phosphorus loading in a typical aquacultural lake[J]. Science of the Total Environment, 744: 140883. DOI:10.1016/j.scitotenv.2020.140883 |
Lin Q, Fan M, Peng X, et al. 2020. Response of vallisneria natans to aluminum phytotoxicity and their synergistic effect on nitrogen, phosphorus change in sediments[J]. Journal of Hazardous Materials, 400: 123167. DOI:10.1016/j.jhazmat.2020.123167 |
Liu Z, Zhang Y, Yan P, et al. 2020. Synergistic control of internal phosphorus loading from eutrophic lake sediment using MMF coupled with submerged macrophytes[J]. Science of the Total Environment, 731: 138697. DOI:10.1016/j.scitotenv.2020.138697 |
Loh P S, Ying C Y, Alnoor H I M, et al. 2020. Comparative study on the elucidation of sedimentary phosphorus species using two methods, the SMT and SEDEX methods[J]. Journal of Analytical Methods in Chemistry, 2020: 8548126. |
Ni Z K, Wang S R, Cai J J, et al. 2019. The potential role of sediment organic phosphorus in algal growth in a low nutrient lake[J]. Environmental Pollution, 255(2): 113235. |
Peng J, Wang B, Song Y, et al. 2007. Adsorption and release of phosphorus in the surface sediment of a wastewater stabilization pond[J]. Ecological Engineering, 31: 92-97. DOI:10.1016/j.ecoleng.2007.06.005 |
Penn M R, Auer M T, Vanorman E L, et al. 1995. Phosphorus diagenesis in lake sediments, investigation using fractionation techniques[J]. Marine and Freshwater Research, 46: 89-99. DOI:10.1071/MF9950089 |
Rattray M R, Howard-Williams C, BrownAuer J M A. 1991. Sediment and water as sources of nitrogen and phosphorus for submerged rooted aquatic macrophytes[J]. Aquatic Botany, 40: 225-237. DOI:10.1016/0304-3770(91)90060-I |
Wang L, Liu Q, Hu C, et al. 2018. Phosphorus release during decomposition of the submerged macrophyte Potamogeton crispus[J]. Limnology, 19: 355-366. DOI:10.1007/s10201-018-0538-2 |
王立志, 董彬, 宋红丽, 等. 2020. 衰亡期黑藻与生长期菹草交替生长对水体磷迁移的影响[J]. 生态科学, 39(3): 160-171. |
王立志, 王国祥, 俞振飞, 等. 2012. 沉水植物生长期对沉积物和上覆水之间磷迁移的影响[J]. 环境科学, 33(1): 385-392. |
Wang S, Jin X, Bu Q, et al. 2008a. Effects of dissolved oxygen supply level on phosphorus release from lake sediments[J]. Colloids And Surfaces a-Physicochemical and Engineering Aspects, 316: 245-252. |
Wang S, Jin X, Zhao H, et al. 2008b. Phosphate biosorption characteristics of a submerged macrophyte Hydrilla verticillata[J]. Aquatic Botany, 89: 23-26. DOI:10.1016/j.aquabot.2008.01.006 |
吴强亮, 谢从新, 赵峰, 等. 2014. 沉水植物苦草(Vallisneria natans)对沉积物中磷赋存形态的影响[J]. 湖泊科学, 26(1): 228-234. |
Yuan F S, Li H W, Kakarla R, et al. 2020. Variability of sedimentary phosphorus fractions in the western and Sandusky basins of Lake Erie[J]. Journal of Great Lakes Research, 46(4): 976-988. DOI:10.1016/j.jglr.2020.05.013 |
Zan F, Huo S, Xi B, et al. 2011. Phosphorus distribution in the sediments of a shallow eutrophic lake, Lake Chaohu, China[J]. Environmental Earth Sciences, 62: 1643-1653. DOI:10.1007/s12665-010-0649-5 |
Zhang Q, Liu Y, Luo F, et al. 2019. Does species richness affect the growth and water quality of submerged macrophyte assemblages?[J]. Aquatic Botany, 153: 51-57. DOI:10.1016/j.aquabot.2018.11.006 |
Zhang Y, He F, Xia S, et al. 2015. Studies on the treatment efficiency of sediment phosphorus with a combined technology of PCFM and submerged macrophytes[J]. Environmental Pollution, 206: 705-711. DOI:10.1016/j.envpol.2015.08.018 |
 2021, Vol. 41
2021, Vol. 41


