2. 中国科学院生态环境研究中心城市与区域生态国家重点实验室, 北京城市生态系统研究站, 北京 100085
2. Beijing Urban Ecosystem Research Station, State Key Laboratory of Urban and Regional Ecology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
浮游植物是水生态系统中主要的初级生产者, 其群落结构变化可以影响水生态系统的能量流动、物质循环和信息传递(张国庆等, 2020), 进而反映水环境的状况及水环境变化规律, 是评价水体状况的重要指示物种之一(Naselli et al., 2007;2013).目前已有不少学者对丹江口水库的浮游植物群落结构进行了研究调查, 例如, 王英华等(2016)对库区的研究发现, 硅藻为春、秋和冬季的优势门类, 溶解氧浓度、pH值、总磷浓度和水温是影响浮游植物组成的主要环境因子;郑保海等(2018)于2015年9月—2016年10月对丹江口水库着生藻类进行了6次连续监测, 发现硅藻为全年优势群, 群落存在时空差异;贾海燕等(2019)研究发现, 丹江口水库浮游植物群落结构特征由春季的硅藻、蓝藻向夏季的绿藻、蓝藻和隐藻, 以及秋、冬季的硅藻、隐藻和蓝藻转变.
丹江口水库是南水北调中线工程水源地, 是一座以供水、防洪、发电为主, 兼具灌溉、养殖等功能的大型水库(杨广等, 1996), 为20多座大中城市提供用水.其中, 河南省南部的淅川库区面积为546 km2, 占库区总面积的52%.根据2013—2015年度《河南省生态环境厅》提供的数据, 丹江口水库取水口陶岔水质总体良好, 水质符合Ⅱ类标准, 但总氮(TN)除外.总氮是评估湖泊水体富营养水平的重要指标, 同时也是浮游植物生长代谢必不可少的元素之一.近年来丹江口水库总氮含量异常, 且库区所在地淅川县之前面源污染较为严重(姜世英等, 2010), 这些将直接影响丹江口水库水质.而近年来对该库区浮游植物群落结构特征及其水环境因子的研究较少.因此, 本研究采用高通量测序方法对库区浮游植物群落结构进行分析, 并采用简单相关系数、典型相关分析研究浮游植物和水环境因子的相互关系, 以期为丹江口水库水质保护工作及水生态修复等提供基础数据支撑.
2 材料与方法(Materials and methods) 2.1 研究区概况研究区域为河南省南部丹江口水库淅川库区, 位于丹库下游, 面积546 km2, 占库区总面积的52%, 地理坐标为32°39′0.595″~32°48′0.892″N、111°30′0.833″~111°37′0.645″E, 属于亚热带向暖温带过渡带, 气候适宜, 为人工峡谷型水库.2014年开始向南水北调中线工程沿线地区的北京、天津、河南、河北4个省市的20多座大中城市提供生活和生产用水, 正常年份5—10月为丰水期, 11—次年4月为枯水期.
2.2 采样点设置为全面了解库区浮游植物群落结构特征, 根据淅川库区整体结构特点, 在主要入库支流与库区交汇处、取水口及代表性点位附近设置9个采样点(图 1、表 2), 每个采样点周边另设置两个平行采样点, 各采样点距离不少于300 m, 均在离岸边300 m外开敞水域进行.
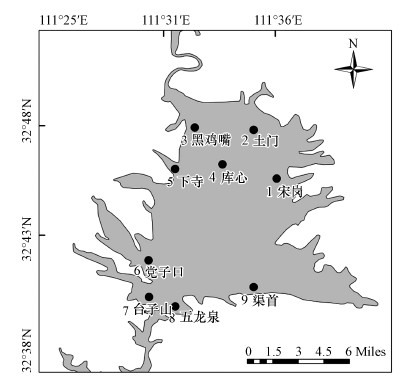 |
| 图 1 淅川库区采样点分布 Fig. 1 Locations of the sampling sites in the Xichuan Reservoir area |
浮游植物样品于2019年2月27日采自丹江口水库淅川库区, 使用采水器收集水面以下1、5、10 m深处水样, 经过网孔直径为64 μm的25号浮游生物网并将网内浓缩液置于离心管中, 经0.22 μm微孔滤膜过滤, 收集水中的浮游植物, 将滤膜放入液氮罐中保存, 用于各采样点的浮游植物群落结构及其多样性分析.水样采用直接采水法, 在各采样点采集1.5 m深处水样用于理化分析.
2.4 水样理化指标测定采用便携式水质检测仪现场测定水温(T)、溶解氧(DO)、电导率(Cond)和pH值.参照《水和废水分析方法》对水体中的总氮(TN)、氨氮(NH4+-N)、硝氮(NO3--N)、亚硝态氮(NO2--N)等进行测定(国家环境保护总局《水和废水分析方法》编委会, 2002).
2.5 DNA的提取和高通量测序将存放于液氮中的滤膜用无菌刀剪碎, 总DNA提取操作步骤按照E.Z.N.A.®soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)说明书进行, 利用NanoDrop2000对DNA浓度和纯度进行检测, DNA提取质量利用1%琼脂糖凝胶电泳检测.PCR扩增及测序所用引物为DIV4F-GCGGTAATTCCAGCTCC AATAG和DIV4R-CTCTGACAATGGAATACGAATA, 对V4可变区进行PCR扩增(Demetrio et al., 2019).扩增体系为20 μL, 扩增程序为:94 ℃预变性2 min, 32个循环(95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s), 最后72 ℃延伸10 min(PCR仪:ABI GeneAmp® 9700型).PCR产物经分离纯化后采用Illumina MiSeq PE300进行高通量测序.测序工作委托上海美吉生物信息公司进行, 对原始序列进行预处理, 选取高质量的序列进行分析.
2.6 生物信息数据分析使用Qiime 1.9.1 (http://qiime.org/install/index.html)软件对序列去重过滤、序列分类注释、beta多样性距离计算, 对高质量序列在相似性≥97%(默认为种水平的相似度)的划分标准上进行最佳分类单元(Operational Taxonomic Unit, OTU)划分.将测序的OTUs结果与SILVA 132 rRNA数据库(https://www.arb-silva.de/)进行对比, 根据RDP Classifier 2.11(https://sourceforge.net/projects/rdp-classifier/)对得到的OTUs代表序列进行分类注释.使用Mothur 1.30.2对浮游植物Alpha多样性(Chao指数、Ace指数、Shannon-Wiener指数和Simpson指数)进行分析.
2.7 浮游植物群落结构分析采用Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)评估水体营养状态(李芳芳等, 2011), 采用优势度指数(Y)描述浮游植物群落优势种(Noman et al., 2019), 将Y≥0.02的浮游植物定为优势种.具体计算公式如下所示:
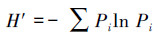
|
(1) |
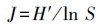
|
(2) |
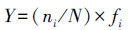
|
(3) |
式中, Pi为第i种物种的个体数量占总个体数量的比值;S为样品中藻类种类数;ni为第i种的个体数;N为所有种类总个数;fi为第i种藻类在各站位出现的频率.常见的浮游植物多样性判别水体水质状况的标准见表 1(熊莲等, 2016).
| 表 1 多样性指数评判标准 Table 1 Assessment standard of diversity indexes |
参数均经过lg(x+1)转换, 使得数据呈正态分布.使用Excel 2007和Origin8.0软件包进行数据绘图;对多样性指数与环境因子用SPSS 26.0软件包进行Pearson相关分析;采用Canoco 5.0软件包对浮游植物优势种作趋势对应分析(Detrended Correspondence Analysis, DCA), 当计算梯度大于4时, 采用典范对应分析(CCA)方法;当计算梯度小于3时, 采用冗余分析(RDA)方法;当计算梯度处于3~4时, RDA和CCA皆可选择.
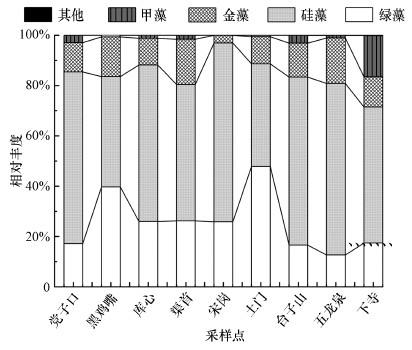
3 结果分析(Results analysis) 3.1 群落组成分析基于门分类水平下, 丹江口水库9个采样点中浮游植物主要类群有硅藻9属(58.8%不含未定属)、绿藻18属(27.2%不含未定属)、金藻3属(11.8%不含未定属)、甲藻1属(2.3%), 其他如隐藻、真眼点藻等浮游植物不足1%.其中, 除土门(TM)的绿藻相对丰度(47.8%)大于硅藻(40.7%)外, 其余各采样点群落大致相同, 均以硅藻占绝对优势, 其次为绿藻, 其中, 宋岗(SG)样点的硅藻相对丰度达到71%(图 2).
 |
| 图 2 门分类水平下各采样点浮游植物相对丰度 Fig. 2 Relative abundance of phytoplankton at different sampling sites at the level of phylum classification |
基于属分类水平下, 丹江口水库各采样点浮游植物主要类群见表 2.各采样点浮游植物共检测到77属, 均有类群未能鉴定到属, 其中, 硅藻门的冠盘藻属(Stephanodiscus)相对丰度最高(45.3%), 其次为绿藻门的葡萄藻属(Botryococcus, 16.4%)、硅藻门的直链藻属(Melosira, 10.1%)及金藻门的近囊胞藻属(Paraphysomonas, 4.8%)和金藻门未定属(6.42%).各采样点主要类群差异不大, 除了宋岗以硅藻门直链藻属(Melosira, 56.80%)、土门以绿藻门葡萄藻属(Botryococcus, 37.46%)相对丰度最高, 其他各采样点均以硅藻门冠盘藻属(Stephanodiscus)相对丰度最高.
| 表 2 属分类水平下浮游植物主要类群 Table 2 Classification of main groups of phytoplankton at genus level |
为了解丹江口水库淅川库区中浮游植物优势物种, 将测序得到的OTU结果与数据库进行对比后, 对主要OTU的相对丰度进行了分析.在调查期间获取到浮游植物优势种7种, 分别为硅藻门的冠盘藻(Stephanodiscus suzukii)(0.325)、变异直链藻(Melosira varians)(0.069), 绿藻门的葡萄藻(Botryococcus braunii)(0.094)、索囊藻(Choricystis sp.)(0.035)、麦可属一种(Mychonastes sp.)(0.02), 以及金藻门近囊胞藻(Paraphysomonas sp.)(0.03)和未定种(0.035).
3.3 测序结果及多样性分析为了验证引物对真核浮游植物扩增的特异性, 对9个采样点样品进行PCR扩增.不同样品的第一轮PCR扩增产物基因片段条带单一, 且亮度较为一致, 长度为370 bp, 满足测序要求.
丹江口水库样品浮游植物通过Miseq高通量测序分别获得12041~20152条原始序列, 之后筛选优质序列得到11749~19603条有效序列, 使用Uparse7.0.1090 (http://www.drive5.com/uparse/)对所有样品的有效序列进行聚类, 将相似度≥97%的序列划分为一个OTU, 共得到168个OTUs, 去掉不能注释的OTU得到115种真核浮游植物OTU(刘卫东等, 2017;Lu et al., 2020).
各采样点样品碱基平均长度为282~287 bp.由表 3可知, 覆盖度均超过99%, 稀释曲线逐渐趋于平缓, 说明测序深度已足够覆盖绝大多数真核浮游植物, 数据可靠(Hajibabaei et al., 2011).香农-威纳多样性指数(H′)为1.76~2.52, 均值为2.14±0.28, Pielou均匀度指数(J)为0.28~0.38, 均值为0.33±0.03, 除3个采样点的J值在0.3以下, 其余均超过0.3, 结合水质评价标准(表 1), 判断水质状况为β-中污带.Ace指数用于评估样本中物种组成的丰富度和均匀度, Chao指数用于估算样品中所含OTU数目的指数, 其值越大表示物种数目越多, 二者均为物种多样性指数, 其值越大代表物种丰度越高, 本研究中Ace指数和Chao指数分别为83~123和81~122.综合以上几种多样性指数, 黑鸡嘴样点的物种多样性最为丰富, 党子口和台子山的物种多样性指数较低.
| 表 3 丹江口水库浮游植物多样性指数表 Table 3 Diversity index of phytoplankton in Danjiangkou Reservoir |
丹江口水库各采样点浮游植物多样性指数与环境因子的Pearson相关性分析见表 4, 其中, 相对丰度表示各个采样点各种浮游植物相对丰度的总和.结果显示, 香农-威纳指数(H′)与Pielou均匀度指数(J)呈显著正相关(p<0.01), 与Simpson多样性指数呈显著负相关(p<0.01), 此外, 水温(T)、溶解氧(DO)的变化对浮游植物的多样性有一定影响.
| 表 4 多样性指数与环境因子的Pearson相关性分析(n=26) Table 4 Pearson correlation analysis of environmental factors and diversity index |
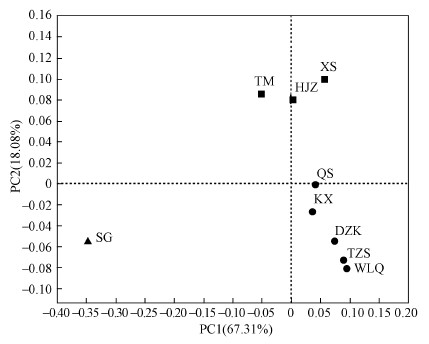
采用PCoA分析各采样点浮游植物群落组成的相似度, 两点距离越远则表示两点之间物种组成差异越大.结合主成分PC1及PC2进行分析, 计算得出PC1和PC2对种群分布的总解释度为85.39%.如图 3所示, 9个采样点分布在不同的3个位置, 其中台子山(TZS)、五龙泉(WLQ)、党子口(DZK)、库心(KX)、渠首(QS)5个点相似性较高为一组;土门(TM)、黑鸡嘴(HJZ)、下寺(XS)3个点相似度较高为一组;宋岗(SG)为一组, 可以发现不同采样点之间浮游植物群落存在一定差异.
 |
| 图 3 各采样点浮游植物群落相似性分析 Fig. 3 Similarity analysis of phytoplankton community in different sampling sites |
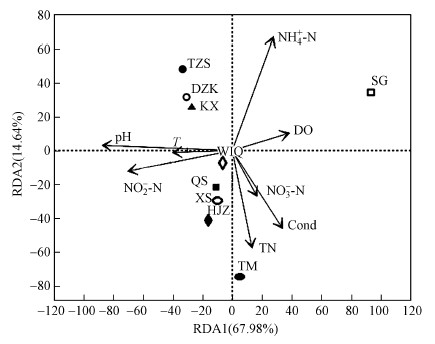
将氨氮(NH4+-N)、硝氮(NO3--N)、亚硝态氮(NO2--N)、电导率(Cond)、pH、溶解氧(DO)、总氮(TN)、水温(T)等8个理化因子进行膨胀因子分析, 选择方差膨胀因子(VIF)小于10的环境因子与浮游植物进行RDA分析, 结果见图 4.前两轴分别解释了浮游植物的67.98%和14.64%.其中, pH对库区浮游植物群落结构影响最大且显著相关(p < 0.05), 其次是NH4+-N、NO2--N、TN和Cond.TN、Cond和NO3--N与渠首(QS)、下寺(XS)和黑鸡嘴(HJZ)样品呈正相关, 与台子山(TZS)、党子口(DZK)和库心(KX)样品呈负相关.
 |
| 图 4 浮游植物与环境因子的RDA分析 Fig. 4 RDA Analysis of phytoplankton and Environmental factors |
参考《地表水环境质量标准基本项目标准限值》(GB3838—2002)对丹江口水库9个采样点的TN、NH4+-N、DO、pH进行评价(表 5).由表 5可知, TN含量为0.93~1.21 mg·L-1, 以库心最低, 符合Ⅲ类水标准, 其他各点TN含量均为Ⅳ类水标准;NH4+-N含量为0.22~0.34 mg·L-1, 各点均符合Ⅱ类水标准;DO含量为10.7~13.3 mg·L-1, 各点均优于Ⅰ类水标准;pH值为8.57~8.76, 符合地表水环境质量标准范围.各样点NH4+-N含量均符合Ⅱ类水标准, 而TN符合Ⅳ类水标准, 由此推断, NO3--N浓度过高可能是影响丹江口水库水质的重要因素.
| 表 5 各采样点主要水化学参数 Table 5 Main water chemical parameters of sampling sites |
目前对丹江口水库浮游生物群落结构特征的研究大多建立在光学显微镜观察鉴定的基础上, 存在工作量大、不易精确鉴别等不足, 可能致使研究结果产生误差.高通量测序技术的出现和日趋成熟为该领域研究的深入开展提供了契机, 使科研人员可以掌握更为全面的生物群落信息, 其对生物多样性监测和量化已经被证明是可行的(Mitchell et al., 2006;Letunic et al., 2007;艾铄等, 2018).例如, 王靖琪等(2017)通过高通量测序和显微镜观察法对比发现, 高通量测序技术对辽河真核浮游藻类多样性有极高的还原能力且弥补了显微镜观察研究中可能丢失的物种信息, 提高了对真核浮游藻类监测的能力.高通量测序技术可以监测到显微镜观察法不能直接鉴别的新物种, 本研究通过对样品18S rRNA基因的V4可变区进行测序分析发现真眼点藻纲(Eustigmatophyceae)、绿藻门麦可属(Mychonastes)等丹江口水库新纪录种, 而前人通过显微镜观察发现的小环藻属(Cyclotella)、脆杆藻属(Fragilaria)在高通量测序结果中未能找到, 可能与18S rRNA基因的V4可变区引物的特异性有关, 需要结合其他的条形码基因进行完善.
4.1 群落结构特征分析多样性指数是反映物种群落结构特征的重要参数, 主要包括Shannon-Wiener指数、Pielou均匀度指数.多样性指数越高, 其群落结构越复杂, 稳定性越高, 水质越好(宋勇军等, 2019).本研究通过高通量测序对丹江口水库浮游植物群落特征的研究发现, 各采样点香农-威纳多样性指数为1.76~2.52, Pielou均匀度指数(J)为0.28~0.38, 结合藻类水质指示种评价的标准, 判断水质状况为β-中污带.
浮游植物主要为硅藻门、绿藻门、金藻门、甲藻门, 其中以硅藻相对丰度最高(55.4%不含未定属), 这与前人对丹江口水库浮游植物群落结构的调查结果一致(谭香等, 2011;王英华等, 2016).调查期间发现优势种有7种, 分别为硅藻门的冠盘藻(Stephanodiscus suzukii)(0.325)、变异直链藻(Melosira varians)(0.069), 绿藻门的葡萄藻(Botryococcus braunii)(0.094)、索囊藻(Choricystis sp.)(0.035)、麦可属一种(Mychonastes sp.)(0.02), 以及金藻门近囊胞藻(Paraphysomonas sp.)(0.03)及未定种(0.035).优势种类与谭香等(2011)、邬红娟等(1966)对丹江口水库优势种的调查结果有所不同, 这可能是因为使用的调查方法不同, 前人大多基于传统的形态学角度对库区浮游植物进行分类和优势度划分, 此外, 丹江口水库浮游植物结构具有时空差异, 采样点和采样季节的不同导致浮游植物优势种可能也存在差异.张晓红等(2016)研究发现, 硅藻适应在较低温度的水体中生长, 最适温度为20 ℃左右, 蓝绿藻适宜在较高温度水体中生长, 最适温度为25~35 ℃, 与本文早春季节硅藻占绝对优势这一结果一致.其中, 占绝对优势的藻属冠盘藻(Stephanodiscus), 隶属于硅藻门, 是单细胞或成链状群体, 主要为淡水浮游藻种, 也是富营养化重要指示物种, 以及硅藻水华优势种, 常出现于冬末春初时节(Won et al., 2008).韩国Nakdong River频繁发生冠盘藻水华, 研究发现, 冠盘藻生长的最适宜温度为8.7 ℃, 冬季到春季是其生长最佳季节(Kim et al., 2018);此外, 通过对汉江冠盘藻的研究发现, 在早春温度适宜条件下, 冠盘藻会迅速生长, 成为绝对优势种, 并开始出现水华, 这与本文研究结果一致(殷大聪等, 2011;郑玲玲等, 2017).
4.2 浮游植物与库区水质的关系近年来丹江口水库水质总体良好, 符合Ⅱ类标准, 但总氮(TN)超标, 本次调查期间总氮浓度为0.93~1.21 mg·L-1(表 5), 符合Ⅲ~Ⅳ类标准.张雅洁等(2017)对北海湖调查发现, 北海湖水体中TN是影响水质的关键因素, 尤其在冬季, 其含量达到2.20 mg·L-1.浮游植物作为水生态系统的初级生产者、氮循环的主要承担者, 可以为好氧型微生物的硝化作用提供充足的氧气和良好的微生态环境, 同时也直接吸收利用溶解态氮用于自身生长, 在湖泊氮素循环过程中具有重要作用.氮浓度的变化可以直接影响到浮游植物的生长状况, 进而对浮游植物的群落结构产生深刻影响, 导致耐低氮的硅藻等数量减少, 而耐高氮的藻类数量上升成为优势种, 从而对水库水质产生影响(Elser et al., 2009).
根据况琪军等(2004)、张乃群等(2006)利用藻类水质指示种评价的标准, 在本次调查发现的优势种中具有指示作用的有冠盘藻(β-中污型)和变异直链藻(αβ-中污型), 显示丹江口水库水质状况为β-中污带.
通过香农-威纳指数(H′)、Pielou均匀度指数(J)对丹江口水库水质状况进行分析, 结果表明, 香农-威纳多样性指数为1.76~2.52, Pielou均匀度指数为0.28~0.38, 基本可以认为水质处于β-中污带.由于本次调查期间为冬季, 水温、光照相比其他季节可能不利于一些藻种生长, 这可能也使得本次调查结果多样性指数低于其他季节, 这与谭香等(2011)的研究结果一致.
4.3 各采样点差异性分析RDA分析表明, pH、NH4+-N和NO2--N是影响丹江口水库真核浮游生物群落结构特征的重要环境因子, 其中, pH为主要影响因子, 这与王英华等(2016)对丹江口水库的研究结论一致.聚类分析表明, 各样点浮游植物群落结构通过聚类大致分为3个部分:样点2(TM)、3(HJZ)、5(XS)聚为一类, 靠近北部旱田地带, 为库区下游;样点4(KX)、6(DZK)、7(TZS)、8(WLQ)、9(QS)聚为一类, 靠近南边丘陵地带, 为库区上游;1号样点(SG)位于东边, 周围主要为水田, 人为活动也较为频繁, 与其他点差异较大.其中, 党子口、五龙泉、台子山3个地方真核浮游植物群落结构特征最为相近, 可能是因为这3个地方相对距离最近, 且都在汉江排水口附近;而宋岗与其他样点真核浮游生物群落结构均有较大差异, 可能有两个原因:其一与地理位置有关, 经调查, 库区东面为水田, 人为活动较为频繁, 加上淅川县农业面源污染较为严重, 宋岗浮游植物群落结构可能会受此影响;其二人为因素影响, 本次采样时间为2019年2月27日, 未到禁渔期, 且采样点距离码头较近, 受渔期人为因素影响较大, 致使宋岗采样点浮游植物群落结构特征差异较大.
丹江口水库为人工峡谷型水库, 深处可达80余米.王煜等(2009)研究发现, 水库的温度分层会影响水体理化因子, 从而影响水库氮的动态转化过程及水生生态系统的生产力.本研究中浮游植物样品采集于水面以下1.5、5、10 m深处, 后经过滤收集为混合样, 而测定水体理化参数的样品采集于水面以下1.5 m深处, 没有进行分层采集, 这可能也会导致本次研究中氮营养盐与浮游植物群落结构之间没有显著的相关性.
5 结论(Conclusions)1) 采用高通量测序发现, 丹江口水库浮游植物群落香农-威纳指数(H′)为1.76~2.52, Sobs指数为72~108.各采样点主要优势类群差异不大, 以硅藻门相对丰度最高, 绿藻次之.优势种为硅藻门的冠盘藻(Stephanodiscus suzukii)(0.325)、变异直链藻(Melosira varians)(0.069), 绿藻门的葡萄藻(Botryococcus braunii)(0.094)、索囊藻(Choricystis sp.)(0.035)、麦可属一种(Mychonastes sp.)(0.02), 以及金藻门近囊胞藻(Paraphysomonas sp.)(0.03)及未定种(0.035).早春优势种冠盘藻(Stephanodiscus suzukii)为硅藻水华优势种, 在适宜温度条件下会迅速繁殖, 使丹江口水库发生水华的风险增加, 因此, 要加强对丹江口水库水质的检测和防范意识.
2) 相关性分析表明, 香农-威纳指数(H′)与Pielou均匀度指数(J)、Simpson多样性指数显著相关(p < 0.01);RDA分析表明, pH、NH4+-N和NO2--N是影响丹江口水库真核浮游生物群落结构特征的主要环境因子.
3) 库区水质总体良好, 符合Ⅱ类水标准, 但总氮超标, 浓度为0.93~1.21 mg·L-1, 符合Ⅲ~Ⅳ类标准, 结合香农-威纳指数(H′)、Pielou均匀度指数(J)及藻类水质指示种评价的标准可知, 丹江口水库水质状况为β-中污带.
艾铄, 张丽杰, 肖芃颖, 等. 2018. 高通量测序技术在环境微生物领域的应用与进展[J]. 重庆理工大学学报(自然科学), 32(9): 117-127. |
Demetrio M, Nélida A, Sebastian P, et al. 2019. Morphology and metabarcoding: a test with stream diatoms from Mexico highlights the complementarity of identification methods[J]. Journal of Freshwater Science, 38(3): 448-464. DOI:10.1086/704827 |
Elser J J, Andersen T, Baron J S, et al. 2009. Shifts in lake N: P stoichiometry and nutrient limitation driven by atmospheric nitrogen deposition[J]. Science, 326: 835-837. DOI:10.1126/science.1176199 |
Hajibabaei M, Shokralla S, Zhou X, et al. 2011. Environmental barcoding: A next-generation sequencing approach for biomonitoring applications using river benthos[J]. Plos One, 6(4): e17497. DOI:10.1371/journal.pone.0017497 |
Jung S W, Lee J H, Han M S, et al. 2008. Algicidal effect of Pseudomonas fluorescens against Stephanodiscus Hantzschii (Bacillariophyceae) during winter freshwater blooms: Biological impact of algicidal activity in mesocosms[J]. Journal of Biotechnology, 136: S636-S636. DOI:10.1016/j.jbiotec.2008.07.1473 |
贾海燕, 徐建锋, 雷俊山, 等. 2019. 丹江口库湾浮游植物群落与环境因子关系研究[J]. 人民长江, 50(5): 52-58. |
姜世英, 韩鹏, 贾振邦, 等. 2010. 南水北调中线丹江口库区农业面源污染PSR评价与基于GIS的空间特征分析[J]. 农业环境科学学报, 29(11): 2153-2162. |
Kim J S, Seo I W, Lyu S, et al. 2018. Modeling water temperature effect in Diatom (Stephanodiscus hantzschii) prediction in eutrophic rivers using a 2D contaminant transport model[J]. Journal of Hydro-environment Research, 19: 41-55. DOI:10.1016/j.jher.2018.01.003 |
况琪军, 胡征宇, 周广杰, 等. 2004. 香溪河流域浮游植物调查与水质评价[J]. 武汉植物学研究, 22(6): 507-513. DOI:10.3969/j.issn.2095-0837.2004.06.007 |
Letunic L, Bork P. 2007. Interactive tree of life (iTOL): An online tool for phylogenetic tree display and annotation[J]. Bioinformatics, 23(1): 127-128. DOI:10.1093/bioinformatics/btl529 |
Lu L H, Zhou X, Yang J X, et al. 2020. Biogeography of eukaryotic plankton communities along the upper Yangtze River: The potential impact of cascade dams and reservoirs[J]. Journal of Hydrology, 590: 125495. DOI:10.1016/j.jhydrol.2020.125495 |
李芳芳, 董芳, 段梦, 等. 2011. 大辽河水系夏季浮游植物群落结构特征及水质评价[J]. 生态学杂志, 30(11): 2489-2496. |
刘卫东, 宋伦, 吴景, 等. 2017. 环境样本中微型和微微型浮游植物高通量测序的引物优化[J]. 生态学报, 37(12): 4208-4216. |
Naselli-Flores L, Barone R. 2007. Pluriannual morphological variability of phytoplankton in a highly productive Mediterranean reservoir(Lake Arancio Southwestern Sicily)[J]. Hydrobiologia, 578(1): 87-95. DOI:10.1007/s10750-006-0436-1 |
Naselli-Flores L, Barone R. 2013. Invited review -fight on plankton! or, Phytoplankton shape and size as adaptive tools to get ahead in the struggle for life[J]. Cryptogamie Algologie, 2(2): 157-204. |
Noman A, Sun J, Gang Q, et al. 2019. Factors regulating the phytoplankton and tintinnid microzooplankton communities in the East China Sea[J]. Continental Shelf Research, 181: 14-24. DOI:10.1016/j.csr.2019.05.007 |
Sogin M, Morrison H, Huber J, et al. 2006. Microbial diversity in the deep sea and the underexplored "Rare Biosphere"[J]. Proceedings of the National Academy of Sciences of the United States of America, 103(32): 12115-12120. DOI:10.1073/pnas.0605127103 |
宋勇军, 戚菁, 刘立恒, 等. 2019. 程海湖夏冬季浮游植物群落结构与富营养化状况研究[J]. 环境科学学报, 39(12): 4106-4113. |
谭香, 夏小玲, 程晓莉, 等. 2011. 丹江口水库浮游植物群落时空动态及其多样性指数[J]. 环境科学, 32(10): 2875-2882. |
王靖淇, 王书平, 张远, 等. 2017. 高通量测序技术研究辽河真核浮游藻类的群落结构特征[J]. 环境科学, 38(4): 1403-1413. |
王英华, 陈雷, 牛远, 等. 2016. 丹江口水库浮游植物时空变化特征[J]. 湖泊科学, 28(5): 1057-1065. |
王煜, 戴会超. 2009. 大型水库水温分层影响及防治措施[J]. 三峡大学学报(自然科学版), 28(6): 11-14. |
邬红娟, 彭建华, 韩德举, 等. 1996. 丹江口水库浮游植物及其演变[J]. 湖泊科学, 8(1): 43-50. |
熊莲, 刘冬燕, 王俊莉, 等. 2016. 安徽太平湖浮游植物群落结构[J]. 湖泊科学, 28(5): 1066-1077. |
杨广, 杨干荣, 刘金兰, 等. 1996. 丹江口水库浮游生物资源调查[J]. 湖北农学院学报, (1): 38-42. |
殷大聪, 郑凌凌, 宋立荣, 等. 2011. 汉江中下游早春冠盘藻(Stephanodiscus hantzschii)水华暴发过程及其成因初探[J]. 长江流域资源与环境, (4): 69-76. |
张国庆, 杨雨玲, 唐爱国, 等. 2020. 新安江流域(屯溪段)浮游植物群落结构及其与环境因子的关系[J]. 生态学杂志, 39(2): 527-540. |
张乃群, 王正德, 杜敏华, 等. 2006. 南水北调中线水源区浮游植物与水质研究[J]. 应用与环境生物学报, 12(4): 506-510. DOI:10.3321/j.issn:1006-687X.2006.04.014 |
张晓红, 刘旭东, 孙立娥, 等. 2016. 基于浮游植物群落的青岛世园会天水水库水体评价[J]. 中国环境监测, (2): 64-70. |
张雅洁, 李珂, 朱浩然, 等. 2017. 北海湖微生物群落结构随季节变化特征[J]. 环境科学, 38(8): 3319-3329. |
郑凌凌, 张琪, 李天丽, 等. 2017. 三种不同环境因子对汉江硅藻水华优势种冠盘藻(Stephanodiscus sp.)生长生理的影响[J]. 海洋湖沼通报, 159(6): 91-97. |
郑保海, 朱静亚, 许信, 等. 2018. 丹江口水库着生藻类群落特征及其水质评价[J]. 河南师范大学学报(自然版), 46(4): 95-101. |
 2021, Vol. 41
2021, Vol. 41


