纳米材料因其独特的物理和化学特性, 在光电、催化、化学和生物传感以及诊断治疗学中发挥着重要作用.近年来, 黑磷(Black Phosphorus, BP)作为一种新兴纳米材料受到广泛关注.BP是磷元素中最稳定的同素异形体, 具有片层蜂窝状折叠结构和可调带隙, 对从远红外到可见范围的光均有响应, 可填补石墨烯和过渡金属二卤化合物间的带隙空白, 是难得的光电子材料(Xia et al., 2014;Guo et al., 2015);同时, BP还被认为是治疗恶性肿瘤的有效药物载体(Chen et al., 2018).然而, 学界对其生物毒性和生态风险的探究尚不够深入.
近年来, 有关黑磷纳米片(BPNSs)对生物毒性效应的研究逐渐成为热点.目前已知的纳米材料对细胞的毒性机制主要为: 细胞膜损伤, 活性氧(Reactive oxygen species, ROS)介导的氧化损伤, 对植物细胞光合作用的抑制, 蛋白质氧化, 遗传毒性等(Klaine et al., 2008).已有研究表明: BPNSs会对人肺上皮细胞(A549)产生显著毒性效应, 暴露24 h后50 mg·L-1 BPNSs会使细胞活性降低至48%, 这是介于氧化石墨烯和金属氧化物之间的毒性值(Latiff et al., 2015).黑磷量子点对HeLa细胞也有显著凋亡作用, 可对其造成氧化损伤从而引起急性毒性效应(Mu et al., 2017).Zhang等(2017)研究了BPNSs对293T、NIH3T3和HCoEpiC的毒性效应, 发现其可以通过刺激细胞产生ROS诱导细胞凋亡, 并表现出剂量-效应关系.Song等(2018)研究发现BPNSs对成纤维细胞的毒性效应与其浓度和暴露时间成正比, 细胞内ROS大量产生所导致的抗氧化酶活性降低及其对细胞膜的破坏是主要的毒性来源.
尽管已有研究揭示了BPNSs对细菌和人体细胞的毒性机制, 但是关于BPNSs对水生生物毒性的研究还很匮乏.藻类作为生态系统的初级生产者, 是水环境安全领域中的典型指示生物, 研究BPNSs对藻类的毒性效应可以为后续其在水环境食物链中的潜在富集风险相关研究提供理论支撑.最近, Li等(2020)讨论了BPNSs对小球藻的毒性机制, 发现在暴露120 h后, 1 mg·L-1 BPNSs促进小球藻的生长, 而5和10 mg·L-1 BPNSs抑制其生长.毒性来源可能是BPNSs降解产生的可溶性磷酸盐H3PO2、H3PO3和H3PO4的逐步释放, 且3种磷酸盐的含量最终决定了BPNSs对小球藻的毒性效应(Li et al., 2020).斜生栅藻作为水环境安全领域的指示物种, 研究其对高浓度BPNSs的毒性响应具有重要科学价值, 然而目前相关研究还很匮乏.
为此, 本文首先通过液相剥离法制备BPNSs, 并对其进行结构表征;随后系统研究了BPNSs对斜生栅藻的生物学效应及其潜在的毒性机制, 以期丰富BPNSs的藻类毒性效应基础研究数据.
2 材料与方法(Materials and methods) 2.1 实验材料黑磷晶体购买自南京先丰纳米有限公司(XFNANO, Nanjing).实验用斜生栅藻(Scenedesmus obliquus)购买自中国科学院淡水藻种库(FACHB), 标号为(FACHB-417).斜生栅藻细胞呈纺锤形, 常为4个细胞组成, 群体宽为12~34 μm, 长为10~21 μm(图 10 a).
2.2 实验方法 2.2.1 BPNSs的制备及表征手段利用液相剥离法制备PBNSs, 制备过程如图 1所示, 将BP晶体研磨成粉末倒入装有无氧水的密封瓶中, 在600 W的功率下超声处理(Scientz-950E)16 h, 冰水浴将温度保持在293 K以下(Brent et al., 2014).将超声破碎后得到的BP悬浮液进行2000 r·min-1离心, 取上清液再进行8000 r·min-1离心, 得到的沉淀即为成品BPNSs.
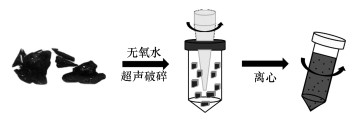 |
| 图 1 BPNSs制备过程 Fig. 1 Preparation process of BPNSs |
利用紫外可见分光光度计(Uv-Vis, HACH, DR6000)、拉曼光谱仪(Raman spectrometer, HORIBA, HR800)、场发射扫描电子显微镜(FE-SEM, 蔡司, ULTRA PLUS)、透射电子显微镜(TEM, FEI, G20)、原子力显微镜(AFM, AGILENT, 5100)对BPNSs进行结构表征.
2.2.2 斜生栅藻的培养将斜生栅藻藻种活化后, 将其置于灭菌三角瓶内, 按V藻/V培养基=1/3比例加入BG11培养基(表 1), 于光照培养箱中进行培养(培养条件: 光照/黑暗=14 h/10 h, 温度25 ℃), 每天定时摇瓶3次.
| 表 1 BG11培养基的成分 Table 1 The composition of BG11 medium |
① 将制得的BPNSs分别配置成浓度为20、100、200 mg·L-1的BPNSs母液.取不同浓度BPNSs母液与同体积藻液于无菌三角瓶中混合, 得到BPNSs最终浓度为10、50、100 mg·L-1的混合液用于后续实验, 各浓度分别设3组平行, 并设对照组(0 mg·L-1 BPNSs).每天定时取藻液测其在650 nm处吸光度, 以此反映斜生栅藻生物量.
② 半数效应浓度(EC50)的计算.藻细胞生长抑制率(IR)利用式(1)计算.
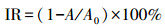
|
(1) |
式中, A为处理组藻细胞密度;A0为对照组藻细胞密度.
利用SPSS软件中概率单位回归法计算BPNSs对斜生栅藻的120 h EC50.
2.2.4 毒性指标的测定① 叶绿素a含量的测定.每天定时取藻液, 通过真空抽滤将藻泥截留在醋酸滤膜上, 将滤膜放入离心管内加入乙醇(95%).避光静置抽提24 h后取出进行10000 r·min-1离心, 取上清液测其在663、645 nm处的吸光度值, 利用式(2)进行叶绿素a含量的测定(李合生等, 2000).
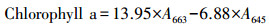
|
(2) |
式中, A663为663 nm处吸光度值, A645为645 nm处吸光度值.
② 活性氧自由基(ROS)含量的测定.采用活性氧自由基检测试剂盒(Beyotime, S0033S)进行藻细胞内ROS含量的测定.荧光探针DCFH-DA本身没有荧光, 可以自由穿过细胞膜, 进入细胞内后, 可以被细胞内的酯酶水解生成DCFH;而DCFH不能通过细胞膜, 从而使探针很容易被装载到细胞内.细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF, 检测DCF的荧光即可以反映细胞内活性氧的水平.取暴露时间为48 h的4组藻液, 离心收集藻细胞, 加入适量荧光探针使其处于悬浮状态, 在培养箱内孵育0.5 h, 0.01 mol·L-1PBS 3次洗涤后利用荧光分光光度计(激发波长488 nm, 发射波长525 nm)测试荧光强度.采用式(3)计算藻细胞内ROS含量.
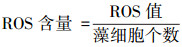
|
(3) |
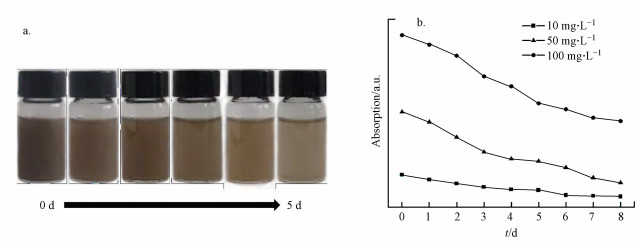
③ 超氧化物歧化酶(SOD)含量的测定.利用超氧化物歧化酶(SOD)测定试剂盒(南京建成生物工程研究所, A001-3-1)进行藻细胞内SOD活性测定.取暴露时间为48 h的4组藻液, 离心收集藻细胞后加入适量0.01 mol·L-1 PBS进行超声破碎(功率为450 W, 超声时间为15 min).破碎后再次离心取上清液至96孔板中, 按说明书依次加入试剂, 孵育0.5 h后利用酶标仪(BioTek, ELX800)进行数值测定(450 nm).SOD抑制率利用式(4)进行计算, SOD活性利用式(5)进行计算.

|
(4) |
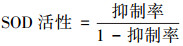
|
(5) |
式中, A对照为对照孔的数值, A对照空白为对照空白孔的数值, A测定为测定孔的数值, A测定空白为测定空白孔的数值.
④ BPNSs对斜生栅藻的吸附团聚.使用荧光显微镜(Olympus, BX53)观察BPNSs暴露48 h后斜生栅藻的形态及其对藻细胞的吸附团聚现象.
⑤ BPNSs对斜生栅藻的物理损伤.BPNSs对斜生栅藻的物理损伤通过场发射扫描电子显微镜(FE-SEM, 蔡司, ULTRA PLUS)进行观测.取暴露48 h的藻液, 0.01 mol·L-1 PBS 3次洗涤(6000 r·min-1, 5 min)收集藻细胞, 将其悬浮分散于2.5% 戊二醛中固定24 h(4 ℃), 再次用0.01 mol·L-1 PBS洗涤藻细胞3次(6000 r·min-1, 5 min), 收集藻细胞进行乙醇梯度脱水(分别用30%、50%、70%、85%、90%的乙醇脱水1次, 100%乙醇2次, 15 min·次-1;乙酸异戊酯置换乙醇2次, 20 min·次-1), 每一步完成后进行8000 r·min-1离心5 min.将得到的沉淀冷冻干燥后进行喷金处理, 利用FE-SEM观察.
2.3 分析方法利用Origin 2020、SPSS Statistics 25软件进行误差分析、数据分析和图形绘制, 显著水平设置在ɑ=0.05.
3 结果(Results) 3.1 BPNSs结构表征① BPNSs线性吸收光谱分析.如图 2a所示, 可以清晰地看到BPNSs在紫外可见吸收光谱内具有平滑的吸收曲线, 表明BPNSs是一种宽带的光学材料.
 |
| 图 2 BPNSs紫外可见吸收谱图(a)及块状BP、BPNSs拉曼光谱图(b) Fig. 2 Uv-Vis absorption spectrogram of BPNSs(a) and Raman spectra of Bulk BP、BPNSs(b) |
② BPNSs拉曼光谱分析.BPNSs特征峰利用拉曼光谱仪(Raman spectrometer, HORIBA, HR800)进行表征, 取固体BP与制得的BPNSs分别进行测试.如图 2 b所示, 固体BP与BPNSs在362.4、435.5和460.3 cm-1处有3个特征峰, 分别对应于Ag1, B2g和Ag2模式(Lu et al., 2014).且与块状BP相比, BPNSs的波峰呈现微小的红移现象, 说明其为多层次结构(Guo et al., 2015).
③ BPNSs形貌分析.BPNSs的形貌利用场发射扫描电子显微镜(FE-SEM, Carl Zeiss AG, ULTRA PLUS)和透射电子显微镜(TEM, FEI, G20)进行表征.取制得的BPNSs滴于电镜用硅片上, 真空干燥过夜后进行FE-SEM表征.如图 3a所示, 可以看出BPNSs呈不规则的片状.将少量制得的BPNSs滴于电镜用30目铜网上, 真空干燥过夜后进行TEM表征.图 3 b可以清晰的看出BPNSs具有的片层结构.BPNSs的横向尺寸为(541.25±176.22) nm(图 3c).
 |
| 图 3 BPNSs的SEM(a)、TEM(b)及横向尺寸统计图(c) Fig. 3 SEM(a), TEM(b) and Lateral size of BPNSs(c) |
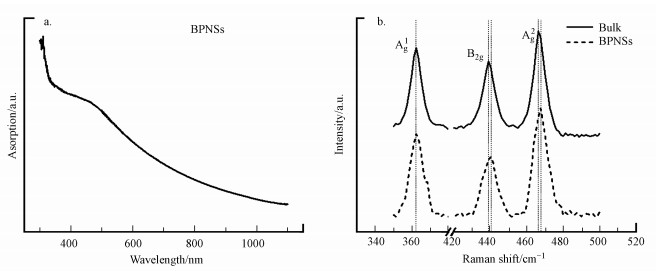
④ BPNSs厚度分析.BPNSs的厚度分布利用原子力显微镜(AFM, AGILENT, 5100)进行表征.取制得的BPNSs滴于硅片上, 真空干燥过夜后进行AFM表征(图 4 a).统计分析得到BPNSs的厚度分布图(图 4 b).制得的BPNSs厚度为(58.05±36.48) nm, 大约为25~111层.
 |
| 图 4 BPNSs的AFM图(a)及厚度统计图(b) Fig. 4 AFM image of BPNSs (a) and thickness distribution of BPNSs(b) |
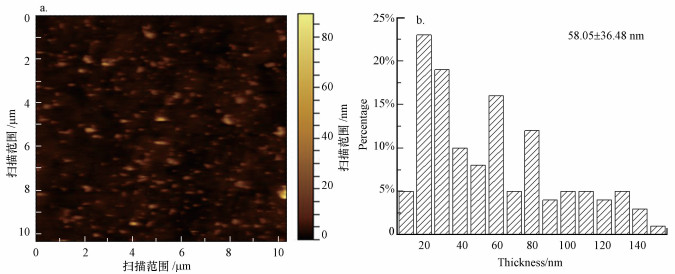
将BPNSs置于培养基中, 图 5a记录了100 mg·L-1 BPNSs第0~5 d的颜色变化, 从棕黑色逐步变为浅棕黄色;如图 5 b所示, 通过测试各浓度BPNSs在460 nm处的吸光度值变化反映了其第0~5 d的降解情况.结果表明随着时间增加各浓度的BPNSs均在逐步降解.
 |
| 图 5 100 mg·L-1BPNSs第0~5 d颜色变化(a)及各浓度BPNSs在460 nm处的降解曲线(b) Fig. 5 Color change of 100 mg·L-1BPNSs from 0 d to 5 d(a) and Degradation curves of 0、50 and 100 mg·L-1BPNSs at 460 nm(b) |
① 斜生栅藻生长曲线及拟合方程.斜生栅藻培养过程中利用荧光显微镜(Olympus, BX53)观察计数来确定其生长曲线(图 6 a).利用紫外可见分光光度计(Uv-Vis, HACH, DR6000)在650 nm处测得OD值, 将其与斜生栅藻密度进行拟合得到拟合方程y=0.02445x-0.07259(图 6b).正式实验前将斜生栅藻预培养至对数生长期.
 |
| 图 6 斜生栅藻生长曲线(a)及拟合方程(b) Fig. 6 Growth curve of Scenedesmus obliquus(a) and Fitted equation of Scenedesmus obliquus (b) |
② BPNSs对斜生栅藻的生长抑制效应.对照组与各处理组斜生栅藻第0~5 d的颜色变化如图 7 a所示, BPNSs处理组颜色随着暴露时间增加而变浅, 说明BPNSs在逐渐降解.图 7 b是对照组与处理组斜生栅藻的生长曲线: 可以看出各浓度BPNSs均抑制斜生栅藻的正常生长.暴露120 h后, 各处理组藻细胞密度与对照组相比均产生显著性差异(p < 0.05), 10、50、100 mg·L-1 BPNSs对斜生栅藻的生长抑制率分别为22.64%, 37.34%, 59.07%.通过计算得出120 h斜生栅藻的EC50为74.86 mg·L-1.
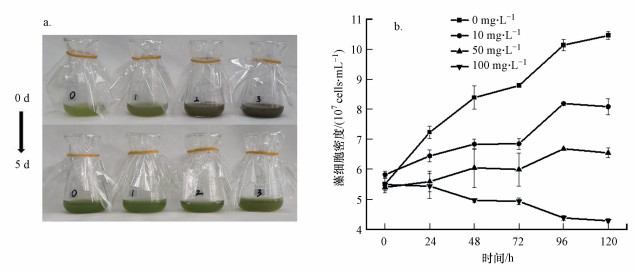 |
| 图 7 斜生栅藻第0~5 d的颜色变化(a)及BPNSs对斜生栅藻的生长抑制效应(b) Fig. 7 Color change from 0 d to 5 d of Scenedesmus obliquus (a) and Inhibition effect of BPNSs on the growth of Scenedesmus obliquus (b) |
非生物胁迫会影响藻类的光合色素含量, 降低藻类的光合效率, 进而影响藻类的正常生长.图 8反映的是BPNSs暴露120 h后对照组与处理组斜生栅藻的叶绿素a含量.可以看出处理组藻类叶绿素a含量与对照组相比显著降低(p < 0.05), 10、50、100 mg·L-1处理组含量分别下降11.12%、39.59%、50.69%, 呈明显剂量-效应关系;表明BPNSs会抑制藻类进行正常光合作用.
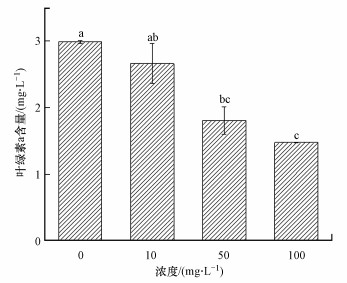 |
| 图 8 暴露120 h时斜生栅藻叶绿素a含量 Fig. 8 The content of Chlorophyll a in Scenedesmus obliquus after 120 h exposure |
图 9a反映的是BPNSs暴露48 h后对照组与处理组斜生栅藻细胞内ROS的含量.由图可知, 暴露48 h后各处理组藻细胞内ROS含量均显著高于对照组(p < 0.01), 10、50、100 mg·L-1处理组ROS含量分别为对照组的2.76、4.80及8.14倍, 呈现明显剂量-效应关系;表明BPNSs会刺激斜生栅藻产生大量ROS.
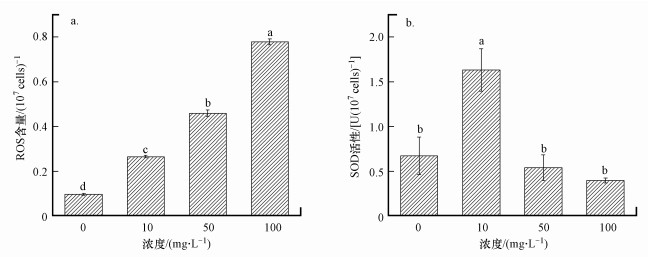 |
| 图 9 暴露48 h时斜生栅藻细胞内ROS含量(a) 及暴露48 h时斜生栅藻细胞内SOD活性(b) Fig. 9 The content of ROS in Scenedesmus obliquus after 48 h exposure (a) and SOD activity in Scenedesmus obliquus after 48 h exposure(b) |
SOD能歧化超氧阴离子自由基, 生成过氧化氢和分子氧, 在细胞的抗氧化保护机制中起着至关重要的作用(马旭俊等, 2003).由图 9 b可以看出暴露48 h后斜生栅藻细胞内SOD的活性随着BPNSs浓度的增加先升高再降低: 10 mg·L-1处理组SOD活性是对照组的2.44倍, 活性明显增强(p < 0.05);而50、100 mg·L-1处理组SOD活性分别为对照组的0.80、0.59倍, 且呈现非显著性差异(p>0.05).
3.3.4 BPNSs对斜生栅藻的吸附团聚现象图 10 a是对照组斜生栅藻在显微镜(100×)下的形态, 呈完整光滑的纺锤形;图 10 b是斜生栅藻暴露于100 mg·L-1 BPNSs中48 h后的形态, 可以明显看出斜生栅藻周围团聚了大量BPNSs(箭头所指为BPNSs).由此推测BPNSs可能会吸附团聚在藻细胞周围影响其吸收光能进行光合作用从而抑制细胞正常生长.
 |
| 图 10 显微镜下(100 ×), 对照组斜生栅藻形态(a)及100 mg·L-1 BPNSs处理组斜生栅藻形态(b) Fig. 10 Under the microscope (100 ×), the morphology of Scenedesmus obliquus of the control group(a) andthe morphology of Scenedesmus obliquus exposed to 100 mg·L-1 BPNSs(b) |
场发射扫描电镜(FE-SEM)观察结果与显微镜观察结果基本一致.对照组的斜生栅藻呈完整光滑的纺锤形(图 11a);处理组的藻细胞周围和表面团聚了大量BPNSs(黑色箭头所指为BPNSs), 且细胞形态发生明显变化, 细胞边缘不再完整, 细胞破裂(白色箭头所指为细胞受损状态)导致内容物流出(图 11 b).
 |
| 图 11 正常斜生栅藻扫描电镜图(a) 及100 mg·L-1 BPNSs处理组斜生栅藻扫描电镜图(b) Fig. 11 SEM images of Scenedesmus obliquus (a) and Scenedesmus obliquus exposed to 100 mg·L-1BPNSs (b) |
每个磷(P)原子上都有一对活跃的孤电子, 所以BPNSs易被氧化.水分子(H2O)解离生成的氢氧根离子(OH-)接近BPNSs后可自发反应形成P—O键, 同时导致BPNSs原有的P—P键断裂, 从而引发一连串的降解反应.而且在有水存在的条件下, 氧化后的P可以继续与水反应生成磷酸盐(Zhang et al., 2019;秦莉等, 2020).Li等(2020)通过离子色谱法测得BPNSs逐步降解的主要产物为可溶性磷酸盐H3PO2、H3PO3和H3PO4, 比例分别为18.4%, 48.2%和35.4%.且3种磷酸盐总浓度为100 μmol·L-1(相当于6.60 mg·L-1 H3PO2、8.20 mg·L-1 H3PO3、9.80 mg·L-1 H3PO4)时, 会显著抑制小球藻生长.此前已有研究人员进行了不同质量浓度总磷对栅藻生长影响的实验, 发现> 0.2 mg·L-1的总磷即可对栅藻产生较明显的抑制效应(林海等, 2018).因此, 高浓度BPNSs逐步降解产生的磷酸盐可能会增强BPNSs对斜生栅藻的毒性效应.
4.2 BPNSs对斜生栅藻的生长抑制效应BPNSs对斜生栅藻的生长抑制效应呈现时间-效应与剂量-效应关系.10、50 mg·L-1BPNSs在前96 h内对斜生栅藻的生长抑制效应并不明显, 96 h开始显著抑制其生长, 这可能是养分不足及BPNSs暴露的双重胁迫造成的;而100 mg·L-1 BPNSs对斜生栅藻生长起到显著抑制效应.BPNSs对斜生栅藻的120 h EC50为74.86 mg·L-1.目前, 还没有相关文献报道过BPNSs在水环境中的分布残留情况, 从本研究结果来看, 其对藻类生长的危害较小, 若长期排放或大量残留在水体中可能导致一定的生态环境风险.
4.3 BPNSs对斜生栅藻光合作用的影响光合作用是藻类生长的重要生命活动, 叶绿素a的合成决定了叶绿素的总量.此前已有研究证实纳米材料会抑制植物的光合作用: 纳米氧化铜破坏藻类的细胞结构, 造成叶绿体形变, 抑制藻类进行正常的光合作用(车兴凯, 2019);Dewez等(2012)研究发现纳米银可以导致衣藻细胞光合体系反应中心结构性恶化, 抑制电子传递链的活性从而抑制光合作用. 本实验中斜生栅藻叶绿素a含量的降低表明, BPNSs可能会抑制藻类合成光合色素, 导致其对光能的吸收及转化效率下降, 光合能力降低, 从而影响生物体进行正常生理代谢.
4.4 BPNSs对斜生栅藻的氧化损伤作用氧化损伤是指细胞内还原型谷胱甘肽(GSH)被耗尽而氧化型谷胱甘肽(GSSG)累积的状态(Wedgwood et al., 2019).ROS是分子态氧在还原过程中产生的一系列中间产物, 生物体内正常代谢可以产生ROS, 同时生物体本身存在清除ROS的体系, 包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等, 这一体系使生物体内ROS保持在对机体无害的水平.但在细胞受到外界刺激后, 细胞内ROS含量快速增加, 导致细胞内ROS生成与清除系统失衡, 造成细胞氧化损伤;进而破坏生物膜、扰乱DNA表达、抑制蛋白质活性从而导致细胞死亡.已有研究表明, BPNSs会导致细胞氧化损伤, 细胞内ROS大量产生引起SOD活性降低、脂质过氧化和DNA断裂(Song et al., 2018).Hu等(2014)探索了不同浓度氧化石墨烯(GO)对斜生栅藻的致毒机理, 结果表明GO能够对斜生栅藻产生氧化损伤, 导致一系列的代谢紊乱.在本研究中, 各浓度BPNSs均刺激斜生栅藻产生大量ROS, 且呈现出剂量-效应关系.低浓度BPNSs(10 mg·L-1)引起藻细胞内SOD活性升高, 以此来对抗BPNSs造成的氧化损伤;当BPNSs浓度较高时(50、100 mg·L-1), 抑制SOD活性, 细胞内累积的ROS量过多超出了可清除阈值, 预示着细胞稳态的失衡.
4.5 BPNSs对斜生栅藻的吸附团聚作用纳米材料在生物环境中会选择性地吸附生物环境中的离子/分子而形成纳米-生物的聚集体(nano-bio-complex), 揭示了纳米材料-生物体系之间存在复杂的相互作用(Xu et al., 2012).已有研究表明: 纳米材料可以吸附在生物体的外表面.参照Handy等(2008)提出的生物表面不动层会吸附纳米材料的理论, 藻细胞表面可能形成了含有黏液分泌物(比如富含多糖的纤维素)和细胞表面配体的复杂不动层, 其具有缓慢流动性和粘性的特征, 因此会产生剪切力导致颗粒聚集, 即细胞表面不动层带来了更高的表面张力, 从而对黑磷产生了吸附作用.同时黑磷作为纳米材料粒径很小, 因而具有极高的比表面能和很大的范德华力, 分子间作用力极强, 容易与藻细胞产生物理吸附作用(王壮等, 2009;张宁等, 2011).此前已有研究证实了这一观点, 莱茵依藻细胞表面吸附有大量纳米量子点形成聚集物, 从而影响藻细胞进行正常生理活动(Lin et al., 2009);纳米碳管可以团聚斜生栅藻和月牙藻, 生成藻-纳米碳管聚合物, 并且产生遮光效应从而抑制藻的正常生长(Schwab et al., 2011);氧化石墨烯也被发现可以与大量微生物形成聚合物(Mohanty et al., 2011;Wahid et al., 2013).综上所述, BPNSs可能会通过吸附作用团聚在斜生栅藻周围, 形成物理上的遮光作用, 从而很大程度影响细胞内叶绿体等各个细胞器的正常生理活动抑制细胞生长.
4.6 BPNSs对斜生栅藻的物理损伤纳米材料可以通过对细胞造成物理损伤从而抑制其生长.Akhavan等(2010)将大肠杆菌暴露于石墨烯中, 发现细菌RNA出现外流现象, 说明石墨烯锋利的边缘直接与细菌接触, 很大程度地破坏了细菌的细胞壁, 导致细菌失去活性.Kang等(2008)通过SEM观测发现碳纳米管与大肠杆菌直接接触会严重破坏其细胞壁的完整性, 相关基因的表达也支持了这一发现.即使藻细胞具有由多糖和纤维素组成的较硬的细胞壁, 纳米材料依然能够对其造成物理损伤.已有研究表明, 石墨烯锋利的边缘直接接触斜生栅藻会使其细胞壁严重受损, 甚至进入细胞造成叶绿体等细胞器的损伤(Du et al., 2016).Zhao等(2017)也同样发现石墨烯锋利的边缘能够破坏细胞结构造成物理损伤.图 11可以看出BPNSs对斜生栅藻产生了极大的物理损伤, 这一现象可能是BPNSs的片层结构导致的, 其锋利的边缘切割藻细胞壁对其造成物理损伤;藻细胞结构严重受损, 膜功能运作受阻, 细胞内容物流出, 进而引发细胞功能异常.
5 结论(Conclusions)1) 不同浓度BPNSs均抑制斜生栅藻的生长且呈现时间-效应、剂量-效应关系, 120 h EC50为74.86 mg·L-1.
2) 不同浓度BPNSs均能够诱导藻细胞产生过量ROS, 各处理组细胞内部ROS水平显著高于对照组, 说明BPNSs对斜生栅藻造成了不同程度的氧化损伤从而抑制藻细胞生长.
3) BPNSs可能通过吸附作用团聚在藻细胞周边及表面, 影响细胞内叶绿体等各个细胞器的正常生理活动从而抑制细胞生长.
4) BPNSs为片层结构, 其锋利的边缘或许会破坏藻细胞壁造成物理损伤, 引起藻细胞结构破坏, 膜功能运作受阻, 细胞内容物流出, 进而引发细胞功能异常.
Akhavan O, Ghaderi E. 2010. Toxicity of graphene and graphene oxide nanowalls against bacteria[J]. ACS Nano, 4(10): 5731-5736. DOI:10.1021/nn101390x |
Brent J R, Savjani N, Lewis E A, et al. 2014. Production of few-layer phosphorene by liquid exfoliation of black phosphorus[J]. Chemical Communications, 50(87): 13338-13341. DOI:10.1039/C4CC05752J |
车兴凯. 2019. 纳米氧化铜对藻类毒害的机理研究[D]. 山东: 山东农业大学. 0-88
|
Chen W S, Jiang O Y, Yi X Y, et al. 2018. Black phosphorus nanosheets as a neuroprotective nanomedicine for neurodegenerative disorder therapy[J]. Advanced Materials, 30(3): 1703458. DOI:10.1002/adma.201703458 |
Dewez D, Oukarroum A. 2012. Silver nanoparticles toxicity effect on photosystem Ⅱ photochemistry of the green alga Chlamydomonas reinhardtii treated in light and dark conditions[J]. Toxicological and Environmental Chemistry, 94(8): 1536-1546. DOI:10.1080/02772248.2012.712124 |
Du S T, Zhang P, Zhang R R, et al. 2016. Reduced graphene oxide induces cytotoxicity and inhibits photosynthetic performance of the green alga Scenedesmus obliquus[J]. Chemosphere, 164: 499-507. DOI:10.1016/j.chemosphere.2016.08.138 |
Guo Z N, Zhang H, Lu S B, et al. 2015. Phosphorene: From black phosphorus to phosphorene: Basic solvent exfoliation, evolution of raman scattering, and applications to ultrafast photonics[J]. Advanced Functional Materials, 25(45): 6996-7002. DOI:10.1002/adfm.201502902 |
Handy R D, Kammer F, Lead J R, et al. 2008. The ecotoxicology and chemistry of manufactured nanoparticles[J]. Ecotoxicology, 17: 287-314. DOI:10.1007/s10646-008-0199-8 |
Hu X G, Kang J, Lu K C, et al. 2014. Graphene oxide amplifies the phytotoxicity of arsenic in wheat[J]. Scientific Reports, 4: 6122. |
Kang S, Herzberg M, Rodrigues D, et al. 2008. Antibacterial effects of carbon nanotubes: Size does matter![J]. Langmuir, 24(13): 6409-6413. DOI:10.1021/la800951v |
Klaine S J, Alvarez P J J, Batley G E, et al. 2008. Nanomaterials in the environment: Behavior, fate, bioavailability, and effects[J]. Environmental Toxicology and Chemistry, 27(9): 1825-1851. DOI:10.1897/08-090.1 |
李合生, 孙群, 赵世杰, 等. 2000. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 134-137.
|
林海, 王源, 李冰. 2018. 不同浓度的磷对栅藻生长的影响[J]. 吉林农业, 441(24): 65. |
Latiff N M, Teo W Z, Sofer Z, et al. 2015. The cytotoxicity of layered black phosphorus[J]. Chemistry, 21(40): 13991-13995. DOI:10.1002/chem.201502006 |
Li P, Zeng L, Gao J, et al. 2020. Perturbation of normal algal growth by black phosphorus nanosheets: The role of degradation[J]. Environmental Science & Technology Letters, 7(1): 35-41. |
Lin S, Bhattacharya P, Rajapakse N C, et al. 2009. Effects of quantum dots adsorption on algal photosynthesis[J]. Journal of Physical Chemistry C, 113(25): 10962-10966. DOI:10.1021/jp904343s |
Lu W L, Nan H Y, Hong J H, et al. 2014. Plasma-assisted fabrication of monolayer phosphorene and its Raman characterization[J]. Nano Research, 7(6): 853-859. DOI:10.1007/s12274-014-0446-7 |
马旭俊, 朱大海. 2003. 植物超氧化物歧化酶(SOD)的研究进展[J]. 遗传, 25(2): 225-231. DOI:10.3321/j.issn:0253-9772.2003.02.025 |
Mohanty N, Fahrenholtz M, Nagaraja A, et al. 2011. Impermeable graphenic encasement of bacteria[J]. Nano Lett, 11(3): 1270-1275. DOI:10.1021/nl104292k |
Mu X Y, Wang J Y, Bai X T, et al. 2017. Black phosphorus quantum dot induced oxidative stress and toxicity in living cells and mice[J]. ACS Applied Materials & Interfaces, 9(24): 20399-20409. |
秦莉, 李瑞瑞, 何汇洋, 等. 2020. 黑磷纳米片的制备及降解特性评价[J]. 沈阳药科大学学报, 37(5): 385-389. |
Song S J, Shin Y C, Lee H U, et al. 2018. Dose-and time-dependent cytotoxicity of layered black phosphorus in fibroblastic cells[J]. Nanomaterials, 8(6): 408. DOI:10.3390/nano8060408 |
Schwab F, Bucheli T D, Lukhele L P, et al. 2011. Are carbon nanotube effects on green algae caused by shading and agglomeration?[J]. Environmental Science & Technology, 45(14): 6136-6144. |
王壮, 陈景文, 邱文, 等. 2009. 纳米TiO2和CeO2及外源性化合物对绿藻的联合毒性[C]. 第五届全国环境化学大会. 大连: 560
|
Wahid M H, Eroglu E, Chen X J, et al. 2013. Entrapment of Chlorella vulgaris cells within graphene oxide layers[J]. RSC Advances, 3(22): 8180-8183. DOI:10.1039/c3ra40605a |
Wedgwood S, Steinhorn R H, Lakshminrusimha S. 2019. Optimal oxygenation and role of free radicals in PPHN[J]. Free Radical Biology and Medicine, 142: 97-106. DOI:10.1016/j.freeradbiomed.2019.04.001 |
Xia F N, Wang H, Xiao D, et al. 2014. Two-dimensional material nanophotonics[J]. Nature Photonics, 8(12): 899-907. DOI:10.1038/nphoton.2014.271 |
Xu M S, Li J, Hideo I, et al. 2012. Formation of nano-bio-complex as nanomaterials dispersed in a biological solution for understanding nanobiological interactions[J]. Scientific Reports, 2(1): 2781-2795. |
张宁, 金星龙, 李晓, 等. 2011. 人工纳米材料对藻类的毒性效应研究进展[J]. 安徽农业科学, 39(10): 6000-6003. DOI:10.3969/j.issn.0517-6611.2011.10.126 |
Zhang X J, Zhang Z M, Zhang S Y, et al. 2017. Size effect on the cytotoxicity of layered black phosphorus and underlying mechanisms[J]. Small, 13(32): 1701210. DOI:10.1002/smll.201701210 |
Zhang S Y, Zhang X J, Lei L, et al. 2019. pH-dependent degradation of layered black phosphorus: Essential role of hydroxide ions[J]. Angewandte Chemie International Edition, 58(2): 467-471. DOI:10.1002/anie.201809989 |
Zhao J, Cao X S, Wang Z Y, et al. 2017. Mechanistic understanding toward the toxicity of graphene-family materials to freshwater algae[J]. Water Research, 111: 18-27. DOI:10.1016/j.watres.2016.12.037 |
 2021, Vol. 41
2021, Vol. 41


