污水资源化已成为污水处理可持续发展的一个重要方向.针对普遍认为棘手的污水处理产物——剩余污泥, 目前国际上兴起的污泥有机质转化高附加值产品的研究也已兴起(van Loosdrecht et al., 2014; Lin et al., 2015; Xue et al., 2019; Kim et al., 2020), 传统上仅仅将污泥有机质视作能源载体(转化甲烷/CH4)的观点正受到质疑(Hao et al., 2019).污泥中胞外聚合物(EPS)、藻酸盐、PHA等高附加值有机物转化与提取具有潜在应用前景(Madkour et al., 2013; van der Roest et al., 2015; Urtuvia et al., 2017; Leeuwen et al., 2018; Nancharaiah et al., 2018; Kim et al., 2020).
污泥主要由细胞体和EPS两大部分组成.EPS约占污泥干重的10%~40%(Basuvara et al., 2015).EPS通常来自于微生物细胞自溶、细胞分泌物以及细胞表面脱落物等, 主要为多糖、蛋白质(结构蛋白或胞外酶)、核酸、脂质、腐殖质和其他一些胞内物质(Flemming et al., 2016).其中, 蛋白质和多糖为主要成分, 约占EPS总含量的70%~80%.EPS分子相对较低的表面电荷和较高的疏水性可促进微生物聚集; 多糖分子富含羟基、羧基等亲水官能团, 可以通过吸附架桥等作用形成稳定而具有弹性的网状结构对游离细胞进行交联与固定则有利于污泥絮凝(Wang et al., 2006; Li et al., 2006; Adav et al., 2008a); 蛋白质和脂质可维持絮体结构稳定性, 相应改善污泥生物絮凝性.这些物质通过静电作用力、氢键结合、离子吸引力、生物化学等作用形成紧致高密网状结构, 可作为微生物的保护层, 抵御外部重金属和有毒化合物等不利因素侵袭(Sheng et al., 2010).EPS成分不同性能和组合方式使其具有多种复杂结构, 具有较高的回收与利用价值(More et al., 2014).
目前, 对污泥EPS研究侧重于其在污水处理过程中促进污染物去除机理以及在后续污泥处理处置中承担的作用.一些以提取与回收EPS研究也多采用典型方法“囫囵”提取, 提取物仅仅被谓之“胞外聚合物”或“有机物混合物”, 并非“高附加值有机物”, 较难获得纯度较高的某一类、甚至某一种有机化合物(Seviour et al., 2019).
国际上, 一些学者已经意识到这些典型方法的缺陷, 开展了较多针对颗粒污泥EPS优化提取方法的研究, 试图提高EPS纯度与产量, 同时保留其理化性质(Pronk et al., 2017; Lin et al., 2018; Lotti et al., 2019; Wang et al., 2020), 这些方法与传统典型方法截然不同.基于此, 本文首先阐述EPS在污泥中含量及成分差异, 进而分析典型传统EPS提取方法之利弊; 以此为基础, 阐述基于特定单一或多组分物质“定制”的提取方法(包括胞外多糖与胞外蛋白质), 从而指明高附加值回收EPS发展方向; 在总结进水基质、营养物负荷、运行参数、优势菌属等因素对污泥EPS产量产生差异的情况下, 提出EPS高效增产技术方案; 最后, 分析当前EPS回收应用瓶颈, 以期为EPS未来广泛回收利用之前景奠定理论与技术基础.
2 EPS含量与成分差异(Proportions and components of EPS)EPS提取的基础是了解其在污泥中含量以及成分, 并剖析其理化特性.不同种类污泥EPS含量不同, 表 1中列出了3种典型污泥中EPS含量与组分.一般认为絮状污泥(~10%)相较颗粒污泥(~20%)而言产生的EPS含量少, 而生物膜EPS含量则处于最低水平(Mahendran et al., 2012; Basuvaraj et al., 2015; Ding et al., 2015; Zhu et al., 2015).EPS通过改变表面电荷以及疏水性影响污泥絮凝以及造粒过程(Zhu et al., 2015), 而从活性污泥向颗粒污泥造粒转变过程其EPS含量变化机理则存在较大争议(Tu et al., 2012; Li et al., 2017; Schambeck et al., 2020).研究表明, 在絮状污泥向颗粒化转化的前后阶段(80%絮状污泥颗粒化)EPS含量并无明显变化(Schambeck et al., 2020); 但也存在着相反的研究结果, 认为EPS含量随着颗粒化程度提高而不断降低(Tu et al., 2012; Li et al., 2017).一些研究还认为, 较高水平EPS含量有利于颗粒污泥形成与稳定(Liu et al., 2009; Tang et al., 2011), 但过量EPS则会限制氧气、有机物和营养物质扩散与传质, 这意味着过量EPS对颗粒污泥的稳定性是有害的(Corsino et al., 2016).
| 表 1 不同污泥种类EPS含量与组分分析 Table 1 Proportions and components of EPS in different types of sludge |
表 1显示, 不同污泥EPS含量不同, 其组分也不一样, 而关于EPS对污泥聚集性和结构稳定性具有决定影响的关键成分目前还未得到明确界定(Yu, 2020).针对生物膜, 有人利用荧光原位杂交(FISH)与荧光染色两种分子生物学方法研究了生物膜EPS与微生物在生物膜表面纵向空间分布; 结果显示, 生物膜中不同组分沿EPS厚度方向上呈梯度变化, 表层蛋白质含量高, 而沿生物膜深度方向逐渐减少, 多糖则与之相反(陈园园等, 2017).这可能是因为表层高活性微生物增殖与代谢能力均强于内层, 导致产生的胞外酶相对较多, 而胞外酶则是一种组成EPS的特殊蛋白质分子(陈园园等, 2017).多糖凝胶特性是作为生物膜的“粘合剂”, 有利于微生物粘附聚集到载体表面, 尤其对生物膜吸附成膜具有重要作用, 这与生物膜内沿深度方向粘结力增大所相对应, 导致多糖含量沿生物膜深度方向逐渐增加(殷峻等, 2012).从这些研究可以推测得出, 生物膜系统中胞外蛋白和胞外多糖也许是分别作为功能性成分和结构性成分而存在.
研究表明, EPS对颗粒污泥形成、结构和功能完整性存在重要影响, 可促进颗粒污泥形成(Wang et al., 2005; Sheng et al., 2010).但不同于生物膜, 研究认为胞外蛋白可能是颗粒污泥EPS的主要结构性成分, 而非功能性成分(McSwain et al., 2005; Zhu et al., 2012; Zhu et al., 2015; Lotti et al., 2019).蛋白质含有较多疏水性官能团、且能有效降低细胞表面电负性容易凝聚成细小生物聚集团体, 最终帮助成核; 辅之以反应器水力筛选作用, 最终富集获得大颗粒污泥(Boleij et al., 2019; Lotti et al., 2019).研究人员采用原位荧光染色、辅以激光共聚焦显微镜(CLSM)技术观测到颗粒污泥的最内核主要是蛋白质结构, 推测蛋白质是形成颗粒污泥的基础(McSwain et al., 2005).有人利用三维荧光光谱(3D-EEM)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE)也得到同样结论, 认为芳香蛋白、色氨酸蛋白等高分子量蛋白是颗粒污泥中关键组分, 其蛋白结构上多种官能团可以提供更多与阳离子和其他有机物结合位点和作用点, 对颗粒污泥形成和结构稳定性起着重要作用(Zhu et al., 2015); 进一步对EPS成分多糖和蛋白质量化分析发现, 胞外蛋白含量在絮状、好氧颗粒污泥以及厌氧颗粒污泥LB-EPS(松散型EPS)中含量分别为(8.5±1.5)、(33.6±9.7)以及(27.1±2.8) mg·g-1, 而在TB-EPS(紧密性EPS)中分别为(43.1±2.7)、(96.8±11.9)以及(61.6±4.2) mg·g-1, 表明不论在TB-EPS还是LB-EPS中, 颗粒污泥中胞外蛋白含量都要远高于絮状污泥; 而胞外多糖含量在三者之间却无明显差异, 平均约为30 mg·g-1(Zhu et al., 2015).胞外蛋白与胞外多糖之比(PN/PS)也能更好评价污泥EPS成分特征; 颗粒污泥PN/PS值分别为3.3(好氧)和4.2(厌氧), 远远高于活性污泥絮体的1.6(Zhu et al., 2015)以及生物膜的1.2(Mahendran et al., 2012), 推测可能较高的PN/PS比更有利于污泥颗粒化转变和稳定性保持(Zhu et al., 2012).但也有研究认为, 胞外蛋白并非EPS主要结构成分; 因为胞外多糖具有凝胶性质, 它可能才是主要促成和保持污泥颗粒化的主要成分(Seviour et al., 2010a; Lin et al., 2010).
3 典型EPS提取方法(Conventional EPS extraction methods) 3.1 方法评价如表 1所示, 不同种类污泥EPS含量与组分差异较大, EPS主要结构与功能组分还存在较大争议, 直接影响到EPS在污水处理过程促进污染物去除的角色与机理探究.为此, 大部分提取、分析EPS的研究均期望能得出有关EPS的准确结论.综合来看, 这些研究中有关污泥典型EPS提取方法主要包括物理法、化学法及其组合方法.其中, 物理法通常是采用外力(如, 剪切力、离心力等)将EPS与细胞分离, 并将其溶解后实现固、液两相分离, 包括超声波处理、高速离心和热提取法; 化学法是通过添加化学试剂(如, 酸、碱、有机溶剂等)实现与EPS所含某些特殊官能团螯合而实现EPS的分离与提取, 包括阳离子交换树脂(CER)、甲醛-氢氧化钠(HCHO-NaOH)法、乙二胺四乙酸(EDTA)法、高温碳酸钠(Na2CO3)法和甲酰胺-氢氧化钠(HCONH2- NaOH)法等(Sheng et al., 2010).典型EPS提取方法原理与优缺点比较列于表 2(方晓敏, 2019).有人则分别采用这些方法提取好氧颗粒污泥中EPS, 结果如图 1所示(Felz et al., 2016).从图 1可以看出, 物理提取方法效率较低, 化学法相对较高; 但综合考虑表 2中化学法提取缺点, 化学法可能改变EPS组分性能, 同时, “化学破坏”过程可能导致提取物纯度不高.
| 表 2 EPS不同提取方法原理与优缺点(方晓敏, 2019) Table 2 Advantages and disadvantages of different EPS extraction methods |
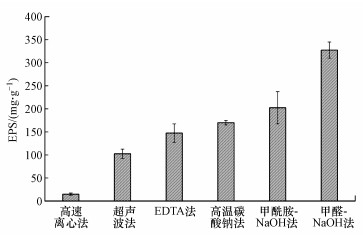 |
| 图 1 典型EPS提取方法获取的好氧颗粒污泥EPS量 (Felz et al., 2016) Fig. 1 EPS proportions of aerobic granular sludge by different EPS extraction methods |
为弥补以上方法所存在的缺陷, 同时提高EPS产量与效率, 很多研究者针对提取过程参数开展了优化研究并予以验证, 这包括化学药剂投加顺序和浓度、设备操作参数(超声功率与脉冲时间、离心转速与时间等)、提取操作环境(pH、温度等)等(段亮等, 2010; 郑晓英等, 2013).以本研究团队尝试调整超声波功率与离心转速为例, 超声功率越高, EPS提取量越大; 150 W功率提取量较100 W可提高29.4%;继续增加功率至200 W, EPS提取量仅提高16.7%, 增量效果逐渐减弱(王欣, 2020).对离心转速(5145~10000 r·min-1)调整试验发现, EPS提取量提高仅介于11.2%~18.0%(王欣, 2020).显然, 传统优化手段在一定程度上通过调整参数均可一定程度提高EPS提取产量, 但是, 优化过程所采取的高功率、长时耗、高转速等手段却意味着较高的能耗和成本支出, 且并不能获得高纯度EPS物质.
4 EPS提“纯”策略(Strategies for high purified EPS)优化方法直接影响到提取效率以及提取组分.目前, EPS典型提取方法只是将EPS作为一种笼统研究对象, 并没有针对其中某种组分或结构予以提取并分离(Seviour et al., 2019).高效优化方法则改变固有观念, 在考虑EPS组分的物理、化学性质差异基础上, “定制”基于产物的提取方法, 有可能分离出某种或几种高纯度EPS物质, 使EPS高值回收成为现实.
4.1 基于单一目标产物回收EPS物质主要成分为胞外多糖和胞外蛋白质, 以下从针对这两种特定物质的提取、分离方法总结EPS回收策略.
4.1.1 胞外多糖(PS)EPS组分胞外多糖中典型组分是类藻酸盐物质(ALE), 为一种主要由多糖以及蛋白构成的高聚物, 它与从大型海藻提取的藻酸盐具有高度相似结构和性质(Lin et al., 2010).ALE与二价阳离子具有高度特异性作用, 表现出刚性、不可变形凝胶性质, 是维持污泥强度、弹性、疏水性以及保护微生物细胞的一种密实结构(Lin et al., 2010); ALE亦可广泛应用于食品、医药、纺织、印染、造纸、日化、建筑等行业, 用作各类防水、防火材料、增稠剂、乳化剂、稳定剂、粘合剂、上浆剂等(Rehm, 2010; Lin et al., 2015; Kim et al., 2020).
目前从污泥中提取藻酸盐方法主要借鉴了从海藻中提取藻酸盐的方法:钙凝离子交换法、钙凝酸化法、酸凝酸化法、酶解法(王孝华, 2003; 田洪芸等, 2016).王琳等(2007)借鉴酸凝酸化法采用高温碳酸钠以及酸析出、有机萃取的方法成功从颗粒污泥中提取出藻酸盐类物质, 过程如图 2a所示.在ALE提取过程中, 颗粒污泥可与Na2CO3反应, Ca2+的位置被Na+取代, Ca2+以CaCO3沉淀形式脱离, 而ALE则由不溶性藻酸钙转变为可溶性藻酸钠, 同时, 好氧颗粒污泥也从凝胶态转变为溶胶态, 最终可获得类藻酸盐物物质提取量达35.1%±1.9%.污泥ALE成功提取与分离奠定了污泥胞外多糖研究的基础, 将胞外多糖模糊研究逐步深入到单一多糖研究层面(王琳等, 2007).以此为基础, Lin等(2010; 2013; 2015)继续深入研究, 继续沿用以上方法提取活性污泥(7.2%±0.6%)与颗粒污泥(16%±0.4%)中类藻酸盐物质, 显示出颗粒污泥具有更大类藻酸盐物质提取潜力.这些研究不仅着眼于ALE提取量, 更重要的是关注了提取物的特殊用途, 特别表征了ALE其作为表面涂料/防火涂层的性能(Lin et al., 2015; Kim et al., 2020).
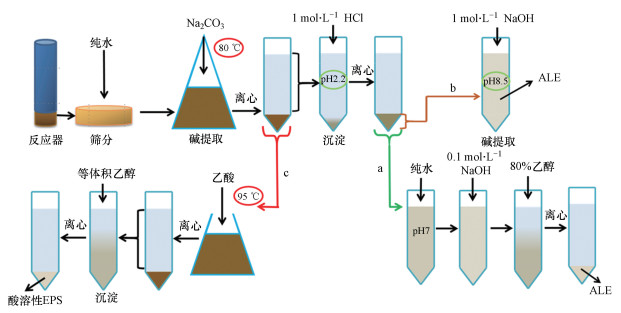 |
| 图 2 污泥类藻酸盐物质与酸溶性EPS提取方法 (Lin et al., 2010; 2015;Felz et al., 2016; Pronk et al., 2017) Fig. 2 Extracted methods of alginate-like exopolysaccharides and acid soluble EPS |
Felz等(2016)采用表 2所列6种典型提取方法, 验证了不同方法的有效性的同时, 进一步评价了好氧颗粒污泥中ALE含量与组分; 结果发现, 只有高温碳酸钠法能够有效将颗粒污泥解体并获得溶解性水凝胶基质, 从而顺利分离出类藻酸盐物质, 而其他5种方法仅能部分破坏污泥表观结构, 并不能改变这种类藻酸盐物质存在形式(颗粒态向溶解态转变), 也就无法实现有效分离(Felz et al., 2016).
Pronk等(2017)利用Felz等(2016)所采用的高温碳酸钠方法(其过程见图 2b)继续研究好氧颗粒污泥类藻酸盐物质提取; 他们惊讶的发现, 在高温碳酸钠处理后准备固液分离时仍存在大量完整的不溶颗粒态物质, 推测为未溶解的污泥颗粒.Felz等(2016)研究强调, 颗粒完全溶解是提取结构性EPS的重要前提条件, 意味着只有当颗粒状或生物膜结构被完全溶解后结构性EPS(类藻酸盐物质)方有可能被释放而被提取.这也解释了为什么Pronk等(2017)提取的ALE产率极低, 仅为1.4%VSS, 远远低于Felz等(2016)研究报道的约20%VSS.
上述研究虽然解释了类藻酸盐物质提取量低的原因, 但存在的疑问是大量研究发现高温碳酸钠法提取的污泥胞外多糖物质(PS)含量占比>5%(Lin et al., 2013)!莫非Pronk等(2017)研究获得1.4%VSS之外的多糖物质为其他物质?Pronk等(2017)猜想, EPS成分中也许只有部分物质作为结构性成分而存在, 其他物质可能为“填充物”或“功能修饰物”.为此, Pronk等(2017)将未溶解的颗粒态物质进行萃取、分离(图 2c), 因此而获得另外一种胞外多糖物质, “酸溶性EPS(Acid soluble EPS)”; 成分剖析显示, 这是一种由O-甲基葡萄糖和半乳糖作为单体组成的聚合物, 其来源是以Defluviicoccus Cluster Ⅱ菌属为主的颗粒污泥胞外高聚物, 成分与类藻酸盐物质或淀粉样蛋白质完全不同; 有关于其具体结构功能以及潜在应用前景还有待进一步研究(Lin et al., 2010; 2018; Pronk et al., 2017; Lotti et al., 2019).
在评价EPS提取方法体系中认为EPS作为胞外聚合物而在提取过程强调保证细胞的完整性, 以防细胞内有机物流出而造成提取物污染, 这就导致方法选择多以温和(中性pH=7和T=30 ℃等)与稳定环境为主(Flemming et al., 2010).但对于大多数多糖类物质(如上述类藻酸盐物质以及淀粉、纤维素、果胶等)而言, 在温和条件下均不易溶解, 只有通过更为“剧烈”的方法才能使其与细胞完全剥离并溶解, 从而实现这些物质高效提取效率(Zhang et al., 2017).因此, 提取优化需寻求高效提取与细胞破坏二者之间平衡, 以最大化获得目标产物.而实际上, 即使细胞破壁导致胞内物质流出, 特定的溶解、离心分离以及药剂萃取条件都会将摒弃无关物质, 最终仍可以获得所目标物质, 即使其来源源于细胞之内也能进一步实现目标产物的增产!
为进一步扩大产物潜在高值应用范围, Felz等(2020)继续优化方法, 舍弃乙醇萃取纯化过程, 直接在碱性环境(pH=8.5)下溶解析出产物, 得到包括ALE在内的大量多糖类高聚物(透明质酸与类硫酸化糖胺聚糖物).这些物质是酸性粘多糖, 其独特分子结构与理化性质在人体机体内可显示出多种重要生理功能, 如, 润滑关节、调节血管壁通透性、调节蛋白质、水电解质扩散及运转、促进创伤愈合等(Felz et al., 2020).在得到一定浓度碱性EPS溶液之后, 利用乙醇萃取还可获得具有极高阻燃特性的防火材料(Kim et al., 2020).
污泥EPS多糖组分中还有一种极具回收价值的物质——类硫酸盐多糖(SPs), 它是一种广泛使用的工业原料和肥料, 多用于服装、药剂中间产物; 从污泥中直接提取回收SPs, 可大大减少工业上的合成成本; 因此, SPs具有较高经济价值(Xue et al., 2019).Xue等(2019)针对富含硫酸离子的特殊水质所培养的污泥进行SPs回收中试; 首先添加钙离子部分析出和分离类藻酸盐物质, 然后使用不同浓度梯度乙醇与苯酚、乙酸钠等有机物溶液共同萃取纯化, 最终获得较高纯度的SPs(图 3); 他们从中试反应器(进水硫酸盐500 mg·L-1)中所回收的SPs高达到(342.8±0.3) mg·g-1, 而从实际含盐污水处理厂剩余污泥提取的SPs更是可高达(418.1±0.4) mg·g-1.
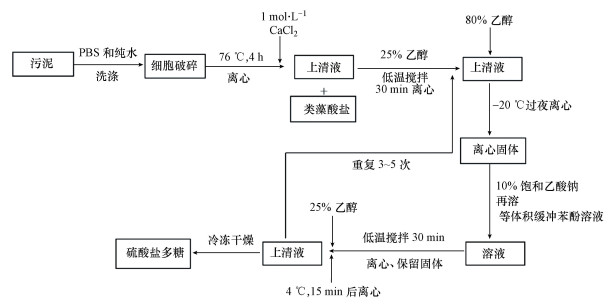 |
| 图 3 富含硫酸根离子培养污泥提取类硫酸盐多糖物质方法 (Xue et al., 2019) Fig. 3 Extracted method of sulfated polysaccharides (SPs) from sludge with high concentration of sulfate |
目前关于胞外蛋白质(PN)的突破性研究为功能性淀粉样蛋白质, 其在EPS基质中的作用还不够明晰, 但一些研究发现其主要存在于生物膜结构中, 认为其能够增加生物膜整体疏水性, 也能使生物膜变得更为牢固(Romero et al., 2010; Zeng et al., 2015).而在某些颗粒污泥中亦可作为一种结构性成分, 具有增加强度、保持颗粒化作用; 更有研究发现它是一种抵抗外界病毒、细菌毒素攻击的成分, 例如, 抗菌肽成分(Destoumieux-Garzón D et al., 2003).
利用现有方法可以在大部分生物膜中检测到淀粉样蛋白质的存在(Dueholm et al., 2016), 但只能从少数纯培养的絮状污泥生物体中得到纯化(Larsen et al., 2008a); 一直未能从颗粒污泥中提取到淀粉样蛋白质存在被认为是目前常用提取方法并不能检测到它的存在(Lin et al., 2018; Boleij et al., 2018; Lotti et al., 2019).Lin等(2018)对高富集亚硝化菌(AOB)好氧颗粒污泥(10 ℃下, 亚硝化反应运行达8个月以上)提取EPS过程发现, 当采用ALE (Lin et al., 2010)、颗粒体多糖(Granulan)(Seviour et al., 2010a)和酸溶性EPS (Pronk et al., 2017)提取方法时, 颗粒固体始终无法溶解, 导致无法正常推进这类污泥的提取及研究EPS工作.他们推测, 在这种颗粒状污泥中可能存在另一种新型结构EPS聚合物, 典型提取分离方法并不适用之.经过尝试, 投加0.1%十二烷基硫酸钠(SDS)和在pH=9和T=100 ℃环境下加热30 min后, 固体颗粒完全溶解, 最终从回收的萃取物中提取出EPS达(480±90)mg·g-1(Lin et al., 2018).
分析这种淀粉样蛋白质难以在普通条件下分离的原因, 发现其化学和热稳定性都极强, 即使在强变性试剂(2 mol·L-1的硫脲+ 8 mol·L-1的尿素+ 3%的SDS)中煮沸60 min, 也只能分解部分蛋白质; 在上述提取条件(0.1% SDS、T=100 ℃环境下加热30 min)也只能部分剥离蛋白的四级和三级结构, 而二级结构蛋白则无任何改变(Lin et al., 2018).这也许能够解释AOB被称之为强大的微菌落, 菌落具有致密性和高黏附等特性, 使其能够抵抗高剪切力和适应不同的物理/化学环境(Larsen et al., 2008b).也正受限于此, 典型方法提取富含AOB微菌落EPS量总是相对较少(平均仅为20 mg·g-1, 9 mg·g-1)(Wang et al., 2014b).相比之下, Lin等(2018)研究采用优化添加SDS后碱性高温环境下提取的EPS量相对较高.类似情况也出现在Lotti等(2019)以及Boleij等(2018)对厌氧氨氧化(ANAMMOX)颗粒污泥EPS的研究中, 他们发现针对不同污泥类型必须采取特定提取方法才能高效提取出淀粉样蛋白质成分.
4.2 基于多目标产物回收基于单一物质回收策略的前提是需要了解EPS具体组成, 从而评价、制定特定适用方法.但大多数研究者并不能明确EPS组成, 也就无法选择最佳的最高效提取方法.另外一种基于多目标产物回收策略, 则以回收多重产物为目的, 考虑分层、分级将复杂的EPS组分最大程度进行分离, 间接实现较高回收效率和应用价值.分析EPS不同特定官能团或性质以及分子量大小两个方面, 确定了分级提取和膜分离提取两种方法.
4.2.1 分级提取EPS组分复杂, 但每种成分均具有特定官能团结构或特殊化学性质.如上所述, 酸溶性EPS具有的某些结构使其可以在酸性条件下溶解或析出, 再进行离心、分离; 某些具有典型的活性特征官能团(如羧基、羟基、磷酸基等)物质可以与外加离子或物质发生作用, 可改变物质存在形态(颗粒态、溶解态或乳浊态等), 从而进行分离; 也可添加有机溶剂, 萃取出可溶于有机溶剂的物质(Tomanee et al., 2004; Crampon et al., 2013; Seviour et al., 2010b).单一手段或组合手段可以将EPS混合物分离为性质明确的多种混合物, 进一步对其理化性质进行分析表征, 也许可以指导单一特定物质的提纯.
4.2.2 膜分离法不同膜孔径分离是简单、直接的分子量分离手段, 可获得不同粒径EPS组分, 其作用原理如图 4所示(Saude et al., 2002).分离过程亦可考虑对膜片进行物理、化学改性, 调节母液酸/碱度(pH)、添加化学药剂(碳酸钠、氢氧化钠、PBS等)、有机溶剂(乙醇、四氯化碳等)等, 以寻求最大分离、纯化效率, 从而提高产物纯度(Cao et al., 2017; 2018).但该方法也需考虑膜分离过程膜通量下降、膜污染等问题, 在不影响回收产物的基础上可添加部分金属元素或采取其他措施来减弱膜污染现象(Cao et al., 2017).对于膜分离回收EPS研究十分有限, 其回收经济性等也有待于进一步分析.
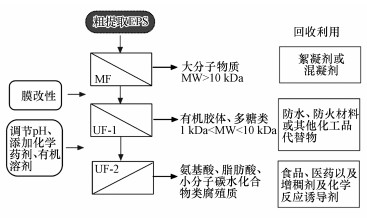 |
| 图 4 膜分离、纯化EPS组分流程图 Fig. 4 The process of EPS separation and purifying by membrane |
高质EPS提取仅从提取物纯度角度出发, 试图提高EPS应用的附加值.但污泥EPS提取效率受限于污泥本底EPS含量, 这又决定于进水基质、营养物负荷、运行参数、优势菌属等诸多因素.探究这些条件下污泥EPS产量差异, 将有助于高效提取EPS, 增加其回收效率.
5.1.1 进水基质进水水质及比例会影响EPS产量及组分, 如表 3所列数据.人工配水活性污泥EPS产量明显低于实际生活污水, 而掺混一定比例工业废水污泥EPS含量则会发生明显变化.这与Pronk等(2017)研究结果一致, 以乙酸盐作为碳源的颗粒污泥获得的ALE仅为1.4%VSS, 远低于实际污水颗粒污泥的17.8%VSS.这可能是因为污水作为营养基质, 某些微生物能分解得到或直接合成某些营养物质而被其他微生物所利用, 这些共生关系微生物菌株处于产生EPS有益环境之中, 可提高EPS产量.如垃圾渗滤液中高浓度氨氮会导致胞外蛋白增加(Wilén et al., 2003; Peng et al., 2012), 而染料、酿酒废水中的高碳水化合物则可促进胞外多糖生成(Sponza, 2002; Wilén et al., 2003), 进水成分若含有较多硫酸根离子则易生成硫酸盐多糖物质(Xue et al., 2019).
| 表 3 不同进水基质条件下活性污泥EPS组分及其含量变化 Table 3 Protein and polysaccharide in EPS extracted from activated sludge with different types of influent substrate |
不同进水基质对EPS产量影响机制总结于图 5.以进水乙酸钠、淀粉和蔗糖作为碳源予以解释; 乙酸钠分子可以主动运输直接穿过细胞进入, 在细胞内转化为乙酰辅酶-A而开始三羧酸循环(TCA); 淀粉和蔗糖首先在细胞外被水解酶转化为单糖再进入细胞, 但需要在特定酶催化下糖酵解转化为丙酮酸、乙酰辅酶-A后才进行TCA循环.在这个复杂转移、转化过程中, 中间代谢产物积累与消耗、酶合成与分泌等都可能作为EPS成分而影响最终EPS产量与组成(Ye et al., 2011).
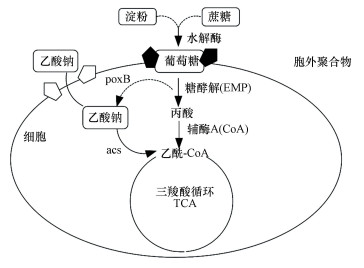 |
| 图 5 不同碳源基质细胞内物质合成与代谢途径 Fig. 5 Intracellular substance synthesis and metabolic pathway with different carbon sources |
基质种类可能因代谢途径不同而影响EPS产量, 而碳、氮以及磷作为微生物营养元素则可能直接影响EPS产量和组成.总结不同研究对污泥EPS含量、成分与C/N及C/P关系并进行非线性拟合, 结果图 6所示(Sanin et al., 2003; Hoa et al., 2003; Liu et al., 2006; Wang et al., 2014a).从图 6a和6c可以看出, 污泥EPS含量随着C/N、C/P比值首先逐渐升高; 这可能是因为在低C/N(< 20)、C/P(< 100)条件下细菌可吸收营养受限而致死亡率较高; 再加上丝状菌竞争使细菌死亡情况变得恶化; 最终导致细胞内物质自溶流出, 使胞外EPS中蛋白质、多糖和DNA量的增加.但过量碳源(C/N>20)并不能被微生物充分利用而转化, 堆积起来导致EPS总量及多糖含量增加(吴志高, 2006); 完全过量碳源(C/N>40)细胞增殖出现氮、磷元素的不足, 系统处于“亚健康”状态, 此时EPS可能作为氮源、磷源被内源消耗, 表现为EPS含量反降现象(图 6a).因现有数据过少而未能获得C/P>100情况下EPS产量结果.从图 6b中可以看出, EPS中蛋白组分与C/N关系也出现同样现象; 有趣的是, 胞外多糖随C/N比升高而不断升高, 可能是因为过量碳源直接与EPS粘附结合, 最终被一同分离获得, 表现为多糖含量增加.图 6d显示的结果意味着C/P逐渐接近100, 细菌营养状态逐渐平衡, 合成与分解代谢恢复正常, EPS含量逐渐升高.单一变量(C/N或C/P)对污泥影响仅作为参考, 实际中需综合考虑C/N/P三者之间平衡关系, 保证污染物高效去除的同时尽可能实现EPS“原位”增产.
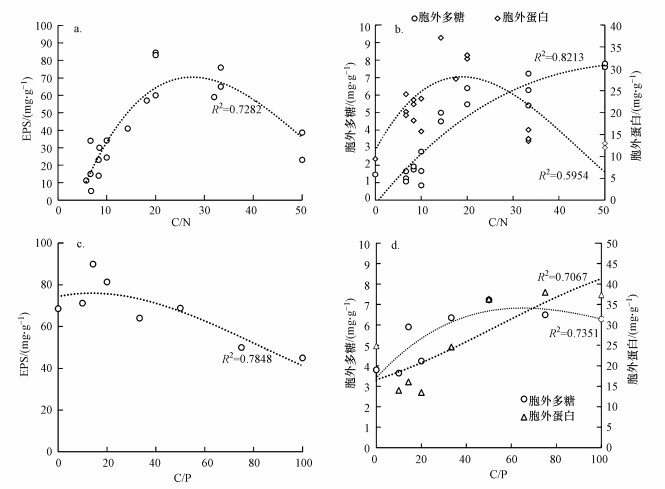 |
| 图 6 不同C/N和C/P比与EPS含量及成分拟合 (a.C/N与EPS产量关系, b.C/N与多糖、蛋白质成分关系, c.C/P与EPS产量关系, d.C/P与多糖、蛋白质成分关系)(Wang et al., 2014a; Sanin et al., 2003; Liu et al., 2006; Hoa et al., 2003) Fig. 6 Non-linear fitting of relationship between EPS production and the ratio of C/N/P |
溶解氧(DO)、温度、pH、污泥停留时间(SRT)和污泥负荷(Ns)等运行参数都会影响EPS的形成.
① 高DO条件下微生物新陈代谢能力提高, EPS产量随之提高; 低DO条件下微生物活性降低, 且多为世代时间长的厌氧型微生物, 新陈代谢活跃度降低, EPS产量可能较少(Shen et al., 2010; More et al., 2014).但李军等(2014)研究发现, 随着DO增加, LB-EPS含量逐渐增加, 其中多糖含量也增加, 但蛋白质等基本不变.
② 周健等(2004)研究发现反应器温度从10 ℃升至15 ℃时, 污泥EPS含量有所降低, 蛋白质及DNA含量同时降低; 而当温度从15 ℃升至30 ℃时, EPS含量却增加了14%, 蛋白质及DNA含量未显著增加, 多糖含量则增加.赵华南(2016)发现15 ℃时EPS含量最高, 25 ℃次之, 35 ℃含量最低; 究其原因可能是15 ℃时微生物生长速率下降, 细胞死亡释放出大量胞内聚合物, 而获得更多EPS; 而25 ℃时微生物生长代谢较旺盛, 细菌分泌EPS; 但35 ℃高温微生物生长速率缓慢, 而导致EPS含量下降.高永青等(2010)研究发现随着温度的升高, 污泥中EPS含量逐渐降低, 而溶液中的EPS含量逐渐升高; 说明温度因素影响EPS的溶解特性; 随着温度的升高从18 ℃升至35 ℃时, 溶液中的EPS含量逐渐升高, 与温度呈指数函数关系; 不同温度条件下, 污泥EPS的组分差异较大; 35 ℃时由微生物新陈代谢产生的EPS含量最多.从上述研究中可以看出温度对EPS含量的影响还没有统一定论, 但可以肯定的是温度对EPS产量有一定的影响.
③ 郑蕾等(2007)研究结果显示, 污泥EPS产量随pH值的升高而上升.pH值从7下降到3, EPS产量下降50%, 胞外多糖下降约30%, 胞外蛋白下降约70%;而pH值从7上升到11, EPS产量提高20%~30%, 胞外多糖升高约15%, 胞外蛋白升高20%~50%.然而, 庄芜等(2006)却得到不同结论, 从pH =7升至10过程, EPS含量却从125 mg·g-1降至90 mg·g-1, 可能是因为碱性环境下EPS易从微生物表面脱落, 导致污泥絮体EPS含量减小.董姗(2012)研究也发现, 初始pH=6时, EPS总量为47 mg·g-1(以SS计); 当pH增加到7时, EPS总量略微下降; 而随着pH增至9.5时, EPS总量增加至约58 mg·g-1(以SS计); 其中, 蛋白质含量变化与EPS含量变化一致, pH从6升至7时有所降低, 而pH从7升至9.5时不断增加; 但多糖与DNA含量随pH的变化其含量差异较小.
④ Liao等(2001)发现, EPS中蛋白质和多糖含量在SRT=4~9 d时分别出现明显增加和减少, 直至SRT=16~20 d时, 两者比例才趋于稳定.这可能是短SRT导致微生物来不及吸收进水基质中碳源而导致胞外多糖含量减少.李莹等(2011)研究发现, 随着污泥龄增加, 附着型EPS浓度先是稍有减少, 之后由于内源代谢期间微生物对自身进行代谢分解而快速增加.溶解性EPS则随着SRT增加而增加.龙向宇等(2008)发现, SRT由3 d增加到20 d时, LB-EPS中的蛋白质、多糖、腐殖质与DNA含量均随SRT增加呈先减少再略微增大的趋势; 而TB-EPS中蛋白质与DNA含量逐渐降低, 多糖与腐殖质的平均含量则逐渐增加.
以上各种原因都会影响微生物新陈代谢以及生物化学、物理化学反应过程, 最终导致EPS生成量及成分发生变化.
5.1.4 优势菌属不同细菌菌株产生EPS的能力不尽相同, 表 4中列举了部分纯菌株实验培养环境下EPS产量.结果显示, 枯草杆菌EPS产量最低, 仅为6.3 g·L-1, 而克雷博氏菌产EPS能力最强, 高达27.7 g·L-1.但枯草杆菌胞外多糖和蛋白成分并非最低, 反而是克雷伯氏菌胞外蛋白含量为最低; 乙酰微小杆菌EPS产量居中, 但胞外多糖和蛋白质均处于较低水平(Buthelezi et al., 2010).这可能与不同菌属新陈代谢方式不同, EPS主要成分来源于细菌过程分泌物, 也就造成了EPS产量和组分在不同细菌之间存在较大差异.
| 表 4 不同纯种菌株培养EPS产量与组成(Buthelezi et al., 2010) Table 4 EPS proportion from different microorganisms |
在实际污水处理系统中, 根据这些单一菌属得出的结论忽视了混合培养过程中微生物之间的相互作用; 共生微生物系统中, 微生物协同生长会影响产生EPS的浓度和特性.在活性污泥系统中, 产生EPS菌株和不产生EPS菌株混合培养比纯培养可产生相对更高的EPS; More等(2015)实验发现与纯培养物EPS(2.7~3.7 g·L-1)相比, 混合培养物可产生更高的EPS浓度(4.9 g·L-1).在生物膜系统中, 两种或两种以上微生物菌株EPS生成比单一纯菌种生成的EPS更能促进生物膜持续稳定生长(Zhang et al., 2007; Li et al., 2012).EPS不仅可促进合成自身细胞粘附和生长, 还会促进其他微生物菌种粘附和生长; 不同微生物分泌的某些酶可以帮助微生物在复杂环境中获得足够营养需求, 会增加底物利用效率, 进而提高EPS产量(More et al., 2014).但在某些情况下, 混合培养菌株也可能对EPS生产及其聚合性能产生有害影响, 降低其产量(More et al., 2014).
菌属种类不同不仅会影响EPS产量, 更会直接影响EPS组分和特性.例如, 在以亚硝化细菌(AOB)与厌氧氨氧化细菌(ANAMMOX)为主导的污泥系统中, 其所含EPS含量分别为(49.4±2.4) mg·g-1和(110±5) mg·g-1, 均高于(31.8±1.6) mg·g-1的传统活性污泥EPS产量(Yin et al., 2015).关于AOB与ANAMMOX细菌EPS中多糖和蛋白质哪一个占主导作用目前还未获得明确结论; Yin等(2015)报道了以ANAMMOX细菌为主导系统中EPS以蛋白质为主, 其PN/PS=2.64±0.12;这与Tang等(2011)报道的富含ANAMMOX细菌污泥EPS中蛋白含量为(164.4±9.3) mg·g-1、多糖含量为(71.8±2.3) mg·g-1(PN/PS=2.3)的结论基本一致; 也与Lotti等(2019)报道的富含ANAMMOX细菌污泥EPS中蛋白含量为(143±15) mg·g-1、多糖含量为(15±4) mg·g-1(PN/PS=9.7)结论基本一致.但Ni等(2010)研究获得相反的结论, 认为在富含ANAMMOX细菌污泥(PN/PS =0.51)中EPS以多糖成分为主.Yin等(2015)结果显示, 以AOB为主导的系统EPS以多糖为主, 其PN/PS=0.56±0.03;这一结论同样在Zhang等(2011)和Shen等(2014)结论中出现, 他们均认为来自以AOB为主的混合菌群EPS中多糖含量高于蛋白质含量; 且随着硝化负荷增加, PN/PS会进一步降低(Shen et al., 2014).但Liang等(2010)研究报道, 在富含AOB培养物中, EPS蛋白含量反而高于多糖.而活性污泥细菌EPS组分中PN/PS之比为1.96±0.09(Yin et al., 2015).这些研究证明了细菌种属不同可能会导致EPS组成和含量存在较大差异, 而对于不同优势细菌种属存在条件下的EPS含量与成分确定还有待进一步研究.
5.2 协同效应污泥培养过程本底EPS的增量为后续高效EPS提取前提条件, 但也需保证各类污泥EPS充分分离、溶出方可保证更高的回收效率.使用某些特殊协同手段可以较为容易实现EPS与细胞的分离, 达到事半功倍之效果, 例如, 添加表面活性剂的超声波提取方法(Kavitha et al., 2016; 王欣, 2020).王欣(2020)添加十六烷基三甲基溴化铵(CTAB)和十二烷基硫酸钠(SDS)后采用超声波法提取EPS, 较单一超声波法提取量分别提高了76.5%和53.1%, 效率提高十分明显; 但对EPS组分多糖和蛋白质分析发现, 其组分比例并未发生明显变化.进一步分析EPS粒径发现, 添加表面活性剂后EPS粒径明显减小(表 5), 这意味着表面活性剂可能仅仅是整体提高了EPS溶出或溶解过程进而提高EPS产量(Kavitha et al., 2016; 王欣, 2020); 可能的机理是表面活性剂增溶和分散作用使得EPS脱离污泥絮体溶于液相(吴桂标等, 2001; Chen et al., 2001):①溶解细胞膜上的蛋白质与多糖物质, 同时破坏细胞膜, 致使部分细胞质流出细胞外(Andersen et al., 2014); ②疏水基团与细胞壁相互作用, 表面活性剂与细胞接触后通过静电吸引、氢键作用力以及疏水间作用力吸附在细胞上, 过量地摄入营养, 导致细胞裂解(Muthukumar et al., 2007).不同的提取效果表明, 表面活性剂会因自身结构不同亦会产生独特的增产机理, 如CTAB自身线性烃链形成胶束, 通过互溶原理能加速EPS的释放(Lai et al., 2016).
| 表 5 提取前后污泥粒径分布(王欣, 2020) Table 5 Size distribution of excess sludge before and after extraction |
污泥本底EPS含量及其组分因环境不同和培养条件差异而存在较大区别.需要了解污泥来源和基本参数, 包括进水水质、营养物负荷以及运行环境等; 同时, 在可能情况下要对微生物种属进行鉴别, 探知是否存在优势种属, 由此判定EPS含量及主要组分; 最后综合分析评价EPS高附加值成分与类型.在此基础上, 尽可能优化控制培养参数, 以实现污泥本底EPS含量增加, 并针对优势成分制定与优化提取方法, 以实现高纯度物质的高效提取回收, 基本路线见图 7(Lin et al., 2018; Lotti et al., 2019; Wang et al., 2020).
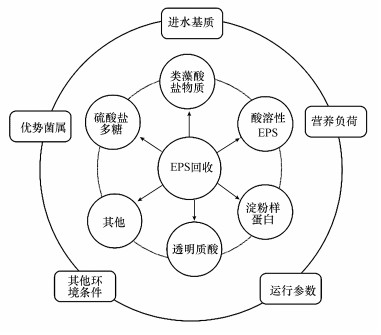 |
| 图 7 EPS高效高质提取策略 Fig. 7 Strategies for high-valued EPS extraction and recovery |
研究EPS应以识别和鉴定EPS结构与功能性为首要目的, 因为EPS结构特性是了解其控制污泥系统的关键途径, 它的功能特性决定了污泥系统运行的稳定性.基于对EPS物质回收和应用角度, 主要取决于深入了解污泥中存在哪些EPS成分, 分别起什么作用以及它们如何调节和表达, 这应该是研究EPS所面对的挑战(Seviour et al., 2019; Yu, 2020).当前, 物理和化学法均用于提取EPS, 在保证细胞不被破损的情况下需要最大程度提高其提取效率(Ras et al., 2011).然而, 目前已有方法能否有效提取出EPS、且保证其结构和功能完整并没得到有效验证; 也许这些方法有效但只是部分奏效, 导致所提取的EPS可能并非原始态EPS物质, 势必影响表征生物膜、絮状污泥、颗粒污泥等(Felz et al., 2016; Wang et al., 2020).有时为了更深入研究EPS对污泥系统的作用, 有必要采用损害细胞的方法, 而不是优先考虑其完整性(Felz et al., 2016); 可以鉴定提取物是否为胞外聚合物, 再通过电泳或色谱等进一步纯化提取目标EPS(Seviour et al., 2010b).
另一方面, 现有手段费“九牛二虎之力”分离获得的EPS分析显得过于狭隘, 只能简单表征EPS组成及结构, 对其中不可分离或不稳定化学成分显得捉襟见肘, 分子水平EPS检测手段研究近乎空白(Yu, 2020).与此同时, EPS中存在的杂质也会干扰检测结果准确性, 这些都会限制EPS提取物更广泛研究与推广应用(Yu, 2020).因此, 需要用更全面表征手段, 如, 原位检测、X射线光电子能谱(XPS)等(图 8, Seviour et al., 2019), 深入研究EPS.
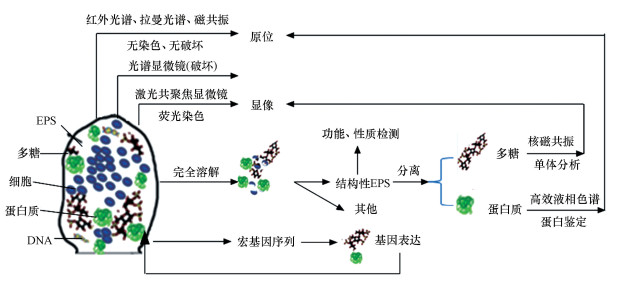 |
| 图 8 EPS鉴定、表征方法 (Seviour et al., 2019) Fig. 8 Identification and analysis methods for EPS |
1) 高附加值回收产物是污水/污泥资源化成功与否的关键, 而EPS作为天然有机高聚物所表现出的轻质阻燃特性使之有可能作为飞机等航空器的表面涂层.这就是为什么近年来国际上对污泥EPS研究一下上升为高效提取、高值利用的主要原因.然而, 污泥EPS提取方法非常复杂, 典型提取方法所提取获得的往往是“笼统”有机物混合物, 无法实现回收物的高值利用.
2) 传统提取方法存在物理低效性和化学低值性等缺陷.于是, 针对污泥EPS组分胞外多糖(类藻酸盐物质、酸溶性EPS、硫酸盐多糖以及透明质酸等)和胞外蛋白(淀粉样蛋白质等)的深度分离与提纯技术开始出现.类藻酸盐物质提取、分离技术发展历程表明, 随着物质检测与分析手段不断完善, 基本上可以实现目标回收物纯度提高的愿望, 并建立高效的提取、回收技术体系.为此, 通过研究制定出基于单一目标或多目标产物的提取技术策略, 这对提高分离回收产物纯度, 实现其高值利用意义重大.
3) 此外, EPS高效回收也受限于其污泥本底含量.不同进水基质(生活污水、工业废水等)、营养物负荷(碳、氮、磷元素均衡)以及运行工况(溶解氧、温度、pH、污泥停留时间和污泥负荷等)、系统优势菌属等都会影响污泥EPS的生成与性质.目前, EPS增量机理并无统一结论, 需统一考量实际过程诸因素对EPS的影响, 因地制宜地针对具体EPS组分进行过程优化, 以实现目标物污泥系统中“原位”增产.同时, 应借鉴其他协同手段(如, 表面活性剂增溶)进一步优化提取方法, 以实现回收物高效提取与高值回收利用.
未来基于EPS研究则需要更加关注EPS检测与分析的方法, 以深入透彻了解EPS在污泥中的功能与结构影响, 不仅指导污水处理提质增效, 同时也进一步明晰EPS提取与应用之路.
Adav S S, Lee D J, Tay J H. 2008a. Extracellular polymeric substances and structural stability of aerobic granule[J]. Water Research, 42(42): 1644-1650. |
Adav S S, Lee D J. 2008b. Extraction of extracellular polymeric substances from aerobic granule with compact interior structure[J]. Journal of Hazardous Materials, 154(42007): 1120-1126. |
Andersen K K, Otzen D E. 2014. Folding of outer membrane protein A in the anionic biosurfactant rhamnolipid[J]. Febs Letters, 588(10): 1955-1960. DOI:10.1016/j.febslet.2014.04.004 |
Basuvaraj M, Fein J, Liss S N. 2015. Protein and polysaccharide content of tightly and loosely bound extracellular polymeric substances and the development of a granular activated sludge floc[J]. Water Research, 82: 104-117. DOI:10.1016/j.watres.2015.05.014 |
Boleij M, Seviour T, Li L, Loosdrecht M C M Van, et al. 2019. Solubilization and characterization of extracellular proteins from anammox granular sludge[J]. Water Research, 164: 114952. DOI:10.1016/j.watres.2019.114952 |
Buthelezi S P, Olaniran A O, Pillay B. 2010. Production and characterization of bioflocculants from bacteria isolated from wastewater treatment plant in South Africa[J]. Biotechnology and Bioprocess Engineering, 15: 874-881. DOI:10.1007/s12257-009-3002-7 |
Boleij M, Pabst M, Neu T R, et al. 2018. Identification of glycoproteins isolated from extracellular polymeric substances of full-scale anammox granular sludge[J]. Environmental Science Technology, 52: 13127-13135. DOI:10.1021/acs.est.8b03180 |
Chen Y, Yang H, Gu G. 2001. Effect of acid and surfactant treatment on activated sludge dewatering and settling[J]. Water Research, 35(11): 2615-2620. DOI:10.1016/S0043-1354(00)00565-0 |
陈园园, 彭党聪. 2017. 生物膜中EPS与微生物的分布及测定[J]. 中国给水排水, (15): 25-30. |
Cao D Q, Hao X D, Wang Z, et al. 2017. Membrane recovery of alginate in an aqueous solution by the addition of calcium ions: Analyses of resistance reduction and fouling mechanism[J]. Journal of Membrant Scienc, 535: 312-321. DOI:10.1016/j.memsci.2017.04.050 |
Cao D Q, Song X, Hao X D, et al. 2018. Ca2+-aided separation of polysaccharides and proteins by microfiltration: Implications for sludge processing[J]. Separation and Purification Technology, 202: 318-325. DOI:10.1016/j.seppur.2018.03.070 |
Corsino S F, Capodici M, Torregrossa M, et al. 2016. Fate of aerobic granular sludge in the long-term: the role of EPSs on the clogging of granular sludge porosity[J]. Journal of Environmental Management, 183: 541-550. DOI:10.1016/j.jenvman.2016.09.004 |
Crampon C, Mouahid A, Toudji S A A, et al. 2013. Influence of pretreatment on supercritical CO2 extraction from Nannochloropsis oculata[J]. The Journal of Supercritical Fluids, 79: 337-344. DOI:10.1016/j.supflu.2012.12.022 |
段亮, 夏四清, 宋永会, 等. 2010. 活性污泥胞外聚合物提取方法优化[J]. 环境工程学报, 4(1): 63-66. |
Ding Z, Bourven I, Guibaud G, et al. 2015. Role of extracellular polymeric substances (EPS) production in bioaggregation: Application to wastewater treatment[J]. Applied Microbiology and Biotechnology, 99(23): 9883-9905. DOI:10.1007/s00253-015-6964-8 |
Dueholm M S, Nielsen P H. 2016. Amyloids-A neglected child of the slime. In: Flemming H C, Neu T R, Wingender J (Eds. ), The Perfect Slime: Microbial Extracellular Polymeric Substances (EPS)[M]. IWA Publishing, London, UK, 1130133
|
Destoumieux-Garzón D, Thomas X, Santamaria M, et al. 2003. Microcin E492 antibacterial activity: evidence for a TonB-dependent inner membrane permeabilization on Escherichia coli[J]. Molecular Microbiology, 49(4): 1031-1041. DOI:10.1046/j.1365-2958.2003.03610.x |
董姗. 2012. 球形红细菌沉降特性分析及其处理啤酒废水的研究[D]. 哈尔滨: 哈尔滨工业大学
|
Felz S, Al-Zuhairy S, Aarstad O A, et al. 2016. Extraction of structural extracellular polymeric substances from aerobic granular sludge[J]. Journal of Visualized Experiments, 115: 1-8. |
Felz S, Neu T R, van Loosdrecht M C M, et al. 2020. Aerobic granular sludge contains Hyaluronic acid-like and sulfated glycosaminoglycans-like polymers[J]. Water Research, 169: 115291. DOI:10.1016/j.watres.2019.115291 |
Flemming H C, Wingender J. 2010. The biofilm matrix[J]. Nature Reviews Microbiology, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
Flemming H C, Wingender J, Szewzyk U, et al. 2016. Biofilms: an emergent form of bacterial life[J]. Nature Reviews Microbiology, 14: 563-575. DOI:10.1038/nrmicro.2016.94 |
方晓敏. 2019. 超滤浓缩EPS及其正渗透膜分离实验研究[D]. 北京: 北京建筑大学
|
Guibaud G, van Hullebusch E, Bordas F. 2006. Lead and cadmium biosorption by extracellular polymeric substances (EPS) extracted from activated sludges: pH-sorption edge tests and mathematical equilibrium modelling[J]. Chemosphere, 64(11): 1955-1962. DOI:10.1016/j.chemosphere.2006.01.012 |
Guibaud G, Bhatia D, d'Abzac P, et al. 2012. Cd(Ⅱ) and Pb(Ⅱ) sorption by extracellular polymeric substances (EPS) extracted from anaerobic granular biofilms: evidence of a pH sorption-edge[J]. Journal of the Taiwan Institute of Chemical Engineers, 43: 444-449. DOI:10.1016/j.jtice.2011.12.007 |
高永青, 彭永臻, 王建龙, 等. 2010. 剩余污泥水解酸化过程中胞外聚合物的影响因素研究[J]. 中国环境科学, 30(1): 58-63. |
Hao X, Li J, van Loosdrecht M C M, et al. 2019. Energy recovery from wastewater: Heat over organics[J]. Water Research, 161: 74-77. DOI:10.1016/j.watres.2019.05.106 |
Hoa P T, Nair L, Visvanathan C. 2003. The effect of nutrients on extracellular polymeric substance production and its influence on sludge properties[J]. Water SA, 29: 437-442. |
Yu H Q. 2020. Molecular insights into extracellular polymeric substances in activated sludge[J]. Environmental Science Technology, 54: 7742-7750. DOI:10.1021/acs.est.0c00850 |
Kim N K, Mao N, Lin R, et al. 2020. Flame retardant property of flax fabrics coated by extracellular polymeric substances recovered from both activated sludge and aerobic granular sludge[J]. Water Research, 170: 115344. DOI:10.1016/j.watres.2019.115344 |
Kavitha S, Stella P B C, Kaliappan S, et al. 2016. Enhancement of anaerobic degradation of sludge biomass through surfactant-assisted bacterial hydrolysis[J]. Process Safety and Environmental Protection, 99: 207-215. DOI:10.1016/j.psep.2015.11.009 |
Lai Y J S, Francesco F D, Aguinaga A, et al. 2016. Improving lipid recovery from Scenedesmus wet biomass by surfactant-assisted disruption[J]. Green Chemistry, 18: 1319-1326. DOI:10.1039/C5GC02159F |
Liao B Q, Allen D G, Droppo I G, et al. 2001. Surface properties of sludge and their role in bioflocculation and settleability[J]. Water Research, 35(2): 339-350. DOI:10.1016/S0043-1354(00)00277-3 |
Lotti T, Carretti E, Berti D, et al. 2019. Extraction, recovery and characterization of structural extracellular polymeric substances from anammox granular sludge[J]. Journal of Environmental Management, 236: 649-656. |
Li Z H, Kuba T, Kusuda T. 2006. The influence of starvation phase on the properties and the development of aerobic granules[J]. Enzyme and Microbial Technology, 38(5): 670-674. DOI:10.1016/j.enzmictec.2005.07.020 |
Li X, Luo J, Guo G, et al. 2017. Seawater-based wastewater accelerates development of aerobic granular sludge: a laboratory proof-of-concept[J]. Water Research, 115: 210-219. DOI:10.1016/j.watres.2017.03.002 |
Liu J R, Liu C T, Edwards E A, et al. 2006. Effect of phosphorus limitation on microbial floc structure and gene expression in activated sludge[J]. Water Science Technology, 54: 247-255. |
Liang Z, Li W, Yang S, et al. 2010. Extraction and structural characteristics of extracellular polymeric substances (EPS), pellets in autotrophic nitrifying biofilm and activated sludge[J]. Chemosphere, 81(5): 626-632. DOI:10.1016/j.chemosphere.2010.03.043 |
Li W, Mutuvulla M, Chen X, et al. 2012. Isolation and identification of high viscosity-producing lactic acid bacteria from a traditional fermented milk in Xinjiang and its role in fermentation process[J]. European Food Research and Technology, 235(3): 497-505. DOI:10.1007/s00217-012-1779-7 |
Lin Y M, Merle de K, van Loosdrecht M C M, et al. 2010. Characterization of alginate-like exopolysaccharides isolated from aerobic granular sludge in pilot-plant[J]. Water Research, 44(11): 3355-3364. DOI:10.1016/j.watres.2010.03.019 |
Lin Y M, Nierop K G J, Girbal-Neuhauser E, et al. 2015. Sustainable polysaccharide-based biomaterial recovered from waste aerobic granular sludge as a surface coating material[J]. Sustain Materials Technology, 4: 24-29. DOI:10.1016/j.susmat.2015.06.002 |
Larsen P, Nielsen J L, Otzen D, et al. 2008a. Amyloid-like adhesins produced by floc-forming and filamentous bacteria in activated sludge[J]. Applied and Environmental Microbiology, 74(5): 1517-1526. DOI:10.1128/AEM.02274-07 |
Larsen P, Nielsen J L, Svendsen T C, et al. 2008b. Adhesion characteristics of nitrifying bacteria in activated sludge[J]. Water Research, 42(10): 2814-2826. |
Lin Y, Reino C, Carrera J, et al. 2018. Glycosylated amyloid-like proteins in the structural extracellular polymers of aerobic granular sludge enriched with ammonium-oxidizing bacteria[J]. Microbiologyopen, 7: 1-13. |
Liu X W, Sheng G P, Yu H Q. 2009. Physicochemical characteristics of microbial granules[J]. Biotechnol. Adv, 27(6): 1061-1070. DOI:10.1016/j.biotechadv.2009.05.020 |
Lin Y M, Sharma P K, van Loosdrecht M C M. 2013. The chemical and mechanical differences between alginate-like exopolysaccharides isolated from aerobic flocculent sludge and aerobic granular sludge[J]. Water Research, 47: 57-65. DOI:10.1016/j.watres.2012.09.017 |
李莹, 田林, 张宏伟, 等. 2011. 膜生物反应器中排泥方式对污泥胞外聚合物的影响[J]. 环境科学与技术, 34(6G): 10-13. |
Leeuwen K, van Vries E, de Koop S, et al. 2018. The energy & raw materials factory: Role and potential contribution to the circular economy of the Netherlands[J]. Environmental Management, 61(5): 786-795. DOI:10.1007/s00267-018-0995-8 |
李军, 商卫纯, 蔡娟, 等. 2014. 不同曝气强度下活性污泥中松散束缚型胞外聚合物组分含量及其对污泥沉降性能的影响[J]. 环境污染与防治, 36(4): 6-10. DOI:10.3969/j.issn.1001-3865.2014.04.002 |
龙向宇, 龙腾锐, 唐然, 等. 2008. 污泥龄对胞外聚合物组分与表面性质的影响[J]. 中国给水排水, 24(15): 1-6. DOI:10.3321/j.issn:1000-4602.2008.15.001 |
Metivier R, Bourven I, Labanowski J, et al. 2013. Interaction of erythromycin ethylsuccinate and acetaminophen with protein fraction of extracellular polymeric substances (EPS) from various bacterial aggregates[J]. Environmental Science and Pollution Research International, 20(10): 7275-7285. DOI:10.1007/s11356-013-1738-2 |
Madkour M H, Heinrich D, Alghamdi M A, et al. 2013. PHA recovery from biomass[J]. Biomacromolecules, 14: 2963-2972. DOI:10.1021/bm4010244 |
McSwain B S, Irvine R L, Hausner M, et al. 2005. Composition and dis-tribution of extracellular polymeric substances in aerobic flocs and granular sludge[J]. Applied Environmental Microbiology, 71(2): 1051-1057. DOI:10.1128/AEM.71.2.1051-1057.2005 |
Mahendran B, Lishman L, Liss S N. 2012. Structural, physicochemical and microbial properties of flocs and biofilms in integrated fixed-film activated sludge (IFFAS) systems[J]. Water Research, 46(16): 5085-5101. DOI:10.1016/j.watres.2012.05.058 |
Muthukumar N, Maruthamuthu S, Palaniswamy N. 2007. Role of cationic and nonionic surfactants on biocidal efficiency in diesel-water interface[J]. Colloids and Surfaces B: Biointerfaces, 57(2): 152-160. DOI:10.1016/j.colsurfb.2007.01.019 |
More T T, Yadav J S S, Yan S, et al. 2014. Extracellular polymeric substances of bacteria and their potential environmental applications[J]. Journal Environmental Management, 144: 1-25. |
More T T, Yan S, Tyagi R D, et al. 2015. Biopolymers production by mixed culture and their applications in water and wastewater treatment[J]. Water Environment Research, 87(6): 533-546. DOI:10.2175/106143015X14212658614676 |
Ni B J, Hu B L, Fang F, et al. 2010. Microbial and physicochemical characteristics of compact anaerobic ammonium-oxidizing granules in an upflow anaerobic sludge blanket reactor[J]. Applied and Environmental Microbiology, 76(8): 2652-2656. DOI:10.1128/AEM.02271-09 |
Nancharaiah Y V, Reddy G K K. 2018. Aerobic granular sludge technology: Mechanisms of granulation and biotechnological applications[J]. Bioresource Technology, 247: 1128-1143. DOI:10.1016/j.biortech.2017.09.131 |
Peng G, Ye F, Li Y. 2012. Investigation of extracellular polymer sub-stances (EPS) and physicochemical properties of activated sludge from different municipal and industrial wastewater treatment plants[J]. Environmental Technology, 33(8): 857-863. DOI:10.1080/09593330.2011.601763 |
Pronk M, Neu T R, van Loosdrecht M C M, et al. 2017. The acid soluble extracellular polymeric substance of aerobic granular sludge dominated by De fl uviicoccus sp[J]. Water Research, 122: 148-158. DOI:10.1016/j.watres.2017.05.068 |
Rehm B H. 2010. Bacterial polymers: biosynthesis, modifications and applications[J]. Nat Rev Microbiol, 8: 578-592. DOI:10.1038/nrmicro2354 |
Ras M, Lefebvre D, Derlon N, et al. 2011. Extracellular polymeric substances diversity of biofilms grown under contrasted environ-mental conditions[J]. Water Research, 45(4): 1529-1538. DOI:10.1016/j.watres.2010.11.021 |
Romero D, Aguilar C, Losick R, et al. 2010. Amyloid fibers provide structural integrity to Bacillus subtilis biofilms[J]. Proceedings of the National Academy of Sciences of the United States of America, 107(5): 2230-2234. DOI:10.1073/pnas.0910560107 |
Seviour T, Derlon N, Dueholm M S, et al. 2019. Extracellular polymeric substances of biofilms: Suffering from an identity crisis[J]. Water Research, 151: 1-7. DOI:10.1016/j.watres.2018.11.020 |
Seviour T, Lambert L K, Pijuan M, et al. 2010a. Structural determination of a key exopolysaccharide in mixed culture aerobic sludge granules using NMR spectroscopy[J]. Environmental Science Technology, 44(23): 8964-8970. DOI:10.1021/es102658s |
Seviour T, Donose B C, Pijuan M, et al. 2010b. Purification and conformational analysis of a key exopolysaccharide component of mixed culture aerobic sludge granules[J]. Environmental Science Technology, 44(12): 4729-4734. DOI:10.1021/es100362b |
Saude N, Chèze-Lange H, Beunard D, et al. 2002. Alginate production by Azotobacter vinelandii in a membrane bioreactor[J]. Process Biochem, 38: 273-278. DOI:10.1016/S0032-9592(02)00090-0 |
Sanin F D, Durmaz B. 2003. Effect of carbon to nitrogen ratio on the physical and chemical properties of activated sludge[J]. Environmental Technology (United Kingdom), 24: 1331-1340. |
Shen L, Yao Y, Meng F. 2014. Reactor performance and microbial ecology of a nitritation membrane bioreactor[J]. Journal of Membrane Science, 462: 139-146. DOI:10.1016/j.memsci.2014.03.034 |
Sponza D T. 2002. Extracellular polymer substances and physicochemical properties of flocs in steady and unsteady-state activated sludge systems[J]. Process Biochemistry, 37(9): 983-998. DOI:10.1016/S0032-9592(01)00306-5 |
Schambeck C M, Bruna S M, Laís C R de S, et al. 2020. Biopolymers recovery: Dynamics and characterization of alginate-like exopolymers in an aerobic granular sludge system treating municipal wastewater without sludge inoculum[J]. Journal of Environmental Management, 263: 110394. DOI:10.1016/j.jenvman.2020.110394 |
Sheng G P, Yu H Q, Li X Y. 2010. Extracellular Polymeric Substances (EPS) of microbial aggregates in biological wastewater treatment systems: A review[J]. Biotechnology Advances, 28(6): 882-894. DOI:10.1016/j.biotechadv.2010.08.001 |
Tomanee P, Hsu J T, Ito Y. 2004. Fractionation of protein, RNA, and plasmid DNA in centrifugal precipitation chromatography using cationic surfactant CTAB containing inorganic salts NaCl and NH4Cl[J]. Biotechnology and Bioengineering, 88(1): 52-59. DOI:10.1002/bit.20203 |
Tang C J, Zheng P, Wang C H, et al. 2011. Performance of high-loaded ANAMMOX UASB reactors containing granular sludge[J]. Water Research, 45(1): 135-144. DOI:10.1016/j.watres.2010.08.018 |
Tu X, Song Y, Yu H, et al. 2012. Fractionation and characterization of dissolved extracellular and intracellular products derived from floccular sludge and aerobic granules[J]. Bioresource Technology, 123: 55-61. DOI:10.1016/j.biortech.2012.07.075 |
田洪芸, 冯炜, 任雪梅, 等. 2016. 复合酶法提取褐藻酸钠的工艺研究[J]. 世界科技研究与发展, 38(2): 312-316. |
Urtuvia V, Nataly M, Fernando A, et al. 2017. Bacterial alginate production: An overview of its biosynthesis and potential industrial production[J]. World Journal of Microbiology & Biotechnology, 33(11): 198. |
van Loosdrecht M C M, Brdjanovic D. 2014. Anticipating the next century of wastewater treatment: Advances in activated sludge sewage treatment can improve its energy use and resource recovery[J]. Science, 344: 1452-1453. DOI:10.1126/science.1255183 |
van der Roest H, van Loosdrecht M C M, Langkamp E J, et al. 2015. Recovery and reuse of alginate from granular Nereda sludge[J]. Water, 21: 4-48. |
Wilén B M, Jin B, Lant P. 2003. The influence of key chemical constituents in activated sludge on surface and flocculating properties[J]. Water Research, 37(9): 2127-2139. DOI:10.1016/S0043-1354(02)00629-2 |
Wang Z P, Li L L, Jie Y, et al. 2006. Effects of extracellular polymeric substances on aerobic granulation in sequencing batch reactors[J]. Chemosphere, 63(10): 1728-1735. DOI:10.1016/j.chemosphere.2005.09.018 |
Wang Z W, Liu Y, Tay J H. 2005. Distribution of EPS and cell surface hydrophobicity in aerobic granules[J]. Applied Microbiology and Biotechnology, 69(4): 469-473. DOI:10.1007/s00253-005-1991-5 |
Wang W, Yan Y, Wang J, et al. 2020. Comparison and optimization of extraction methods of extracellular polymeric substances in anammox granules: from maintaining protein secondary structure perspective[J]. Chemosphere, 259: 127539. DOI:10.1016/j.chemosphere.2020.127539 |
Wang H, Deng H, Ma L, et al. 2014a. The effect of carbon source on extracellular polymeric substances production and its influence on sludge floc properties[J]. Journal of Chemistry Technology Biotechnology, 89: 516-521. DOI:10.1002/jctb.4147 |
Wang Z, Zhang X X, Lu X, et al. 2014b. Abundance and diversity of bacterial nitrifiers and denitrifiers and their functional genes in tannery wastewater treatment plants revealed by high-throughput sequencing[J]. PLOS ONE, 9(11): 1-9. |
王孝华. 2004. 海藻酸钠的提取及应用研究[D]. 重庆: 重庆大学
|
吴桂标, 杨海真, 陈银广, 等. 2001. 表面活性剂对污泥沉降及脱水性能的影响[J]. 中国给水排水, 17(1): 68-70. DOI:10.3321/j.issn:1000-4602.2001.01.021 |
吴志高. 2006. 胞外聚合物(EPS)对污泥沉降性能的影响及其在生物除磷中的作用研究[D]. 重庆: 重庆大学
|
王欣. 2020. 高效提取剩余污泥中高分子物质实验研究[D]. 北京: 北京建筑大学
|
王琳, 林跃梅. 2007. 好氧颗粒污泥中细菌藻酸盐的提取和鉴定[J]. 中国给水排水, 23(24): 88-91. DOI:10.3321/j.issn:1000-4602.2007.24.022 |
Xue W, Zeng Q, Lin S, et al. 2019. Recovery of high-value and scarce resources from biological wastewater treatment: Sulfated polysaccharides[J]. Water Research, 163: 114889. DOI:10.1016/j.watres.2019.114889 |
殷峻, Derlon N, Paul E. 2012. 限制基质条件下生物膜特性的研究[J]. 中国给水排水, (1): 24-27. |
Yin C, Meng F, Chen G. 2015. Spectroscopic characterization of extracellular polymeric substances from a mixed culture dominated by ammonia-oxidizing bacteria[J]. Water Research, 68: 740-749. DOI:10.1016/j.watres.2014.10.046 |
Ye F X, Peng G, Li Y. 2011. Influences of influent carbon source on extracellular polymeric substances (EPS) and physicochemical properties of activated sludge[J]. Chemosphere, 84: 1250-1255. DOI:10.1016/j.chemosphere.2011.05.004 |
Zhang Z J, Chen S H, Wang S M, et al. 2011. Characterization of extracellular polymeric substances from biofilm in the process of starting-up a partial nitrification process under salt stress[J]. Applied Microbiology and Biotechnology, 89(5): 1563-1571. DOI:10.1007/s00253-010-2947-y |
郑晓英, 黄希, 王兴楠, 等. 2013. 好氧颗粒污泥中胞外聚合物的提取方法及其优化[J]. 中国给水排水, 29(7): 1-4+9. DOI:10.3969/j.issn.1000-4602.2013.07.001 |
Zhang Z, Lin B, Xia S, et al. 2007. Production and application of a novel bioflocculant by multiple-microorganism consortia using brewery wastewater as carbon source[J]. Journal of Environmental Sciences-China, 19(6): 667-673. DOI:10.1016/S1001-0742(07)60112-0 |
周健, 龙腾锐, 苗利利. 2004. 胞外聚合物EPS对活性污泥沉降性能的影响研究[J]. 环境科学学报, 24(4): 613-618. DOI:10.3321/j.issn:0253-2468.2004.04.009 |
Zhu L, Qi H, Lv M, et al. 2012. Component analysis of extracellular polymeric substances (EPS) during aerobic sludge granulation using FTIR and 3D-EEM technologies[J]. Bioresource Technology, 124: 455-459. DOI:10.1016/j.biortech.2012.08.059 |
郑蕾, 田禹, 孙德智. 2007. pH值对活性污泥胞外聚合物分子结构和表面特征影响研究[J]. 环境科学, 28(7): 1507-1511. DOI:10.3321/j.issn:0250-3301.2007.07.017 |
Zeng G, Vad B S, Dueholm M S, et al. 2015. Functional bacterial amyloid increases Pseudomonas biofilm hydrophobicity and stiffness[J]. Frontiers in Microbiology, 6: 1099-1099. |
Zhang J, Wu J, Yu J, et al. 2017. Application of ionic liquids for dissolving cellulose and fabricating cellulose-based materials: state of the art and future trends[J]. Materials Chemistry Frontiers, 1(7): 1273-1290. DOI:10.1039/C6QM00348F |
庄芫, 吴金玲, 黄霞, 等. 2006. pH调节对活性污泥混合液膜过滤性的影响[J]. 环境化学, 25(1): 55-59. DOI:10.3321/j.issn:0254-6108.2006.01.013 |
赵华南. 2016. SBR运行方式、温度及C/N对生物脱氮过程胞外聚合物(EPS)组分的影响[D]. 兰州: 兰州交通大学
|
Zhu L, Zhou J, Lv M, et al. 2015. Specific component comparison of extracellular polymeric substances (EPS) in flocs and granular sludge using EEM and SDS-PAGE[J]. Chemosphere, 121: 26-32. DOI:10.1016/j.chemosphere.2014.10.053 |
 2021, Vol. 41
2021, Vol. 41


