传统活性污泥法通过能量和物质密集投入的方式去除有机污染物和氮元素, 这种污水处理模式电耗高且污泥产量大(王洪臣, 2014), 在节能降耗、资源循环和能源回收等方面显示出固有局限, 不符合当前能源危机及全球气候变化背景下的可持续发展理念.因而发展新型集能源回收、能耗削减、温室气体减排为一体的污水处理工艺成为当前污水处理技术革新的重要方向(Rubin et al., 2004).
厌氧膜生物反应器-部分亚硝化/厌氧氨氧化(AnMBR-PN/A)可实现污水中能源回收、有机物及氮素高效去除, 是一种极具发展前景的污水处理工艺(杨舒茗等, 2019).其前段AnMBR将厌氧生物处理与膜分离技术相结合, 产生可回收利用能源的同时高效降解有机物(Ng et al., 2004;Chen et al., 2017);PN/A利用氨氧化菌(AOB)和厌氧氨氧化菌进行自养脱氮(张敏等, 2018;Miao et al., 2018b).与传统活性污泥法相比该工艺不仅能够减少50%以上能源和75%的污泥产量, 还可以有效降低温室气体排放(Klartal et al., 2010;Ali et al., 2014;Yang et al., 2018;Xiao et al., 2018).
然而, AnMBR-PN/A工艺处理城市污水仍然面临众多挑战, 其中城市污水氨氮浓度较低, 在低氨氮条件下实现PN过程的稳定和Anammox过程功能微生物的富集为主要挑战(Liu et al., 2013).本研究着重研究了影响PN过程和Anammox菌富集的因素, 特别是不同水力停留时间(HRT)对工艺脱氮和有机物(COD)去除效率的影响.提出了工艺处理效果最佳的HRT, 分析了该HRT下微生物群落结构以及能量平衡, 为AnMBR-PN/A工艺的高效稳定运行提供参考.
2 材料与方法(Materials and methods) 2.1 实验装置该工艺包含一个有效体积为6.0 L(总体积10.0 L)的AnMBR, 反应器进出水采用蠕动泵控制, 水力停留时间通过泵不同频率的启闭来控制, 反应器产生的生物沼气由湿式气体流量计测量, 并由真空泵以5 L·min-1的流速进行循环曝气以控制膜污染;PN过程由一个有效体积为1.0 L(总体积1.3 L)的序批式反应器(SBR)实现, SBR每个循环包括7 min, 通过定时装置控制蠕动泵开关实现, 曝气通过增氧泵实现, 曝气量由玻璃转子流量计控制;Anammox反应在一个有效体积为2.3 L(总体积1.3 L)的上流式厌氧污泥床反应器(UASB)中实现.所有反应器用恒温水浴将温度维持在(25±1) ℃.AnMBR-PN/A的总HRT设置为20、16、11.2和7.8 h, AnMBR的HRT设置为12、10、7.2和5 h, PN/A的HRT设置为8、6、4和2.8 h.
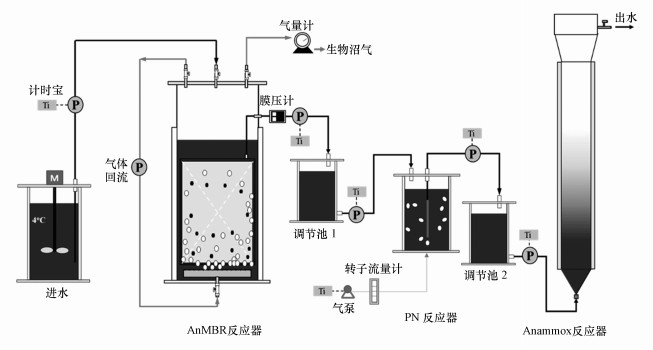 |
| 图 1 耦合工艺反应流程图 Fig. 1 Schematic diagram of coupled AnMBR-Anammox reactor |
本实验用水为人工模拟污水, COD为(500 ± 50) mg·L-1, TN浓度为(50 ± 5) mg·L-1, 总磷浓度为(5 ± 1) mg·L-1, 主要成分及其浓度分别为:尿素88.2 mg·L-1、乙酸钠220.6 mg·L-1、NaHCO3 800 mg·L-1、KH2PO4 21.9 mg·L-1、FeSO4·7H2O 5 mg·L-1、MgCl2·6H2O 5 mg·L-1、酵母浸膏56.8 mg·L-1、牛肉浸膏64.6 mg·L-1、酵母56.8 mg·L-1、葡萄糖220.6 mg·L-1, 微量元素参照文献中的配方(杨舒茗等, 2019).AnMBR接种污泥取自西安汉斯啤酒厂中温污泥厌氧消化池, PN/A反应器污泥取自西安某污水厂A2O缺氧池末端.
2.3 水质分析项目及测定方法反应器产生的生物沼气组分采用气相色谱(GC 7900;天美, 中国)测定, 色谱柱:碳分子TDX-01, 柱温箱温度为145 ℃, 检测器温度为150 ℃.COD采用快速消解分光光度法, TN采用碱性过硫酸钾法, NH4+-N采用钠氏试剂分光光度法, NO2--N采用N-(1-萘基)-乙二胺分光光度法, NO3--N采用紫外分光光度法.
2.4 微生物群落分布分析 2.4.1 高通量测序在AnMBR-PN/A工艺稳定运行第150 d分别从PN和Anammox反应器中采集污泥样品所采集的污泥样品置于-20 ℃冰箱中保存备用, 利用DNA提取试剂盒(Omega Bio-tek Inc, USA)提取样品中DNA.选用16S rDNA V3~V4区域的引物341F(5′-CCTACGGGNGGCWGGAG-3′)和805R(5′- GACTACHVGGGTATCTAATCC-3′)进行聚合链式反应(PCR)扩增, PCR扩增产物通过Sangon Biotech Co.(中国上海)的lllumina MiSeq平台进行高通量测序比对, 分析不同条件下微生物群落特征(王杉允, 2016).
2.4.2 荧光原位杂交(FISH)采用荧光原位杂交法分析第150 d反应器内的微生物菌群.污泥采用冷冻切片机(Leica CM 1950, Germany)进行切片, 杂交后的样品通过激光共聚焦显微镜(TCS SP8, 莱卡)进行观察, 并在100倍的物镜下采集图像, 具体操作参照文献中的方法进行(左剑恶等, 2004).实验所用探针:总细菌采用EUBmix(EUB338、EUBⅡ、EUB338Ⅲ、EUB338Ⅳ), 厌氧氨氧化菌采用AMX820, AOB采用AOBmix(NSO190、NSO1225、NEU和CNEU), NOB采用NOBmix(NIT3和CNIT3).
2.5 能量平衡分析AnMBR-PN/A工艺能量产生(E0)指甲烷产生能量, 其按式(1)计算(Xiao et al., 2018).
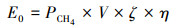
|
(1) |
式中, PCH4为甲烷产量(L·L-1·d-1), V为反应器的有效体积(L), ζ为甲烷气体的燃烧热值(35.8 kJ·L-1), η为甲烷能量转化效率.
能量消耗(E1)按公式(2)计算(Verrecht et al., 2008;Mei et al., 2016; Shin et al., 2018).
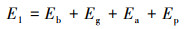
|
(2) |
净能量消耗(E2)按式(3)计算.
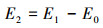
|
(3) |
式中, Eb为AnMBR进水基质桶的搅拌混合, Ep为泵的输送, Eg为AnMBR段沼气循环冲刷膜表面, Ea是PN段曝气.
3 结果与讨论(Results and discussion) 3.1 AnMBR-PN/A工艺处理性能在超过200 d的运行过程中, COD去除效果如图 2a所示.工艺出水COD基本稳定, 浓度在20 mg·L-1左右, 说明有机物被高效去除.其中AnMBR段去除率均大于95%, 出水COD在25 mg·L-1左右, 出水C/N值为0.5, 这对后续Anammox过程是有利的, 研究发现当C/N≤0.5时, 部分反硝化和完全反硝化作用可利用COD为Anammox菌提供生长基质NO2--N和无机碳源, 同时Anammox过程产生的NO3--N可为反硝化提供电子受体, 两者能实现协同作用(Winkler et al., 2012).COD通过PN/A后被进一步去除, 可归因于反应器内存在少量异养菌, 总去除率均大于97%, 实现了高效的COD去除效率.在整个运行过程中, COD去除率变化不大, HRT对工艺中COD的去除无显著影响.图 2b为不同HRT下AnMBR段的甲烷产率.甲烷产率随着HRT的缩短不断提高.在HRT为7 h时, 平均甲烷产率高达0.6 L·L-1·d-1, 这是由于HRT缩短, 反应器中单位时间进水有机物总量增加, 微生物可利用的底物增加.
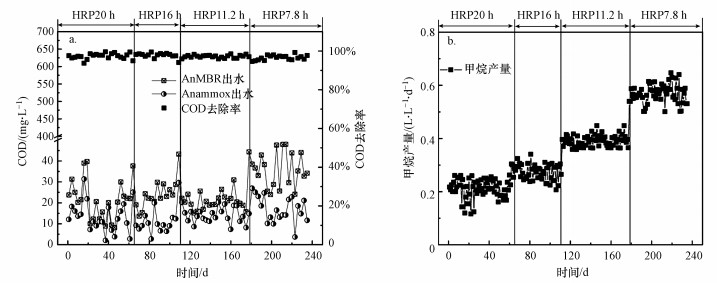 |
| 图 2 工艺COD去除效果 (a. 进出水COD及去除率, b. 甲烷产率) Fig. 2 COD treatment performance of coupled AnMBR-PN/A |
在不同HRT下, AnMBR-PN/A工艺出水TN去除率分别为70.6%、74.9%、78.4%和60.8%(图 3a).出水TN平均浓度为(14.2±4.2) mg·L-1.其中在PN段约8%的TN被去除, 说明PN段存在脱氮反应.各处理单元中氮素的转化分析表明:在整个运行过程中, AnMBR段进水有机氮浓度为51.2 mg·L-1, 几乎所有的氮素通过氨化作用被转化为NH4+-N;PN段47%的NH4+-N转化为NO-x-N, 出水NO3--N浓度低于7.5 mg·L-1;Anammox段出水NO2--N、NH4+-N和NO3--N平均浓度分别为0.9、6.4和6.8 mg·L-1(图 3b). 在HRT=7.8 h时, PN/A出水NH4+-N、NO2--N和NO3--N浓度较高且波动大, 整个工艺极不稳定, 主要是因为PN段氨氮转化不足;然而, 在HRT=11.2 h时, 出水水质已达城镇污水处理排放一级A标准(NH4+-N≤5 mg·L-1, TN≤15 mg·L-1, GB18918—2002).
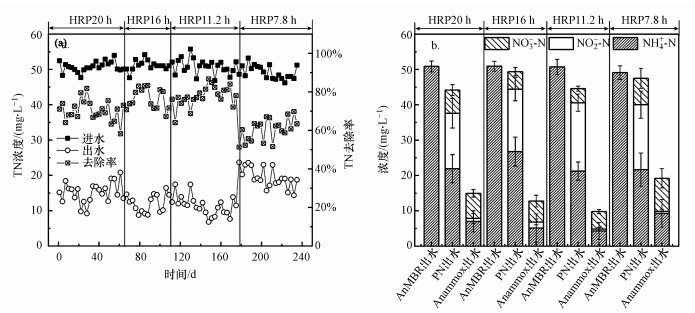 |
| 图 3 工艺TN去除效果 (a. 进出水TN浓度及去除率, b. 氮素转化) Fig. 3 TN treatment performance of coupled AnMBR-PN/A |
基于COD和N的去除效果, 对工艺进一步分析.TN去除率随HRT的变化呈先上升后下降的趋势(图 4a), HRT=11.2 h时达到最大值(78%).COD转化为CH4效率从HRT=20 h时的72.3%增加到HRT=7.8 h时的84.7%.此外, 对PN段NH4+-N转化和NO2--N积累进行分析.PN段为后续Anammox提供进水基质条件, 并且有研究发现, PN段在低氨氮浓度下难以控制, FA或FNA浓度较低, 对亚硝酸盐氧化菌(NOB)抑制作用减弱甚至消失(Miao et al., 2018a), 导致运行过程不稳定, 因而是AnMBR-PN/A工艺稳定运行的关键因素.如图 4b所示, NO2-/NH4+和NO2-/(NO2-+NO3-)随HRT的变化呈先上升后下降的趋势, 在HRT=11.2 h时, NO2-/NH4+为0.91±0.1, 接近理论值, 实现了NO2--N的积累;NO2-/(NO2-+NO3-)值为0.81±0.04, 抑制了NOB的增长, 达到整个运行过程中所需最优效果, 实现了稳定的部分亚硝化过程, 这可归因于合适的HRT和溶解氧.HRT过短会导致生化反应不完全;且本研究中溶解氧控制为0.2~0.5 mg·L-1, AOB相比于NOB有更低的氧饱和常数, 所以低溶解氧环境一定程度的抑制NOB的代谢, 促进亚硝酸盐的积累.综上, HRT=11.2 h被证明是AnMBR-PN/A工艺的最佳工况.
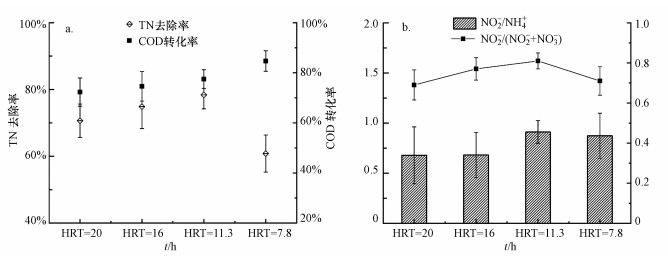 |
| 图 4 工艺处理效果 (a. 工艺TN去除率和COD转化为CH4效率, b. PN段NO2-/NH4+, NO2-/(NO2-+NO3-) Fig. 4 Performance of coupled AnMBR-PN/A |
图 5a为HRT=11.2 h时PN段微生物在属水平下的群落构成, 起亚硝化作用的主要微生物为Nitrosomonas, 其丰度为7.09%, NOB主要为Nitrospira(0.16%), 表明在该HRT下, PN段富集AOB的同时抑制了NOB;在PN段检测到反硝化菌(Denitratisoma, Terrimonas), 其丰度分别为1.57%和2.16%, 厌氧氨氧化菌(Candidatus Brocadia)丰度为0.69%, 这些细菌的存在解释了PN段出现TN去除的现象.Anammox段微生物在属水平下的群落构成如图 5b所示, 目前研究发现厌氧氨氧化菌共有5个属, 分别为Candidatus Brocadiaa, Candidatus Kuenenia, Candidatus Scalindua, Candidatus Anammoxoglobus和Candidatus Jetteni (Narita et al., 2007), 本研究只检测到Candidatus Brocadia, 其丰度高达21.01%, 说明Candidatus Brocadia在低氨氮浓度下易于生存, 这与以前的研究一致(王杉允, 2016);此外, 反应器内存在丰度为3.86%反硝化细菌(Denitratisoma), 反硝化细菌通过部分反硝化过程产生的NO2-可以被Anammox菌利用, 进一步强化了Anammox过程.
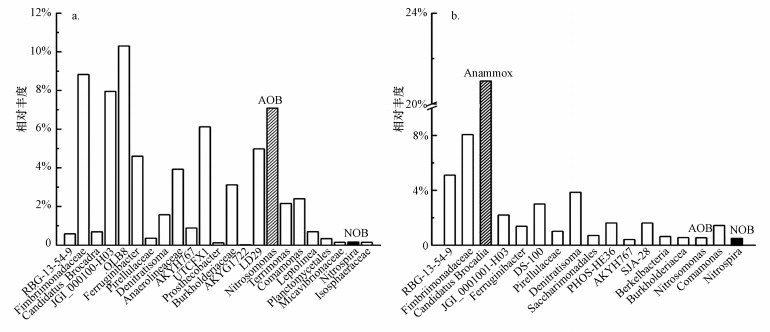 |
| 图 5 属水平细菌群落丰度柱状图 (a. PN段细菌群落, b. Anammox段细菌群落) Fig. 5 Bacterial community abundance histogram of the samples at the genus level |
在HRT=11.2 h时反应器中微生物的FISH分析结果如图 6所示, 由图可见.寡核苷酸探针EUBmix(染料为FAM, 激发波长495 nm)用于检测所有细菌(蓝色), AOBmix(染料为CY3, 激发波长为594 nm)用于检测AOB(绿色), NOBmix(染料为405, 激发波长为401 nm)用于检测NOB, 探针AMX820(染料为CY5, 激发波长665 nm)用于检测Anammox(红色).在PN段, AOB所占比例较高, 且主要集中在絮体边缘, 絮体内部缺氧环境可能给反硝化菌和Anammox菌创造生存条件, 在本研究中的FISH图像中没有检测出NOB, 这表明PN段成功富集AOB的同时抑制了NOB, 实现了PN段稳定运行.在Anammox段中, Anammox菌所占比例很高, 说明此阶段Anammox菌为反应器中的绝对优势菌, 且菌落之间存在明显的气孔通道, 颗粒内部结构不致密, 这可归因于Anammox过程产生了N2.
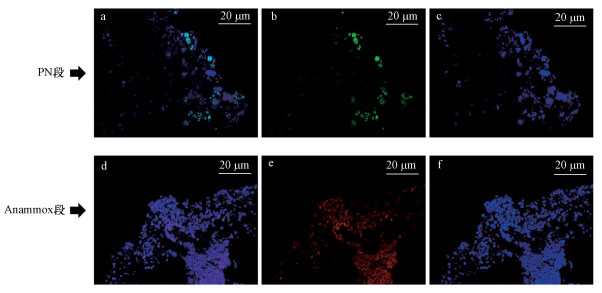 |
| 图 6 荧光原位杂交 (a. PN段EUBmix、AOBmix、NOBmix杂交结果, b. PN段AOBmix杂交结果, c. PN段EUBmix杂交结果, d. Anammox段EUBmix和AMX820杂交结果, e. Anammox段AMX820杂交结果, f. Anammox段EUBmix杂交结果) Fig. 6 FISH |
基于甲烷产能和工艺运行过程中的能量消耗进行能量平衡分析(表 1).在HRT=11.2 h时, 甲烷产率为0.39 L·L-1·d-1(图 2b), 按式(1)计算出能源回收潜力为0.4 kWh·m-3.AnMBR-PN/A工艺能量消耗为进水基质筒的搅拌, 进出水的输送, 沼气循环和曝气, 具体计算结果如表 1所示.该工艺总净能量消耗为0.013 kWh·m-3, 从能量角度看, AnMBR-PN/A工艺相比于其它污水处理工艺是有前景且可持续的.其中最大能量消耗来源于沼气循环(0.24 kWh·m-3), 这与其他研究中膜污染控制是AnMBR的主要能耗来源的结果一致(Dai et al., 2015).因此, 膜污染控制是实现能量盈余的重要限制单元, 需要开发更加节能的膜污染控制方式.
| 表 1 能量平衡分析 Table 1 Energy balance analysis |
本研究提出AnMBR-PN/A工艺同步实现了能源回收和自养脱氮, COD和TN去除率稳定达到了97%和78%.工艺中AnMBR段COD被高效转化为CH4, PN/A实现了自养深度脱氮.在HRT=11.2 h下达到最优处理效果, 反应器内AOB和Anammox菌形成良好的协同作用并有效抑制NOB, 能量平衡结果表明, 该工艺应用于城市污水处理能基本实现能量平衡.
Ali M, Oshiki M, Okabe S. 2014. Simple, rapid and effective preservation and reactivation of anaerobic ammonium oxidizing bacterium Candidatus Brocadia sinic[J]. Water Research, 57: 215-222. DOI:10.1016/j.watres.2014.03.036 |
Chen R, Nie Y, Hu Y, et al. 2017. Fouling behaviour of soluble microbial products and extracellular polymeric substances in a submerged anaerobic membrane bioreactor treating low-strength wastewater at room temperature[J]. Journal of Membrane Science, 531: 1-9. DOI:10.1016/j.memsci.2017.02.046 |
Dai W, Xu X, Liu B, et al. 2015. Toward energy-neutral wastewater treatment: A membrane combined process of anaerobic digestion and nitritation-anammox for biogas recovery and nitrogen removal[J]. Chemical Engineering Journal, 279: 725-734. DOI:10.1016/j.cej.2015.05.036 |
Kartal B, Kuenen J G, Van Loosdercht M C M. 2010. Sewage treatment with anammox Science[J]. Science, 328: 702-703. DOI:10.1126/science.1185941 |
Kuenen J G. 2008. Anammox bacteria: From discovery to application[J]. Nature Reviews Microbiology, 6(4): 320-326. DOI:10.1038/nrmicro1857 |
Liu G M. 2010. Long-term low DO enriches and shifts nitrifier community in activated sludge[J]. Environmental Science & Technology, 47: 5109-5117. |
Mei X, Wang Z, Miao Y, et al. 2016. Recover energy from domestic wastewater using anaerobic membrane bioreactor: operating parameters optimization and energy balance analysis[J]. Energy, 98: 146-154. DOI:10.1016/j.energy.2016.01.011 |
Miao Y Y, Zhang L, Yang Y D, et al. 2018a. Start-up single partial nitrification-anammox process treating low-strength sewage and its restoration from nitrate accumulation[J]. Bioresource Technology, 218: 771-779. |
Miao Y Y, Peng Y Z, Zhang L, et al. 2018b. Partial nitrification-anammox(PNA) treating sewage with intermittent aeration mode: Effect of influent C/N ratios[J]. Chemical Engineering Journal, (334): 664-672. |
Ng H Y, Hermanowicz S W. 2018. Membrane bioreactor operation at short solids retention times: Performance and biomass characteristics[J]. Water Research, 39(6): 981-992. |
Narita Y K, Zhang L, Zenichiro K, et al. 2018. Enrichment and physiological characterization of an anaerobic ammoniumoxidizing bacterium 'Candidatus Brocadiasapporoensis'[J]. Systematic and Applied Microbiology, 40(7): 448-457. |
Rubin K. 2013. The water resources utility of the Future: A blueprint for Action[R]. U. S: NACWA. WERF&WEF
|
Shin C, Bae J. 2018. Current status of the pilot-scale anaerobic membrane bioreactor treatments of domestic wastewaters: A critical review[J]. Bioresource Technology, 247: 1038-1046. DOI:10.1016/j.biortech.2017.09.002 |
Verrecht B, Judd S, Guglielmi G, et al. 2008. An aeration energy model for an immersed membrane bioreactor[J]. Water Research, 42: 4761-4770. DOI:10.1016/j.watres.2008.09.013 |
Winkler M K H, Kleerebezem R, van Loosdrecht M C M. 2012. Integration of anammox into the aerobic granular sludge process for main stream wastewater treatment at ambient temperatures[J]. Water Research, 46(1): 136-144. DOI:10.1016/j.watres.2011.10.034 |
王洪臣. 2014. 百年活性污泥法的革新方向[J]. 中国给水排水, 40(10). |
王杉允. 2016. 低氨氮浓度厌氧氨氧化工艺强化及颗粒污泥菌群特性研究[D]. 哈尔滨: 哈尔滨工业大学
|
Xiao B, Qin Y, Wu J, et al. 2018. Comparison of single-stage and two-stage thermophilic anaerobic digestion of food waste: performance, energy balance and reaction process[J]. Energy ConversIon and Management, 156: 215-223. DOI:10.1016/j.enconman.2017.10.092 |
Yang W, He S L, Han M, et al. 2018. Nitrogen removal performance and microbial community structure in the start-up and substrate inhibition stages of an anammox reactor[J]. Journal of Bioscience & Bioengineering, 126(1): 88-95. |
杨舒茗, 雷振, 黄兴园, 等. 2019. AnMBR-Anammox耦合污水甲烷回收及自养脱氮的工艺特性研究[J]. 环境科学学报, 39(10): 3265-3272. |
张敏, 汪瑶琪, 姜滢, 等. 2018. 匹配厌氧氨氧化型亚硝化的调控过程研究进展[J]. 水处理技术, 44(5): 7-12. |
左剑恶, 杨洋, 沈平, 等. 2004. 荧光原位杂交(FISH)技术在厌氧颗粒污泥研究中的应用[J]. 中国沼气, 22(1): 3-6. DOI:10.3969/j.issn.1000-1166.2004.01.001 |
 2021, Vol. 41
2021, Vol. 41


