2. 湖北科技学院五官医学院, 咸宁 437100;
3. 湖北科技学院临床医学院 & 附属第二医院, 咸宁 437100
2. Wuguan Medical College, Hubei University of Science and Technology, Xianning 437100;
3. Clinical Medical School & Second Affiliated Hospital, Hubei University of Science and Technology, Xianning 437100
阿尔茨海默病(Alzheimer′s disease, AD)是一种老年慢性进展性中枢神经系统变性疾病, 伴随不可逆性神经退行性损伤, 其临床表现为认知功能减退、记忆恶化和智力下降(Hardy et al., 2002).AD的病理学特征是β-淀粉样蛋白(Aβ)沉积、Tau蛋白过度磷化及神经原纤维缠结, 这些病变引起突触损失和神经元死亡, 导致认知功能障碍(Selkoe, 1991; Perl, 2010).
关于AD的发病机制有各种不同的学说, 但均无法解释其病因并提出有效的治疗方案.氧化应激被认为是AD发生、发展的新病因(Yamada et al., 2013), 研究表明, 氧化应激可导致神经元的代谢障碍及突触功能丧失(Butterfield et al., 2007; Querfurth et al., 2010).Aβ在脑组织中不可逆性沉积, 可引起氧化应激, 氧化应激造成生物活性分子如蛋白质、脂质、糖类、核酸等氧化修饰(Halliwell, 2006), 使之丧失原有结构和功能, 最终导致神经元功能缺失, 学习认知及记忆功能下降(Tönnies et al., 2017).
邻苯二甲酸酯类(Phthalateesters, PAEs)是一种化学助剂, 可以增加塑料制品的柔韧性和拉伸性.PAEs可通过多种途径进入人体, 如皮肤接触、饮食、饮水和空气吸入等, 已被我国列为了必须优先控制的污染物之一(Xu et al., 2016).最近越来越多的研究表明, PAEs不仅有生殖和发育毒性, 还有免疫和神经毒性, 能够导致认知缺陷和焦虑((Farzanehfar et al., 2016).邻苯二甲酸二丁酯(Dibutyl Phthalate, DBP)是PAEs中最典型的代表, 对学习记忆能力的不良影响已被广泛报道(Miodovnik et al., 2014).
研究证实, DBP诱导的学习、记忆功能障碍与海马神经元有关(Wójtowicz et al., 2017), 而氧化应激已被证实在其中起着非常重要的作用(Salminen et al., 2014).因此, 本研究通过构建阿尔茨海默病大鼠模型, 探讨DBP暴露对其学习记忆能力的影响及分子机制.
2 材料与方法(Materials and methods) 2.1 实验动物使用5~6周龄的Wistar大鼠, SPF级, 雌性, 体重(150±10) g, 购自湖北省实验动物研究中心(使用证明:No.42000600030398).动物房温度设定为(25±2) ℃, 湿度为45%, 昼夜交替各12 h, 动物自由饮食进水.
2.2 试剂与仪器试剂:DBP(≥99.6%, 84-74-2)购自美国Sigma公司;活性氧(ROS)、还原型谷胱甘肽(GSH)、丙二醛(MDA)测定试剂盒均购自南京建成生物工程研究所;8-羟基脱氧鸟苷(8-OHdG)ELISA试剂盒购自上海源叶生物科技有限公司;逆转录试剂盒购自美国Promega公司;Trizol试剂盒购自美国Invitrogen公司;qPCR试剂盒购自日本Toyobo公司;BCA蛋白浓度测定试剂盒购自美国Thermo Scientific公司;抗Bcl-2抗体、抗Bax抗体和抗Caspase-3抗体购自美国Abcam公司;辣根过氧化物酶标记的山羊抗兔IgG二抗购自美国EarthOx公司.
仪器:EthoVision XTVersion 12.0荷兰Noldus实验动物神经行为记录仪;BAS124S德国Sartorius电子天平;CH2日本Olympus生物显微镜;MDF-U53V日本Sanyo -80 ℃超低温冰箱;3K15德国Sigma高速冷冻离心机;Epoch美国BioTek酶标仪;CFX Connect美国Bio-Rad荧光定量PCR仪;PowerPac Basic美国Bio-Rad Western blot电泳仪.
2.3 动物模型使用脑立体定位仪, 给大鼠双侧海马分别一次性注射聚集态Aβ25~35制作AD模型.具体步骤为:10%水合氯酸(0.4 mL/100 g)腹腔注射麻醉大鼠, 将鼠头固定于脑立体定位仪, 保持前囟和后囟在同一水平, 碘伏擦拭后剪开头皮, 暴露前囟, 定位到海马区(前囟后3.5 mm, 中线旁开2.0 mm, 硬脑膜下2.7 mm), 台式牙钻机钻一小孔(直径1 mm), 垂直插入微量进样器, 将Aβ25~35聚集液缓慢注入其中, 左右两侧各注射2 μL, 注射速度0.2 μL·min-1, 留针5 min, 使Aβ25~35充分浸润局部组织, 然后按1.0 mm·min-1的速度缓慢拔针.注射完成后立刻缝合头皮, 术后每天肌注青霉素, 10万U·只-1, 持续5 d.
2.4 染毒方法与动物分组 2.4.1 实验方法研究表明, 各类食品中DBP的含量为0~46.50 mg·kg-1, 平均含量为0.11 mg kg-1 (王彝白纳等, 2016).以此为依据, 本实验设置DBP染毒剂量为0.25、2.5、25、250 mg·kg-1.DBP首先被配制成原液, 浓度为50 mg·mL-1, 再逐步稀释为0.025、0.25、2.5、25 mg·mL-1的染毒液(Wu et al., 2017).染毒组大鼠通过灌胃给予不同浓度的DBP染毒液, 对照组给予生理盐水, 大鼠灌胃体积为10 mL·kg-1, 持续28 d.大鼠在第22~26 d共进行5 d的水迷宫定向航行训练, 第27 d停止训练, 第28 d撤掉平台后, 大鼠进行空间探索实验(Yan et al., 2016).
2.4.2 动物分组适应性喂养5 d后, 将56只大鼠随机均分为7组, 每组8只, 分别为:阴性对照组(Saline组)、0.25 mg·kg-1·d-1 DBP组(DBP 0.25组)、2.5 mg·kg-1·d-1 DBP组(DBP 2.5组)、25 mg·kg-1·d-1 DBP组(DBP 25组)、250 mg·kg-1·d-1 DBP组(DBP 250组)、AD模型组(AD组)、AD+25 mg·kg-1·d-1 DBP组(AD+DBP组).
2.4 Morris水迷宫实验选用大小鼠通用型Morris水迷宫(Morris Water Maze, MWM), 其中, 圆桶形水箱直径为100 cm, 水深20 cm, 水温控制在(24±2) ℃.圆桶形水箱被人为假设等分为东北、东南、西北、西南(NE、SE、NW、SW)4个象限, 逃逸平台位于SW象限的正中央, 距离水面1 cm.
每天分别从不同象限池边的固定位置将大鼠面向池壁放入水中, 使它们寻找固定在WS象限的逃逸平台.记录不同实验组大鼠的逃避潜伏期、游泳轨迹及在目标象限停留时间, 并通过EthoVision XT Version 12.0软件采集和分析实验数据.
2.5 脑海马组织匀浆制备大鼠海马组织置于预冷的PBS(pH=7.4)中漂洗, 拭干后置于匀浆器中加预冷的PBS制成匀浆液(1 g组织用9 mL的PBS匀浆), 将制备好的匀浆在4 ℃、10000 g条件下离心10 min, 取上清分装于EP管, -80 ℃冷冻保存.
2.6 脑海马组织氧化应激水平的检测ROS含量用DCF荧光法进行测定(LeBel et al., 1992), 通过荧光酶标仪读取激发波长485 nm和发射波长525 nm处的荧光强度.GSH含量按照Folin-酚法进行测定, GSH含量(CGSH, μmol·g-1, 以prot计) 计算公式为CGSH=[(Am-Ab)/(As-Ab)]×Cs, 其中, Am为测定OD值, Ab为空白OD值, As为标准OD值, Cs为标准管浓度.MDA含量采用硫代巴比妥酸(TBA)法进行测定(Ohkawa et al., 1979), MDA含量(CMDA, μmol·g-1, 以prot计)计算公式为CMDA=6.45(A532-A600)-0.56A450.8-OHdG含量测定严格按照ELISA试剂盒说明书进行操作, 于波长450 nm处测定吸光度.
2.7 脑海马组织Bcl-2、Bax和Caspase-3 mRNA转录水平的测定 2.7.1 RNA提取和逆转录严格按照Trizol试剂盒说明书的操作提取大鼠海马细胞总RNA, 于波长260 nm处测定吸光度(A)值, 计算RNA浓度.取纯化后的RNA, 利用Olig(dT)逆转录为cDNA, 反应体系(20 μL)包括:0.5 μg·μL-1 Olig(dT) 1 μL, 总RNA 2 μg, 70 ℃孵育10 min后, 迅速在冰上冷却10 min;继续加入Reverse Transcription 10× Buffer 2 μL, 10 mmol·L-1 dNTP Mixture 2 μL, 40 U·μL-1 Ribonuclease Inhibitor 0.5 μL, 10 U·μL-1 AMV Reverse Transcriptase 1.5 μL, Nuclease free H2O补足体积至20 μL, 在42 ℃条件下进行逆转录反应60 min, 在95 ℃条件下酶灭活5 min;所得cDNA产物保存于-70 ℃备用.
2.7.2 引物的设计和合成根据GenBank中大鼠β-actin、Bcl-2、Bax、Caspase-3全序列, 取其保守区, 按照实时荧光定量PCR引物设计原则设计引物, 引物序列由武汉擎科生物技术有限公司合成.PCR引物序列如下:
Bcl-2 mRNA引物扩增产物(163 bp)序列:上游:5′-ACGGTGGTGGAGGAACTCTT-3′;下游:5′-GCAGATGCCGGTTCAGGTA-3′.
Bax mRNA引物扩增产物(136 bp)序列:上游:5′-CCAGGACGCATCCACCAAGAAGC-3′;下游:5′-TGCCACACGGAAGAAGACCTCTCG-3′.
Caspase-3引物扩增产物(148 bp)序列:上游:5′-AGAGCTGGACTGCGGTATTGAG-3′;下游:5′-GAACCATGACCCGTCCCTTG-3′.
β-actin mRNA引物扩增产物(116 bp)序列:上游:5′-CTCATGCCATCCTGCGTCT-3′;下游:5′-ACGCACGATTTCCCTCTCA-3′.
2.7.3 PCR扩增以逆转录后的cDNA为模板, 按照qPCR试剂盒操作步骤进行PCR扩增.反应体系(15 μL)包括:模板(cDNA)1.5 μL, 2×SYBR Green Realtime PCR Master Mix 7.5 μL, 上、下游引物(10 μmol·L-1)各0.5 μL, Nuclease-Free Water 5 μL.PCR反应条件为:95 ℃变性30 s, 60 ℃退火30 s, 72 ℃延伸50 s, 共39个循环.
2.8 Western blot检测脑海马组织Bcl-2、Bax和Caspase-3蛋白表达水平提取海马组织总蛋白, 采用BCA蛋白定量分析试剂盒测定其蛋白浓度, 蛋白样用5×SDS-PAGE缓冲液混匀后沸水煮8 min, 用12%的SDS聚丙烯酰胺分离胶和5%的浓缩胶电泳分离蛋白, 湿转后用5%脱脂奶粉封闭90 min, 兔抗大鼠Bcl-2(1∶1000)、Bax(1∶1000)、Caspase-3(1∶1000) 4 ℃孵育过夜, 洗膜后加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶10000), 室温下摇床孵育60 min, 采用增强化学发光法显色, 以β-actin (Abbkine)为内参.
2.9 统计学分析使用SPSS19.0统计软件进行数据处理, 数据用平均数±标准差表示, 组间差异采用单因素方差(ANOVA) 结合最小显著性差异法LSD-t检验比较, p < 0.05表示差异具有统计学意义.
3 结果(Results) 3.1 水迷宫实验结果由图 1A可知, 随着训练时间的增加, 不同组大鼠逃避潜伏期均下降, 其中, Saline组下降最为明显, 而DBP 250组和AD+DBP组的下降幅度最低.由图 1B可知, 与Saline组相比, 不同染毒组大鼠在第22~26 d寻找目标象限(SW象限)中逃逸平台的平均潜伏期出现了显著上升趋势, 且随DBP染毒浓度升高而延长(p < 0.01);与Saline组相比, DBP 25组、DBP 250组、AD组和AD+DBP组平均潜伏期增加, 差异具有统计学意义(p < 0.05, p < 0.01);AD+DBP组较AD组平均逃避潜伏期增加, 差异具有统计学意义(p < 0.05).
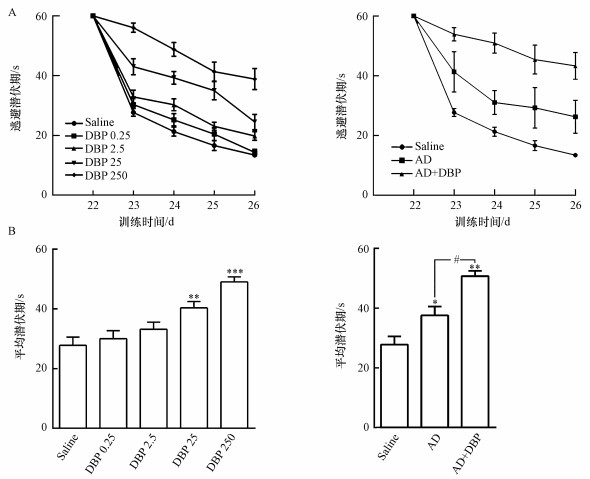 |
| 图 1 各组大鼠的逃避潜伏期 (A.第22~26 d逃避潜伏期;B.第22~26 d平均潜伏期;n=8, 与Saline组比较, *p < 0.05, **p < 0.01, ***p < 0.001;组间比较, #p < 0.05) Fig. 1 Escape latency of rats in each group |
水迷宫第28 d测试结果显示(图 2), 不同染毒组大鼠在目标象限停留时间均下降, 且随DBP染毒浓度升高而降低;DBP 25组、DBP 250组、AD组及AD+DBP组与Saline组比较, 差异具有统计学意义(p < 0.05, p < 0.01);且AD+DBP组相较AD组大鼠在目标象限停留时间短, 差异具有统计学意义(p < 0.05).
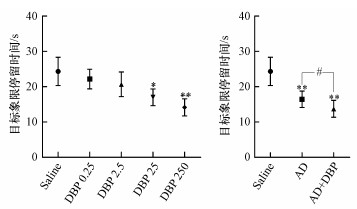 |
| 图 2 各组大鼠第28 d在目标象限停留时间 (n=8;与Saline组比较, *p < 0.05, **p < 0.01;组间比较, #p < 0.05) Fig. 2 Target quadrant stay time of rats in each group on day 28 |
水迷宫第28 d测试, 对大鼠空间记忆能力进行检测的游泳轨迹结果显示(图 3), 大鼠运动60 s内寻找平台, Saline组游泳轨迹集中在原放置平台的象限(SW象限), 而DBP 25组、DBP 250组、AD组及AD+DBP组大鼠游泳轨迹较散乱, 不规则, AD+DBP组相较AD组大鼠的游泳轨迹较少出现在目标象限, 运动目的性不强.
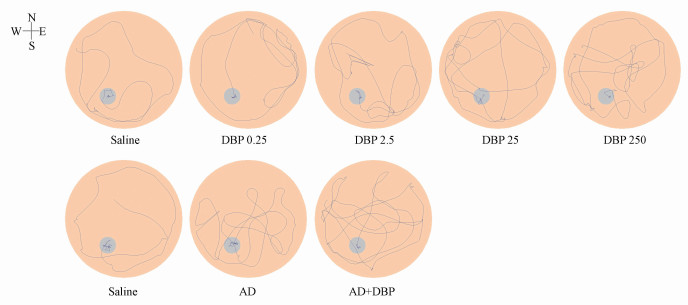 |
| 图 3 各组大鼠第28 d的游泳轨迹 (n=8;蓝色线条代表大鼠的运动轨迹, 无轨迹表示大鼠未运动到该区域) Fig. 3 The swimming track of rats in each group on day 28 |
DBP暴露后大鼠海马组织中ROS相对荧光强度、MDA和8-OHdG含量随DBP染毒浓度升高均出现不同程度的上升, DBP 25组、DBP 250组、AD组及AD+DBP组与Saline组相比, 差异具有统计学意义, AD+DBP组较AD组上述3个指标上升, 差异具有统计学意义(p < 0.05, p < 0.01)(图 4A、4C、4D).GSH含量随DBP染毒浓度升高而下降, DBP 25组、DBP 250组、AD组及AD+DBP组与Saline组相比, 差异具有统计学意义, AD+DBP组较AD组GSH含量下降, 差异有统计学意义(p < 0.05, p < 0.01)(图 4B).
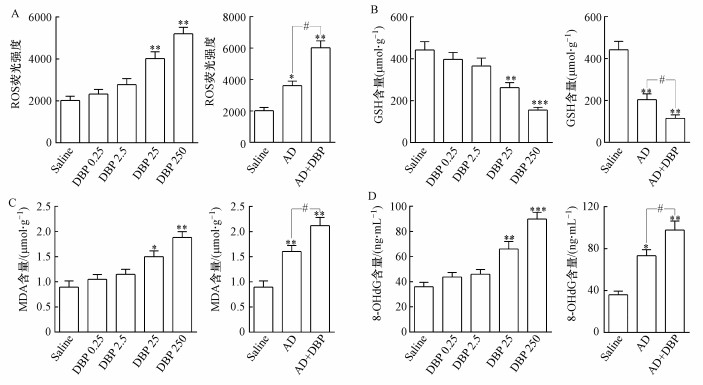 |
| 图 4 各组大鼠脑海马组织的氧化应激水平 (n=8;与对照组比较, *p < 0.05, **p < 0.01, ***p < 0.001;组间比较, #p < 0.05) Fig. 4 The levels of oxidative stress in the hippocampus of rats in each group |
由图 5可知, 与Saline组相比, AD组和AD+DBP组大鼠海马组织中Bcl-2 mRNA转录水平显著下降, Bax mRNA和Caspase-3 mRNA转录水平显著升高, 差异有统计学意义(p < 0.05, p < 0.01);AD+DBP组相较于AD组Bcl-2 mRNA转录水平明显下降, Bax mRNA和Caspase-3 mRNA转录水平则明显升高(p < 0.05).
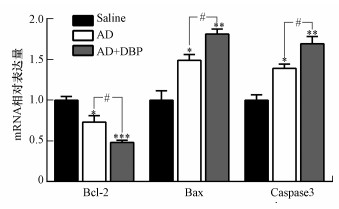 |
| 图 5 qPCR检测的各组大鼠脑海马组织Bcl-2、Bax和Caspase-3 mRNA转录水平 (n=8;*p < 0.05, **p < 0.01, ***p < 0.001;组间比较, #p < 0.05) Fig. 5 The transcriptional levels of Bcl-2, Bax and Caspase-3 mRNA were detected in the hippocampus of rats in each group by qPCR |
由图 6可知, 与Saline组相比, AD组和AD+DBP组大鼠海马组织中Bcl-2蛋白表达水平显著降低, Bax和Caspase-3蛋白表达水平显著升高;AD+DBP组相较于AD组Bcl-2蛋白表达水平明显降低, Bax和Caspase-3蛋白表达水平则明显升高.
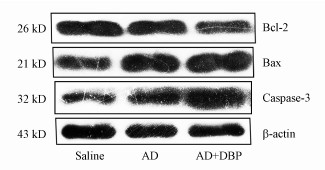 |
| 图 6 Western blot检测的各组大鼠脑海马组织Bcl-2、Bax和Caspase-3蛋白表达水平 (n=8) Fig. 6 Western blot was used to detect the protein expression levels of Bcl-2, Bax and Caspase-3 in the hippocampus of rats in each group |
近年来, 有关氧化应激与AD发病机制的研究越来越受到重视, 研究表明, 氧化应激广泛参与衰老、炎症和肿瘤等多种病理生理过程(Sehieber et al., 2014; Bhatti et al., 2017), 尤其在AD发病机制中扮演着重要的角色(Teixeira et al., 2019).海马是中枢神经系统中参与学习和记忆储存的重要器官, 位于大脑皮质, 是脑边缘系统的重要结构, 海马神经元的损伤及凋亡可能是发生学习记忆障碍的关键因素(Whitlock et al., 2006).研究证实, 长期DBP暴露可引起脑组织氧化应激, 导致海马组织神经细胞凋亡, 继而影响学习记忆能力(Yan et al., 2019).因此, 本实验通过构建阿尔茨海默病大鼠模型, 研究DBP暴露对其学习记忆能力、脑组织氧化应激水平和海马组织损伤的影响, 并探索DBP对阿尔茨海默病大鼠学习记忆能力影响的分子机制.
水迷宫结果显示, 训练第22~26 d, 各染毒组大鼠逃避潜伏期均下降, 平均潜伏期则出现了显著上升趋势, 第28 d测试, 各染毒组大鼠在目标象限停留时间均下降, 且其游泳轨迹不规则, 较无目的性, 说明DBP染毒后大鼠的空间学习记忆能力受损, 而DBP对学习记忆能力的影响具有一定剂量依赖性, 随着染毒剂量增加, 损害加重.另外, AD组和AD+DBP组与Saline组相比差异具有统计学意义(p < 0.05, p < 0.01), 而与AD组比较, AD+DBP组逃避潜伏期和在目标象限停留时间明显下降, 平均潜伏期明显上升, 游泳轨迹更不规则(p < 0.05), 表明AD大鼠的学习记忆能力受到损害, 暴露于DBP后, 其学习记忆能力进一步受损.
大脑富含不饱和脂肪酸, 属于高耗氧量型器官, 神经元是一种高代谢细胞, 其基本功能的维持有赖于线粒体呼吸链及氧化磷酸化所提供的能量, 因而容易受到氧化应激的影响(Islam, 2017).氧化应激是机体氧化和抗氧化系统失衡, ROS和活性氮(RNS)产生过多, 氧化程度超出抗氧化物的清除能力所造成的组织损伤(Wang et al., 2014), 其常见的检测指标有ROS、GSH、MDA和8-OHdG.
本研究中, 各染毒组ROS、MDA和8-OHdG含量均出现不同程度的上升, GSH含量明显降低, 说明DBP暴露可导致氧化应激, 且随着DBP染毒剂量的升高, 氧化应激水平上升.另外, AD组和AD+DBP组与Saline组相比差异具有统计学意义(p < 0.05, p < 0.01), 而与AD组比较, AD+DBP组上述4个指标的含量均有明显变化(p < 0.05), 表明暴露于DBP后可导致AD大鼠的氧化应激水平进一步上升.
Bcl-2/Bax/Caspase-3是参与细胞凋亡的重要信号通路, 当发生氧化应激反应时, Bax表达增多, Bcl-2表达下降.Bax从胞质转移到线粒体外膜, 形成Bax/Bax同二聚体, 线粒体外膜通透性增加, 细胞色素C(Cyt-c)等被释放到细胞质中.Cyt-c激活下游分子Caspase-3, Caspase-3使DNA修复酶断裂, 导致DNA的损伤和细胞凋亡(Sinha et al., 2013).本研究结果发现, DBP(25 mg·kg-1·d-1)可上调AD大鼠海马组织Bax、Caspase-3 mRNA和蛋白表达水平, 下调Bcl-2 mRNA和蛋白表达水平, 提示DBP可通过上调Bcl-2/Bax/Caspase-3信号通路促进AD大鼠海马组织凋亡.
本研究结果表明, DBP染毒后大鼠的空间学习记忆能力受损, 氧化应激水平上升, 且随着染毒剂量增加损伤加重.另外, AD+DBP组大鼠较AD组在学习记忆能力、氧化应激水平、Bcl-2/Bax/Caspase-3信号通路方面均有明显变化, AD+DBP组大鼠学习记忆能力损伤加剧, 氧化应激水平和Bcl-2/Bax/Caspase-3信号通路上调.
综上所述, 本研究水迷宫结果显示为DBP染毒后AD大鼠的学习记忆能力进一步受损, 学习记忆能力是大脑最重要的高级神经活动之一, 与海马组织关系密切, 而海马神经元的损伤和凋亡可能是引起学习记忆能力受损的主要原因.Yan等(2019)的研究证实DBP长期暴露可导致机体氧化应激, 从而促进海马组织神经细胞凋亡.本研究结果显示, DBP染毒后大鼠海马组织氧化应激水平升高, 且暴露于DBP可导致AD大鼠的氧化应激水平进一步上升.氧化应激可促进Bcl-2家族中Bax等促凋亡蛋白的表达, 并抑制Bcl-2等抗凋亡蛋白的表达(Sinha et al., 2013).本研究中Bcl-2/Bax/Caspase-3信号通路表达上调, 说明DBP通过氧化应激上调Bcl-2/Bax/Caspase-3凋亡信号通路, 促进海马组织凋亡, 导致学习记忆能力障碍.
5 结论(Conclusions)DBP(25、250 mg·kg-1·d-1)28 d重复染毒, 可导致大鼠海马组织氧化应激, 学习记忆能力受损.而25 mg·kg-1·d-1 DBP通过氧化应激上调Bcl-2/Bax/Caspase-3信号通路, 促进AD大鼠海马组织凋亡, 导致AD大鼠学习记忆能力进一步受到损害.本文通过DBP影响AD大鼠学习记忆能力的分子机制研究, 揭示了氧化应激对凋亡信号通路的作用, 并为进一步研究DBP的毒性提供了理论和数据依据.
Bhatti J S, Bhatti G K, Reddy P H. 2017. Mitochondrial dysfunction and oxidative stress in metabolic disorders: A step towards mitochondria based therapeutic strategies[J]. Biochimica et Biophysica Acta-Molecular Basis of Disease, 1863(5): 1066-1077. DOI:10.1016/j.bbadis.2016.11.010 |
Butterfield D A, Reed T, Newman S F, et al. 2007. Roles of amyloid beta-peptide-associated oxidative stress and brain protein modifications in the pathogenesis of Alzheimer's disease and mild cognitive impairment[J]. Free Radical Biology & Medicine, 43(5): 658-677. |
Farzanehfar V, Naderi N, Kobarfard F, et al. 2016. Determination of dibutyl phthalate neurobehavioral toxicity in mice[J]. Food & Chemical Toxicology, 94: 221-226. |
Halliwell B. 2006. Oxidative stress and neurodegeneration: Where are we now?[J]. Journal of Neurochemistry, 97(6): 1634-1658. DOI:10.1111/j.1471-4159.2006.03907.x |
Hardy J, Selkoe D J. 2002. The amyloid hypothesis of Alzheimer's disease: Progress and problems on the road to therapeutics[J]. Science, 297(5580): 353-356. DOI:10.1126/science.1072994 |
Islam M T. 2017. Oxidative stress and mitochondrial dysfunction-linked neurodegenerative disorders[J]. Neurological Research, 39(1): 73-82. DOI:10.1080/01616412.2016.1251711 |
LeBel C P, Ischiropoulos H, Bondy S C. 1992. Evaluation of the probe 2', 7'-dichlorofluorescin as an indicator of reactive oxygen species formation and oxidative stress[J]. Chemical Research in Toxicology, 5: 227-231. DOI:10.1021/tx00026a012 |
Miodovnik A, Edwards A, Bellinger D C, et al. 2014. Developmental neurotoxicity of ortho-phthalate diesters: Review of human and experimental evidence[J]. Neurotoxicology, 41: 112-122. DOI:10.1016/j.neuro.2014.01.007 |
Ohkawa H, Ohishi N, Yagi K, et al. 1979. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction[J]. Analytical Biochemistry, 95(2): 351-358. DOI:10.1016/0003-2697(79)90738-3 |
Perl D P. 2010. Neuropathology of Alzheimer's Disease[J]. Mount Sinai Journal of Medicine, 77(1): 32-42. DOI:10.1002/msj.20157 |
Querfurth H W, LaFeda F M. 2010. Alzheimer's disease[J]. The New England Journal of Medicine, 362(4): 329-344. DOI:10.1056/NEJMra0909142 |
Salminen L E, Paul R H. 2014. Oxidative stress and genetic markers of suboptimal antioxidant defense in the aging brain: a theoretical review[J]. Reviews in the Neurosciences, 25(6): 805-819. |
Sehieber M, Chandel N S. 2014. ROS function in redox signaling and oxidative stress[J]. Current Biology, 24(10): R453-462. DOI:10.1016/j.cub.2014.03.034 |
Selkoe D J. 1991. The molecular pathology of Alzheimer's disease[J]. Neuron, 6(4): 487-498. DOI:10.1016/0896-6273(91)90052-2 |
Sinha K, Das J, Pal P B, et al. 2013. Oxidative stress: the mitochondria-dependent and mitochondria-independent pathways of apoptosis[J]. Archives of Toxicology, 87(7): 1157-1180. DOI:10.1007/s00204-013-1034-4 |
Teixeira J P, de Castro A A, Soares F V, et al. 2019. Future therapeutic perspectives into the Alzheimer's disease targeting the oxidative stress hypothesis[J]. Molecules, 24(23): 4410. DOI:10.3390/molecules24234410 |
Tönnies E, Trushina E. 2017. Oxidative stress, synaptic dysfunction, and Alzheimer's disease[J]. Journal of Alzheimer's Disease, 57(4): 1105-1121. DOI:10.3233/JAD-161088 |
Wang X L, Wang W Z, Li L, et al. 2014. Oxidative stress and mitochondrial dysfunction in Alzheimer's disease[J]. Biochimica et Biophysica Acta, 1842(8): 1240-1247. DOI:10.1016/j.bbadis.2013.10.015 |
王彝白纳, 蒋定国, 杨大进, 等. 2016. 中国居民邻苯二甲酸二丁酯膳食摄入水平及其风险评估[J]. 中国食品卫生杂志, 28(6): 800-804. |
Whitlock J R, Heynen A J, Shuler M G, et al. 2006. Learning induces long-term potentiation in the hippocampus[J]. Science, 313(5790): 1093-1097. DOI:10.1126/science.1128134 |
Wójtowicz A K, Szychowski K A, Wnuk A, et al. 2017. Dibutyl phthalate (DBP)-induced apoptosis and neurotoxicity are mediated via the aryl hydrocarbon receptor (AhR) but not by estrogen receptor alpha (ERα), estrogen receptor beta (ERβ), or peroxisome proliferator-activated receptor gamma (PPARγ) in mouse cortical neurons[J]. Neurotoxicity Research, 31(1): 77-89. DOI:10.1007/s12640-016-9665-x |
Wu Y, Li J Q, Yan B, et al. 2017. Oral exposure to dibutyl phthalate exacerbates chronic lymphocytic thyroiditis through oxidative stress in female wistar rats[J]. Scientific Reports, 7(1): 15469. DOI:10.1038/s41598-017-15533-z |
Xu W H, You Y M, Wang Z G, et al. 2016. The microbiome and functions of black soils are altered by dibutyl phthalate contamination[J]. Applied Soil Ecology, 99: 51-61. DOI:10.1016/j.apsoil.2015.11.024 |
Yamada J, Jinno S. 2013. Spatio-temporal differences in perineuronal net expression in the mouse hippocampus, with reference to parvalbumin[J]. Neuroscience, 253: 368-379. DOI:10.1016/j.neuroscience.2013.08.061 |
Yan B, Guo J H, Liu X D, et al. 2016. Oxidative stress mediates dibutyl phthalate induced anxiety-like behavior in Kunming mice[J]. Environmental Toxicology & Pharmacology, 45: 45-51. |
Yan B, Sun Y L, Zeng J, et al. 2019. Combined use of vitamin E and nimodipine ameliorates dibutyl phthalate-induced memory deficit and apoptosis in mice by inhibiting the ERK 1/2 pathway[J]. Toxicology and Applied Pharmacology, 368: 1-17. DOI:10.1016/j.taap.2019.02.008 |
 2021, Vol. 41
2021, Vol. 41


