2. 桂林理工大学环境科学与工程学院, 桂林 541004;
3. 桂林理工大学地球科学学院, 桂林 541004
2. College of Environmental Science and Engineering, Guilin University of Technology, Guilin 541004;
3. College of Earth Science, Guilin University of Technology, Guilin 541004
高砷地下水在世界范围内广泛分布, 如印度、孟加拉国、越南、缅甸、智利、阿根廷、匈牙利、美国和中国(Nordstrom et al., 2002; Fendorf et al., 2010).我国高砷地下水主要分布在气候干旱半干旱、水资源匮乏的北方地区, 如新疆、内蒙古、山西、宁夏、青海等地(段艳华等, 2014).长期饮用高砷水(As > 10 μg·L-1)将导致慢性中毒和各种疾病, 包括皮肤癌、膀胱癌、肝癌、肺和支气管癌以及恶性肿瘤的生长(Kan et al., 2013).地下水砷中毒对人类健康损害极大, 对砷中毒的研究日益受到人们的重视.
砷在地下水环境中的浓度分布和迁移主要受到砷与含水层介质相互作用的影响.含水层沉积物中各类含砷岩石和矿物(如砷硫铁矿等)是地下水砷的最初来源, 水-岩相互作用使沉积物吸附态的砷被释放进入地下水, 导致地下水中的砷富集, 因此, 吸附-解吸行为被认为是影响和控制砷迁移释放过程的主要机制之一(Smedley et al., 2002; 王焰新等, 2010).大同盆地高砷地下水的调查研究发现, 碱性地下水环境中, 砷会大量从含铁、锰等的氧化物、氢氧化物的矿物上解吸附进入地下水中, 造成砷质量浓度升高(郭华明等, 2003).尽管铁的(氢)氧化物对砷具有强烈的亲和性, 但在碱性还原含水系统中, 部分铁锰氧化物可被还原为低价态可溶性铁锰, 从而使与其结合的砷也得以释放进入地下水中(王焰新等, 2010).需要注意的是, 砷与含水层介质的相互作用会受到水化学条件的显著影响.Pierce等(1982)研究了pH对氢氧化铁-砷相互作用的影响, 发现pH较低时, 铁的氢氧化物对砷酸盐吸附量大于亚砷酸盐, 但随着pH值的增大, 铁的氢氧化物对砷酸盐解吸量也大于亚砷酸盐; 郭华明(2007)等研究发现, 氧化环境中砷会被大量吸附在胶体或铁锰(氢)氧化物上, 导致地下水中砷质量浓度低, 但在还原环境中, 胶体变得不稳定或铁锰的氢氧化物被还原, 吸附在其表面的砷被解吸进入地下水中, 形成高砷地下水.大量研究已经证实, 地下水中普遍存在的各种离子(如PO43-、HCO3-、SiO32-、SO42-、NO3-等)可能会占据吸附剂的吸附位点(Appelo et al., 2005; 倪萍等, 2016; 张伟等, 2019), 通过竞争吸附、配位体交换(周晓馨等, 2018)、离子交换(杨雪等, 2016)等使砷解吸进入地下水, 显著改变地下水中砷的浓度分布.
地下水-地表水相互作用带(Groundwater and surface water interaction zone, GSIZ), 是地球关键带中一种重要的潜流带, 该区域中地下水和地表水的往复交替补给使得含水层不断经历着氧化和还原环境的波动变化, 生物地球化学条件常常处于一种动态的变化过程中, 这使得砷的分布和迁移行为变得更加复杂(苏小四等, 2019).河岸带是GSIZ中常见的一种形式, 许多学者在四河环绕(东荆河、通顺河、屡丰河和奎阁河)、遍布地表水的江汉平原河岸带针对高砷地下水做了大量野外调查和监测研究.Duan等(2015)对沙湖村39口监测井以及两条河流进行监测, 发现地下水位与地表水位随季节波动, 地下水-地表水发生相互作用, 低砷地表水补给稀释高砷地下水, 或者地下水向地表水排泄, 氧化还原环境也会发生季节性变化, 地下水砷浓度与地下水位呈正相关; 在雨季, 随着条件变得更加还原, Fe(Ⅲ)氧化物的还原溶解和As(Ⅴ)的还原解吸增强, 导致砷浓度上升, 而在旱季, 新的氧化铁生成, 更多的砷被固定在其上, 导致砷浓度降低.
然而, 以往大多研究主要基于野外监测观察并分析河岸带中砷的行为, 针对砷在河岸带主要的砂质含水介质上的吸附解吸行为及不同水化学因素对其影响的机理性实验研究成果还很少, 深刻解释这一问题有助于进一步认识河岸带中砷的行为机理.因此, 本研究采集河岸带常见的河砂为吸附介质, 配制As(Ⅲ)和As(Ⅴ)模拟液, 开展河砂对As(Ⅲ)和As(Ⅴ)的吸附动力学和等温吸附实验, 重点探究不同水化学因素(包括:pH、氧化还原条件、共存离子)对砷在河砂上吸附行为的影响, 识别主要水化学影响因素及其机理.
2 材料与方法(Materials and methods) 2.1 试剂与材料实验材料为粒径 < 2 mm的河砂, 反复浸泡清洗至溶液的电导率稳定不变(约30 μS·cm-1), 50 ℃下烘干48 h, 保存备用, 河砂主要组成成分见表 1.实验过程中所用试剂NaAsO2、Na2HAsO4·7H2O、NaH2PO4、Na2SiO3·9H2O、NaHCO3、Na2SO4、NaNO3、FeCl3·6H2O、FeCl2·4H2O、Na2S·9H2O、硫脲(H2NCSNH2)和抗坏血酸(C6H8O6)等均为分析纯, KOH、NaOH、HCl和H2SO4均为优级纯.所有试剂均购自西陇科学股份有限公司.实验用水均为超纯水(电导率 < 18 μS·cm-1).
| 表 1 河砂样品化学组成 Table 1 Chemical compositions of river sand |
准确称取(1.0000±0.0010) g河砂至一系列50 mL塑料离心管中, 分别加入40 mL质量浓度为1 mg·L-1的As(Ⅲ)和As(Ⅴ)模拟液, 振荡反应1、3、5、12、24、48、72、96、120、144、168、192、216、240 h后取上清液用于砷含量测定.
2.2.2 等温吸附实验准确称取(1.0000±0.0010) g河砂至一系列50 mL塑料离心管中, 分别加入40 mL质量浓度为0.1、0.5、2、5、10、20 mg·L-1的As(Ⅲ)或As(Ⅴ)模拟液, 振荡反应200 h后取上清液用于砷含量测定.
2.2.3 水化学因素影响实验初始pH影响:准确称取(1.0000±0.0010) g河砂至一系列50 mL塑料离心管中, 分别添加40 mL 1 mg·L-1的As(Ⅲ)或As(Ⅴ)模拟液, pH分别调至3、4、5、6、7、8、9、10、11, 振荡反应200 h后取上清液用于砷含量测定.
氧化还原条件影响:分别设置有氧组、缺氧组和还原组实验.有氧组:含有较高浓度溶解氧(DO), 实验步骤与2.2.1节一致; 缺氧组:含有较低浓度DO, 即向超纯水中持续通入N2, 制备无氧水, 用无氧水配制1 mg·L-1的As(Ⅲ)或As(Ⅴ)模拟液, 取40 mL与河砂混合; 还原组:含有较低浓度的DO及负的氧化还原电位(Eh), 即在缺氧组的基础上, 分别加入0.1、1、5、20 mg·L-1的S2-, 以模拟富含硫化物的还原性水环境.反应在50 mL厌氧瓶中进行, 反应前用针筒抽出瓶内空气, 以模拟缺氧密闭的环境.
共存离子影响:准确称取(1.0000±0.0010) g河砂至一系列50 mL厌氧瓶中, 分别添加40 mL 1 mg·L-1的As(Ⅲ)或As(Ⅴ)模拟液.一组向反应体系中分别添加20 mg·L-1 PO43-、SiO32-、SO42-、NO3-、HCO3-、Fe3+和Fe2+, 利用0.1 mol·L-1 HCl或0.1 mol·L-1 NaOH调节溶液初始pH为7, 用针筒抽出瓶内空气, 密闭条件下振荡反应200 h后取上清液用于砷含量测定.另外一组为了识别不同离子添加对反应体系pH值的改变及其共同作用下砷在河砂上吸附的变化, 向反应体系中分别添加PO43-、SiO32-、SO42-、NO3-、Fe3+和Fe2+使其初始浓度分别为0.1、1、5、20 mg·L-1, 分别添加HCO3-使其初始浓度分别为5、20、100、200 mg·L-1.测定初始pH值后, 用针筒抽出瓶内空气, 密闭条件下振荡反应200 h后测定pH值, 同时取上清液用于砷含量测定.
上述所有实验在恒温气浴摇床30 ℃, 200 r·min-1振荡速度下进行, 样品采集后3 d内完成测试, 测试前过0.45 μm滤膜.为保证结果的准确性, 所有实验重复3次.
2.3 模型与计算 2.3.1 平衡吸附量河砂对As(Ⅲ)和As(Ⅴ)单位吸附量用式(1)计算.
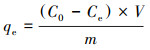
|
(1) |
式中, qe为吸附平衡时河砂对砷的单位吸附量(μg·g-1), C0为初始溶液中砷的浓度(μg·L-1), Ce为吸附平衡后溶液中砷的浓度(μg·L-1), V为反应溶液体积(L), m为河砂的投加质量(g).
2.3.2 吸附动力学模型利用准一级动力学模型和准二级动力学模型对吸附数据进行拟合, 两种模型的表达式分别如式(2)和式(3)所示.

|
(2) |
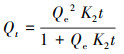
|
(3) |
式中, K1和K2分别为准一级吸附速率常数和准二级吸附速率常数, Qt为t时刻的吸附量(μg·g-1), Qe为平衡时的吸附量(μg·g-1).
2.3.3 等温吸附模型分别采用Langmuir和Freundlich模型对等温吸附曲线进行拟合分析, 两种模型的表达式分别如式(4)和式(5)所示.

|
(4) |
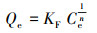
|
(5) |
式中, Qmax为单层最大吸附量; Qe为平衡时吸附量(μg·g-1); KL和KF分别为与热力学和吸附强度有关的常数; Ce平衡时溶液中砷浓度(μg·L-1); 常数n与吸附能力相关.
2.4 仪器分析溶液中总砷浓度用原子荧光形态分析仪(AFS-933/SA-20, 北京吉天仪器, 检测限≤0.01 μg·L-1)测定, PO43-浓度用UV-9600紫外/可见分光光度计测定, 总铁(0.02~3 mg·L-1)、Fe2+(0.02~3 mg·L-1)、S2-(5~800 μg·L-1)浓度用HACH DR1900便携式可见分光光度计(美国哈希)测定, HCO3-、CO32-浓度用智能电位滴定仪(METROHM 888 Titrando, 瑞士万通)测定, 反应前后溶液pH、溶解氧(DO)和氧化还原电位(Eh)用便携式多参数数字化分析仪(Hach-HQ30d)测定, 零点电位(pHpzc)用Zeta电位仪(Nano zs90, 英国马尔文仪器公司)测定.
3 结果与讨论(Results and discussion) 3.1 吸附动力学特征图 1是河砂吸附As(Ⅲ)和As(Ⅴ)的准一级、准二级吸附动力学拟合曲线.从图中可以看出, 河砂对As(Ⅴ)的吸附量大于As(Ⅲ), 都可分为3个阶段:快速吸附、慢吸附和吸附平衡阶段.对于As(Ⅲ), 0~120 h为快速吸附阶段, 吸附量随时间增加而明显增大, 120 h时分别达到准一级、准二级动力学平衡吸附容量的91.7%和80.3%左右; 120~168 h为慢吸附阶段, 吸附量增加缓慢; 168 h后达到吸附平衡.对于As(Ⅴ), 0~72 h为快速吸附阶段, 吸附量随时间增加而明显增大, 吸附速率比As(Ⅲ)快, 72 h分别达到准一级、准二级动力学平衡吸附容量的84.9%和71.3%左右; 72~168 h为慢吸附阶段, 吸附量增加缓慢; 168 h后为吸附平衡阶段.因此, 河砂吸附As(Ⅲ)和As(Ⅴ)的平衡时间为大于168 h.
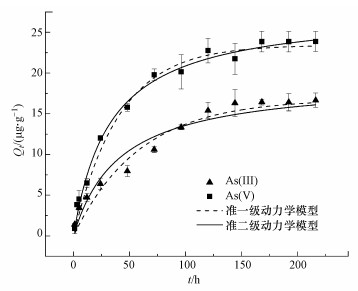 |
| 图 1 河砂对As(Ⅲ)和As(Ⅴ)的吸附动力学拟合曲线 Fig. 1 Fitting curves of As(Ⅲ) and As(Ⅴ) adsorption on river sand using kinetics models |
两个动力学模型的拟合参数见表 2.对比发现准二级模型对河砂吸附As(Ⅲ)和As(Ⅴ)过程拟合结果的相关系数R2略大于准一级模型, 分别为0.9850和0.9918.表明河砂对砷的吸附过程更符合准二级动力学模型, 反应主要受外层吸附控制(Pignatello et al., 1996).
| 表 2 河砂对As(Ⅲ)和As(Ⅴ)的吸附动力学拟合参数 Table 2 Fitting parameters of kinetics models for As(Ⅲ) and As(Ⅴ) adsorption on river sand |
Langmuir模型是基于吸附剂表面同质, 且为单分子层吸附, Freundlich模型是基于吸附剂表面具有不同吸附点位及吸附能的经验模型, 存在多层吸附(何明靖等, 2019).两种等温吸附模型对河砂吸附As(Ⅲ)和As(Ⅴ)过程的拟合结果如图 2所示, 拟合参数见表 3.从图中可以看出, 河砂对As(Ⅲ)和As(Ⅴ)的吸附量随着砷平衡浓度的增加逐渐升高, 且对As(Ⅴ)的吸附量高于As(Ⅲ).Langmuir和Freundlich模型均能很好地拟合河砂吸附As(Ⅲ)和As(Ⅴ)的等温吸附曲线, 相关吸附R2均大于0.99.利用Langmuir模型拟合得到河砂对As(Ⅲ)和As(Ⅴ)的单层最大吸附量Qmax分别为348.19 μg·g-1和442.76 μg·g-1, 说明河砂对As(Ⅴ)的吸附强于As(Ⅲ), 这与吸附动力学的结果一致.
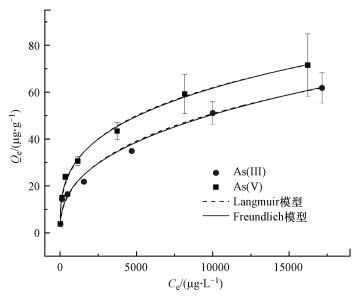 |
| 图 2 河砂对As(Ⅲ)和As(Ⅴ)的等温吸附拟合曲线 Fig. 2 Fitting curves of As(Ⅲ) and As(Ⅴ) adsorption on river sand using isothermal models |
| 表 3 河砂对As(Ⅲ)和As(Ⅴ)的等温吸附拟合参数 Table 3 Fitting parameters of isotherm models for As(Ⅲ) and As(Ⅴ) adsorption on river sand |
图 3a为溶液初始pH对河砂吸附As(Ⅲ)和As(Ⅴ)的影响曲线图.从图中可以发现, 对于As(Ⅲ), pH在3~8时, 吸附量上下波动不大, 在pH=4左右达到最大; 当pH从8增加至11时, 吸附量快速降低.亚砷酸盐的pK1值为9.2, 当pH < 9.2时主要以H3AsO30存在, pH > 9.2时主要以H2AsO3-存在.由图 3b可知河砂的zeta零点电位(pHpzc)约为7.19.这意味着当pH < 7.19时, 介质表面带正电, 此时As(Ⅲ)主要以不带电的H3AsO30存在, 河砂与As(Ⅲ)之间无静电作用, 因此pH的改变对As(Ⅲ)的吸附无明显影响.在高pH值(> 9.2)条件下, As(Ⅲ)的吸附量迅速降低可归因于河砂表面的负电荷与H2AsO3-之间的静电排斥(Nikic et al., 2019).当初始pH为4~10时, 河砂吸附砷反应后的pH值均在7左右(表 4).
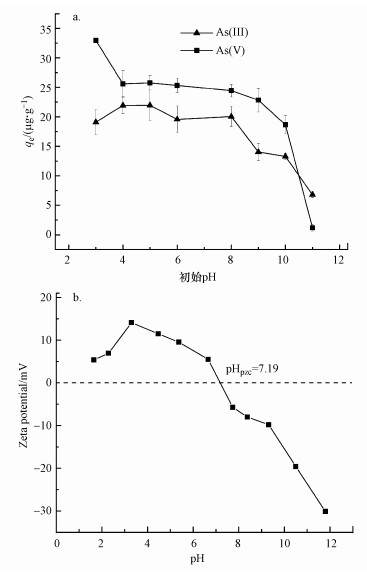 |
| 图 3 初始pH对河砂吸附As(Ⅲ)和As(Ⅴ)的影响(a)及河砂的zeta电位(b) Fig. 3 The effect of initial pH value on river sand adsorption for As(Ⅲ) and As(Ⅴ) and zeta of river sand (b) |
| 表 4 反应前后溶液pH值变化 Table 4 The pH values of solutions before and after arsenic adsorption |
对于As(Ⅴ)而言, 所有初始pH条件下, 吸附量随着pH的增大而出现不同程度的减小:pH从3增加至4时, 吸附量明显下降; pH从4增加至8, 吸附量下降缓慢; pH从8增加至11时, 吸附量快速下降.砷酸盐的解离常数为pKa1=2.3, pKa2=6.8, pKa3=11.6(Nikic et al., 2019), 当2.3 < pH < 6.8时发生一级解离, 主要以H2AsO4-存在, 6.8 < pH < 11.6时以HAsO42-存在(郑曌等, 2011).河砂的pHpzc约为7.19, 且在pH=3左右, 表面正电荷达到最大(图 3b), 与As(Ⅴ)阴离子之间产生静电吸引最大, 对As(Ⅴ)吸附量也最大; 在较高pH(pH>7.19)时河砂表面带负电荷, 与同是带负电荷的As(Ⅴ)阴离子之间产生静电排斥(Nikic et al., 2019), OH-浓度的增大还会与As(Ⅴ)竞争吸附导致吸附量降低(邓天天等, 2012).
总体来说, 偏酸性环境都有利于三价砷和五价砷的吸附, 此后随着pH增大, 河砂对砷的吸附量呈现不同程度的减小, 这与王建燕(2019)、曾辉平(2018)和Nikic(2019)等研究相似.可能的原因是:河砂的pHpzc约为7.19, 当溶液pH较低时, 河砂表面的正电荷增多, 质子化作用增强, (亚)砷酸根离子与河砂的静电引力增强, 吸附量升高(张丽萍等, 2014).随着溶液初始pH升高, 河砂表面带负电荷, 与(亚)砷酸根离子产生静电斥力, 导致吸附量下降.OH-的增加, 也会与砷竞争吸附位点(苏春利, 2009), 因此碱性环境下砷的吸附量显著下降.河砂中含有少量的铁铝氧化物矿物, 能很好地吸附砷, 但当pH增大时, 砷会从其上解吸, 进入水中(郭华明等, 2003).
3.4 氧化还原条件影响有氧组反应前DO浓度为8.13 mg·L-1, 反应后浓度为8.20 mg·L-1; 缺氧组反应前DO浓度为0.84 mg·L-1, 反应后为5.20 mg·L-1, 表明反应过程中瓶内有一定浓度的氧气.还原组实验中, 不同S2-浓度(0.1、1、5、20 mg·L-1)对应的As(Ⅲ)体系反应前Eh分别为-283.40、-343.50、-375.10、-401.70 mV, 反应后分别为243.93、46.93、47.60、-195.93 mV; As(Ⅴ)体系反应前Eh分别为-256.4、-316.9、-338.9、-398.5 mV, 反应后分别为223.9、174.0、115.6、-191.3 mV.不同的正电位和负电位分别指示了不同程度的氧化和还原环境.参考Smedley(2002)的As-O2-H2O pH-Eh图, 可知在本实验Eh-pH条件下, 存在As(Ⅲ)和As(Ⅴ)形态的转化, 因此本实验只讨论氧化还原电位对总砷平衡吸附量的影响.
图 4a为不同氧化还原条件对河砂吸附As(Ⅲ)的影响柱状图, 相对于有氧环境, 缺氧环境下河砂对As(Ⅲ)的吸附量较低, 这可能是因为有氧体系中一部分As(Ⅲ)被氧化为As(Ⅴ), 河砂对As(Ⅴ)的吸附量高于As(Ⅲ).而有氧和缺氧反应体系中, 河砂对As(Ⅴ)的吸附量无明显差别.添加S2-的还原体系中, S2-浓度越大, Eh越低, 说明还原环境越强, 河砂对As(Ⅲ)的吸附量也逐渐减小.一方面可能的原因是随着还原程度加强, As(Ⅲ)被氧化为As(Ⅴ)的数量减少, 导致吸附量下降, 另一方面可能是因为随着S2-浓度增大, 溶液pH也逐渐增大(表 5), 不利于As(Ⅲ)的吸附.而对于As(Ⅴ)(图 4b), 随着S2-浓度增大, 河砂对As(Ⅴ)的吸附量逐渐减小.可能的原因是随着还原程度加强, As(Ⅴ)被还原为As(Ⅲ)的数量增加(许嘉琳, 1996), 溶液pH的增大也不利于As(Ⅴ)的吸附, 导致吸附量下降.
 |
| 图 4 不同氧化还原条件对河砂吸附As(Ⅲ)(a)和As(Ⅴ)(b)的影响 Fig. 4 The effect of different redox conditions on river sand adsorption for As(Ⅲ)(a) and As(Ⅴ)(b) |
| 表 5 反应前后溶液pH值变化 Table 5 The pH values of solutions before and after arsenic adsorption |
添加20 mg·L-1 S2-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为5.85 μg·g-1和9.12 μg·g-1, 相对于不添加S2-的反应体系, 吸附量分别下降了67.08%和58.19%.当反应体系初始pH调整为相同(pH=7)时, 添加20 mg·L-1 S2-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为12.75 μg·g-1和18.18 μg·g-1, 相对于不添加S2-的反应体系, 吸附量分别下降了28.2%和16.67%.分析认为:S2-的添加显著影响了砷在河砂上的吸附, 一方面, S2-的强还原环境不利于河砂对砷的吸附, 另一方面, S2-的添加增大了反应体系的pH值, pH的升高使得As(Ⅲ)和As(Ⅴ)与河砂之间产生静电排斥, 导致吸附量降低.
总的来说, 随着实验条件从有氧→缺氧→还原, 进而还原程度不断加强, 河砂对As(Ⅲ)和As(Ⅴ)的吸附量逐渐减小, 说明碱性的还原条件不利于砷的吸附.由表 1可知, 河砂中含有少量的铁铝等金属氧化物, 还原条件下铁铝(氢)氧化物的还原溶解是造成砷迁移性增强的原因之一(安礼航等, 2020).
3.5 共存离子影响 3.5.1 PO43-影响不同初始PO43-浓度下河砂对As(Ⅲ)和As(Ⅴ)的吸附影响如图 5所示.随着初始PO43-浓度的增大, 河砂对As(Ⅲ)和As(Ⅴ)的吸附量快速下降, 同时PO43-在河砂上的吸附量显著升高.其中, 当初始PO43-浓度为20 mg·L-1时, 河砂对As(Ⅲ)的单位吸附量比没有PO43-存在时下降了81.96%, 对As(Ⅴ)的单位吸附量比没有PO43-存在时下降了56.4%.PO43-对河砂吸附As(Ⅲ)和As(Ⅴ)的抑制作用可能是因为PO43-与亚砷酸根和砷酸根离子具有相似的物理化学性质, 与砷发生竞争吸附, 因此PO43-的吸附量升高而砷的吸附量降低.
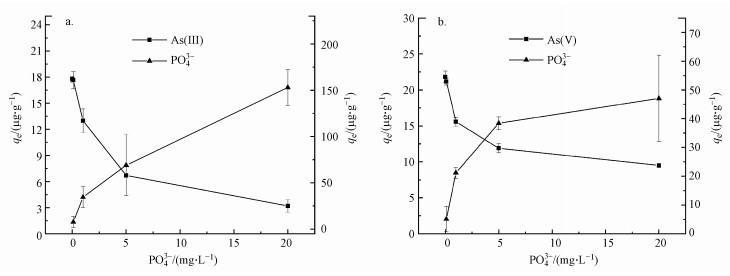 |
| 图 5 不同浓度PO43-对河砂吸附As(Ⅲ)(a)和As(Ⅴ)(b)的影响 Fig. 5 The effect of different PO43-on river sand adsorption for As(Ⅲ)(a) and As(Ⅴ)(b) |
曾辉平等(2018)研究铁锰泥颗粒(GA)对As(Ⅴ)的吸附去除时发现, 随着PO43-浓度的增大, GA对砷几乎无去除效果.分析其原因并用来探讨本实验PO43-影响河砂吸附As(Ⅲ)和As(Ⅴ)的机理:这是因为PO43-阴离子与(亚)砷酸根阴离子结构相似, 可以与河砂表面吸附点位进行配位交换, 同时还发生电正性吸附位点的竞争, 最终导致了河砂对砷吸附效果的大幅下降.参照Nikic等(2019)的研究成果, 可以用它们相似的化学结构来解释, (亚)砷酸盐和PO43-均为四面体阴离子, 都可与河砂表面的吸附位点结合, 而吸附点位是有限的, 因此, 在PO43-存在的情况下, 砷的吸附量下降可以归因于PO43-对砷吸附点位的竞争.
3.5.2 SiO32-影响图 6a为不同初始SiO32-浓度对河砂吸附As(Ⅲ)和As(Ⅴ)的影响曲线图.从图中可以看出, 随着初始SiO32-浓度的增大, As(Ⅲ)和As(Ⅴ)的吸附量显著下降.这是因为SiO32-具有跟(亚)砷酸根离子相似的结构, 可以通过共价键结合吸附在河砂表面, 与砷竞争吸附(丁文成等, 2013); SiO32-对As(Ⅴ)竞争吸附效应强于As(Ⅲ), 这可能是由于As(Ⅲ)在溶液中(pH < 9.2)主要以电中性的H3AsO3形式存在, 而As(Ⅴ)主要以带负电荷的H2AsO4-和HAsO42-形式存在(张丽萍等, 2014), 河砂表面带负电荷, 两者产生静电排斥作用, 使As(Ⅴ)吸附量降低.
 |
| 图 6 不同浓度SiO32-(a)、HCO3-(b)、SO42-(c)及NO3-(d)对河砂吸附As(Ⅲ)和As(Ⅴ)的影响 Fig. 6 The effect of different SiO32-(a)、HCO3-(b)、SO42-(c) and NO3-(d) on river sand adsorption for As(Ⅲ) and As(Ⅴ) |
添加20 mg·L-1 SiO32-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为4.24 μg·g-1和3.54 μg·g-1, 相对于不添加SiO32-的反应体系, 吸附量分别下降了76.14%和83.8%.当反应体系初始pH调整为相同(pH=7)时, 添加20 mg·L-1 SiO32-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为10.28 μg·g-1和13.92 μg·g-1, 相对于不添加SiO32-的反应体系, 吸附量分别下降了42.14%和36.2%.分析认为:SiO32-的添加显著影响了砷在河砂上的吸附, 一方面, SiO32-与砷竞争吸附, 导致砷的吸附量降低, 另一方面, SiO32-的添加增大了反应体系的pH值, pH的升高使得砷与河砂之间产生静电排斥, 不利于河砂对砷的吸附.
| 表 6 反应前后溶液pH值变化 Table 6 The pH values of solutions before and after arsenic adsorption |
与本实验类似, Christl等(2012)研究认为SiO32-与砷的竞争效应很大程度上取决于SiO32-的浓度和pH值, 当SiO32-浓度为0.1 mmol·L-1, 只有pH值大于8时, 对砷的吸附才会降低; 但当SiO32-浓度增加到1.8 mmol·L-1, 由于SiO32-的聚合作用, 在pH值为6时, 砷的吸附已经降低.Hu等(2015)研究发现, 实验条件下, 在0.5~3 h的时间内, 在吸附剂表面可检测到SiO32-单体、二聚体、低聚物和聚合物, SiO32-低聚物是吸附剂表面的主要物质.溶液中砷可以使SiO32-单体和二聚体在吸附剂表面脱附, 而SiO32-低聚物和聚合物不受溶液中砷的影响.本实验吸附平衡时间较长, 因此在河砂表面, SiO32-低聚物和聚合物随时间的增加而增加, 与砷竞争吸附位点, 降低砷的吸附.
3.5.3 HCO3-影响图 6b为不同初始浓度HCO3-对河砂吸附As(Ⅲ)和As(Ⅴ)的影响曲线图.对于As(Ⅲ), 较高浓度的HCO3-对河砂吸附As(Ⅲ)有明显的抑制作用, 而较低浓度无明显影响.对于As(Ⅴ), 随着初始HCO3-浓度的增大, 河砂对As(Ⅴ)的单位吸附量显著降低.虽然反应后各体系HCO3-+CO32-的总量无明显变化, 但在添加不同浓度HCO3-的体系中, 反应后的溶液检测到了不同浓度的CO32-, CO32-比亚砷酸根离子有更强的吸附竞争力, 会与砷竞争吸附, 导致砷的单位吸附量降低(伍新花等, 2012).
已有的研究表明, 水中HCO3-浓度偏高时, 水溶液呈碱性, 会影响除砷效率(曾辉平等, 2018), 因此, HCO3-浓度增大引起溶液pH的升高(表 7)不利于砷的吸附.另外, 本实验添加不同浓度HCO3-体系中, 反应后的溶液检测到了不同浓度的CO32-, 而王喆等(2020)认为水中CO32-会和砷竞争矿物表面的吸附点位, 形成含有碳酸盐的复合物, 使得砷吸附量减少.
| 表 7 反应前后pH值变化 Table 7 The pH values of solutions before and after arsenic adsorption |
添加20 mg·L-1 HCO3-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为11.22 μg·g-1和11.77 μg·g-1, 相对于不添加HCO3-的反应体系, 吸附量分别下降了36.83%和46.06%.当反应体系初始pH调整为相同(pH=7)时, 添加20 mg·L-1 HCO3-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为12.99 μg·g-1和18.18 μg·g-1, 相对于不添加HCO3-的反应体系, 吸附量分别下降了26.85%和16.67%.分析认为:HCO3-的添加显著影响了砷在河砂上的吸附, 一方面, HCO3-/CO32-与砷竞争吸附, 导致砷的吸附量降低, 另一方面, HCO3-的添加增大了反应体系的pH值, pH的升高使得砷与河砂之间产生静电排斥, 不利于河砂对砷的吸附.
3.5.4 SO42-影响图 6c是不同初始浓度SO42-对河砂吸附As(Ⅲ)和As(Ⅴ)的影响曲线图.从图中可以看出, 所有初始浓度SO42-对河砂吸附As(Ⅲ)无显著影响.而SO42-对河砂吸附As(Ⅴ)有明显的抑制作用, 即便是在较低初始浓度的体系中, 而随着初始SO42-浓度增大, 单位吸附量缓慢降低.有趣的是, 添加SO42-的体系下, 河砂对三价砷的吸附量比五价砷高.河砂对As(Ⅴ)吸附的抑制作用可能是SO42-与同是含氧阴离子的砷酸根离子发生了离子交换反应(杨雪等, 2016), 导致As(Ⅴ)单位吸附量减小.另一方面, SO42-浓度增大引起溶液pH的升高(表 8)也不利于砷的吸附, 而As(Ⅲ)体系反应前后溶液pH无明显改变.
| 表 8 反应前后溶液pH值变化 Table 8 The pH values of solutions before and after arsenic adsorption |
添加20 mg·L-1SO42-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为16.73 μg·g-1和13.99 μg·g-1, 相对于不添加SO42-的反应体系, 吸附量分别下降了5.78%和35.87%.当反应体系初始pH调整为相同(pH=7)时, 添加20 mg·L-1 SO42-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为18.06 μg·g-1和17.13 μg·g-1, 相对于不添加SO42-的反应体系, 吸附量分别提高了1.7%和下降了21.5%.分析认为:SO42-的添加显著影响了As(Ⅴ)在河砂上的吸附, 一方面, SO42-与As(Ⅴ)之间存在离子交换, 导致砷的吸附量降低, 另一方面, SO42-的添加增大了反应体系的pH值, pH的升高使得As(Ⅴ)与河砂之间产生静电排斥, 不利于河砂对As(Ⅴ)的吸附.而SO42-的添加对As(Ⅲ)在河砂上的吸附无明显影响.
与本实验类似, 陈维芳等(2012)研究发现, 通入含有20 mg·L-1 SO42-的进水溶液对As(Ⅴ)的吸附有轻微的抑制作用.Nikic等(2019)研究发现, 随着SO42-浓度的增大, As(Ⅴ)的去除率降低, 这可归因于SO42-与氢氧化铁的球内络合作用, 在本实验中可能是SO42-与河砂表面吸附点位的络合作用, 从而与砷酸根竞争吸附.
3.5.5 NO3-影响图 6d为不同初始浓度NO3-对河砂吸附As(Ⅲ)和As(Ⅴ)的影响曲线图.NO3-对河砂吸附As(Ⅲ)无显著影响.较低浓度NO3-对河砂吸附As(Ⅴ)有明显的抑制作用, 但高浓度下吸附量有所提升.抑制最明显在初始NO3-为5 mg·L-1时, 河砂对As(Ⅴ)的单位吸附量比没有NO3-存在时下降了31.62%.与SO42-相似, NO3-对河砂吸附As(Ⅴ)的抑制作用可能是NO3-与同是含氧阴离子的砷酸根离子发生了离子交换反应, 与As(Ⅴ)竞争吸附, 导致As(Ⅴ)单位吸附量减小(杨雪等, 2016).反应后溶液pH升高(表 9)也是导致吸附量下降的一个重要原因.
| 表 9 反应前后溶液pH值变化 Table 9 The pH values of solutions before and after arsenic adsorption |
添加20 mg·L-1 NO3-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为16.39 μg·g-1和16.95 μg·g-1, 相对于不添加NO3-的反应体系, 吸附量分别下降了7.69%和22.33%.当反应体系初始pH调整为相同(pH=7)时, 添加20 mg·L-1 NO3-的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为14.74 μg·g-1和13.98 μg·g-1, 相对于不添加NO3-的反应体系, 吸附量分别下降了16.98%和35.95%.分析认为:NO3-的添加显著影响了As(Ⅴ)在河砂上的吸附, 一方面, NO3-与As(Ⅴ)之间存在离子交换或者竞争吸附作用, 导致砷的吸附量降低, 另一方面, NO3-的添加降低了反应体系的pH值, pH的降低有利于河砂对As(Ⅲ)和As(Ⅴ)的吸附.
与已有研究类似, Moed等(2012)开展砂柱试验研究表明, 当进水NO3-浓度达到1 mmol·L-1时, 砷的阻滞因子下降, 意味着NO3-对砷的去除有明显的抑制作用.伍新花等(2012)发现水滑石(Mg6Al2(OH)16CO3·4H2O)的除砷效率随着NO3-浓度的增大而降低.与SO42-对As(Ⅴ)的影响相似, NO3-对As(Ⅴ)的影响可能是因为NO3-与砷竞争吸附.
3.6 铁离子影响 3.6.1 Fe3+影响图 7为不同初始浓度Fe3+对河砂吸附As(Ⅲ)和As(Ⅴ)的影响曲线图, 从图中可以看出, 随着初始Fe3+浓度的逐渐增大, 河砂对As(Ⅲ)和As(Ⅴ)的单位吸附量显著升高.添加Fe3+后溶液显酸性(表 10), 这可能是因为Fe3+水解形成Fe(OH)3胶体导致pH降低.取两份20 mg·L-1初始Fe3+体系反应后的溶液, 一份过0.45 μm滤膜, 一份不过滤膜, 使用便携式分光光度计测总铁含量, 发现过滤膜的溶液中未检测到铁, 而不过滤膜的溶液中检测到了9~16.7 mg·L-1铁的存在, 这进一步说明Fe3+在溶液中生成了Fe(OH)3胶体或铁氧化物, 铁(氢)氧化物对砷有很强的吸附能力, 使得吸附量显著提升.
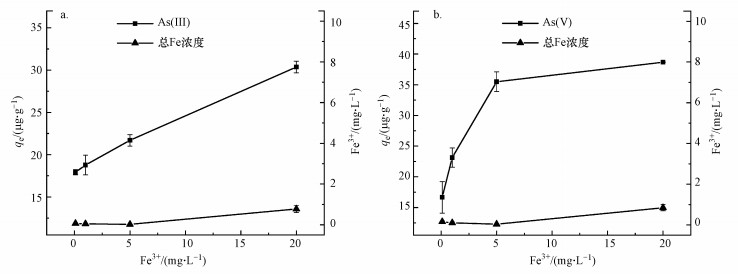 |
| 图 7 不同浓度Fe3+对河砂吸附As(Ⅲ)(a)和As(Ⅴ)(b)的影响 Fig. 7 The effect of different Fe3+on river sand adsorption for As(Ⅲ)(a) and As(Ⅴ)(b) |
| 表 10 反应前后溶液pH值变化 Table 10 The pH values of solutions before and after arsenic adsorption |
添加20 mg·L-1 Fe3+的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为30.37 μg·g-1和38.67 μg·g-1, 分别是不添加Fe3+反应体系吸附量的1.71倍和1.77倍.当反应体系初始pH调整为相同(pH=7)时, 添加20 mg·L-1Fe3+的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为35.93 μg·g-1和38.18 μg·g-1, 是不添加Fe3+反应体系吸附量的2.02倍和1.75倍.分析认为:Fe3+在溶液中生成了Fe(OH)3胶体或铁氧化物, 大量的砷被吸附在其上, 显著影响了砷在河砂上的吸附.虽然Fe3+的添加降低了反应体系的pH值, 但高pH条件下更有利于Fe(OH)3胶体的形成, 因此初始pH=7时更有利于Fe3+体系中河砂对砷的吸附.
3.6.2 Fe2+影响图 8为不同初始浓度Fe2+对河砂吸附As(Ⅲ)和As(Ⅴ)的影响曲线图.与Fe3+体系相似, 随着初始Fe2+浓度逐渐增大, 河砂对As(Ⅲ)和As(Ⅴ)的单位吸附量显著升高.其中, 初始Fe2+浓度为20 mg·L-1时, 河砂对As(Ⅲ)的单位吸附量是没有Fe2+存在时的1.51倍.对As(Ⅴ)的单位吸附量是没有Fe2+存在时的1.69倍.Fe2+浓度的增大引起溶液pH的降低(表 11)是吸附量显著升高的一个原因.由于Fe2+易氧化成Fe3+, Fe2+促进河砂吸附As(Ⅲ)和As(Ⅴ)的机理相似, 反应后添加20 mg·L-1 Fe2+体系中检测到了一定浓度的Fe2+和Fe3+, 说明未完全转化为Fe(OH)3胶体, 因此Fe2+的促进作用不如Fe3+.
 |
| 图 8 不同浓度Fe2+对河砂吸附As(Ⅲ)(a)和As(Ⅴ)(b)的影响 Fig. 8 The effect of different Fe2+on river sand adsorption for As(Ⅲ)(a) and As(Ⅴ)(b) |
| 表 11 反应前后溶液pH值变化 Table 11 The pH values of solutions before and after arsenic adsorption |
添加20 mg·L-1 Fe2+的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为26.88 μg·g-1和36.94 μg·g-1, 分别是不添加Fe2+反应体系吸附量的1.51倍和1.69倍.当反应体系初始pH调整为相同(pH=7)时, 添加20 mg·L-1 Fe2+的反应体系中, 河砂对As(Ⅲ)和As(Ⅴ)的平衡吸附量分别为36.23 μg·g-1和38.11 μg·g-1, 是不添加Fe2+反应体系吸附量的2.04倍和1.75倍.Fe2+易被氧化为Fe3+, 因此添加Fe2+对河砂吸附砷的影响与Fe3+体系相似.
3.7 共存离子影响排序图 9a为不同浓度、不同共存离子对河砂吸附As(Ⅲ)的影响汇总图, 低浓度共存离子对河砂吸附As(Ⅲ)无明显影响, 高浓度共存离子能显著抑制河砂吸附As(Ⅲ), 抑制作用大小:PO43- > SiO32- > S2- > HCO3-; Fe3+和Fe2+能显著促进河砂吸附As(Ⅲ), 促进作用大小:Fe3+ > Fe2+.图 9b为不同浓度、不同共存离子对河砂吸附As(Ⅴ)的影响汇总图, 低浓度共存离子对河砂吸附As(Ⅴ)无明显影响, 高浓度共存离子能抑制河砂吸附As(Ⅴ), 抑制作用大小:SiO32- > PO43- > S2- > HCO3- > SO42- > NO3-; Fe3+和Fe2+能显著促进河砂吸附As(Ⅴ), 促进作用大小:Fe3+ > Fe2+.
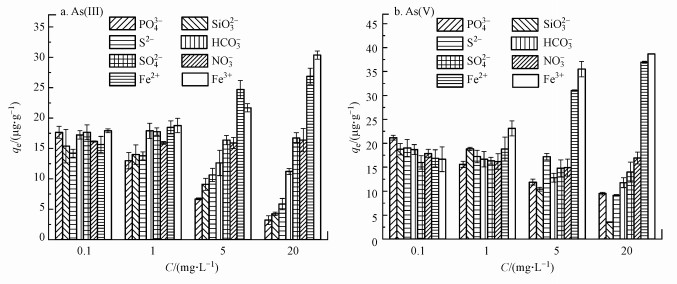 |
| 图 9 不同浓度共存离子对河砂吸附As(Ⅲ)(a)和As(Ⅴ)(b)的影响 Fig. 9 The effect of different concentrations of coexisting ions on river sand adsorption for As(Ⅲ)(a) and As(Ⅴ)(b) |
准二级模型能更好地拟合河砂对As(Ⅲ)和As(Ⅴ)的吸附过程, 表明河砂对砷的吸附反应主要受外层吸附控制; Langmuir和Freundlich模型均能很好地拟合河砂吸附As(Ⅲ)和As(Ⅴ)的等温吸附曲线(R2>0.99), 单层最大吸附量Qmax分别为348.19 μg·g-1和442.76 μg·g-1, 对砷具有一定的吸附能力.随着pH增大, 河砂对砷的吸附量逐渐减小.随着实验条件从有氧→缺氧→还原, 进而还原程度不断加强, 河砂对As(Ⅲ)和As(Ⅴ)的吸附量逐渐减小, 还原条件不利于河砂对砷的吸附.整体上, 共存阴离子对河砂吸附砷存在抑制作用, 顺序为:PO43- > SiO32- > S2- > HCO3- > SO42- > NO3-, 共存阳离子对河砂吸附砷具有促进作用, 顺序为:Fe3+>Fe2+.通过本实验识别出溶液pH、氧化还原环境、PO43-、SiO32-、HCO3-、Fe3+和Fe2+是影响河砂吸附砷的主要水化学因素.pH通过改变河砂表面和砷之间的静电引(斥)力以及OH-与砷的竞争吸附影响着砷的吸附解吸; 氧化还原环境通过改变砷的形态影响砷的迁移; PO43-、SiO32-和HCO3-通过与砷竞争吸附, 以及添加共存离子后改变了溶液的pH值, 对砷的吸附产生抑制作用; Fe3+和Fe2+通过形成铁的(氢)氧化物或胶体, 有利于砷的吸附.
国内外对潜流带中砷行为特征的认识仍不系统和深入, 还有待进一步深入研究和探讨.如模拟地下水-地表水反复交替的动水状态下河砂对砷的迁移转化研究成果较少, 应进一步用模型深入刻画.本实验中, 河砂对As(Ⅲ)和As(Ⅴ)实际吸附容量分别为23和17 μg·g-1左右, 且达到吸附平衡时间较长.我们开展了动态试验, 发现在2.5 mL·min-1的流速下, 大约2 h左右砂柱基本穿透.尽管在动水状态下河砂对砷的吸附有限, 但是, 天然条件下砂质含水层仍能够一定程度上抑制高砷地下水向地表水中排泄砷.此外, 微生物活动影响潜流带中砷的迁移转化过程仍不明确, 有待进一步解释.
致谢: 感谢3位匿名评审专家和编辑对论文修改完善提出的重要建议!此外, 本文英文摘要的翻译得到美国德克萨斯农工大学詹红兵教授的指导和帮助, 在此表示衷心的感谢!
Appelo C A J, Postma D. 2005. Geochemistry, Groundwater and Pollution, 2rd edition[M]. 2rd edition. Leiden: A A Balkema, 634.
|
安礼航, 刘敏超, 张建强, 等. 2020. 土壤中砷的来源及迁移释放影响因素研究进展[J]. 土壤, 52(2): 234-246. |
Christl I, Brechbuhl Y, Graf M, et al. 2012. Polymerization of silicate on hematite surfaces and its influence on arsenic sorption[J]. Environmental Science & Technology, 46(24): 13235-13243. |
常方方, 曲久辉, 刘锐平, 等. 2006. 铁锰复合氧化物的制备及其吸附除砷性能[J]. 环境科学学报, 26(11): 1769-1774. DOI:10.3321/j.issn:0253-2468.2006.11.003 |
陈维芳, 程明涛, 张道方. 2012. CTAC改性活性炭去除水中砷(Ⅴ)的柱实验吸附和再生研究[J]. 环境科学学报, 32(1): 150-156. |
Duan Y, Gan Y, Wang Y, et al. 2015. Temporal variation of groundwater level and arsenic concentration at Jianghan Plain, central China[J]. Journal of Geochemical Exploration, 149: 106-119. DOI:10.1016/j.gexplo.2014.12.001 |
邓天天, 李义连, 田蓉. 2012. 山阴地区浅层沉积物中砷的分布特征及吸附行为[J]. 环境工程学报, 6(11): 4006-4014. |
丁文成, 闫凤冬, 赵洪伟, 等. 2013. 饮用水除砷材料吸附特性及影响因素分析[J]. 环境工程学报, 7(3): 873-878. |
段艳华, 甘义群, 郭欣欣, 等. 2014. 江汉平原高砷地下水监测场水化学特征及砷富集影响因素分析[J]. 地质科技情报, 33(2): 140-147. |
Fendorf S, Michael H A, Van Geen A, et al. 2010. Spatial and temporal variations of groundwater arsenic in South and Southeast Asia[J]. Science, 328(5982): 1123-1127. DOI:10.1126/science.1172974 |
郭华明, 王焰新, 李永敏. 2003. 山阴水砷中毒区地下水砷的富集因素分析[J]. 环境科学, (4): 60-67. |
郭华明, 杨素珍, 沈照理. 2007. 富砷地下水研究进展[J]. 地球科学进展, (11): 1109-1117. DOI:10.3321/j.issn:1001-8166.2007.11.002 |
Hu S, Yan W, Duan J, et al. 2015. Polymerization of silicate on TiO2 and its influence on arsenate adsorption: An ATR-FTIR study[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 469(1): 180-186. |
何明靖, 杨志豪, 魏世强. 2019. 5种典型有机磷酸酯在水-土壤界面吸附特征及影响因素[J]. 环境科学, 40(10): 4604-4610. |
何薪. 2010. 河套平原农业灌溉影响下地下水中砷迁移富集规律研究[D]. 北京: 中国地质大学
|
Kan C C, Wan M W, Yang H L, et al. 2013. Effect of quartz sand coated with water-treatment residuals as arsenic adsorbent[J]. Advanced Materials Research, 663(February 2013): 1064-1069. |
Moed D H, Van Halem D, Verberk J Q, et al. 2012. Influence of groundwater composition on subsurface iron and arsenic removal[J]. Water Science and Technology, 66(1): 173-178. DOI:10.2166/wst.2012.151 |
Nikic J, Agbaba J, Watson M, et al. 2019. Arsenic adsorption on Fe-Mn modified granular activated carbon (GAC-FeMn): batch and fixed-bed column studies[J]. Journal of Environmental Science and Health Part A-toxic/hazardous Substances & Environmental Engineering, 54(3): 168-178. |
Nordstrom D K. 2002. Worldwide occurrences of arsenic in ground water[J]. Science, 296(5576): 2143-2145. DOI:10.1126/science.1072375 |
倪萍. 2016. 河套盆地含水层沉积物赋存态砷及对地下水砷富集的影响[D]. 北京: 中国地质大学
|
Pierce M L, Moore C B. 1982. A desorption of arsenite and arsenate on morphous iron hydroxide[J]. Water Research, 16: 1247-1253. DOI:10.1016/0043-1354(82)90143-9 |
Pignatello J J, Xing B. 1996. Mechanisms of slow sorption of organic chemicals to natural particles[J]. Environmental Science & Technology, 30(1): 1-11. |
Smedley P, Kinniburgh D. 2002. A review of the source, behaviour and distribution of arsenic in natural waters[J]. Applied Geochemistry, 17(5): 517-568. |
苏春利, Win hlaing, 王焰新, 等. 2009. 大同盆地砷中毒病区沉积物中砷的吸附行为和影响因素分析[J]. 地质科技情报, 28(3): 120-126. |
苏小四, 师亚坤, 董维红, 等. 2019. 潜流带生物地球化学特征研究进展[J]. 地球科学与环境学报, 41(3): 337-351. DOI:10.3969/j.issn.1672-6561.2019.03.008 |
王建燕, 张传巧, 陈静, 等. 2019. 新型铁铜锰复合氧化物颗粒吸附剂As(Ⅲ)吸附行为与机制研究[J]. 环境科学学报, 39(8): 2575-2585. |
王焰新, 苏春利, 谢先军, 等. 2010. 大同盆地地下水砷异常及其成因研究[J]. 中国地质, 37(3): 771-780. DOI:10.3969/j.issn.1000-3657.2010.03.033 |
王喆, 赵志西. 2020. 砷迁移释放过程中吸附-脱附作用机制的研究进展[J]. 化学通报, 83(1): 23-29. |
吴鹏. 2017. 焙烧态Mg-Fe-La类水滑石的制备及其吸附氟、砷的研究[D]. 武汉: 武汉理工大学
|
伍新花. 2012. 水滑石的制备及其吸附去除砷氟性能研究[D]. 长沙: 湖南农业大学
|
许嘉琳, 杨居荣, 荆红卫. 1996. 砷污染土壤的作物效应及其影响因素[J]. 土壤, (2): 85-89. |
杨雪. 2016. 铝锆复合金属氧化物对水中砷、磷的吸附效能及机理探究[D]. 杨凌: 西北农林科技大学
|
曾辉平, 吕赛赛, 杨航, 等. 2018. 铁锰泥除砷颗粒吸附剂对As(Ⅴ)的吸附去除[J]. 环境科学, 39(1): 170-178. |
张丽萍, 谢先军, 李俊霞, 等. 2014. 大同盆地地下水中砷的形态、分布及其富集过程研究[J]. 地质科技情报, 33(1): 178-184. |
张伟. 2019. 新型复合铁钛锰吸附剂的研制及其除砷效能与机制研究[D]. 哈尔滨: 哈尔滨工业大学
|
郑曌. 2011. 铝厂赤泥在废水处理中的应用探讨[D]. 厦门: 福州大学
|
周晓馨. 2018. 铁锰氧化物/介孔氧化硅复合材料对水中砷的吸附性能及机理研究[D]. 杭州: 浙江大学
|
 2021, Vol. 41
2021, Vol. 41


