在过去的半个世纪里, 关于城市河道富营养化的报道显著增加(Ho et al., 2019).生物修复由于在代谢过程中能够实现对污染物的降解, 且具备一定的生物可持续性, 是目前最流行的修复水生环境的方法之一(Patel et al., 2020).传统的生物脱氮工艺包括好氧硝化和缺氧反硝化过程, 但实际河水中很难同时满足好氧和缺氧的条件.1983年, Robertson等(1983)首次从脱硫脱硝废水中分离出异养硝化-好氧反硝化(HN-AD)菌株, 该菌株在好氧条件下既能进行硝化作用又能进行反硝化作用, 引发了广泛关注.
近年来, 研究人员从不同环境中分离出了近20个属约100种具有HN-AD代谢特征的菌株(Yuan et al., 2019).目前, 大部分研究仍集中于新菌株的筛选及考察所得菌株在培养基中的脱氮能力等方面.一些研究探讨了从废水中分离出来的HN-AD菌株对污染物的去除性能.从活性污泥中分离得到的菌株Acinetobacter sp. ND7对培养基中的NH4+-N、NO3--N和NO2--N的最大去除率分别为99.8%、97.2%和96.2%, 最佳C/N比条件为8(Xia et al., 2020).从深海沉积物中分离得到的菌株Pseudomonas bauzanensis DN13-1在C/N为8的培养基中可去除100%的NH4+-N、65.9%的NO3--N和98.8%的NO2--N(Zhang et al., 2019).在间歇式反应器中接种Vibrio diabolicus SF16后, NH4+-N及TN的去除率分别由31.6%和26.7%提高到97.1%和73.9%(Duan et al., 2015).一些菌株在实际废水的处理中也展现出了良好的HN-AD能力.Bacillus cereus GS-5对生活污水中NH4+-N、NO3--N和NO2--N的去除率分别能达到96.0%、95.0%和81.0%(Rout et al., 2017).从海水养殖废水中分离得到的Arthrobacter sp. HHEP5在TOC/TN为20的条件下, 对海水养殖废水和生活污水的TN去除率最高可分别达到95.4%和95.3%(Zhang et al., 2020).将Pseudomonas Stutzeri SDU10接种于养猪废水中, 在CODCr/NH4+-N为5.57的条件下对NH4+-N的去除率为63.2%, 对CODCr的去除率为79.5%(Chen et al., 2020).
尽管HN-AD菌在废水处理中的应用已进行了广泛的研究, 但在城市河道河水净化中的研究较少.有研究从天然湖水中分离出Penicillium tropicum IS0293菌株, 将其接种至生物反应器中对实际湖水进行了脱氮处理, NO3--N去除率为94.0%, 但需要在反应器中投加纤维素类基质为反硝化提供额外碳源(Liu et al., 2020).由于反硝化过程需要有机碳源提供电子供体, 低C/N会直接影响反硝化的程度, 因此天然水体中的低C/N一直是地表水脱氮净化的难题(魏旖旎等, 2016).在天然河水中溶解氧充足的情况下, 反硝化效率显得尤为重要, 它是影响河水脱氮净化的关键限制步骤, 而目前关于HN-AD菌株在不同C/N条件下对实际河水脱氮净化效果的研究还十分有限.根据课题组于2018年10月至2020年8月对天津市某二级河道水质的长期监测可知, 河水CODCr/TN大多数集中分布于5左右.而夏季强降雨会引发雨水径流污染, 河水中的有机质浓度提高, 进而使河水中的CODCr/TN在短期内达到20左右, 同时水质也迅速变差.因此有必要研究在不同C/N条件下HN-AD菌对河水的脱氮净化效果.
本研究从天津市海河支流月牙河中富集脱氮菌群, 并在低C/N条件下分离出8株HN-AD菌株, 考察了各个菌株的脱氮性能.根据菌株种别及脱氮特性, 制备了5种复配菌剂, 研究和比较了菌剂的脱氮效果, 并将脱氮能力最强的复配菌剂接种至实际河水中, 验证复配菌剂对河流水质的净化效果.
2 材料与方法(Materials and methods) 2.1 菌种来源与培养基将取自天津市海河支流月牙河水中的原始河水装于灭菌取样瓶中, 放置于便携式低温(4 ℃)冷藏箱内, 并于24 h内运回实验室.实验所用到的培养基(信欣等, 2014)具体组成如表 1所示.
| 表 1 实验所用培养基 Table 1 The constituents in the Experimental medium |
将新鲜的河水用0.45 μm的滤膜过滤后, 将滤膜直接放入分别装有100 mL富集培养基EM1和EM2的250 mL锥形瓶中, 每3 d转接至新鲜的富集培养基中, 转接4次.将富集所得的菌液梯度稀释, 取稀释至10-4、10-5、10-6、10-7倍的菌液分别涂布至BTBM1和BTBM2固体培养基上, 置于生化培养箱中30 ℃下恒温培养.待菌落长出后, 取生长量约为30~300个菌落的平板, 从中挑选出自身或周围变蓝的菌落并进行编号, 将挑出的菌落进行平板划线, 重复划线2~3次.取划线平板上的单一菌落分别接种至装有100 mL HNM1和HNM2培养基的锥形瓶中, 在瓶口处覆盖封口膜以防止空气中微生物污染并保证培养基的好氧条件, 在30 ℃下恒温培养.从菌液变浑浊的培养基中取10 mL菌液分别接种至100 mL NM11和NM12培养基中, 包上封口膜, 于30 ℃下恒温培养, 待菌液变浑浊后, 取10 mL菌液分别接种至100 mL NM21和NM22培养基中, 继续恒温培养.以上步骤均在超净台中进行操作, 所用培养基及实验材料均在121 ℃条件下进行30 min高温高压灭菌.
2.3 菌株的鉴定取培养至对数生长期的菌液10 mL, 用DNA提取试剂盒(TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0)进行DNA提取.将提取的DNA样品用微量紫外分光光度计(Q9000, Quawell, USA)进行浓度和纯度的测定.将DNA样品用通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)及1492R(5′-TTGGYTACCTTGTTACGACT-3′)进行PCR扩增, 并对扩增产物进行一代测序(生工生物工程(上海)股份有限公司).
将所得菌株序列于NCBI数据库GenBank中进行BLAST同源性比对, 取相似度最高的菌株序列与分离所得菌株序列通过MEGA-X计算系统进化距离, 建立系统发育树, 从而完成对所得菌株的鉴定.将分离所得的8个不同系统进化的菌株16S rRNA基因序列提交至NCBI序列读取存档, 序列号分别为: MT995127、MT995149、MT995048-MT995053.
2.4 菌株的脱氮性能检测将在C/N为10条件下分筛所得菌株分别投加至灭菌后的HNM1、NM11、NM21培养基中, 将在C/N为3的条件下分筛所得菌株分别投加至灭菌后的HNM2、NM21、NM22培养基中, 对所得菌株的NH4+-N、NO3--N和NO2--N的去除效率进行检测, 考察各单菌株的脱氮性能.
2.5 复配菌剂脱氮性能试验用原水水质及试验方法复配菌剂脱氮性能的试验研究采用天津市海河支流月牙河河水.根据2019年3-9月河水水质的监测结果, 将取得的实际河水通过添加NH4Cl、NaNO3、NaNO2或Na3C6H5O7·2H2O以模拟两种典型的实际河水水质, 其中CODCr/TN为5的试验用原水MW-B代表了大部分河水样品的水质特点, CODCr/TN为20的试验用原水MW-A代表了雨季受污染情况下的特殊水质.共进行两批次实际河水净化试验, 第一批试验用于比较不同复配菌剂的脱氮效率, 第二批试验进一步考察了优选菌剂的污染物去除性能, 具体试验用原水水质如表 2所示.
| 表 2 复配菌剂脱氮性能试验用原水水质 Table 2 Characteristics of the raw water (MW) for the experiments on nitrogen removal performance of mixed cultures |
将复配菌剂以体积比为1%接种至装有200 mL原水的锥形瓶中, 在30 ℃、好氧(溶解氧6~8 mg·L-1)条件下进行脱氮性能考察试验, 以未接种复配菌剂的原水为对照组, 试验组和对照组均设置3组平行, 每天检测CODCr、NH4+-N、NO3--N、NO2--N浓度.
2.6 水质分析方法NH4+-N、NO3--N、NO2--N浓度在测定前, 用0.45 μm滤膜对样品进行过滤后取上清液进行检测.其中NH4+-N采用纳氏试剂比色法;NO3--N采用紫外分光光度法;NO2--N采用N-(1-萘基)-乙二胺分光光度法测定(国家环境保护总局, 2002).COD采用HACH法测定(HACH, 美国).所有样品的指标测定均取3个平行样.
3 结果与讨论(Results and discussion) 3.1 菌株的分离鉴定从富集菌液中共筛分得到8株HN-AD菌株, 其中在C/N为10的条件下共筛选得到2株HN-AD菌株, 分别为Pseudomonas sp. MR5及Klebsiella oxytoea MR7.在C/N为3的条件下共筛选得到6株HN-AD菌株, 分别为Pseudomonas stutzeri MR1、Pseudomonas sp. MR2、Pseudomonas sp. MR3、Pseudomonas balearica MR4、Klebsiella variicola MR6、Catellibacterium terrae MR8.8株菌株的BLAST同源性比对结果如表 3所示.
| 表 3 HN-AD菌株同源性比对结果 Table 3 Isolates of HN-AD bacteria and the species with highest similarity |
对所得8株菌株的NH4+-N、NO3--N和NO2--N的去除效率进行检测, 结果如图 1所示.由图 1可知, Pseudomonas sp. MR5及Klebsiella oxytoea MR7对NO3--N具备较强去除能力, 去除率分别为95.7%、94.5%, 但有NO2--N积累.两株菌株在C/N为10的条件下对NH4+-N的去除效率分别能够达到80.0%及52.6%.Pseudomonas stutzeri MR1、Pseudomonas sp. MR2、Pseudomonas sp. MR3、Pseudomonas balearica MR4、Klebsiella variicola MR6及Catellibacterium terrae MR8在C/N为3时对NH4+-N的去除效率为32.4%~44.1%;对NO3--N去除率为94.5%~99.9%, 期间无NO2--N积累, 具备较好的反硝化性能.在上述菌属中, Pseudomonas stutzeri、Pseudomonas sp.、Pseudomonas balearica、Klebsiella variicola、Catellibacterium terrae均被证实具有HN-AD功能.从污水处理厂二沉池中分离出来的Pseudomonas stutzeri XL-2, 在好氧条件下对NO3--N去除率可达97.9%(Zhao et al., 2018);自饮用水水库中分离得到的Pseudomonas stutzeri ZF31, 对NO3--N去除率可达97.0%, 期间无NO2--N积累(Huang et al., 2015);Pseudomonas balearica RAD-17对NO3--N及NO2--N的去除率大于95.0%(Ruan et al., 2020), 这与本研究的实验结果一致.文献报道, Klebsiella variicola sd-1对NH4+-N去除率为96.2%, 对NO3--N去除率为73.4%, 期间无NO2--N积累, 该菌株具备较强硝化性能, 但反硝化性能较差(Feng et al., 2018).本实验筛选所得菌株均具备HN-AD能力, 其中Pseudomonas sp. MR5具备较强硝化能力, Pseudomonas stutzeri MR1、Pseudomonas sp. MR2、Pseudomonas sp.MR3、Pseudomonas balearica MR4、Klebsiella variicola MR6及Catellibacterium terrae MR8具备较强反硝化性能.
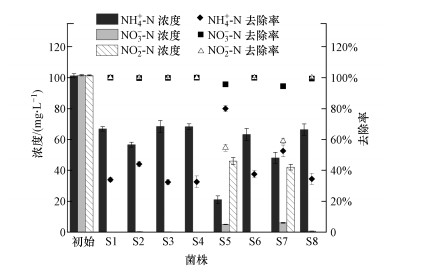 |
| 图 1 单菌株对NH4+-N, NO3--N及NO2--N的去除效率 Fig. 1 The removal efficiencies of NH4+-N, NO3--N NO2--N by isolated strains |
将分离得到的8株HN-AD菌株根据其自身的种属类别及脱氮性能进行菌剂复配, 复配方案如表 4所示.将5种菌剂以总体积比为1%的比例分别投加至MW-A和MW-B两种水质的河水中, 监测各菌剂对河水的脱氮效果, 结果如表 5所示.由表 5可以看出, 尽管Pseudomonas sp. MR5在C/N为10的条件下对NH4+-N去除效果能够达到80.0%, 但在投加较多Pseudomonas sp. MR5的菌剂-4和菌剂-5中, NH4+-N的去除效率相较于其它菌剂未有明显优势.5种菌剂对河水中NH4+-N的去除效率介于6.52%~25.5%.菌剂-1与菌剂-2的反硝化性能相较于其它菌剂更好, 其中菌剂-2为最佳, 对NO3--N, NO2--N的去除效率分别能够达到96.3%和94.3%.由此可见, 本研究复配菌剂对实际河水具有较强的反硝化能力, 但硝化作用优势不明显.而对于维持好氧条件较好的河流, 较高的好氧反硝化效率对于河水脱氮具有重要作用.有文献报道, 从水库样本中富集驯化得到的好氧反硝化菌对低营养水库水的NO3--N去除率为75.3%(Wang et al., 2019), 明显低于本研究中复配菌剂的NO3--N去除率.从湖泊底泥中富集得到的好氧反硝化菌群在C/N为5的条件下对反硝化培养基中NO3--N的去除率可达98.0%以上(Zhang et al., 2019), 与本研究去除效果相当.因此选取脱氮效果最佳的菌剂-2为优选复配菌剂, 进一步验证其对河水的脱氮效果.
| 表 4 复配菌剂的组成 Table 4 The compositions of Mixed cultures |
| 表 5 5种菌剂对河水中的NH4+-N、NO3--N及NO2--N去除率 Table 5 The removal efficiencies of NH4+-N, NO3--N, NO2--N by different mixed cultures |
将菌剂-2分别投加至两种CODCr/TN条件的河水中, 以同样体积的不接种任何菌剂的河水作为对照组, 监测复配菌剂-2对河水的脱氮效果, 结果如图 2所示.
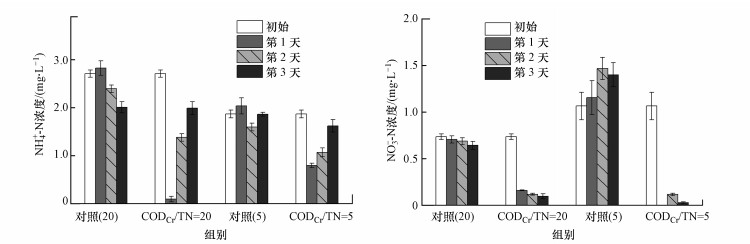 |
| 图 2 菌剂-2对不同CODCr/TN河水中NH4+-N (a)及NO3--N (b)的去除效果 (其中“对照”括号中的数字表示河水的CODCr/TN比) Fig. 2 The removal of NH4+-N(a) and NO3--N(b) in river water with different CODCr/TN ratios by Mixed Culture-2 |
通过对两种模拟河水中NH4+-N、NO3--N、NO2--N的为期3 d的连续监测, 可以看出接种菌剂-2后, CODCr/TN为20的河水中NO3--N浓度不断下降, 最终去除效率达到87.1%.CODCr/TN为5的河水在接种后第1 d NO3--N能够达到100%去除, 最终去除率为97.5%.两种河水中NO2--N的去除率在接种菌剂-2后分别能够达到99.0%和91.1%, 且3 d内均保持较低浓度.投加菌剂-2后, 两种河水中的NH4+-N浓度在第1 d均有明显降低, 去除率分别为96.6%和57.6%, 但第2 d NH4+-N浓度开始升高, 但始终明显低于对照组的NH4+-N浓度.回升的NH4+-N浓度可能是来源于河水中凋亡的细菌细胞在分解过程中的产物.由于实验室规模的反应器体积较小且批式试验中随着细菌快速生长, 代谢产物的浓度变化对系统中污染物本底浓度的影响较为突出.有文献报道, 将生活污水中分离出来的Pseudomonas sp. YX3投加至河水中后, 对天然河水的NH4+-N最高去除效果可达到57.1%(Wang et al., 2011);Penicillium tropicum IS0293自天然湖水中被分离出来后, 接种至生物反应器中对实际湖水进行脱氮处理, NO3--N去除率为94.0%(Liu et al., 2020), 这与本实验中菌剂-2的脱氮净化效果相近, 但由于复配菌剂由多种HN-AD菌株构成, 因此投加至天然河水中后生物稳定性会更高, 更具备天然河水脱氮净化的实际应用潜能.尽管本研究中优选出的复配菌剂-2对NH4+-N的去除效果并不突出, 但相较于对照组, 投加复配菌剂-2后河水体系中的NH4+-N浓度始终较低.对于溶解氧充足的天然水体来说, NH4+-N的去除还可以通过自养硝化来完成(刘攀龙, 2015), HN-AD菌的加入, 可以加速硝化过程, 强化NH4+-N的去除.
4 结论(Conclusions)1) 从天然河水中成功分筛出8株异养硝化-好氧反硝化菌株, 其中在C/N为10的条件下共筛选得到2株菌株, 分别为Pseudomonas sp. MR5及Klebsiella oxytoea MR7, 对氨氮去除效率分别为80.0%和52.5%;对NO3--N去除效率分别为95.7%和94.5%, 但有NO2--N的积累;对NO2--N的去除效率分别为54.6%和58.9%.在C/N为3的条件下共筛选得到6株菌株, 分别为Pseudomonas stutzeri MR1、Pseudomonas sp. MR2、Pseudomonas sp. MR3、Pseudomonas balearica MR4、Klebsiella variicola MR6及Catellibacterium terrae MR8, 对NO3--N和NO2--N的去除率均大于94.5%, 部分菌株能达到100%;对NH4+-N去除率为32.4%~44.1%.
2) 将菌株依照脱氮性能和种属类别复配成不同菌剂, 投加至CODCr/TN分别为20和5的河水中, 优选出脱氮性能最佳的复配菌剂, 包括6株菌株, 分别为Pseudomonas stutzeri MR1, Pseudomonas sp. MR2, Pseudomonas sp. MR3, Pseudomonas balearica MR4, Klebsiella variicola MR6和Catellibacterium terrae MR8.该复配菌剂在河水CODCr/TN为20和5的条件下, 对NO3--N的去除率分别为87.1%和97.5%, 期间无NO2--N积累;对NH4+-N去除效果在第一天分别达到96.6%和57.6%.复配菌剂对河水的反硝化脱氮作用较强, 并可以强化河水中NH4+-N的去除, 对河水脱氮净化具有较强的实际应用潜能.
Chen L, Lin J, Pan D, et al. 2020. Ammonium removal by a newly isolated heterotrophic nitrification-aerobic denitrification bacteria Pseudomonas stutzeri SDU10 and its potential in treatment of piggery wastewater[J]. Current Microbiology, 77(10): 2792-2801. |
Duan J, Fang H, Su B, et al. 2015. Characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater[J]. Bioresource Technology, 179: 421-428. DOI:10.1016/j.biortech.2014.12.057 |
Feng Y, Feng J, Shu Q L. 2018. Isolation and characterization of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae and Klebsiella variicola strains from various environments[J]. Journal Applied Microbiology, 124(5): 1195-1211. |
Ho J C, Michalak A M, Pahlevan N. 2019. Widespread global increase in intense lake phytoplankton blooms since the 1980s[J]. Nature, 574(7780): 667-670. |
Huang T, Guo L, Zhang H, et al. 2015. Nitrogen-removal efficiency of a novel aerobic denitrifying bacterium, Pseudomonas stutzeri strain ZF31, isolated from a drinking-water reservoir[J]. Bioresource Technology, 196: 209-216. DOI:10.1016/j.biortech.2015.07.059 |
刘攀龙. 2015. 河流脱氮微生物的筛选及脱氮特性研究[D]. 郑州市: 郑州大学
|
Liu X, Huang M, Bao S, et al. 2020. Nitrate removal from low carbon-to-nitrogen ratio wastewater by combining iron-based chemical reduction and autotrophic denitrification[J]. Bioresource Technology, 301: 122731. |
Patel N, Khan M Z A, Shahane S, et al. 2020. Emerging pollutants in aquatic environment: Source, effect, and challenges in biomonitoring and bioremediation-A review[J]. Pollution, 6(1): 99-113. |
Robertson L A, Kuenen J G. 1983. Thiosphaera pantotropha gen. nov. sp. nov., a facultatively anaerobic, facultatively autotrophic sulphur bacterium[J]. Journal of General Microbiology, 129: 2847-2855. |
Rout P R, Bhunia P, Dash R R. 2017. Simultaneous removal of nitrogen and phosphorous from domestic wastewater using Bacillus cereus GS-5 strain exhibiting heterotrophic nitrification, aerobic denitrification and denitrifying phosphorous removal[J]. Bioresource Technology, 244: 484-495. |
Ruan Y, Taherzadeh M J, Kong D, et al. 2020. Nitrogen removal performance and metabolic pathways analysis of a novel aerobic denitrifying halotolerant Pseudomonas balearica strain RAD-17[J]. Microorganisms, 8(1): 72. |
Wang H, Wang T, Yang S, et al. 2019. Nitrogen removal in oligotrophic reservoir water by a mixed aerobic denitrifying consortium: Influencing factors and immobilization effects[J]. International Journal of Environmental Research and Public Health, 16(4): 583. |
Wang J, Pei Y S, Yang Z F, et al. 2011. Characteristics and applications of a heterotrophic nitrification-aerobic denitrification bacterium isolated from an urban river[J]. Fresenius environmental bulletin, 20(1): 114-120. |
魏旖旎, 何志仙, 袁林江. 2016. 进水碳氮比对脱氮污泥羟胺氧化酶活性及N2O产生的影响[J]. 中国环境科学, 36(5): 1417-1425. |
Xia L, Li X, Fan W, et al. 2020. Heterotrophic nitrification and aerobic denitrification by a novel Acinetobacter sp. ND7 isolated from municipal activated sludge[J]. Bioresource Technology, 301: 122749. |
信欣, 姚力, 鲁磊, 等. 2014. 耐高氨氮异养硝化-好氧反硝化菌TN-14的鉴定及其脱氮性能[J]. 环境科学, 35(10): 3926-3932. |
Yuan J, Zhao T, Peng X. 2019. Advances in heterotrophic nitrification-aerobic denitrifying bacteria for nitrogen removal under extreme conditions[J]. Chinese Journal of Biotechnology, 35(6): 942-955. |
Zhao B, Cheng D Y, Tan P, et al. 2018. Characterization of an aerobic denitrifier Pseudomonas stutzeri strain XL-2 to achieve efficient nitrate removal[J]. Bioresource Technology, 250: 564-573. |
Zhang H, Zhao Z, Li S, et al. 2019. Nitrogen removal by mix-cultured aerobic denitrifying bacteria isolated by ultrasound: Performance, co-occurrence pattern and wastewater treatment[J]. Chemical Engineering Journal, 372: 26-36. |
Zhang M, Li A, Yao Q, et al. 2019. Nitrogen removal characteristics of a versatile heterotrophic nitrifying-aerobic denitrifying bacterium, Pseudomonas bauzanensis DN13-1, isolated from deep-sea sediment[J]. Bioresource Technology, 305: 122626. |
Zhang M, Pan L, Liu L, et al. 2020. Phosphorus and nitrogen removal by a novel phosphate-accumulating organism, Arthrobacter sp. HHEP5 capable of heterotrophic nitrification-aerobic denitrification: Safety assessment, removal characterization, mechanism exploration and wastewater treatment[J]. Bioresource Technology, 312: 123633. |
 2021, Vol. 41
2021, Vol. 41


