2. 南京信息工程大学环境科学与工程学院, 南京信息工程大学大气环境与装备技术协同创新中心, 南京信息工程大学江苏省大气环境监测与污染控制高技术研究重点实验室, 南京 210044;
3. 南京江岛环境科技研究院有限公司, 南京 210019
2. Collaborative Innovation Center of Atmospheric Environment and Equipment Technology, Jiangsu Key Laboratory of Atmospheric Environment Monitoring and Pollution Control(AEMPC), Nanjing University of Information Science&Technology, Nanjing 210044;
3. Nanjing Jiangdao Institute of Environmental Research Co., Ltd., Nanjing 210019
二苯甲酮(Benzophenones, BPs)类紫外线吸收剂是目前应用较为广泛的一类光稳定剂, 常用于个人护肤品、食品包装、塑料、油漆、纺织品、汽车维修产品等(DíazCruz et al., 2015).随着人类对皮肤健康的追求, 防晒霜以及化妆品中二苯甲酮类紫外线吸收剂用量与日俱增(Kunz et al., 2006), 大量紫外线吸收剂通过直接输入或间接由废水排放系统而释放到环境中, 并产生累积, 进而流入到海洋环境甚至极地环境中(Cadena-Aizaga et al., 2019).更严重的是, 一些BPs已在人类的尿液(Li et al., 2019)、血液(Zhang et al., 2013)及母乳(Kim et al., 2014)中被频繁检出, BPs及其代谢产物作为一种新兴的污染物, 已成为水环境领域研究的一个热点.
2, 4-二羟基二苯甲酮(BP-1)是一种典型的二苯甲酮类紫外线吸收剂, 其光稳定效果并不突出, 但该物质是其他紫外线吸收剂(2, 2′, 4, 4′-四羟基二苯甲酮, BP-2;2-羟基-4-甲氧基二苯甲酮, BP-3)的主要转化产物(Janjua et al., 2004; Liu et al., 2012), 在沉积物、地表水及废水中都有较高的检出频率(Tsui et al., 2014).研究表明, BP-1是一种具有雌激素效应的内分泌干扰物, 会抑制藻类、无脊椎动物以及鱼类的生长发育(Mao et al., 2018), 并可引起乳腺癌和卵巢癌等雌激素相关性癌症(Park et al., 2013; Shin et al., 2016), 严重危害生态环境和人类健康.关于BP-1降解的研究目前多集中于基于光催化的高级氧化技术. Zúiga-Benítez等(2018)利用自然光联合芬顿处理技术, 在最优条件下, 60 min BP-1的降解率为99.2%.Ge等(2019)利用光照及硝酸盐介导作用, 光照180 min左右BP-1的降解率约为98%, 12 h光照后BP-1矿化度达到31.6%.高级氧化技术利用的是自由基基团(·OH)的氧化能力与BP-1发生氧化、重排、链式反应, 所形成的产物种类繁多、结构多样, 且代谢产物的毒性往往比母体化合物BP-1更强(Carena et al., 2016), 需要进一步监测和处理.
微生物降解可以将有机物污染物彻底分解成CO2和H2O, 是高效低耗实现污染物最终矿化的主要途径(鲁亢等, 2016).张弘等(2014)采用欧洲经济合作与发展组织的生物降解测试标准方法研究发现, BP-3与BP-4(2-羟基-4-甲氧基二苯甲酮-5-磺酸)的可生物降解率分别为68.36%和42.34%.目前, 对于BP-1的微生物去除及降解机理的报道非常少.本文通过高通量测序技术对BP-1好氧/厌氧生物降解富集体系的降解效果和微生物群落结构进行深度解析, 基于上述结果筛选获得BP-1的高效降解功能菌, 并对其进行分子生物学鉴定和功能验证, 为新兴污染物BPs种质资源库的构建和高效去除提供理论依据.
2 材料与方法(Materials and methods) 2.1 材料 2.1.1 污泥样品南京市某市政污水处理厂二沉池活性污泥.
2.1.2 培养基分离培养基:2, 4-二羟基二苯甲酮20 mg·L-1、氢氧化钠1.6 g·L-1、磷酸二氢钾6.8 g·L-1, 琼脂20 g·L-1, pH为7.3~7.5;LB培养基:酵母粉5.0 g·L-1、氯化钠10 g·L-1、蛋白胨10 g·L-1, pH为7.0~7.5.
2.1.3 模拟废水磷酸盐缓冲液(pH=8.0)配制10 mg·L-1的2, 4-二羟基二苯甲酮溶液.
2.1.4 微生物样品明亮发光杆菌T3(Photobacteriumn phosphoreum T3)购买自中国科学院南京土壤所;酿酒酵母(Saccharomyces cerevisiae BLYES)购买自美国田纳西大学;其他试剂均为分析纯试剂.
2.2 方法 2.2.1 BP-1的测定方法采集上清液后, 用0.45 μm的滤膜过滤, 采用HPLC色谱法(Salvador et al., 2005)检测2, 4-二羟基二苯甲酮(BP-1)含量.检测条件为:色谱柱:C18柱;柱温:30 ℃;流动相按甲醇与0.3%甲酸溶液70∶30的比例;流速:1 mL·min-1.
2.2.2 BP-1好氧/厌氧生物降解功能菌群富集及降解速率测定好氧驯化富集:取二沉池活性污泥250 mL于锥形瓶中, 将其置于摇床28 ℃避光振荡, 每天更换上清液并加入新的20 mg·L-1 2, 4-二羟基二苯甲酮溶液, 驯化20 d, 直至上清液中无目标污染物检出;厌氧驯化富集:取二沉池活性污泥250 mL于厌氧瓶中, 将其置于摇床28 ℃避光振荡, 每天更换上清液并加入新的20 mg·L-1 2, 4-二羟基二苯甲酮溶液, 每次开盖后通入氮气吹脱5 min, 以保持厌氧环境, 进行厌氧富集培养, 驯化30 d, 直至上清液中无目标污染物检出;降解速率测定:分别取驯化后的好氧污泥和厌氧污泥, 以3%的接种量分别接种于BP-1模拟废水中, 好氧处理组在锥形瓶中28 ℃避光好氧振荡培养, 厌氧处理组在厌氧瓶中28 ℃避光厌氧振荡培养, 定期分别采集好氧、厌氧处理组的上清液, 检测其中BP-1浓度, 绘制其在不同富集体系中的降解动力学曲线.
2.2.3 16S rRNA高通量测序、微生物群落结构和多样性分析分别采集驯化后的好氧污泥和厌氧污泥, 运用DNA提取试剂盒(FastDNA® Spin Kit, MP Biomedicals, 美国)提取活性污泥的总DNA, 每个样品提取3个平行.将上述获得的DNA样品送至生工生物工程(上海)股份有限公司进行16S rRNA (V3~V4区)高通量测序.测序平台为MiSeq(Illumina, 美国), 测序策略为2×250 bp两端测序.原始数据使用Mothur软件平台进行数据质量过滤、降噪、去嵌合体, 以及去除非细菌序列等质控操作(Schloss et al., 2009).此外, 为了排除测序深度对实验结果的影响, 本文以序列最少的样品为基准随机从每个样品中抽取31027条序列用于后续分析(Caporaso et al., 2010).接下来将统一测序深度标准化后的序列提交QIIME平台进行基于可操作分类单元(OTUs)的一系列分析.选取0.97的相似度阈值进行OTUs划分, 并在此基础上进行alpha多样性计算.最后利用RDP Classifier算法, 通过比对Greengenes数据库进行物种分类信息注释(Desantis et al., 2006).
2.2.4 BP-1降解功能菌株的筛选、分离纯化及鉴定将驯化富集后的好氧污泥用无菌水进行梯度稀释后, 在分离培养基平板上涂布, 28 ℃条件下静态培养3~5 d, 挑取颜色、形态、大小不同的单菌落.将挑取的单菌落于LB固体培养基上划线纯化, 得到纯菌株, 观察菌株形态, 利用革兰氏染色法进行初步鉴定(赵斌等, 2002), 并于斜面上划线保存.提取纯化后细菌的基因组DNA, 采用细菌通用引物27F和1492R扩增菌株的16S rDNA, 并将其送至生工生物工程(上海)股份有限公司进行Sanger测序, 将测序结果与NCBI中核酸数据库进行BLAST比对, 并运用MEGA软件中Neighbor-Joining方法构建系统发育树(杨庆等, 2017).
2.2.5 菌株复筛及降解速率的测定将纯化得到的单菌株置于液体LB培养基中, 28 ℃、150 r·min-1避光振荡培养.取吸光度(OD600)为1.0时细菌, 按3%接种量, 接种至模拟废水中反应24 h, 取样并检测溶液中BP-1浓度, 获得降解效果最佳的菌株.将最佳降解菌株接种至模拟废水中, 条件同上, 定时取样, 测定最佳菌株对BP-1的降解速率.
2.2.6 发光细菌急性毒性测定发光细菌急性毒性测试方法是基于国家标准(GB/T 15441-1995)方法进行了相关优化(Liu et al., 2015):取超低温保存下的明亮发光杆菌T3(Photobacteriumn phosphoreum T3)冻干管传代培养液, 按国标方法进行复苏, 取复苏菌液用3%NaCl溶液稀释至不同浓度梯度, 检测发光量, 取发光量1000~10000 Lum之间的菌液作为实验用菌液.实验设置对照组(不加菌)和处理组(投加菌BP1.1), 分别采集处理过程中不同时间段(0、2、4、6 h)的反应液3 mL, 0.45 μm滤膜过滤得到滤液.分别吸取HgCl2标准曲线溶液及样品滤液180 μL加入96孔板中, 加入20 μL发光菌稀释液, 避光21 ℃反应15 min后, 在酶标仪上检测发光量, 每个样品3个平行.绘制HgCl2浓度与相对发光度(%)的标准曲线, 根据样品相对发光度计算样品当量HgCl2浓度.
2.2.7 类雌激素效应浓度测定重组酵母Saccharomyces cerevisiae BLYES培养方法按文献(Sanseverino et al., 2005)方法进行.首先以17 β-雌二醇(E2)为标准品配制雌激素效应测定的标准曲线, 将E2依次以一定体积进行稀释, 使其浓度为:1×10-11~1×10-6 mol·L-1, 设12个浓度梯度.实验设置对照组(不加菌)和处理组(投加菌BP1.1), 分别采集处理过程中不同时间段(0、2、4、6 h)的反应液3 mL, 0.45 μm滤膜过滤得到滤液.取20 μL待测样品于白色96孔板中, 样品吹干后加入200 μL培养好的BLYES培养液(OD600=0.6~0.8), 在26 ℃, 200 r·min-1条件下培养6~8 h, 酶标仪检测发光量, 每个样品3个平行.绘制雌二醇浓度与相对发光度(%)的标准曲线, 根据样品相对发光度计算样品当量雌二醇(E2)浓度.
3 结果与讨论(Results and discussion) 3.1 好氧/厌氧驯化富集体系对BP-1降解效率好氧和厌氧是微生物降解有机物的两种重要代谢途径, 不同代谢途径条件下微生物的群落结构、反应酶及代谢产物皆有所不同(林颖等, 2006).为了探究不同需氧微生物对BP-1的降解效果, 分别设置了好氧富集和厌氧富集两个处理组.如图 1所示, 好氧系统降解BP-1初始阶段有停滞期(约1 d), 在此期间目标污染物几乎无降解, 接着进入快速降解阶段直至底物消耗殆尽;厌氧系统在初期缓慢降解, 无停滞期, 降解速率比好氧初期快, 接着进入快速降解阶段, 当底物浓度消耗约50%后, 降解速率减缓.张弘等(2014)研究BP-3与BP-4的好氧生物可降解性时, 也发现存在相同的停滞期.产生这种现象的原因可能是由芳香族化合物的生物降解途径的差异造成的.好氧条件下, 多环芳烃主要由单或双加氧酶直接渗入到反应底物中裂解苯环, 分子氧直接参与加氧酶的反应;厌氧条件下, 多环芳烃经过各种脱羟基、脱甲氧基等修饰化作用, 被转化为两种重要的中间体苯甲酸和4-羟基苯甲酸, 然后再进行苯环裂解还原(陈铮等, 2019).此外, 好氧系统与厌氧系统都能降解废水中的BP-1, 从驯化时间来看, 好氧条件下所需要的驯化时间更短.同样地, Liu等(2012)利用活性污泥和消化污泥分别研究了在含氧和无氧条件下对BP-3的降解, 结果表明在好氧与厌氧条件下, BP-3都能被微生物降解, 且好氧条件下可培养细菌数量远高于厌氧条件下可培养细菌数量.需要指出的是, 好氧系统和厌氧系统的平均降解速率分别为2.49 mg·L-1·d-1和0.91 mg·L-1·d-1, 好氧系统的降解速率为厌氧系统降解速率的2.74倍.因此, 好氧处理系统是BP-1生物降解的主要途径.
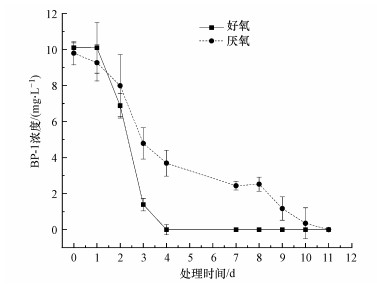 |
| 图 1 好氧/厌氧富集体系对BP-1的降解速率 Fig. 1 Degradation rate of BP-1 by aerobic/anaerobic enrichment systems |
为进一步解析不同氧环境下BP-1生物降解性能差异潜在的微生物机制, 通过高通量测序对驯化完成后的好氧污泥和厌氧污泥进行微生物群落结构和多样性分析.本文选用OTUs和Chao指数来表征样品中微生物的丰富度, 通过Shannon指数来评价样品中微生物多样性.从表 1可以看出, 好氧富集体系的OTU数目、Chao指数、Shannon指数分别为7823、50001和8.80;而厌氧富集体系的OTU数目、Chao指数、Shannon指数分别为6210、35125和7.01.表明好氧驯化后, 微生物种类更多, 且生物多样性显著高于厌氧富集体系(p < 0.01).
| 表 1 好氧与厌氧富集体系中的OTUs及多样性指数 Table 1 The OTUs and alpha diversity index in aerobic and anaerobic enrichment systems |
如图 2a所示, 将各样品中相对丰度最大值超过1%的门进行分析, 发现好氧驯化富集后的优势菌群为变形菌门(Proteobacteria, 40.66%)、拟杆菌门(Bacteroidetes, 11.22%)和绿弯菌门(Chloroflexi, 6.34%);而厌氧驯化富集后的优势菌群为厚壁菌门(Firmicutes, 59.58%)、变形菌门(Proteobacteria, 11.91%)和浮霉菌门(Planctomycetes, 5.30%).通过前期的研究(Zhang et al., 2012)发现, 该生活污水处理厂活性污泥中微生物群落分布比例为变形菌门占比为45%、厚壁菌门占比为11%、放线菌门占比为5.5%、酸杆菌门占比为5%、拟杆菌门占比为4%、绿弯菌门占比为2%、浮霉菌门占比为1.8%.好氧驯化过程中变形菌门丰度略有降低, 但仍是体系中的优势菌门, 拟杆菌门和绿弯菌门的相对丰度有所提高, 好氧富集体系中生物群落的多样性显著提高.在厌氧驯化过程中, 微生物菌落结构发生了较大变化, 厚壁菌门的相对丰度显著升高, 浮霉菌门的相对丰度也有所提高, 而变形菌门相对丰度显著降低.
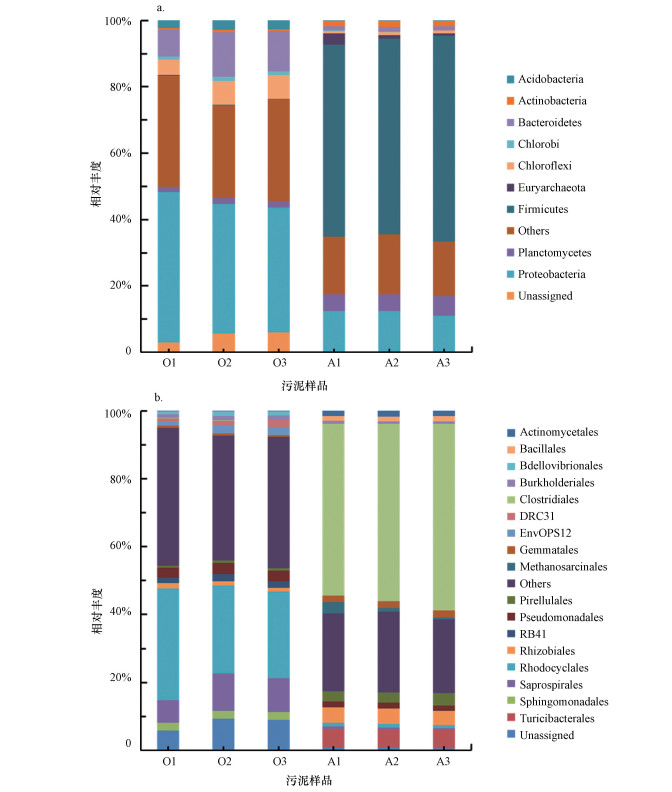 |
| 图 2 微生物门(a)和目(b)水平物种相对丰度 Fig. 2 Relative abundance of microbial species at phylum (a) and order (b) level |
从图 2b可以看出, 不同富集条件显著改变反应器中微生物的组成.好氧富集体系变形菌门中的优势菌目主要为红环菌目(Rhodocyclales, 28.15%)、假单胞菌目(Pseudomonadales, 3.11%)、鞘氨醇菌目(Sphingomonadales, 2.22%);厌氧富集体系厚壁菌门中优势菌群主要为梭菌目(Clostridiales, 52.58%)、苏黎世杆菌目(Turicibacterales, 5.47%)、芽孢杆菌目(Bacillales, 1.53%).众多研究者对PAHs的好氧微生物降解研究表明, 红环菌目、假单胞菌目、鞘氨醇菌目都具有双加氧酶基因(赵百锁, 2008; Oren et al., 2014; Michael et al., 2017), 是多环芳烃好氧降解的优势菌群.这类功能菌群的富集表明好氧微生物降解BP-1的途径可能与双加氧酶有关.
进一步在OTUs水平上对好氧/厌氧两个富集体系中的微生物群落结构进行分析.如图 3所示, 好氧富集体系中的优势菌属主要为假单胞菌属(Pseudomonas, 3.11%)、鞘氨醇属(Sphingobium, 2.19%)、脱氯菌属(Dechloromonas, 1.56%)、蛭弧菌属(Bdellovibrio, 1.19%)、黄杆菌属(Xanthobacter, 0.78%)、菌胶团(Zoogloea, 0.70%);厌氧富集体系中的优势菌属主要为杆菌属(Turicibacter, 5.47%)、梭菌属(Clostridium, 3.81%)、红游动菌属(Rhodoplanes, 3.00%)、A17(1.79%)、甲烷菌属(Methanosaeta, 1.17%)、不动杆菌属(Acinetobacter, 1.43%)、分枝杆菌属(Mycobacterium, 1.20%)、芽孢杆菌属(Bacillus, 0.92%)、甲基暖菌属(Methylocaldum, 0.75%)等.前期研究原始种泥中, 假单胞菌属占比约10%, 鞘氨醇属占比小于0.001%(Sun et al., 2017), 好氧驯化富集体系中假单胞菌菌属相对丰度降低至3.11%, 鞘氨醇属的相对丰度显著升高至2.19%, 表明鞘氨醇属可能与好氧体系中BP-1的生物降解密切相关.鞘氨醇单胞菌是已报道的多环芳烃高效降解菌, 其质粒上成簇的降解基因编码的双加氧酶被认为是降解多环芳烃的主要酶系(纪婷婷等, 2017).鞘氨醇属在好氧体系中丰度的显著提升, 进一步表明好氧体系中BP-1的降解途径可能与双加氧酶有关.
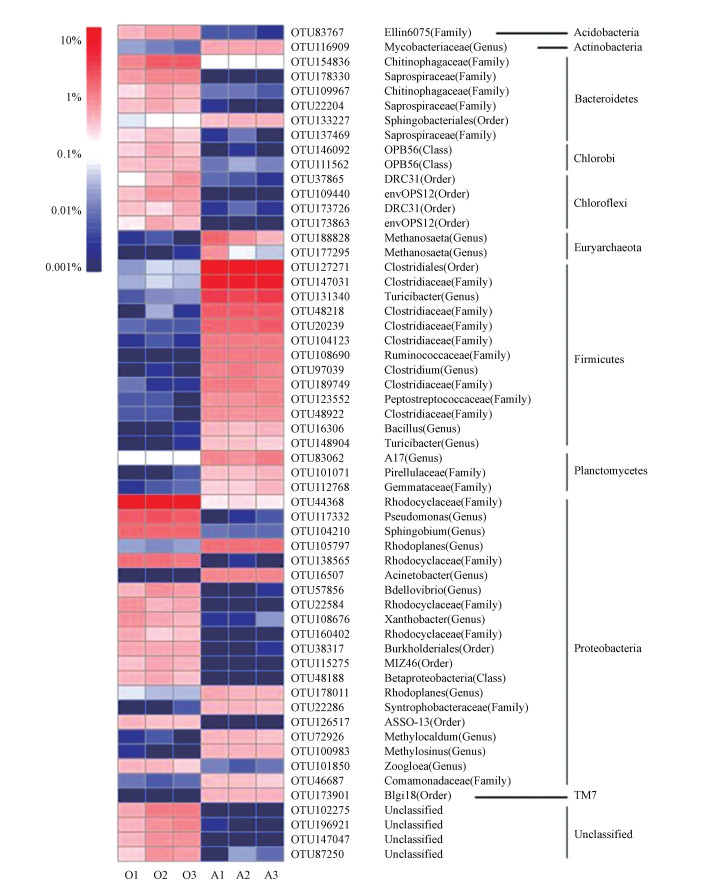 |
| 图 3 微生物在OTUs水平的群落结构热图 Fig. 3 Heatmap of microbial community structure at OTUs level |
基于不同富集体系对BP-1的降解速率以及微生物学机理解析的结果显示, 好氧系统中微生物对BP-1降解效果更好并且微生物多样性更高, 更大概率能够获得高效降解功能微生物.将驯化后的好氧污泥在以BP-1为唯一碳源的分离培养基上涂布, 挑选出菌落形态不同的菌种在LB培养基上进行划线纯化, 初步分离获得能够以2, 4-二羟基二苯甲酮为唯一碳源进行生长的单菌4株, 命名为BP1.1~1.4, 4株菌株的形态及革兰氏染色结果见表 2.
| 表 2 初筛菌株的形态及革兰氏染色结果 Table 2 Morphology and gram staining results of the primary strains |
对4种筛选得到的功能菌株进行分子生物学鉴定, 结果如图 4所示.BP1.1与BP1.2均属于芽孢杆菌, BP1.1与甲基营养型芽孢杆菌Bacillus methylotrophicus strain F7相似度达99%以上, 且与其亲缘关系较近, 鉴定其为甲基营养型芽孢杆菌Bacillus methylotrophicus BP1.1;BP1.2与Bacillus amyloliquefaciens strain InAD-160、Bacillus amyloliquefaciens subsp. plantarum strain Nt1-7、Acinetobacter lwoffii strain 262XY6相似度高达99%以上, 且与解淀粉酶芽孢杆菌Bacillus amyloliquefaciens InAD-160亲缘关系最近, 鉴定其为解淀粉酶芽孢杆菌Bacillus amyloliquefaciens BP1.2;BP1.3与多株红球菌相似度达99%以上, 且亲缘关系接近, 鉴定其为红球菌Rhodococcus sp. BP1.3;BP1.4与鞘氨醇单胞菌相似度高, 但与基因库中现有鞘氨醇单胞菌无显著亲缘关系, 可能为鞘氨醇单胞菌属中新的种类, 结合其革兰氏染色生化鉴定, 定其为鞘氨醇单胞菌Sphingomonas sp. BP1.4.与群落结构分析结果一致, 鞘氨醇单胞菌属是BP-1好氧降解体系中的优势菌群之一, 并可以通过以BP-1为唯一碳源的选择培养基筛选获得.值得指出的是, 两株芽孢杆菌均为兼性厌氧菌, 既存在于好氧体系也存在于厌氧体系, 但好氧体系中芽孢杆菌并没有体现出其丰度的优势性, 可能是由于好氧体系中生物多样性较大, 降低了芽孢杆菌在系统中的丰度.芽孢杆菌是厌氧体系中的优势菌属, 其丰度与BP-1的降解密切相关, 表明生化处理体系中可能存在一类可通过自适应好氧或厌氧条件进行BP-1降解的兼性功能菌.张金宝等(2020)利用多环芳烃芘为唯一碳源进行富集培养和多环芳烃双加氧酶基因检测研究, 分离出9株PAHs降解菌, 其中6株鉴定结果分别是赤红球菌属(Rhodococcus)、芽孢杆菌属(Bacillus)、鞘脂单胞菌属(Sphingomonas)及假单胞菌属(Pseudomonas), 表明BP-1的降解途径可能与多环芳烃芘的降解途径类似.
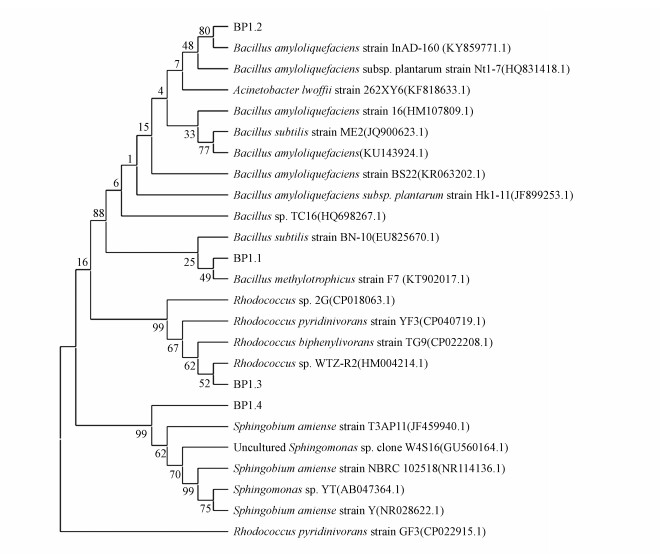 |
| 图 4 BP-1降解菌的系统发育树 Fig. 4 Phylogenetic tree of BP-1 degrading bacteria |
将筛选获得的4株BP-1降解功能菌, 按3%接种量分别接种于模拟BP-1废水中, 28 ℃、好氧培养24 h后, 检测溶液中剩余BP-1浓度, 得到4种菌株对BP-1的去除效率见图 5a.在相同条件下, BP1.1、BP1.2、BP1.3、BP1.4对废水中BP-1的去除率分别为99.62%、44.7%、55.35%、81.8%, BP1.1对微污染物BP-1降解效果最好, BP1.4降解效果次之.进一步研究BP1.1对BP-1的降解动力学(图 5b), 结果显示, BP1.1在6 h可几乎完全降解水中的BP-1(99.9%), 反应的前2 h是停滞期, 此过程中BP1.1降解速率较慢;停滞期过后, BP1.1降解活性迅速提高, 对污染物BP-1降解速率快, 降解速率可达到3.3 mg·L-1·h-1;反应5 h后, 由于底物浓度的降低, 降解速率再次变缓, 平均降解速率降为1.7 mg·L-1·h-1.投加量相同的条件下, BP1.1的降解速率显著高于前期好氧驯化获得的污泥(0.103 mg·L-1·h-1).与Gago-Ferrero等(2012)利用白腐菌Trametes versicolor降解BP-1效果对比, 后者降解相同浓度BP-1需要更长的时间(24 h), 此外, 目前活性污泥降解二苯甲酮类物质的时间一般为6~10 d(Beel et al., 2013;张弘等, 2014).因此, 本研究筛选获得的甲基营养型芽孢杆菌Bacillus methylotrophicus BP1.1大大缩短了BP-1的生物降解时间.
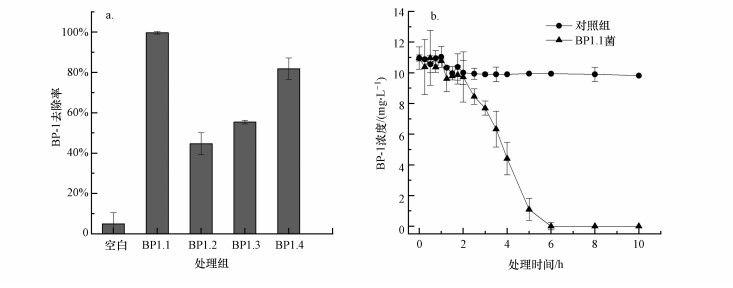 |
| 图 5 不同菌株对BP-1的去除效率(a)及菌BP1.1的去除速率(b) Fig. 5 The removal efficiency of different strains on BP-1 (a) and the removal rate of bacteria BP1.1 (b) |
甲基营养型芽孢杆菌可以对农药DDT污染的土壤进行修复, 能利用二苯化合物作为碳源进行生长(陈苏等, 2016).它的代谢产物主要有抑菌蛋白、蛋白酶、纤维素酶、氨肽酶、果胶酶, 木质素酶等(张妙宜等, 2017), 未见有加氧酶的报道, 其降解BP-1途径可能与双加氧酶以外的酶系有关, 比如木质素酶等, 降解机理有待进一步验证.与菌落分析结果一致, 筛选获得的鞘氨醇单胞菌对BP-1也有较好的降解效果.鞘氨醇单胞菌可以通过在芳环上加氧, 形成醛、酮或醇类中间体, 然后开环分裂, 进一步降解为小分子被吸收利用, 实现对芳香族化合物(如甲苯、二甲苯、萘等)的有效降解(胡杰等, 2007).
3.5 BP-1生物降解毒性评估为进一步探究甲基营养型芽孢杆菌Bacillus methylotrophicus BP1.1在降解BP-1过程中生物毒性的变化情况, 分别采用了发光菌急性毒性和E2类雌激素效应测试方法对生物降解过程中溶液的毒性效应进行了测定.如图 6a所示, 不同反应时间样品当量HgCl2浓度越高, 表明其急性毒性越大.与对照组相比, 处理组在0 h时的毒性略有降低, 可能是由于功能菌BP1.1的加入对溶液中抑制发光菌的物质有一定的吸附作用.处理组溶液的毒性随着处理时间的增加而降低, 急性毒性削减规律与菌BP1.1对BP-1的降解速率较为一致.处理组中原始溶液当量HgCl2浓度为0.028 mg·L-1, 2 h时处理组毒性变化不显著(当量HgCl2浓度约为0.024 mg·L-1), 4 h后毒性显著降低(p < 0.05), 6 h后样品毒性进一步降低(p < 0.01), 此时当量HgCl2浓度约为0.016 mg·L-1, 急性毒性降低了42.8%.根据水质急性毒性(发光菌法)分级标准(那广水, 2010), 当量HgCl2浓度<0.07 mg·L-1为低毒, 因此, 微生物BP1.1在快速降解BP-1的同时, 降低了BP-1的急性毒性, 且并未产生毒性更强的产物.
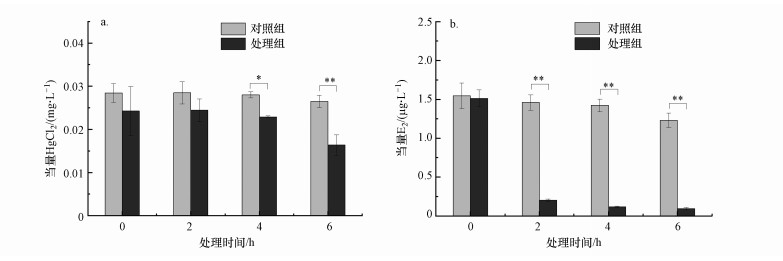 |
| 图 6 菌BP1.1好氧生物降解BP-1过程中急性毒性(a)和类雌激素效应(b)变化(*: p < 0.05; **: p < 0.01) Fig. 6 Acute toxicity (a) and estrogenic effect (b) changes of the reaction solution during the aerobic biodegradation of BP-1 by bacteria BP1.1 (*: p < 0.05; **: p < 0.01) |
如图 6b所示, 不同反应时间样品雌激素活性当量E2浓度越高, 表明其类雌激素效应越大.BP-1类雌激素效应显著, 10 mg·L-1 BP-1雌激素活性相当于1.4~1.5 μg·L-1雌二醇(E2)引起的雌激素效应.经过功能菌BP1.1好氧处理6 h后, 类雌激素效应相当于0.095 μg·L-1雌二醇(E2), 类雌激素效应显著(p < 0.01)降低.Gago-Ferrero等(2012)在白腐真菌和光解对BP-1与BP-3的降解研究中, 也发现微生物处理可以降低二苯甲酮的类雌激素效应, 关于甲基芽营养型孢杆菌Bacillus methylotrophicus BP1.1实际降解途径及产物, 有待后续进一步研究.
4 结论(Conclusions)1) 好氧处理系统是BP-1生物降解的主要途径, 好氧系统的降解速率是厌氧系统的2.74倍.
2) 好氧系统中的微生物多样性显著高于厌氧系统;变形菌门是BP-1好氧富集体系中的优势菌门, 红环菌目、假单胞菌目、鞘氨醇菌目是变形菌门中的优势菌目;好氧驯化过程中鞘氨醇菌属的丰度显著提高, 鞘氨醇属可能与BP-1好氧生物降解过程密切相关.
3) 通过选择培养基从好氧富集体系中共筛选获得了4株BP-1降解菌, 分别鉴定为甲基营养型芽孢杆菌、解淀粉酶芽孢杆菌、红球菌和鞘氨醇单胞菌.其中, 甲基营养型芽孢杆菌Bacillus methylotrophicus BP1.1在6 h对BP-1的去除率高达99.9%, 降解速率可达1.7 mg·L-1·h-1.
4) 应用功能菌BP1.1进行好氧生物处理, 在高效降解BP-1的同时可显著降低BP-1废水的急性毒性和类雌激素效应, 为高效去除废水中BP-1提供了微生物种质资源.
Beel R, Eversloh C L, Ternes T A. 2013. Biotransformation of the UV-Filter sulisobenzone: Challenges for the identification of transformation products[J]. Environmental Science & Technology, 47(13): 6819-6828. |
Cadena-Aizaga M I, Montesdeoca-Esponda S, María E T, et al. 2019. Organic UV filters in marine environments: An update of analytical methodologies, occurrence and distribution[J]. Trends in Environmental Analytical Chemistry, 25: e00079. |
Caporaso J G, Kuczynski J, Stombaugh J, et al. 2010. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
Carena L, Vione D. 2016. Photochemical reaction of peroxynitrite and carbon dioxide could account for up to 15% of carbonate radicals generation in surface waters[J]. Environmental Chemistry Letters, 14(2): 183-187. DOI:10.1007/s10311-016-0549-3 |
陈苏, 单岳, 晁雷, 等. 2016. 表面活性剂-微生物联合修复滴滴涕污染土壤的研究[J]. 生态环境学报, 25(9): 1522-1527. |
陈铮, 陈勇. 2019. 多环芳烃降解菌的研究进展[J]. 浙江万里学院学报, 32(3): 66-70. |
Desantis T Z, Hugenholtz P, Larsen N, et al. 2006. Greengenes, a chimera-checked 16S rDNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology, 72(7): 5069-5072. DOI:10.1128/AEM.03006-05 |
DíazCruz S M, Barceló D. 2015. Personal care products in the aquatic environment[J]. Springer, 155: 1-34. |
Gago-Ferrero P, Badia-Fabregat M, Olivares A, et al. 2012. Evaluation of fungal- and photo-degradation as potential treatments for the removal of sunscreens BP3 and BP1[J]. Science of the Total Environment, 427-428(15): 355-363. |
Ge J L, Huang D Y, Han Z R, et al. 2019. Photochemical behavior of benzophenone sunscreens induced by nitrate in aquatic environments[J]. Water Research, 153: 178-186. DOI:10.1016/j.watres.2019.01.023 |
胡杰, 何晓红, 李大平, 等. 2007. 鞘氨醇单胞菌研究进展[J]. 应用与环境生物学报, (3): 431-437. DOI:10.3321/j.issn:1006-687X.2007.03.030 |
Janjua N R, Mogensen B, Andersson A M, et al. 2004. Systemic absorption of the sunscreens benzophenone-3, octylmethoxycinnamate, and 3-(4-methyl-benzylidene) camphor after whole-body topical application and reproductive hormone levels in humans[J]. Journal of Investigative Dermatology, 123: 57-61. DOI:10.1111/j.0022-202X.2004.22725.x |
纪婷婷, 高莉, 侯彬, 等. 2017. 降解多环芳烃的鞘氨醇单胞菌ahdA1c基因的生物信息学分析[J]. 科学技术与工程, 17(31): 163-169. DOI:10.3969/j.issn.1671-1815.2017.31.026 |
Kim S, Choi K. 2014. Occurrences, toxicities, and ecological risks of benzophenone-3, a common component of organic sunscreen products: A mini-review[J]. Environment International, 70(9): 143-157. |
Kunz P Y, Fent K. 2006. Estrogenic activity of UV filter mixtures[J]. Toxicology and Applied Pharmacology, 217(1): 86-99. DOI:10.1016/j.taap.2006.07.014 |
Li N, Ho W, Shiu R, et al. 2019. Ultra violet filters in the urine of preschool children and drinking water[J]. Environment International, 133: 105-246. |
林颖, 蔡容华. 2006. 芳香族化合物生物降解的研究进展[J]. 福建轻纺, 2: 6-10. |
Liu Y S, Ying G G, Shareef A, et al. 2012. Biodegradation of the ultraviolet filter benzophenone-3 under different redox conditions[J]. Environmental Toxicology and Chemistry, 31(2): 289-295. DOI:10.1002/etc.749 |
Liu H, Sun P, Liu H X, et al. 2015. Acute toxicity of benzophenonetype UV filters for Photobacterium phosphoreum and Daphnia magna: QSAR analysis, interspecies relationship and integrated assessment[J]. Chemosphere, 135: 182-188. DOI:10.1016/j.chemosphere.2015.04.036 |
鲁亢, 杨尚源, 梁志伟, 等. 2013. 选矿废水中黄药自然降解特性的研究[J]. 应用生态学报, 24(2): 597-606. |
Mao F J, He Y L, Gin K Y H. 2018. Evaluating the joint toxicity of two benzophenone-type UV filters on the green alga chlamydomonas reinhardtii with response surface methodology[J]. Toxicology, 6(1): 8. |
Michael A K, Akitomo K, Andreas S. 2017. Aerobic hydrocarbon-degrading alphaproteobacteria: Sphingomonadales[J]. Degrading Microbes, 13: 1-21. |
那广水, 张月梅, 陈彤, 等. 2010. 发光细菌法评价排污口污水中总有机污染物毒性[J]. 中国环境监测, 26(5): 61-64. DOI:10.3969/j.issn.1002-6002.2010.05.017 |
Oren A. 2014. The family Rhodocyclaceae[J]. The Prokaryotes, 11: 975-998. |
Park M A, Hwang K A, Lee H R, et al. 2013. Benzophenone-1 stimulated the growth of BG-1 ovarian cancer cells by cell cycle regulation via an estrogen receptor alpha-mediated signaling pathway in cellular and xenograft mouse models[J]. Toxicology, 305(8): 41-48. |
Salvador A, Chisvert A. 2005. An environmentally friendly ("green") reversed-phase liquid chromatography method for UV filters determination in cosmetics[J]. Analytica Chimica Acta, 537(1/2): 15-24. |
Sanseverino J, Gupta R K, Layton A C, et al. 2005. Use of Saccharomyces cerevisiae BLYES expressing bacterial bioluminescence for rapid, sensitive detection of estrogenic compounds[J]. Applied and Environmental Microbiology, 71(8): 4455-4460. DOI:10.1128/AEM.71.8.4455-4460.2005 |
Schloss P D, Westcott S L, Ryabin T, et al. 2009. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
Shin S, Go R E, Kim C W, et al. 2016. Effect of benzophenone-1 and octylphenol on the regulation of epithelial-mesenchymal transition via an estrogen receptor-dependent pathway in estrogen receptor expressing ovarian cancer cells[J]. Food & Chemical Toxicology, 93: 58-65. |
Sun H, Wu Q, Yu P, et al. 2017. Denitrification using excess activated sludge as carbon source: performance and the microbial community dynamics[J]. Bioresource Technology, 238(8): 624-632. |
Tsui M M P, Leung H W, Wai T C, et al. 2014. Occurrence, distribution and ecological risk assessment of multiple classes of UV filters in surface waters from different countries[J]. Water Research, 67(10): 55-65. |
魏东斌, 赵慧敏, 杜宇国. 2017. 二苯甲酮类紫外防晒剂发光菌急性毒性及QSAR研究[J]. 生态毒理学报, 12(3): 234-242. |
杨庆, 张超奇, 马丽晓, 等. 2017. 一株高效凤眼莲脱胶菌的筛选及鉴定[J]. 生态与农村环境学报, 33(3): 275-280. |
张弘, 殷浩文, 周忠良, 等. 2014. 新兴污染物BP-3和BP-4的好氧生物降解性能[J]. 化工环保, 34(5): 423-428. DOI:10.3969/j.issn.1006-1878.2014.05.005 |
张金宝, 李凤梅, 郭书海, 等. 2020. 高分子量多环芳烃降解菌筛选及在土壤电动-生物修复中应用[J]. 生态学杂志, 39(1): 260-269. |
张妙宜, 云天艳, 周登博, 等. 2017. 甲基营养型芽孢杆菌的研究进展[J]. 热带农业科学, 37(9): 66-70. |
Zhang T, Shao M F, Ye L. 2012. 454 Pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants[J]. The ISME Journal, 6: 1137-1147. DOI:10.1038/ismej.2011.188 |
Zhang T, Sun H, Qin X, et al. 2013. Benzophenone-type UV filters in urine and blood from children, adults, and pregnant women in China: Partitioning between blood and urine as well as maternal and fetal cord blood[J]. Science of The Total Environment, 461-462(9): 49-55. |
赵百锁. 2008. 好氧细菌对多环芳烃降解机制的研究进展[J]. 微生物学通报, 35(3): 414-420. DOI:10.3969/j.issn.0253-2654.2008.03.018 |
赵斌, 何绍江. 2002. 微生物学实验[M]. 北京: 科学出版社, 38-39.
|
Zúiga-Benítez H, Peuela G A. 2018. Application of solar Photo-Fenton for benzophenone-type UV filters removal[J]. Journal of Environmental Management, 217: 929-938. |
 2021, Vol. 41
2021, Vol. 41


