吲哚(Indole)是一种重要的有机原料, 在自然界中广泛分布, 尤其在焦化废水、染料废水、医药废水中浓度较高且在自然界中很难被降解, 对人体、动植物都有毒性作用.物理、化学、生物法都能降解吲哚, 其中生物法因低成本、无二次污染的特性而更具优势.由于吲哚空间结构稳定, 传统的活性污泥生物法降解吲哚废水时需要较高的COD或较长的厌氧降解时间(Lu et al., 2009), 因此寻找一种低耗高效的生物降解技术已经成为研究热点.
微生物燃料电池(MFC)是一种利用微生物代谢活动产电的技术, 已经被证明能够促进有机物矿化, 如光催化耦合MFC技术可去除95%以上的苯酚(Yu et al., 2019).研究人员发现以吲哚等含氮杂环化合物作为燃料的MFC具有较大的产电潜力(Luo et al., 2010; Zhang, 2010; Wang et al., 2015).传统MFC对较低浓度的吲哚废水降解率可达90%(Hu et al., 2011), 但对高浓度吲哚废水的处理能力有限, 120 h内降解率仅为44%.经过改性的阳极碳毡可使降解率提高至90.3% (Jian et al., 2020), 尽管提高了生物降解效率, 但一定程度上增加了废水处理成本, 在实际应用中受到限制.零价铁(ZVI)作为一种经济、绿色的还原剂, 已被用于协助治理含间苯胺黄、苯并三唑(Ahmadi et al., 2018)、乙磺胺(Ling et al., 2018)等有机废水. ZVI单独作用于有机物时效果不明显; 而在微生物体系中, 其强还原性能够降低氧化还原电位(ORP)从而改变有机物降解路径. ZVI腐蚀过程提供的[H]可作为厌氧微生物的电子供体(Zhu et al., 2012), Fe2+可减弱电斥力促进细胞间相互作用, 促进关键酶的合成(Zhen et al., 2015).此外, 微生物在Fe2+作用下产生的胞外聚合物具有电活性, 可参与电子转移过程(Yu et al., 2019; Chen et al., 2020).有研究表明微生物厌氧消化过程中ZVI的添加还能促进难降解有机物向小分子有机物的转化(Honetschlägerová et al., 2018; Zhao et al., 2020). Li等(2020)研究发现在MFC启动过程中添加ZVI使最大输出电压提高了47%, 同时引起了微生物群落结构的改变.本研究以吲哚为单基质燃料, 利用ZVI预厌氧协同MFC技术在对吲哚废水进行高效处理的同时, 研究微生物降解吲哚的特性与路径, 探讨ZVI预厌氧对MFC产电性能和微生物群落结构的影响, 可为含氮杂环化合物的微生物降解提供一定理论基础.
2 材料与方法(Materials and methods) 2.1 实验装置与材料本研究采用矩形双极室MFC反应器, 阴阳极室体积分别为28 mL, 中间用质子交换膜(Nafion 212, Dupont Co., USA)分隔, 阴极以50 mmol·L-1的铁氰化钾溶液为电子受体.阴阳极材料均选用3 cm×3 cm的圆柱形碳纤维刷, 通过钛丝与导线连接, 外电路串联一个1000 Ω的电阻, 通过吉时利(Keithley) 2700采集系统每10 min读取一次输出电压.试验过程保持恒温(30±1) ℃.
2.2 接种与运行将取自山西某污水处理厂的剩余活性污泥与营养液按1∶10的体积比混合, 接种到MFC反应器阳极室中启动.吲哚初始浓度为50 mg·L-1, 营养液组分为: Na2HPO4 4.576 g·L-1、NaH2PO4 2.452 g·L-1、NH4Cl 0.31 g·L-1、KCl 0.13 g·L-1及微量元素.连续3个周期具有稳定的电压输出后进行MFC污泥的驯化, 以每周期增加20 mg·L-1为梯度, 每个浓度梯度驯化5个周期, 逐渐增大吲哚浓度至250 mg·L-1.每周期内定期采样测定吲哚和总有机碳(TOC)浓度, 重复测定多个周期.对比闭路和开路的吲哚的降解效果, 选取效果较好的反应器进行协同处理实验.
将一定量的ZVI加入厌氧瓶中对吲哚进行预氧化处理, 厌氧瓶中污泥与配水体积比为1∶10, 配水由微量元素、矿物质元素和PBS溶液组成.之后向MFC反应体系中投加预厌氧上清液进行连续反应(PA-MFC组), 同时设置单独MFC闭路体系(MFC组)以及开路体系(厌氧组)作为对照组.以96 h为周期进行ZVI预厌氧协同MFC的反应, 对比不同反应时间吲哚与TOC的降解特性.
2.3 分析方法每周期内定期采样, 用0.22 μm滤膜滤除微生物后分析TOC与吲哚浓度. TOC分析采用TOC-VCPH测定仪.吲哚浓度的分析采用Agilent 1260II高效液相色谱仪(HPLC), 液相测定条件: 流动相体积比水(A): 乙腈(B)=40∶60, 流速为1.0 mL·min-1, 色谱柱为TC-C8反相(XDB 250 mm × 4.6 mm, 5 μm), 柱温为30 ℃, 波长为270 nm, 进样量为20 μL.
中间产物采用HPLC-MS/MS分析, 选择0~4 min: A%∶B%=40∶60; 5~7 min: A%∶B%=60∶40; 8~9 min: A%∶B%=40∶60为梯度的流动相比例, 200~360 nm波长内进行PDA连续扫描, MS/MS采用ESI电喷雾电离在50~500 m/z质量范围内扫描.
以原污泥样品为空白组, 对PA-MFC、MFC、厌氧实验组污泥进行采样和高通量测序分析.用上海生工生物工程股份有限公司的土壤DNA试剂盒, 一式三份从4种污泥样品中提取DNA; 16S rRNA基因V3~V4区序列采用引物对341F(5′CCCTA CACGACGCTCTCTTCCGATCTG-3′和805R(5′-GACT GGAGTTCCTTGGCACCCGAGAATTATTA-3′)以及349F(59-GYGCASCAGKCGMGAAW-39)和806R(59-GGACTACVSGGGTATC TAAT-ATA)进行扩增, 通过Illumina高通量测序平台进行群落解析.
反应动力学拟合使用SIGMAPLOT 14.0软件进行.
3 结果与讨论(Results and discussion) 3.1 ZVI投加量以及预厌氧时间的优化为确定ZVI的最优投加量, 对污泥接种量为1∶10的厌氧体系分别进行0、2、4、6、8 g·L-1 ZVI投加量优化试验, 每24 h测定吲哚浓度并计算降解率, 结果如图 1a所示, ZVI浓度小于4 g·L-1时, 吲哚降解率随ZVI含量的增大而增大, 投加量为4~8 g·L-1时, 随着ZVI含量增大, 吲哚降解率逐渐减小, 这一结论与Li等(2020)的研究结果相同.在4 g·L-1投加量下进行预厌氧时间的优化试验, 将ZVI分别进行6、12、24 h的不同预厌氧处理, 3种预厌氧体系协同MFC对吲哚的降解率如图 1b所示, 预厌氧12 h的降解效果明显优于预厌氧6 h与24 h.推测可能原因是低浓度的ZVI水解生成Fe2+和少量Fe3+, 部分Fe2+进一步形成Fe3+, 铁还原菌可以在利用Fe3+还原为Fe2+的过程中降解有机物(Honetschlägerová et al., 2018), 铁离子还能够为微生物的生长活动所利用, 提高微生物代谢能力; 随着ZVI含量升高或预厌氧时间的增加, ZVI水解腐蚀产物在水中积累并吸附在微生物细胞表面, 降低细菌活性甚至破化细胞结构(Wu et al., 2015), 对吲哚的降解反而产生抑制作用.
 |
| 图 1 不同ZVI预厌氧量(a) 与预厌氧时间(b) 对吲哚降解率的影响 Fig. 1 The effect of different ZVI dosage(a) and time (b) on the removal rate of indole |
在上述条件基础上, 将ZVI预厌氧体系引入MFC中构成PA-MFC体系, 吲哚和TOC的降解效果如图 2所示.可以看出, 随着MFC反应器的运行, 降解率曲线均呈增长趋势.在反应器运行前期, ZVI的预氧化使吲哚与TOC浓度迅速降低, 反应24 h后, PA-MFC组、MFC组吲哚降解率分别为40.34%和28.82%, 仅1 d内预厌氧处理使吲哚降解率提高了11.52%.第36 h后PA-MFC组降解增略微减缓, 但仍保持较高降解速率至第72 h, 体系中检测到的吲哚浓度仅为初始浓度的12.68%, 降解率为87.33%, 不仅与同期MFC组的降解率差距达到最大值19.11%, 而且高于MFC组在24 h后的降解率.第84 h开始两组反应器降解率曲线趋于平缓, 说明吲哚降解率已基本稳定, 第96 h MFC组吲哚降解率为82.00%, PA-MFC组降解率则达到97.17%, 周期结束时预厌氧协同体系使吲哚降解率提高了15.17%.
 |
| 图 2 吲哚与TOC的降解特性 Fig. 2 Removal characteristics of indole and TOC |
ZVI预厌氧协同MFC体系对TOC与吲哚的降解趋势基本相同.运行前期PA-MFC组降解率高速增长, 48 h内去除了50.63% TOC, MFC组降解率为44.26%, 随着反应的进行PA-MFC与MFC组的差距逐渐增大, 第72 h的液相分析结果表明MFC组中吲哚的含量占初始浓度的比例为36.85%, PA-MFC组中检测到24.78%吲哚含量, 降解率为75.22%, 而MFC组在24 h后的降解率仅为72.82%, 此时PA-MFC组降解率为89.50%.两组反应器中TOC浓度降低速率从第72 h开始减慢, 降解率曲线趋于平缓. PA-MFC组浓度变化速率比MFC组大, 表明PA-MFC组微生物对TOC的降解能力更强.两组降解率差距随着时间逐渐增大, 第84 h达到最大差值17.39%.周期结束时PA-MFC组和MFC组TOC降解率最高分别为89.50%和79.82%.
从图 2可以看出, 前36 h ZVI的预氧化处理使吲哚和TOC降解速率有明显提高, PA-MFC组的降解率始终比MFC组高, 且降解率差值逐渐增大, 其中吲哚降解率的最大差距出现在第72 h, TOC的最大差距出现在第84 h.随着反应器运行, PA-MFC组吲哚与TOC降解率迅速上升, 36 h后增速减缓, 84 h后基本保持稳定; 而MFC组降解率曲线斜率变化不大, 降解效率匀速上升, 并于84 h后基本保持稳定. PA-MFC组斜率明显高于MFC组, 说明ZVI预厌氧处理提高了微生物对吲哚与TOC的代谢能力, 增大了代谢速率. Jian等(2020)研究发现传统MFC对高浓度吲哚废水在120 h内的降解率仅为44%, 改性阳极的降解率可提高到90%以上, 而本研究使用的ZVI预厌氧处理不仅使吲哚降解率提高至97%以上, 同时降低了电极改性的成本.本研究发现, 在4 g·L-1 ZVI的预厌氧量下, 阳极液的缓冲作用使反应器pH维持在6.7~6.8, 中性pH有利于功能性细菌生长代谢繁殖(Azhdarpoor et al., 2015).
3.3 ZVI预厌氧协同MFC降解吲哚的反应动力学分析用一级动力学方程对MFC中吲哚的降解进行建模分析, 模型方程如下:

|
(1) |
式中, t为反应时间(h); c0为吲哚的初始浓度(mg·L-1), ct为t时间后的吲哚浓度(mg·L-1); k1为一级反应的速率常数.
实验数据与一级反应动力学模型拟合的结果如图 3所示.吲哚在MFC中的降解基本符合一级动力学规律, 相关系数较高, 说明吲哚微生物降解速率与其浓度呈正相关.其中PA-MFC组一级速率常数为0.04 h-1, 大于MFC组一级速率常数0.02 h-1, 根据半衰期公式t1/2=ln2/k, 得到PA-MFC组半衰期为17.33 h, MFC组半衰期为34.66 h, 说明预厌氧过程使吲哚降解的半衰期减小了一半, 使吲哚矿化效率提高了一倍, 与3.2节结论一致.
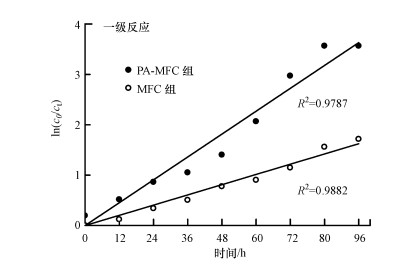 |
| 图 3 一级反应动力学拟合结果 Fig. 3 First-order reaction kinetics fitting results |
图 4a给出了PA-MFC组与MFC组运行稳定后连续3个周期的输出电压变化趋势, 箭头表示更换营养液的时间节点.结果发现PA-MFC组输出电压在6 h内迅速升高至约600 mV, 原因是周期初始阶段反应器内部分好氧微生物的繁殖为厌氧产电菌的代谢活动创造环境条件, 同时提供小分子有机物供产电菌利用(Chae et al., 2009).表现为MFC输出电压在6 h内迅速上升.随后输出电压逐渐降低, 于96 h内降至40 mV并保持稳定, 产电周期为4 d; 而MFC组有明显的滞后现象, 更换营养液后16 h内输出电压达到最大值, 最大电压在500 mV以下, 明显低于PA-MFC组, 同时发现MFC组输出电压整体低于PA-MFC组, 说明预厌氧过程的加入对MFC产电性能有明显强化效果. 一些研究者(Luo et al., 2010; Gao et al., 2020)以相同初始浓度吲哚为单一燃料运行MFC, 最高输出电压仅为120 mV, 进一步表明ZVI预厌氧体系使MFC的产电性能得到提升.
 |
| 图 4 MFC的输出电压(a)及电流密度与电压、功率密度的关系(b) Fig. 4 The stable output voltage of MFC operation (a) and The relationship between current density and voltage and power density (b) |
为进一步检测MFC组与PA-MFC组反应器的产电性能, 将外接电阻阻值从10000 Ω逐渐减小, 监测反应器输出电压, 根据功率与电极面积的比值得到的极化曲线与功率曲线如图 4b所示, PA-MFC组最大功率密度为439.55 mW·m-2. 而MFC组最大功率密度为169.78 mW·m-2, PA-MFC组最大功率密度大于MFC组, 表明预厌氧体系增强了MFC产电性能.
为表征ZVI预厌氧对MFC能量损耗和电子回收效率的影响, 本试验分别引入内阻和库伦效率来检测MFC组与PA-MFC组的产电性能.由式(2)可知MFC最大输出功率Pmax与电阻的关系, OCV为系统可达到的最大电压, Rext为外阻, Rint为内阻.根据式(2)可知, 当外电阻阻值与内电阻相同时, 反应体系功率密度达到最大.计算可知本研究中PA-MFC反应器内电阻为1100 Ω, MFC反应器内阻为1510 Ω.可见ZVI的预厌氧处理减小了MFC反应器内阻.

|
(2) |
根据式(3)可计算体系库伦效率CE, 其中tb为周期, I为体系电流, F为法拉第常数, VAn为阳极液体积(15 mL). 实验测得PA-MFC组ΔCOD为596.67 mg·L-1, MFC组ΔCOD为485.45 mg·L-1. 计算得到PA-MFC组库伦效率为25.58%, MFC组库伦效率为21.77%, 可见ZVI的预厌氧处理提高了MFC电子回收率.
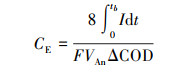
|
(3) |
根据图 5a、5b LC/MS分析结果, 推测本研究中吲哚的降解路径如图 5c所示.吲哚的生物降解主要发生羟基取代与杂环开环过程.在苯酚羟化酶的作用下, 吲哚在C-2、C-3和C-4, 5处的氧化反应同时发生, 分别生成m/z为133和149的羟基吲哚. C-2、C-3处的氢被取代后氧化生成靛红, 靛红中的吡咯环在C-3处水解生成二噁唑; 或吡咯环在C-2, 3之间水解开环, 羟基氧化为羧基, 与氨基相连的羧基脱落生成邻氨基苯甲酸, 进一步生成水杨酸; 2-羟基吲哚还可能发生吡咯环上的C-N键断裂, 氨基与醛基氧化生成m/z为135的化合物P4. C-4和C-5处的氢被羟基取代后, 苯环开环使碳长链暴露, 羟基被氧化为醛基, 随后碳链从吡咯环上脱落, 吡咯环上的基团进一步反应生产P6、P7等化合物.本研究中虚线内的中间产物只在PA-MFC实验组中被检测到, 推测原因是ZVI预厌氧体系增强了水解酸化酶的活性(Liu et al., 2012), 加速了靛红水解与羧酸生成过程, 促进了杂环类化合物厌氧降解. Xu等(2020)对微生物群落功能进行元基因组分析的结果与该结论一致.
 |
| 图 5 PA-MFC组LC/MS谱图(a)、MFC组LC/MS谱图(b)及吲哚降解路径(c) Fig. 5 LC-MS spectra of PA-MFC group (a), LC-MS spectra of MFC group (b) and Indole degradation pathway (c) |
为探究PA-MFC体系降解吲哚对微生物群落水平的影响, 对PA-MFC、MFC、厌氧和原污泥等4组污泥样品进行了高通量测序, 得到的微生物群落结构分布如图 6所示.
 |
| 图 6 微生物群落在门(a)、纲(b)、属(c)水平上的分布 Fig. 6 Distribution of microbial communities at the level of phylum (a), syllabus (b) and genus (c) |
门水平上, 变形菌门(Protebacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)在所有菌种中丰度最高, 这3种细菌丰度之和在4组样品中的比例分别为98.89%、99.48%、98.77%和79.91%, 具有绝对优势, 这表示与其它MFC阳极生物膜细菌种类结构类似, 它们是吲哚微生物降解过程中的优势种群.图 6a中可以看出ZVI的预厌氧处理使厚壁菌门在MFC系统中的比例提高了24.04%, 说明ZVI预厌氧体系的加入有利于厚壁菌门的富集.拟杆菌在降解聚合蛋白质和碳水化合物方面效率较高, 能利用吲哚等物质进行代谢活动(Ma et al., 2015; Huang et al., 2016).本研究中ZVI预厌氧体系对拟杆菌没有明显强化或抑制效果, 这与Wang等(2016)的研究结果一致.
在纲水平上, 梭状芽孢杆菌纲(Clostridia)在4组样品中占比分别为46.47%、27.37%、28.13%和18.47%, PA-MFC中所占的比例MFC中高19.10%; γ-变形菌纲(Gammaproteobacteria)在PA-MFC组的丰度比MFC组低16.30%;此外添加预厌氧上清液后α-变形菌纲(Alphaproteobacteria)在MFC中的占比上升了3.77%.与厌氧组相比, β-变形菌纲(Betaproteobacteria)在MFC组中的丰度高4.55%, 显然ZVI预厌氧处理有利于梭状芽孢杆菌纲和α-变形菌纲富集.本研究中PA-MFC反应器中吲哚降解更快, 这是因为梭状芽孢杆菌纲富集程度较高, 能更高效地代谢吲哚(Hong et al., 2010).
在属水平上, 4组样品的优势属均为梭菌属(Clostridium sensu stricto), 属于梭状芽孢杆菌纲(Clostridia).梭菌是一种重要的厌氧代谢菌, 同时能够作为电子供体参与电子转移过程(Su et al., 2019).图 6显示PA-MFC组中该菌属的占比相较MFC组上升了10.84%, MFC组相较厌氧组上升了3.41%.梭菌等厌氧微生物的富集与ZVI腐蚀产生的H2有关(Zhu et al., 2015; Samanides et al., 2020). α-变形菌纲中鞘氨醇(Sphingopyxis)菌属在PA-MFC组中的丰度比MFC组低1.23%.鞘氨醇菌能够合成一种特殊的蛋白酶来降解芳香族化合物.产碱菌(Alcaligenes)和浮霉菌(Planctomycetia)作为吲哚降解菌(Jensen et al., 1995; Gao et al., 2019), 本研究β-变形菌中的产碱菌属在PA-MFC组中的丰度比MFC组中低1.54%, 说明ZVI预厌氧处理对产碱菌和鞘氨醇菌属的富集有一定抑制作用.假单胞菌属(Pseudomonas)在PA-MFC污泥样品中所占比例比MFC组中高8.38%, 热单胞菌属(Thermomonas)在PA-MFC组中比MFC组中占比高6.56%, 说明ZVI预厌氧促进了这两种菌属的代谢活动.有研究发现热单胞菌在能够利用ZVI生成的H2作为电子供体进行代谢活动(Kulkarni et al., 2020), 常用于厌氧污泥消化(Liu et al., 2021).假单胞菌中的Acinteobacter与MFC产电密切相关(Li et al., 2020), 在生物膜的电活性中发挥重要作用, 解释了3.4节ZVI预厌氧协同MFC反应体系产电性能较好的原因.吲哚的厌氧降解第一步是氮杂环开环, 第二步是氨氮的释放和苯环的开环(Shi et al., 2019). Acinteobacter通过硝化作用将吲哚分解为吲哚基、靛红、邻氨基苯甲酸酯、水杨酸酯、邻苯二酚等中间产物, 再进一步分解为NH4+-N、NO3--N和甲烷以及其他可被细胞利用的小分子物质(Zhang et al., 2019).此外链霉菌属(Streptomyces sp.)属于放线菌门(Actinobacteria), 也是重要的有机物降解菌(Balachandran et al., 2012), ZVI的存在能够促进碳源微生物体内水解酶、氧化还原酶的合成(Zhang et al., 2020), 增强梭菌、放线菌等的代谢活性.图 6可以明显看出在PA-MFC组中更容易富集, 这是因为ZVI预厌氧处理改变了阳极液体系, 导致微生物群落的演替和分化, 促进芳香族污染物降解菌的生长(Wu et al., 2019).链霉菌属属于放线菌门, 是重要的有机物降解菌(Balachandran et al., 2012), ZVI的存在能够促进有机物降解菌体内水解酶、氧化还原酶的合成(Zhang et al., 2020), 增强梭菌、放线菌等的代谢活性, 有利于这些功能细菌的富集.梭状芽孢杆菌、假单胞菌、放线菌等细菌在代谢时可以Fe0为电子供体转移电子(Chen et al., 2018), 说明经过ZVI预厌氧协同的MFC在去除难降解有机物能产生更大的输出电压, 与3.4节结论一致.与单纯厌氧环境相比, MFC对吲哚降解菌的富集作用有限, 而与ZVI预厌氧协同处理的MFC体系能够在提供高输出电压的同时有效提升吲哚降解菌的丰度, 保证对吲哚较高的降解率.
4 结论(Conclusions)1) ZVI在厌氧体系中的最优投加量为4 g·L-1, 预厌氧时间为12 h.
2) 96 h内PA-MFC组中吲哚和TOC降解率分别为97.17%和89.50%;与MFC组相比, ZVI预厌氧体系表现出明显的强化效果: 预厌氧的加入使吲哚降解率提高了19.11%, 使TOC降解率提高了17.39%.
3) 吲哚的微生物降解符合一级反应动力学, ZVI预厌氧处理使一级反应速率常数增大.
4) 最优条件下, MFC反应体系产电周期约为4 d, 周期内最高电压达到600 mV, 最大功率密度为439.55 mW·m-2.
5) 吲哚的生物降解途径主要是羟基取代与杂环开环.靛红是重要的中间产物, ZVI预厌氧处理能够提高水解酸化酶的活性, 从而促进靛红水解与水杨酸生成过程.
6) 高通量测序结果表明, 梭菌、假单胞菌属、热单胞菌属、产碱菌、丛毛单胞菌属和链霉菌等是吲哚微生物代谢中的优势菌属.
Ahmadi M, Ghanbari F. 2018. Degradation of organic pollutants by photoelectro-peroxone/ZVI process: Synergistic, kinetic and feasibility studies[J]. Journal of Environmental Management, 228: 32-39. |
Azhdarpoor A, Nikmanesh R, Samaei M R. 2015. Removal of arsenic from aqueous solutions using waste iron columns inoculated with iron bacteria[J]. Environmental Technology, 36(20): 2525-2531. DOI:10.1080/09593330.2015.1025104 |
Balachandran C, Duraipandiyan V, Balakrishna K, et al. 2012. Petroleum and polycyclic aromatic hydrocarbons (PAHs) degradation and naphthalene metabolism in Streptomyces sp. (ERI-CPDA-1) isolated from oil contaminated soil[J]. Bioresource Technology, 112: 83-90. DOI:10.1016/j.biortech.2012.02.059 |
Chae K J, Choi M J, Lee J W, et al. 2009. Effect of different substrates on the performance, bacterial diversity, and bacterial viability in microbial fuel cells[J]. Bioresource Technology, 100(14): 3518-3525. DOI:10.1016/j.biortech.2009.02.065 |
Chen L, Zhang P, Shang W, et al. 2018. Enrichment culture of electroactive microorganisms with high magnetic susceptibility enhances the performance of microbial fuel cells[J]. Bioelectrochemistry, 121: 65-73. DOI:10.1016/j.bioelechem.2018.01.005 |
Chen S, Tao Z, Yao F, et al. 2020. Enhanced anaerobic co-digestion of waste activated sludge and food waste by sulfidated microscale zerovalent iron: Insights in direct interspecies electron transfer mechanism[J]. Bioresource Technology, 316: 123901. DOI:10.1016/j.biortech.2020.123901 |
Gao Y, Kong X, Zhou A, et al. 2020. Enhanced degradation of quinoline by coupling microbial electrolysis cell with anaerobic digestion simultaneous[J]. Bioresource Technology, 306: 123077. DOI:10.1016/j.biortech.2020.123077 |
Gao Y, Wang G, Zhou A, et al. 2019. Effect of nitrate on indole degradation characteristics and methanogenesis under mixed denitrification and methanogenesis culture[J]. Biochemical Engineering Journal, 145: 33-41. DOI:10.1016/j.bej.2019.02.009 |
Honetschlägerová L, Škarohlíd R, Martinec M, et al. 2018. Interactions of nanoscale zero valent iron and iron reducing bacteria in remediation of trichloroethene[J]. International Biodeterioration & Biodegradation, 127: 241-246. |
Hong X, Zhang X, Liu B, et al. 2010. Structural differentiation of bacterial communities in indole-degrading bioreactors under denitrifying and sulfate-reducing conditions[J]. Research Microbiology, 161(8): 687-693. DOI:10.1016/j.resmic.2010.06.010 |
Hu W J, Niu C G, Wang Y, et al. 2011. Nitrogenous heterocyclic compounds degradation in the microbial fuel cells[J]. Process Safety and Environmental Protection, 89(2): 133-140. DOI:10.1016/j.psep.2010.10.006 |
Huang Y, Hou X, Liu S, et al. 2016. Correspondence analysis of bio-refractory compounds degradation and microbiological community distribution in anaerobic filter for coking wastewater treatment[J]. Chemical Engineering Journal, 304: 864-872. DOI:10.1016/j.cej.2016.05.142 |
Jensen M T, Cox R P, Jensen B B. 1995. 3-Methylindole (Skatole) and indole production by mixed populations of pig fecal bacteria[J]. Applied and Environmental Microbiology, 61(8): 3180-3184. DOI:10.1128/aem.61.8.3180-3184.1995 |
Jian M, Xue P, Shi K, et al. 2020. Efficient degradation of indole by microbial fuel cell based Fe2O3-polyaniline-dopamine hybrid composite modified carbon felt anode[J]. Journal of Hazardous Materials, 388: 122123. DOI:10.1016/j.jhazmat.2020.122123 |
Kulkarni P, Olson N D, Bui A Q, et al. 2020. Zero-valent iron sand filtration can reduce human and plant pathogenic bacteria while increasing plant growth promoting bacteria in reclaimed water[J]. Frontiers in Environmental Science, 8: 541921. DOI:10.3389/fenvs.2020.541921 |
Li C, Zhou K, He H, et al. 2020. Adding zero-valent iron to enhance electricity generation during MFC start-up[J]. Int J Environ Res Public Health, 17(3): 806. DOI:10.3390/ijerph17030806 |
Ling R, Chen J P, Shao J, et al. 2018. Degradation of organic compounds during the corrosion of ZVI by hydrogen peroxide at neutral pH: Kinetics, mechanisms and effect of corrosion promoting and inhibiting ions[J]. Water Research, 134: 44-53. DOI:10.1016/j.watres.2018.01.065 |
Liu J, Su J, Ali A, et al. 2021. Role of porous polymer carriers and iron-carbon bioreactor combined micro-electrolysis and biological denitrification in efficient removal of nitrate from wastewater under low carbon to nitrogen ratio[J]. Bioresource Technology, 321: 124447. DOI:10.1016/j.biortech.2020.124447 |
Liu Y, Zhang Y, Quan X, et al. 2012. Optimization of anaerobic acidogenesis by adding Fe0 powder to enhance anaerobic wastewater treatment[J]. Chemical Engineering Journal, 192: 179-185. DOI:10.1016/j.cej.2012.03.044 |
Lu Y, Yan L, Wang Y, et al. 2009. Biodegradation of phenolic compounds from coking wastewater by immobilized white rot fungus Phanerochaete chrysosporium[J]. Journal of Hazardous Materials, 165(1): 1091-1097. |
Luo Y, Zhang R, Liu G, et al. 2010. Electricity generation from indole and microbial community analysis in the microbial fuel cell[J]. Journal of Hazardous Materials, 176(1/3): 759-764. |
Ma Q, Qu Y, Zhang X, et al. 2015. Systematic investigation and microbial community profile of indole degradation processes in two aerobic activated sludge systems[J]. Scientific Reports, 5(1): 17674. DOI:10.1038/srep17674 |
Samanides C G, Koutsokeras L, Constantinides G, et al. 2020. Methanogenesis inhibition in anaerobic granular sludge for the generation of volatile fatty acids from CO2 and zero valent iron[J]. Frontiers in Energy Research, 8: 37. |
Shi J, Xu C, Han Y, et al. 2019. Enhanced anaerobic biodegradation efficiency and mechanism of quinoline, pyridine, and indole in coal gasification wastewater[J]. Chemical Engineering Journal, 361: 1019-1029. DOI:10.1016/j.cej.2018.12.162 |
Su C, Lin X, Zheng P, et al. 2019. Effect of cephalexin after heterogeneous Fenton-like pretreatment on the performance of anaerobic granular sludge and activated sludge[J]. Chemosphere, 235: 84-95. DOI:10.1016/j.chemosphere.2019.06.136 |
Wang W, Wang S, Zhang J, et al. 2016. Degradation kinetics of pentachlorophenol and changes in anaerobic microbial community with different dosing modes of co-substrate and zero-valent iron[J]. International Biodeterioration & Biodegradation, 113: 126-133. |
Wang Z, Zhang B, Borthwick A G L, et al. 2015. Utilization of single-chamber microbial fuel cells as renewable power sources for electrochemical degradation of nitrogen-containing organic compounds[J]. Chemical Engineering Journal, 280: 99-105. DOI:10.1016/j.cej.2015.06.012 |
Wu D, Zheng S, Ding A, et al. 2015. Performance of a zero valent iron-based anaerobic system in swine wastewater treatment[J]. Journal of Hazardous Materials, 286: 1-6. DOI:10.1016/j.jhazmat.2014.12.029 |
Wu M, Xu X, Lu K, et al. 2019. Effects of the presence of nanoscale zero-valent iron on the degradation of polychlorinated biphenyls and total organic carbon by sediment microbial fuel cell[J]. Science of the Total Environmental, 656: 39-44. DOI:10.1016/j.scitotenv.2018.11.326 |
Xu W, Zhao H, Cao H, et al. 2020. New insights of enhanced anaerobic degradation of refractory pollutants in coking wastewater: Role of zero-valent iron in metagenomic functions[J]. Bioresource Technology, 300: 122667. |
Yu Q, Zhang Y. 2019. Fouling-resistant biofilter of an anaerobic electrochemical membrane reactor[J]. Nature Communications, 10(1): 4860. DOI:10.1038/s41467-019-12838-7 |
Zhang C. 2010. Electricity production from and biodegradation of quinoline in the microbial fuel cell[J]. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering, 2(45): 250-256. |
Zhang Q, Cao J, Wu Y, et al. 2020. Shifts of microbial community and metabolic function during food wastes and waste activated sludge co-fermentation in semi-continuous-flow reactors: Effects of fermentation substrate and zero-valent iron[J]. Bioresource Technology, 313: 123686. DOI:10.1016/j.biortech.2020.123686 |
Zhang X, Jing J, Zhang L, et al. 2019. Biodegradation characteristics and genomic functional analysis of indole-degrading bacterial strain Acinetobacter sp. JW[J]. Journal of Chemical Technology & Biotechnology, 94(4): 1114-1122. |
Zhao B H, Sun Q, Chen J, et al. 2020. 17 beta-estradiol biodegradation by anaerobic granular sludge: Effect of iron sources[J]. Scientific Reports, 10(1): 7777. |
Zhen G, Lu X, Li Y Y, et al. 2015. Influence of zero valent scrap iron (ZVSI) supply on methane production from waste activated sludge[J]. Chemical Engineering Journal, 263: 461-470. |
Zhu L, Jin J, Lin H, et al. 2015. Succession of microbial community and enhanced mechanism of a ZVI-based anaerobic granular sludge process treating chloronitrobenzenes wastewater[J]. Journal of Hazardous Materials, 285: 157-166. |
Zhu L, Lin H Z, Qi J Q, et al. 2012. Effect of H2 on reductive transformation of p-ClNB in a combined ZVI-anaerobic sludge system[J]. Water Research, 46(19): 6291-6299. |
 2021, Vol. 41
2021, Vol. 41


