2. 山东省淡水水产遗传育种重点实验室, 济南 250117
2. Shandong Provincial Key Laboratory of Freshwater Genetics and Breeding, Jinan 250117
草鱼(Ctenopharyngodon idellus)是我国重要的淡水经济鱼类之一, 具有食性简单、产量高等特点, 池塘养殖一直是草鱼最主要的养殖方式, 在我国淡水池塘养殖中占有重要地位(中国农业部渔业局, 2010).然而, 近年来随着高密度集约化养殖的发展, 草鱼池塘环境有机污染严重, 水体富营养化程度加剧, 蓝藻水华暴发频繁.水华发生后, 藻细胞死亡分解污染水质而造成鱼类大量死亡;释放的藻毒素对鱼类产生毒害并残留在鱼体进而威胁人类的食品安全.为此, 防治蓝藻水华成为当前草鱼池塘养殖水体调控的关键技术之一.
溶解性有机质(Dissolved Organic Matter, DOM)广泛存在于各类水生环境, 主要来源于动植物体、残饵等固相颗粒有机质的分解, 在水生态系统营养盐循环和富营养化过程中发挥着关键作用(Nixon, 1995;朱金杰等, 2020).而在水华发生池塘, 蓝藻作为有机质载体大量存在, 藻细胞消亡分解会产生大量藻源性DOM(Algae-Derived Dissolved Organic Matter, A-DOM), 可直接增加水体有机污染负荷(姚昕等, 2014;刘新等, 2017).被释放的A-DOM作为溶解有机碳贮藏库含有丰富的碳(C)、氮(N)、磷(P)等生源要素, 其可通过自然光降解作用缓慢产生各类营养盐直接供藻细胞吸收利用进而促进水华的持续发展.因此, 探讨水体A-DOM的快速利用途径对于降低池塘水体富营养化程度及水华发生机率等具有重要意义.
微生物在自然界物质循环和能量流动中扮演着重要角色, 同样, 它们在(溶解性)有机质分解矿化过程中发挥着重要作用.例如, 养殖环境有机质的累积会导致氨化细菌数量的剧增(Yoram et al., 2003);养殖池中加入碳水化合物能明显增加异养细菌的数量(Ram et al., 1982);养殖过程中的细菌呼吸量随养殖时间渐增, 且细菌能在厌氧条件下通过矿化有机质促进磷酸盐的释放(Ahmed et al., 2005;Beatriz et al., 2006).然而以往类似研究多集中探讨单一菌种或单一类菌群的生物降解作用.近年来, 因分子生物学实验技术的快速发展, 细菌群落成为微生物生态学领域研究的热点.有关细菌群落对溶解有机质的降解研究已见报道(Young et al., 2004;姚昕等, 2014;谭丽菊等, 2016), 但基本侧重于不同DOM的组分变化, 对于细菌群落的有机污染修复能力及伴随的群落演替变化缺少系统而深入的研究.
此外, 环境微生物降解修复作用的强弱与群落自身整体的代谢能力密切相关, 且群落的代谢功能特征及其变化往往能够真实反映环境(修复)的状况及发展趋势(陈法霖等, 2011;Li et al., 2016).因此, 微生物群落代谢功能多样性是细菌群落研究的重点之一.一直以来, BIOLOG-ECO平板是研究微生物群落代谢功能特征的常用技术, 其通过测定微生物对31种碳源的利用程度差异来表征其功能多样性, 进而分析群落在空间或时间尺度上的变化(Li et al., 2016).紫外-可见光谱技术是目前表征DOM特性的重要手段之一, 其根据DOM在不同波长范围内的吸光度及单位浓度的溶解有机碳(DOC)在相应波长处的吸收系数等来反映DOM的组分含量、腐殖化程度及分子量大小等(刘堰杨等, 2018;张欢等, 2019).
基于此, 本研究拟以蓝藻水华发生草鱼养殖池塘为背景, 采用BIOLOG-ECO和紫外-可见光谱技术, 探讨水体细菌群落对蓝藻源溶解性有机质(A-DOM)的降解利用能力及伴随的群落碳代谢功能特征的变化, 以期为分析细菌群落与A-DOM之间的相互作用机理及今后养殖水体及其他环境水域蓝藻水华的监测防治等工作提供一定的理论依据.
2 材料与方法(Materials and methods) 2.1 藻水采集实验采样地为山东省德州市齐河县的1个草鱼养殖池塘(36°26′40″N, 116°47′30″E).于2019年6月下旬水华暴发时期采集含蓝藻水样20 L, 经300目网绢过滤(以除掉绝大部分浮游动物)后装入无菌玻璃器皿, 冷藏带回实验室.
2.2 A-DOM的提取水样经离心(8000 r·min-1, 5 min)获得藻浆;将藻浆用超纯水洗净后置入50 mL离心管中并加入25 mL超纯水混匀, 用超声波细胞粉碎机(Biosafer 900-92)超声10 min, 再放入液氮中快速冷冻, 再解冻, 重复2遍, 将蓝藻细胞打破, 最后将溶液经0.22 μm滤膜过滤获得A-DOM储备液.取适量储备液用0.9%生理盐水稀释至一定体积, 调pH(8.82, 与原位池塘水一致), 分装于1 L锥形瓶中高压灭菌(121 ℃、20 min)后备用.本次实验培养液体积为800 mL·瓶-1, pH为8.86.
2.3 细菌群落的分离、接种及培养细菌群落的分离、接种按照Young等(2004)的方法进行.水样依次经5 μm、1.2 μm微孔滤膜过滤以去掉蓝藻细胞、原生动物等, 然后以10000 r·min-1离心30 min后去掉上清液获得细菌群落接种物, 再加入10 mL灭菌生理盐水重悬作为接种液备用, 最终以水样的离心体积与培养液体积之比来衡量细菌群落的接种密度.通过优化培养条件发现, 细菌群落接种原位浓度(水样离心体积∶培养液体积=1∶1, 血球计数板显微计数为5.2×107 cells·mL-1)、培养液DOM质量浓度(以溶解性有机碳计)为60 mg·L-1(约为原位池水浓度的10倍)时降解效果最佳、用时最短.本次实验共分为2个处理组(实验组(Bacterial group, B), 即加菌处理;对照组(control, C), 即不加菌处理), 每个处理设3次重复, 接种后将培养瓶置于(28±1) ℃、50 r·min-1摇床上振荡培养, 于一定时间取样测定培养液A-DOM的紫外-可见光谱特征、水质状况、细菌群落的生长及代谢功能多样性.根据前期预实验结果, 本文选择每隔6 h取样, 实验持续72 h;最后根据A-DOM的降解情况, 选取0、12、36、60 h时的数据用于分析.
2.4 A-DOM的紫外-可见光谱测定样品先经0.22 μm针孔滤膜过滤以去除细菌干扰;然后采用紫外可见分光光度计(Varian Cary-100)进行扫描, 配以1 cm石英比色皿, 光谱扫描范围为230~500 nm, 间隔1 nm, 以Milli-Q水做参比, 获得各水样光吸收曲线(刘堰杨等, 2018).
2.5 水质因子测定水质理化因子指标主要包括pH、溶解性有机碳(DOC)、总氮(TN)、总磷(TP)、氨态氮(NH4+)、亚硝酸盐氮(NO2-)、硝酸盐氮(NO3-)和磷酸盐(PO43-).pH采用pH酸度计直接读数;DOC采用紫外吸收光谱法测定(UVA254), 用邻苯二甲酸氢钾标准储备液稀释梯度配制标准曲线作为对照(罗小三等, 2007);TN、TP均采用过硫酸钾(K2S2O8)氧化法测定(扈传昱等, 1999;HJ 636—2012);NH4+、NO2-、NO3-和PO43-均采用离子色谱仪(Dionex ICS-90, 戴安, 美国)进行测定, 用相应的标准储备液稀释梯度配制标准曲线作为对照.
2.6 细菌群落的生长及其功能多样性测定采用光电比浊法, 取一定时间的培养液测定600 nm下的吸光度值(OD600), 确定细菌群落的生长状况(陈金春等, 2005).
采用BIOLOG-ECO板(Biolog Inc. Hayward, C.A., USA)分析细菌群落的功能特征.ECO板上含有31种碳源, 具体可划分为六大类:聚合物(4种)、糖类(10种)、羧酸(7种)、氨基酸(6种)、酚(2种)、胺(2种)(陈法霖等, 2011).实验操作步骤如下:取适量培养液用无菌水10倍梯度稀释至10-3(根据ECO板的接种浓度要求, 使每个样品悬液里的细菌数量控制在104 cells·mL-1), 然后取150 μL稀释液接种至ECO板的每个孔中, 对照孔加入相同量的无菌水, 接种后将板置于28 ℃恒温培养72 h, 然后用酶标仪(Biotek Elx800)分别在590和750 nm下测定光密度值.所获数据用于计算细菌对不同类型碳源的利用能力、群落代谢功能多样性指数、主成分分析(Principle Component Analysis, PCA)和冗余分析(Redundancy Analysis, RDA).
2.7 数据分析光吸收系数α(280)用于表征A-DOM的相对含量(张欢等, 2019), 计算公式如下:
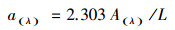
|
(1) |
式中, α(λ)为波长λ处的吸收系数(m-1);A(λ)为波长λ处经过校正的吸光度值(即已扣除700 nm处的吸光度值);L为光程路径(m).
E2/E3为250 nm和365 nm处的吸光度之比, 用于表征A-DOM的分子量大小.由于大分子的DOM在长波长处具有强光吸收, E2/E3比值与DOM的分子量大小成反比(He et al., 2008;刘堰杨等, 2018).
SUVA254为254 nm处的光吸收系数与DOC浓度之比, 计算公式见式(2).SUVA254用于表征A-DOM的芳香性和腐殖化程度, 该值越大, 表示A-DOM芳香性和腐殖化程度越高(Peng et al., 2015).

|
(2) |
平均颜色变化率(Average Well Color Development, AWCD)是反映微生物碳源利用能力的指标, 其计算公式为(闫法军等, 2014):

|
(3) |
式中, Ci为第i个碳源孔的光密度值;R为对照孔的光密度值;n为碳源种数, 取值分别为4(聚合物)、10(糖类)、7(羧酸)、6(氨基酸)、2(酚)、2(胺).
细菌群落代谢功能多样性指数包括McIntosh指数(U)、Shannon-Wiener指数(H')和Simpson指数(D), 其计算方法分别如下所示(马克平等, 1994;闫法军等, 2014):
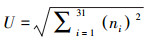
|
(4) |
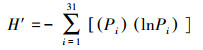
|
(5) |

|
(6) |
式中, 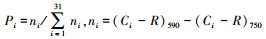
应用主成分分析(PCA)确定不同样品间细菌群落碳代谢功能特征的差异性并获得显著变化的相关碳源, 应用One-way ANOVA方差分析确定不同样品间紫外光谱特征参数、水质因子、碳源利用强度及代谢多样性指数的差异性, 应用Pearson相关性分析确定各环境变量(包括紫外光谱特征参数、水质因子)及多样性指数之间的相关关系, 上述分析均采用SPSS 17.0软件进行, 其中, 相关性分析结果通过采用HemI windows 1.0软件绘制Heatmap图呈现.应用冗余分析(RDA)探讨影响细菌群落功能特征变化的主要环境变量, RDA分析采用CANOCO 4.5软件包完成, 先对环境变量进行预选(Forward Selection), 并检验各环境变量贡献率的显著性(蒙特卡洛置换检验, Monte Carlo Permutation Test, 499次), 最后选取具有显著贡献的环境变量应用CanoDraw软件绘制RDA图.数据显著性水平确定为p < 0.05.
3 结果(Results) 3.1 A-DOM的紫外光谱吸收曲线变化选取0、12、36、60 h(B0、B12、B36、B60)样品考察细菌群落对A-DOM的降解状况(图 1).结果显示, 所有样品的吸收曲线均随波长增加而逐渐降低, 在230~300 nm紫外波段处吸光度最大, 之后波段吸收曲线变化不大, 这与公认的DOM光吸收特征基本符合.各吸收曲线在240~280 nm处均有明显的吸收峰出现, 但比较发现, 其在不同样品之间差异明显, 以B0峰最大, B12次之, B36和B60最小(二者基本吻合).这说明细菌群落对A-DOM起到了明显的降解作用, 其中, 在前期(0~12 h)降解程度最大, 中期(12~36 h)次之, 后期(36~60 h)降解程度很小.总体来看, 图 1显示了一个完整、清晰的菌群降解A-DOM的历程.
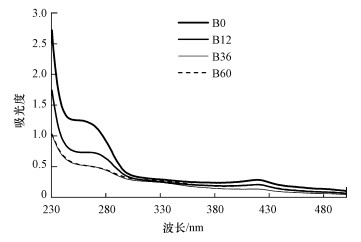 |
| 图 1 草鱼池塘水体细菌群落降解A-DOM过程中紫外光谱吸收曲线的变化 (培养期间对照组吸收曲线变化甚微, 同B0) Fig. 1 Changes in UV-Vis absorption spectra curves during the degradation of algae-derived dissolved organic matter (A-DOM) by bacterial communities from water of grass carp Ctenopharyngodon idellus cultural pond (The absorption spectrum in the control was similar to B0 and did not change throughout the experiment) |
对不同降解时间(0、12、36、60 h)水样的紫外特征参数(α(280)、E2/E3、SUVA254)进行单因素方差分析, 结果见表 1.结果显示, 与对照组相比, 实验组各紫外特征参数均产生了显著变化(p < 0.05), α(280)在0~36 h内逐渐降低, 之后趋于稳定;E2/E3在整个降解时间内呈显著降低趋势;SUVA254在12、36、60 h时均显著高于对照, 但12~60 h之间变化不大.这些说明降解过程中A-DOM的相对含量越来越少、分子量逐渐增大、芳香性程度变大.
| 表 1 草鱼池塘水体细菌群落降解A-DOM的紫外-可见光参数的变化 Table 1 Characteristics of UV-Vis spectrum indices during the degradation of algae-derived dissolved organic matter (A-DOM) by bacterial communities associated with water of grass carp Ctenopharyngodon idellus cultural pond |
对不同降解时间(0、12、36、60 h)水样的理化因子(DOC、TN、TP、NH4+、NO2-、NO3-、PO43-、pH)进行单因素方差分析, 结果见表 2.结果显示, 实验组各因子指标均具有显著变化(p < 0.05), 在降解时间内DOC、TN、TP、NO3-和PO43-浓度均有不同程度的降低, 而NH4+、NO2-浓度呈显著升高的变化趋势, 其中, NO2-浓度在降解末期又恢复至初始水平;pH在12 h时显著降低, 之后有所升高并趋于稳定, 但整个降解过程中pH均显著低于初始值.对照组水质因子仅NH4+发生了显著变化, 但变化与实验组恰恰相反.这些说明细菌群落在降解A-DOM过程中对水体理化性质产生了显著的影响.
| 表 2 草鱼池塘水体细菌群落降解A-DOM过程中水体理化因子的变化 Table 2 Physiochemical properties of the water in grass carp Ctenopharyngodon idellus cultural pond during the degradation of algae-derived dissolved organic matter (A-DOM) by bacterial culture |
A-DOM降解过程中, 细菌群落的生长密度总体呈现先升高后降低的变化趋势(图 2a), 其中, 0~12 h(B0~B12)为快速指数生长期, 12~36 h(B12~B36)为稳定期, 36~60 h(B36~B60)逐渐衰亡, 与典型的“S”型细菌生长曲线基本相似.
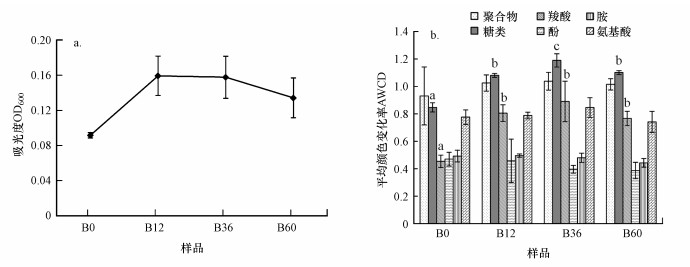 |
| 图 2 草鱼池塘水体A-DOM降解过程中细菌群落的生长(a)及其利用不同类型碳源的能力(b) (以平均颜色变化率的变化表征, 图中同类型数据不同上标字母表示数据之间有显著差异(p < 0.05)) Fig. 2 Variations of microbial growth (a) and average well color development (AWCD) in different types of carbon sources (b) utilized by bacterial communities during the degradation of algae-derived dissolved organic matter (A-DOM) from water of grass carp Ctenopharyngodon idellus cultural pond |
考察降解过程中细菌群落对六大类碳源的利用情况(图 2b), 发现细菌群落仅对糖类和羧酸类碳源的利用能力发生了显著变化(p < 0.05).其中对糖类的利用能力以B36最强, 显著高于其他样品;B12、B60之间差异不大, 但均显著高于B0.对羧酸类的利用以B36、B12、B60三者均显著高于B0(p < 0.05).总体来看, 细菌群落碳源利用能力在0~36 h逐渐升高, 之后降低, 其变化趋势与群落生长曲线基本相似.
3.5 A-DOM降解过程中细菌群落碳源利用的PCA分析A-DOM降解过程中细菌群落对31种碳源利用的主成分分析结果见图 3.结果表明:主成分PC1、PC2分别解释了53.01%、12.74%的碳源信息, 解释量大;从样品点的分布来看, 细菌群落的碳源利用方式在降解过程中发生了显著变化, 比较发现, 其主要表现在B0、B12与B36之间, 即主要发生于降解前、中期(0~36 h).
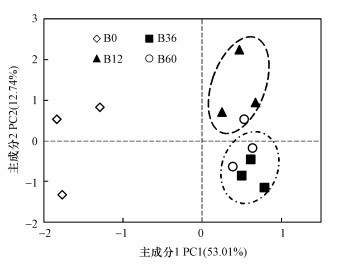 |
| 图 3 草鱼池塘水体A-DOM降解过程中细菌群落碳源利用随时间变化的主成分分析 Fig. 3 Principal components analysis (PCA) of temporal variations of carbon utilization profiles during the degradation of algae-derived dissolved organic matter (A-DOM) by bacterial communities associated with grass carp Ctenopharyngodon idellus cultural pond water |
与PC1、PC2显著相关的碳源信息见表 3, 发现共有23种碳源与主成分显著相关.其中, 与PC1显著相关的碳源有20种, 分别属于聚合物(2种)、糖类(6种)、羧酸(5种)、氨基酸(3种)、酚(2种)、胺(2种), 这些碳源使不同降解时期的细菌群落碳代谢功能多样性在PC1上差异明显;与PC2显著相关的碳源主要有3种, 分别属于羧酸(1种)、氨基酸(2种), 说明有3种碳源使不同时期细菌群落碳代谢多样性在PC2上差异显著.
| 表 3 与主成分1、2显著相关的碳源(取r>0.6) Table 3 Substrates significantly correlated with PC1 and PC2 in PCA |
图 4显示了细菌群落在降解A-DOM过程中碳代谢多样性指数的变化, 包括Shannon、Simpson和McIntosh指数.结果表明, 各多样性指数均发生了显著变化(p < 0.05), 基本呈现先增大后减小的变化趋势.Shannon指数在12 h时(B12)达到峰值, 显著高于0 h时(B0, p < 0.05), 之后呈降低趋势但变化不大(p>0.05);Simpson指数的变化与Shannon指数基本一致;McIntosh指数在0~36 h(B0、B12、B36)呈显著增大趋势, 至60 h(B60)又降低至12 h(B12)水平(p < 0.05).
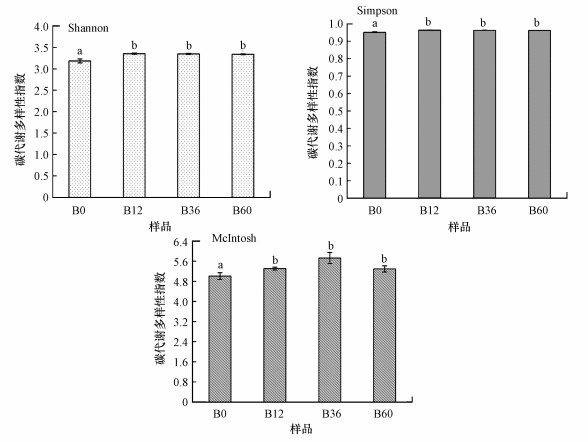 |
| 图 4 草鱼池塘水体A-DOM降解过程中细菌群落碳代谢多样性指数的变化 (图中不同上标字母表示数据之间有显著差异(p < 0.05)) Fig. 4 Metabolic diversity indices of bacterial communities during the degradation of algae-derived dissolved organic matter (A-DOM) associated with water of grass carp Ctenopharyngodon idellus cultural pond |
图 5为A-DOM降解过程中各种环境变量(包括光特征参数与水体理化因子)及群落碳代谢多样性指数之间的相关性分析Heatmap图.结果发现, 除NO2-外, 各环境变量之间均具有显著的相关性, 如α(280)、E2/E3、DOC、TP、NO3-、PO43-(p < 0.05);pH仅与SUVA254、DOC、TN、TP、PO43-显著相关.各多样性指数之间密切相关, 并与绝大多数环境变量呈显著相关关系, 而McIntosh指数与Shannon(Simpson)指数之间有所差异, 具体表现在McIntosh指数与pH、TN、SUVA254、E2/E3之间相关性不强, 而Shannon(Simpson)指数与NO2-、NH4+无显著相关性.总体来看, 细菌群落对A-DOM的降解利用与其代谢多样性的变化密切相关.
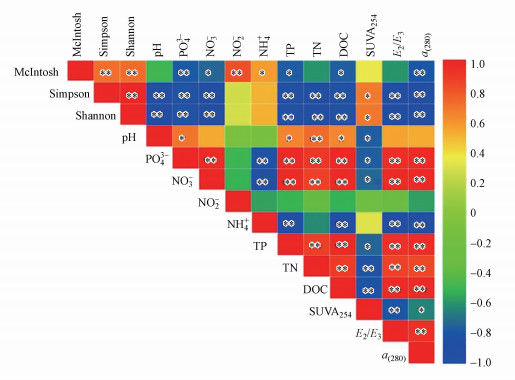 |
| 图 5 草鱼池塘水体细菌群落降解A-DOM过程中各环境变量及碳代谢多样性指数之间的相关性Heatmap图 (*表示p < 0.05, **表示p < 0.01) Fig. 5 The heatmap of Pearson correlation analysis among each environmental factors (including UV-Vis spectrum indices and water physiochemical properties) and metabolic diversity indices during the degradation of algae-derived dissolved organic matter (A-DOM) by bacterial communities associated with water of grass carp Ctenopharyngodon idellus cultural pond |
为所有环境变量(图 5)与细菌群落功能特征(包括对糖类、羧酸类和表 3中23种碳源的利用及碳代谢多样性指数)在不同样品之间的RDA分析.结果显示, DOC和pH为显著影响因子, 对整个细菌群落的功能特征起重要影响作用, 它们共同解释了69.8%的群落功能多样性信息, 其中, DOC解释率为57.0% (p=0.004, F=13.35), pH解释率为12.8%(p=0.008, F=3.74).从图中可以发现, DOC主要对L-AS(正相关)、Carboxy(负相关)、Carbohy(负相关)、D-GAL(负相关)、IA(负相关)、PAME(负相关)、D-GA(负相关)、McIntosh(负相关)等功能指标产生较高影响;pH主要对4-HA(正相关)、NADG(正相关)、PE(负相关)、L-A(负相关)、D-MA(负相关)、α-D-L(负相关)、Shannon(负相关)、Simpson(负相关)等指标产生较高影响.
4 讨论(Discussion)细菌群落与溶解性有机质相互作用研究已有所报道(Docherty et al., 2006).但DOM因来源不同, 其性质和结构存在差异, 微生物与其相互作用途径及程度亦不同(姚昕等, 2014;谭丽菊等, 2016;刘新等, 2017).本研究以草鱼养殖池塘为研究背景, 初步探讨了细菌群落对蓝藻源溶解性有机质(A-DOM)的降解代谢作用, 并分析了作用过程中群落碳代谢功能特征的变化.
4.1 细菌群落对A-DOM的降解利用本研究发现, 细菌群落对A-DOM具有明显的降解作用.例如, 与对照相比, A-DOM的紫外光谱吸收曲线在细菌群落不同培养阶段变化明显, 构成了一个完整清晰的降解历程(图 1);A-DOM的相对含量(α(280)值)随培养时间延长迅速降低(p < 0.05)(表 1).此外, 培养过程中实验组E2/E3呈显著降低的趋势, 而SUVA254明显升高, 这说明A-DOM分子量越来越大, 芳香性及腐殖化程度变大.这与Young等(2004)研究结果基本一致, 细菌代谢DOM过程中会优先选择易降解的小分子成分进行利用, 最终会剩下大分子难降解的物质.另外发现, 本研究A-DOM光谱吸收曲线特征与铜绿微囊藻不同生长阶段释放的DOM光吸收曲线极其相似(杨承虎, 2016).这一方面可能与铜绿微囊藻为本研究水华水体藻群的主要组成成员有关(数据未列出), 另一方面则说明藻类内源性DOM具有相似的光吸收特性.
水质指标的变化可表明细菌群落对A-DOM的降解利用及有机污染修复效果(表 2).如DOC、TN、TP、NO3-和PO43-浓度均有不同程度的降低, 而NH4+、NO2-浓度则呈显著升高趋势(p < 0.05), 这很可能反映了细菌群落对A-DOM中有机碳、氮、磷等营养成分的矿化作用及营养盐吸收转化过程.而矿化过程中NO3-浓度变化不同于其他氮盐, 推测可能是异养反硝化作用的结果, 同时在有机质丰富环境中微生物群落异养代谢活动旺盛且消耗大量氧气, 不利于硝化作用等自养活动的进行从而造成氨等物质的累积.根据本研究结果可推断, 自然水体中A-DOM的微生物降解与DOM一般矿化过程类似, 会产生CO2、N2等气体及大量NH4+、NO2-等还原性有毒物质, 这一方面会对养殖生物直接产生毒害, 另一方面会加速池塘水体耗氧而产生“氧债”, 这便解释了蓝藻水华池塘鱼类易浮头、死亡现象.此外, 细菌絮凝功能亦可能在A-DOM矿化过程中发挥着重要作用(邓燕宁等, 2010), 如实验中发现培养液中产生了较多絮状沉淀, 其中可能包括死亡菌体及诸多营养成分如P元素, 这可解释P作为沉积型营养素从水体环境中去除的途径.最后, 本研究发现细菌降解A-DOM过程中水体pH显著降低.这与姚昕等(2014)的研究结果一致, 认为藻源性DOM本身是弱碱性物质, 细菌对其降解会降低其溶液的pH值.因此, 在防治养殖池塘藻类水华时, 应在减少各种营养物质输入前提下, 适当稳定池水pH以有利于微生物群落对环境A-DOM的持续代谢利用, 减少藻类繁殖营养供给, 同时要加快水体NH4+、NO2-等有毒物质的转化输出, 如开设增氧机、施加硝化细菌等自养微生物制剂等, 以减轻对养殖对象的危害.
细菌对有机质的分解矿化过程必然伴随着细菌的生长(谭丽菊等, 2016).本研究发现, 细菌群落的生长在0~12 h为指数生长期, 12~36 h进入稳定期, 之后开始衰亡, 这与A-DOM的降解历程基本对应(图 1、图 2a).这说明细菌群落对A-DOM的降解利用促进了细菌细胞生长繁殖进而可大大提高群落丰度, 特别是在降解前期各类营养物质丰富时.
4.2 A-DOM降解过程中细菌群落功能特征变化及其主要影响因子微生物群落功能特征变化可通过其碳代谢活性的大小来表征, 具体可通过AWCD反映出来, 其值越高, 微生物代谢活性也就越高(江玉立等, 2018).本研究中细菌群落碳代谢能力具有明显的时间性变化, 尤其是对糖类和羧酸类的利用, 在0~36 h显著升高, 之后有所减弱(图 2b), 这初步反映了细菌群落在降解A-DOM过程中功能特征的变动, 同时据此推测, A-DOM的降解可能会释放出大量的糖类和羧酸类物质, 或者A-DOM本身可能含有诸多易降解的糖类和羧酸类成分, 从而提高了群落对此两类碳源的代谢强度.对31种碳源利用的主成分分析(图 3)充分证实, 降解过程中细菌群落碳代谢方式存在显著变化, 且主要发生在降解前、中期(B0、B12、B36).多样性指数可反映群落对碳源代谢的多样性状况, 包括丰富度和均匀度, 如Shannon与Simpson指数均是反映丰富度(碳源利用种数)和均匀度(不同碳源利用程度的无差别性)的综合指标, 而McIntosh指数用于估算群落对所有碳源的利用程度(与均匀度无关), 利用程度大的其McIntosh指数就高(Magurran, 1988;闫法军等, 2014).本研究发现, 降解过程中Shannon和Simpson指数在12 h即达到峰值, 而McIntosh指数在36 h时最大.这可能是因为群落对A-DOM的降解会逐渐形成一些优势种群, 它们的生长导致群落碳源代谢的丰富度或均匀度降低(Shannon、Simpson指数变小), 但同时也大大提高了对某些碳源的利用(图 2b), 继而导致McIntosh指数滞后升高的结果.尽管存在上述不同, 各多样性指数总体上呈现出先增大后减小的相似变化趋势并彼此显著相关(图 4、图 5).另外发现, 群落碳代谢特征变化与细菌群落生长曲线基本吻合(图 2a), 表明细菌的代谢活动与其生长息息相关.这也说明A-DOM生物降解过程中, 前期可利用营养物质丰富从而可明显提高细菌群落整体代谢活性及代谢多样性, 而后期可利用营养物质变少, 群落代谢活性及多样性随之减弱.因此, 水体环境中A-DOM含量变得丰富时很可能会引起细菌群落碳代谢特征发生上述变化, 反之, 群落的这些变化也为预防养殖池塘藻类水华提供了参考途径.
微生物群落代谢功能特征往往是其生境状况的反映, 与环境理化因子相互限制影响(夏品华等, 2015).如本研究中细菌群落碳代谢多样性指数变化与A-DOM降解光特征参数具有很强的相关性(图 5), 从而表明菌群与A-DOM的相互作用过程.降解过程中发现各环境因子(个别除外)之间亦密切相关(图 5), 这说明细菌降解对各环境因子产生了基本一致或完全相反的作用影响.但冗余分析结果表明(图 6), DOC和pH为主要影响因子, 二者不可被替代, 对整个细菌群落的功能特征影响巨大.与α(280)不同, DOC浓度用来表征DOM的实际绝对含量(李璐璐等, 2014;李帅东等, 2017);另一方面, 水生环境中DOC的产生及被利用情况受微生物群落结构和代谢活性的影响, 同时也反映了DOM的生消过程.因此, 本研究结果进一步证明了A-DOM生物降解过程中其含量对微生物群落代谢功能的重要影响.而除了碳、氮、磷等生源要素, pH亦是微生物重要的生长因子之一, 因此, 其可通过促进或抑制某些微生物的生长繁殖进而来影响群落的整体代谢活性.
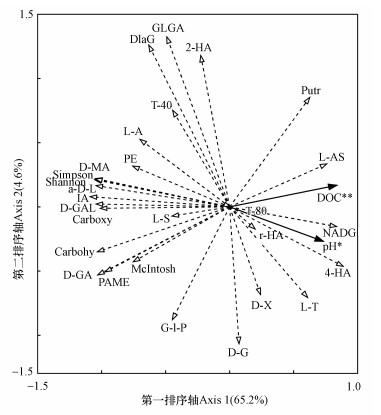 |
| 图 6 草鱼池塘水体A-DOM降解过程中细菌群落碳源利用与环境变量随时间变化的RDA分析 (图中Carbohy、Carboxy分别代表细菌群落对糖类和羧酸类的利用;T-40、NADG、D-GAL等分别代表对吐温40、N-乙酰-D-葡萄胺、D-半乳糖内酯等23种单一碳源(表 3)的利用;“*”表示p < 0.05, “**”表示p < 0.01) Fig. 6 Redundancy analysis (RDA) of temporal variations of carbon utilization profiles of bacterial communities with environmental parameters during the degradation of algae-derived dissolved organic matter (A-DOM) associated with water of grass carp Ctenopharyngodon idellus cultural pond |
此外, 微生物的代谢生长及消亡往往导致群落结构组成的变化, 因此, 生物降解过程中细菌群落功能的变化与群落结构组成的变动亦息息相关(Blanchet et al., 2015).而关于草鱼池塘水体A-DOM降解过程中群落结构的具体变化以及不同菌群接种物对降解及群落代谢功能的影响有待于今后进一步研究.另一方面, 池塘养殖环境水华发生的根本原因是水体富营养化程度的加深, 与其他水域水华的发生因素并无本质区别, 因此, 本研究亦可为其他环境水体微生物群落对A-DOM的代谢作用研究提供一定参考依据.
5 结论(Conclusions)1) 草鱼池塘水体细菌群落对A-DOM具有明显的降解作用;降解过程中A-DOM紫外光谱吸收曲线变化明显(主要表现在240~280 nm处吸光度), A-DOM的含量逐渐降低, 分子量大小和芳香性程度逐渐增大.
2) 细菌群落对A-DOM的降解类似于有机质的一般矿化作用, 降解过程中群落对水体绝大部分营养盐具有较好的利用去除效果, 但会导致有毒物质NH4+、NO2-的累积及水体pH值的降低.
3) 细菌群落降解A-DOM过程中群落的碳代谢特征会发生明显的变化, 主要表现在对糖类和羧酸类碳源的利用能力方面, 且这些变化与细菌群落的生长及对A-DOM的降解息息相关, 并主要受水体A-DOM含量及pH的影响.
Ahmed H A, Naim U. 2005. Bacterial diversity of tilapia (Oreochromisniloticus) cultured inbrackish water in Saudi Arabia[J]. Aquaculture, 250(3/4): 566-572. |
Beatriz T B, Marc V, Eva K, et al. 2006. Decomposition of high protein aquaculture feed under variable oxic conditions[J]. Water Research, 40(7): 1341-1350. DOI:10.1016/j.watres.2006.01.015 |
Blanchet M, Pringault O, Bouvy M, et al. 2015. Changes in bacterial community metabolism and composition during the degradation of dissolved organic matter from the jellyfish Aurelia aurita in a Mediterranean coastal lagoon[J]. Environmental Science and Pollution Research, 22(18): 13638-13653. DOI:10.1007/s11356-014-3848-x |
陈法霖, 郑华, 阳柏苏, 等. 2011. 中亚热带几种针、阔叶树种凋落物混合分解对土壤微生物群落碳代谢多样性的影响[J]. 生态学报, 31(11): 3027-3035. |
陈金春, 陈国强. 2005. 微生物学实验指导[M]. 北京: 清华大学出版社, 36-38.
|
邓燕宁, 刘丛强, 连宾. 2010. 细菌絮凝剂与沸石对模拟重金属废水的吸附作用[J]. 地球与环境, 38(2): 198-201. |
Docherty K M, Young K C, Maurice P A, et al. 2006. Dissolved organic matter concentration and quality influences upon structure and function of freshwater microbial communities[J]. Microbial Ecology, 52(3): 378-388. DOI:10.1007/s00248-006-9089-x |
He M C, Shi Y H, Lin C Y. 2008. Characterization of humic acids extracted from the sediments of the various rivers and lakes in China[J]. Journal of Environmental Sciences, 20(11): 1294-1299. DOI:10.1016/S1001-0742(08)62224-X |
环境保护部. 2012. HJ 636-2012. 水质总氮的测定. 碱性过硫酸钾消解紫外分光光度法[S]. 北京: 中华人民共和国环境保护部
|
扈传昱, 王正芳, 吕海燕. 1999. 海水和海洋沉积物中总磷的测定[J]. 海洋环境科学, 18(3): 48-52. DOI:10.3969/j.issn.1007-6336.1999.03.010 |
江玉立, 黄志涛, 宋协法, 等. 2018. 好氧反硝化反应器中微生物群落的碳代谢特征[J]. 海洋与湖沼, 49(2): 331-339. |
Li L, Liu M, Li Y, et al. 2016. Changes in dissolved organic matter composition and metabolic diversity of bacterial community during the degradation of organic matter in swine effluent[J]. Environmental Science and Pollution Research, 23: 13498-13507. DOI:10.1007/s11356-016-6536-1 |
李璐璐, 江韬, 闫金龙, 等. 2014. 三峡库区典型消落带土壤及沉积物中溶解性有机质(DOM)的紫外-可见光谱特征[J]. 环境科学, 35(3): 933-941. |
李帅东, 张明礼, 杨浩, 等. 2017. 昆明松华坝库区表层土壤溶解性有机质(DOM)的光谱特性[J]. 光谱学与光谱分析, 37(4): 1183-1188. |
刘新, 王友权, 徐华成, 等. 2017. 富营养化湖泊藻型及草型区微生物群落对有色可溶有机物组成的影响[J]. 生态环境学报, 26(8): 1403-1409. |
刘堰杨, 秦纪洪, 孙辉. 2018. 川西高海拔河流中溶解性有机质(DOM)紫外-可见光吸收光谱特征[J]. 环境科学学报, 38(9): 3662-3671. |
罗小三, 仓龙, 郝秀珍, 等. 2007. 原位土壤溶液采样及可溶性有机碳(DOC)的紫外吸收光谱直接测定探讨[J]. 土壤, 39(6): 943-947. DOI:10.3321/j.issn:0253-9829.2007.06.020 |
马克平, 刘玉明. 1994. 生物群落多样性的测度方法Ⅱ: α多样性的测度方法[J]. 生物多样性, 2(4): 231-239. DOI:10.3321/j.issn:1005-0094.1994.04.009 |
Magurran A E. 1988. Ecological Diversity and Its Measurement[M]. Princeton: Princeton University Press, 34-59.
|
Nixon S W. 1995. Coastal marine eutrophication: A definition, social causes, and future concerns[J]. Ophelia, 41(1): 199-219. DOI:10.1080/00785236.1995.10422044 |
Peng J, Ren Z, Song Y, et al. 2015. Impact of spring flooding on DOM characterization in a small watershed of the Hun River, China[J]. Environmental Earth Sciences, 73: 5131-5140. DOI:10.1007/s12665-015-4248-3 |
Ram N M, Zur O, Avnimelech Y. 1982. Microbial changes occurring at the sediment-water interface in an intensively stocked and fed fish pond[J]. Aquaculture, 27: 63-72. DOI:10.1016/0044-8486(82)90110-7 |
谭丽菊, 肖慧, Carlson C A. 2016. 海水中天然细菌对不同生源要素有机物的矿化作用[J]. 生态学报, 36(1): 77-85. |
夏品华, 寇永珍, 喻理飞. 2015. 喀斯特高原退化湿地草海土壤微生物群落碳源代谢活性研究[J]. 环境科学学报, 35(8): 2549-2555. |
闫法军, 田相利, 董双林, 等. 2014. 刺参养殖池塘水体微生物群落功能多样性的季节变化[J]. 应用生态学报, 25(5): 1499-1505. |
杨承虎. 2016. 光谱法研究藻类内源性DOM特性及对其与多环芳烃结合行为的影响[D]. 厦门: 厦门大学
|
姚昕, 张运林, 朱广伟, 等. 2014. 湖泊草、藻来源溶解性有机质及其微生物降解的差异[J]. 环境科学学报, 34(3): 688-694. |
Yoram A, Gad R. 2003. Shrimp and fish pond soils: process and management[J]. Aquaculture, 220(1/4): 549-567. |
Young K C, Maurice P A, Docherty K M, et al. 2004. Bacterial degradation of dissolved organicmatter from two northern Michigan streams[J]. Geomicrobiology Journal, 21: 521-528. DOI:10.1080/01490450490888208 |
张欢, 崔康平, 张强, 等. 2019. 派河水体中DOM的光谱分析及其来源分析[J]. 环境科学研究, 32(2): 227-234. |
中国农业部渔业局. 2010. 中国渔业统计年鉴2010[M]. 北京: 中国农业出版社.
|
朱金杰, 邹楠, 钟寰, 等. 2020. 富营养化巢湖沉积物溶解性有机质光谱时空分布特征及其环境意义[J]. 环境科学学报, 40(7): 2528-2538. |
 2021, Vol. 41
2021, Vol. 41


