2. 山西大学环境与资源学院, 太原 030006
2. College of Environment and Resource, Shanxi University, Taiyuan 030006
砷(As)是自然界广泛存在的环境污染物, 人体砷暴露的主要途径之一是饮用含砷水.据不完全统计, 目前全球约有105个国家和地区的饮用水砷含量超过世界卫生组织规定的限值(≤10 μg · L-1), 饮水砷超标威胁着2亿多居民的健康(Marchiset-Ferlay et al., 2012;Chakraborti et al., 2017).流行病学及毒理学实验结果表明, 长期饮用高砷水会增加心血管系统、呼吸系统、生殖系统及消化系统等多系统器官的功能和结构异常的风险, 还可能诱发肺癌、肝癌、肾癌和前列腺癌等(Naujokas et al., 2013;Rao et al., 2017).由于污染范围广、潜在危害大, 长期慢性砷暴露是世界范围内一个严重的公共卫生问题(O'Bryant et al., 2011).
砷作为一种常见的环境毒物, 其毒性作用受到各界广泛关注, 砷的价态、接触剂量和暴露途径等是影响其毒性的几个决定因素, 而其致毒机制尚未完全阐明, 但现有研究认为氧化应激是导致砷中毒的主要作用机制之一(Hughes et al., 2011).研究发现, 我国内蒙古地区长期饮用高砷地下水(As平均浓度0.41 mg · L-1)的人群, 血清过氧化脂质水平增高、非蛋白巯基含量降低, 提示砷摄入与机体氧化应激相关(Pi et al., 2002).基于动物模型的研究发现, 砷暴露可诱发啮齿类(小鼠或大鼠)和非啮齿类(猫、公鸡)实验动物的血液、肝脏、肺和睾丸等脏器组织细胞的氧化应激, 使相应的器官组织结构出现病理性改变, 通过外源干预提高机体抗氧化能力可抑制砷摄入诱发的氧化应激反应和组织损伤(Mishra et al., 2009;Mahfoud et al., 2012;Zhang et al., 2014;Li et al., 2015;Li et al., 2017;Zhao et al., 2018).上述结果表明, 氧化应激反应是砷暴露引发毒性损伤效应的关键, 但目前关于饮水型砷暴露危害效应的报道主要集中于流行病学调查以及特定条件下个别器官组织的毒性损伤效应, 缺乏对其毒效应的系统性研究.
为进一步系统性评价砷的毒性效应, 本研究通过建立小鼠饮水砷中毒模型, 运用毒理学实验规则检测饮水砷暴露对小鼠基础生理代谢和主要脏器的影响, 以期为砷毒性效应谱的建立提供实验依据, 同时也为(亚)慢性砷中毒的防治和早期诊断奠定理论基础.
2 材料与方法(Materials and methods) 2.1 实验动物分组、染毒与取材前期预实验发现, 饮用含砷水60 d后, 10 mg · L-1 As(由NaAsO2配制)染毒组小鼠主要脏器损伤、血液指标出现异常, 而5 mg · L-1组血液指标未发现异常.由饮水量计算实验动物的砷摄入量, 10 mg · L-1 As组小鼠日均As摄入量约为亚砷酸钠LD50(大鼠经口, 41 mg · kg-1)的1/25.因此本研究中选用含砷(As)为10 mg · L-1(由NaAsO2配制)的水溶液进行染毒.选4周龄SPF级雄性ICR小鼠20只, 体重(20±2) g, 由山西医科大学实验动物中心提供.适应性喂养1周后将小鼠按体重随机分为对照组(CK)和砷染毒组(As), 每组10只.对照组饮用蒸馏水, 染毒组饮用As含量10 mg · L-1的水溶液, 自由摄食和饮水, 饲喂由山西医科大学提供的全价颗粒饲料, 连续染毒60 d.实验期间观察小鼠日常行为、摄食饮水量和体重变化等情况并记录.
染毒结束后, 1%戊巴比妥钠麻醉小鼠, 称重、眼眶采血后解剖, 快速摘取小鼠睾丸、肾脏、肝脏、心脏、肺和小肠等主要器官, 用预冷生理盐水漂洗、粗滤纸拭干浮水后称重.取肝脏左叶边缘组织、左侧睾丸和肾脏以及肺左上叶, 用10%的中性甲醛溶液固定, 其余组织用液氮速冻, -80 ℃冻存.
2.2 组织切片的制备与观察取甲醛固定的睾丸、肾脏、肝脏和肺组织, 制备常规石蜡切片, 经苏木素-伊红(H & E)染色, 光学显微镜观察并拍照(Olympus, 日本).
2.3 血清肝功能指标和脂质含量检测将所取血液制备成血清, 采用南京建成生物工程研究所的试剂盒, 检测血清中谷草转氨酶(AST)和谷丙转氨酶(ALT)活性, 总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)含量.
2.4 组织氧化应激指标测定取-80 ℃冻存的小鼠组织, 制备成10%的组织匀浆液, 按照南京建成生物工程研究所试剂盒说明书检测其中的总超氧化物歧化酶(T-SOD)活性、过氧化氢(H2O2)、丙二醛(MDA)含量, 用DNTB比色法测定还原型谷胱甘肽(GSH)含量, 考马斯亮蓝比色法测定蛋白质含量.
2.5 数据统计分析实验结果用均值±标准误(X±SE)表示.使用IBM SPSS 24.0软件进行统计学分析, 通过t检验法比较染毒组和对照组间的差异显著性, 当p < 0.05时, 组间差异具有统计学意义, 图中用*表示.
3 结果(Results) 3.1 饮水砷暴露对小鼠一般体征和体重的影响实验期间各组小鼠活动状态良好, 摄食、饮水与排便均正常, 毛发顺畅、有光泽, 体征和行为无明显异常, 无死亡现象.染毒60 d后, 两组小鼠体重不同程度增加, 但最终体重和体重增量均无组间差异.饮水量统计结果显示, As组小鼠日均饮水量显著少于对照组(图 1).根据饮水量计算, As组小鼠日均As摄入量为1.5465 mg · kg-1(以体重(BW)计).
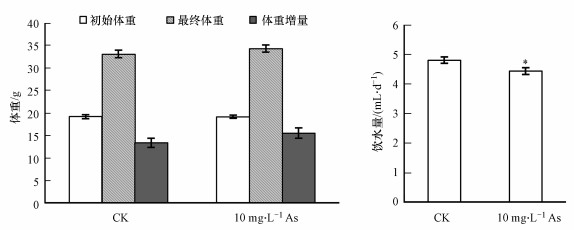 |
| 图 1 砷暴露对小鼠体重和饮水量的影响 Fig. 1 Effects of arsenic exposure on body weight and water consumption in mice |
经解剖观察未发现小鼠体内各器官颜色、相对位置和基本形态有明显异常.计算主要脏器的脏器系数发现, As组小鼠肝脏脏器系数显著降低, 心脏、肾脏、肺脏和睾丸的脏器系数降低, 但无统计学意义(图 2), 说明本文采用的饮水型砷暴露对小鼠主要脏器产生了一定的毒性作用, 引发了肝脏的萎缩.
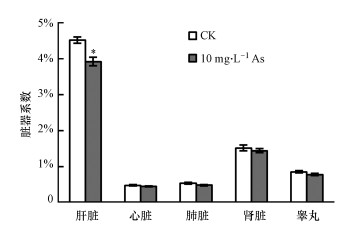 |
| 图 2 砷暴露对小鼠脏器系数的影响 Fig. 2 Effects of arsenic exposure on organ coefficient in mice |
基于砷暴露对小鼠肝脏脏器系数的影响, 本研究检测了肝功能生化指标.结果发现, As组小鼠的AST和ALT活性显著升高(图 3), 说明饮水砷暴露会导致小鼠肝脏功能受损.
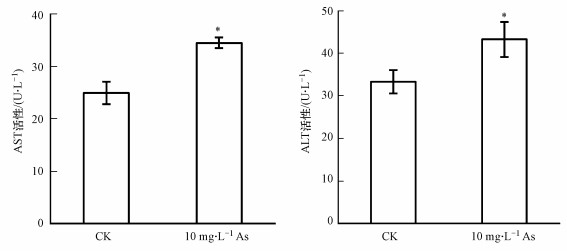 |
| 图 3 砷暴露对小鼠血清肝功能生化指标的影响 Fig. 3 Effects of arsenic exposure on biochemical indices of serum liver function in mice |
肝脏是脂质代谢的主要场所, 肝脏损伤有可能干扰机体脂代谢.检测血清中4种脂质含量发现, As组小鼠的TC和TG含量显著升高, HDL-C含量显著降低, LDL-C含量显著升高(图 4), 说明饮水砷暴露会导致小鼠机体脂代谢紊乱, 引起血脂水平异常.
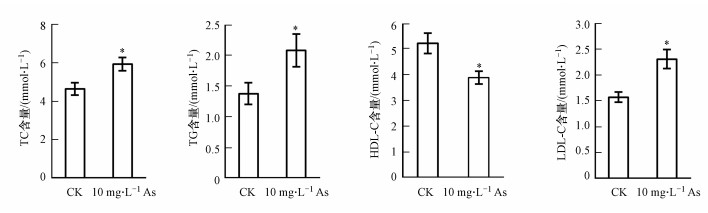 |
| 图 4 砷暴露对小鼠血脂含量的影响 Fig. 4 Effects of arsenic exposure on serum lipid levels in mice |
小鼠肝脏、小肠、心脏、肺脏、肾脏和睾丸组织中GSH含量和总SOD活性不同, As组小鼠GSH含量和T-SOD活性均显著下降(图 5).GSH含量降幅为:小肠、肺、心脏>肾>肝>睾丸, 其中小肠和肺的下降幅度较大, 分别为32.73%和32.17%;T-SOD活性降幅排序为:肝>睾丸、肾、小肠>肺, 肝组织T-SOD活性下降最为明显, 降幅为32.45%.As组小鼠肝脏、小肠、心脏、肺、肾和睾丸组织中的MDA和H2O2含量均显著升高, 其中, 心脏组织的MDA含量增幅最大, 为116.83%, 其他组织的MDA含量增幅为32.74%~74.49%;H2O2含量小肠组织增幅最大, 达95.95%, 其次为睾丸(72.41%)、肺脏(45.88%), 肝和肾的增幅在21%左右, 心脏增幅最低, 为15.87%.由此可见, 饮水砷暴露可导致小鼠多器官组织氧化应激, 引发多系统脏器的氧化损伤效应, 不同脏器对砷摄入的敏感性存在一定差异.
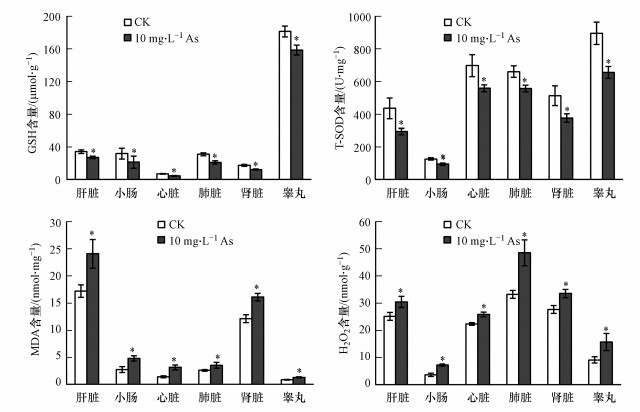 |
| 图 5 砷暴露对小鼠不同脏器氧化应激指标的影响 Fig. 5 Effects of arsenic exposure on oxidative stress indexes in various tissues of mice |
对照组小鼠肝组织中细胞以中央静脉为轴心呈放射状有序排列, 肝细胞核大而圆, 组织结构无明显异常(图 6Ⅰ A);As组肝细胞排列紊乱, 伴有炎性细胞浸润、肝窦充血以及胞浆稀疏、淡染等病理学改变(图 6Ⅱ A).
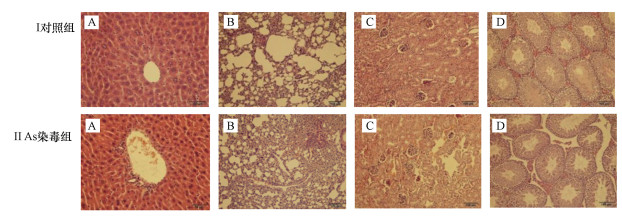 |
| 图 6 砷暴露对小鼠主要脏器组织结构的影响 (A.肝脏, B.肺脏, C.肾脏, D.睾丸) Fig. 6 Effects of arsenic exposure on the tissue structure of mice |
对照组小鼠肺泡结构清晰, 肺泡囊相对较大, 肺泡壁厚度正常, 未见明显异常(图 6Ⅰ B);As组小鼠肺泡囊明显缩小, 肺泡隔普遍增厚, 出现炎性细胞浸润现象(图 6Ⅱ B).
3.6.3 肾脏组织形态结构对照组小鼠肾小球和肾小管形态正常、结构完整, 肾小管上皮细胞间紧密相连且排列整齐, 无明显病变(图 6Ⅰ C);As组肾小球毛细血管扩张并伴有充血, 肾小管上皮细胞部分发生空泡样变, 出现系膜增生、管腔变窄等病理学改变(图 6Ⅱ C).
3.6.4 睾丸组织形态结构对照组小鼠睾丸生精小管排列紧密, 生精细胞形态结构完整且层次分明, 各发育阶段精细胞清晰可见, 管腔内存在大量成熟精子(图 6Ⅰ D).As组小鼠睾丸生精细胞排列疏松且细胞层明显减少, 管腔内成熟精子数量明显减少, 出现支持细胞空泡化和生精小管基膜破损现象(图 6Ⅱ D).
上述结果表明, 通过饮水摄入As能引发实验动物消化系统、呼吸系统、泌尿系统和生殖系统等多系统器官的组织结构病变, 造成实验动物的全身系统性损伤效应.
4 讨论(Discussion)来自世界各地的研究报道显示, 长期饮用含砷水与居民健康的损失相关(Li et al., 2020;Flora et al., 2011).饮水砷暴露诱发的机体砷中毒是一种复杂的全身多器官、多系统损害性疾病, 但目前的研究多针对特定条件下个别器官的毒性效应, 缺乏对机体损伤的全面和系统性研究.研究人员运用体内外模型分析砷对实验动物或离体细胞的毒性效应, 但因染毒方式、剂量、时限的不同, 以及砷的价态、实验动物品系不同等因素导致不同研究者的结果间存在差异.因此, 本文通过建立饮水型砷中毒小鼠模型系统性地研究了饮水砷暴露对实验动物基础生理和多系统脏器的毒性损伤作用, 并从氧化应激角度探讨其可能的毒作用机制.
流行病学调查发现, 慢性砷暴露会导致机体糖脂代谢紊乱, 增加人群罹患糖尿病和心血管疾病等慢性病的风险(Wang et al., 2014;Renu et al., 2018).本研究中小鼠饮用含砷水60 d后血清AST和ALT活性显著升高, 说明饮水砷暴露能引发小鼠肝功能损伤.肝脏是调节机体糖、脂代谢的重要器官之一, 也是机体内源性TC、TG与HDL-C、LDL-C合成的主要场所(Wang et al., 2015), 砷暴露组上述4种血清脂质含量异常, 提示砷诱发的肝脏毒性造成了脂类的合成、分解与运输障碍, 导致过多脂类物质沉积在肝脏, 机体脂代谢紊乱.研究前期发现, C57BL/6小鼠连续饮用含砷5 mg · L-1或50 mg · L-1的水6个月后葡萄糖耐量明显受损(曾群等, 2018).由此可知, 长期饮水摄入砷会扰动实验动物糖、脂代谢, 使机体糖脂代谢紊乱, 继而累及多系统脏器, 引发多系统器官组织损伤.
砷通过饮水自消化道进入体内后由胃肠道吸收进入血液, 经血液循环分布至全身各组织器官进行代谢转化, 部分在胃肠道转化.砷摄入后不同器官组织的损伤程度不同, 与组织中砷化物积累量的差异有一定关系(Li et al., 2020), 还与特定器官组织中砷的代谢转化有关.肝脏是砷代谢的主要场所, 体内的无机砷主要在肝脏中进行氧化还原及甲基化代谢, 产生多种有机砷化物, 如一甲基砷酸盐(MMAⅤ)、二甲基砷酸盐(DMAⅤ)以及二甲基亚砷酸盐(DMAⅢ)等(Ren et al., 2011;Prakash et al., 2016), 在此过程中会产生大量活性氧(ROS), 引发组织氧化胁迫, 进而产生肝毒性(Abdulkadhar et al., 2016).肾脏是砷排泄的主要器官, 进入机体的砷大部分经肾脏由尿液排出, 砷在肾脏中的转运及含砷尿液的滞留增加了砷对肾脏的毒性作用(Gora et al., 2014).虽然存在动物品系的不同, 砷暴露剂量和时长的差异, 但已有研究结果从不同侧面反映了饮水砷暴露对机体主要器官的损伤:昆明种小鼠饮用10、50和100 mg · L-1的NaAsO2水溶液1、3和9个月后, 出现肝脏功能性和器质性改变, 肝脏氧化应激和炎性反应发生(Gao et al., 2013);Wistar大鼠连续饮用25 mg · L-1的NaAsO2水溶液6周后, 血清尿素氮和肌酐水平显著增加, 伴随着肾脏脂质过氧化产物(LPO)显著增加(Sankar et al., 2016);C57BL/6小鼠饮用含100 mg · L-1 As的水3个月后, 肺组织MDA水平显著升高, 并出现明显的炎性细胞浸润和毛细血管周围红细胞聚集(Li et al., 2017);C57BL/6雄性小鼠饮用5 mg · L-1 As水60 d可致其生殖力下降、睾丸组织病变, 睾丸MDA含量显著升高(Li et al., 2018).与上述对个别器官组织的毒性研究相比较, 本研究通过建立饮水砷中毒小鼠模型, 较为系统地检测了饮水砷摄入对实验动物的损害效应, 通过对实验小鼠的一般体征、血清生化指标、组织形态结构及氧化应激等方面的研究分析, 评价饮水砷摄入对多系统器官组织的毒性效应, 并发现砷对肝脏的损伤较其他器官更为严重.
现有研究认为, 细胞氧化还原稳态破坏引发的氧化损伤是砷毒性作用的主要机制.进入体内的砷在进行生物转化的过程中会导致超氧阴离子(O2·-)、羟基自由基(· OH)等活性氧自由基的大量产生, 增加H2O2等的累积, 使组织细胞内ROS水平升高(Jomova et al., 2011).饮水砷暴露能够激活ROS敏感的核转录因子NF-κB与STAT-3等炎症信号通路, 介导炎症反应及免疫失衡, 诱发组织损伤(吉鹏宇等, 2019;李秀娟等, 2019).砷诱发ROS升高还能破坏生物大分子如膜脂、蛋白质和DNA等, 使之氧化、断裂, 从而影响细胞的生理活性(Wu et al., 2010;Navasumrit et al., 2019).本研究中砷摄入引发了小鼠肝脏、小肠、心脏、肾脏、肺和睾丸组织的ROS升高, 使多系统器官组织MDA升高、形态结构异常, 可能与ROS激活机体炎症信号通路介导器官组织的炎症反应加剧有关, 伴随的免疫失衡则促使机体产生系统性损伤.砷摄入引发实验动物的系统性损伤可能还与ROS对细胞膜脂、DNA、蛋白质的氧化损伤有关, 通过对组织细胞的生理和结构损伤影响机体的生理过程和组织结构.此外, 砷暴露组动物器官组织的损伤还与砷的蓄积有关, 体内的砷与巯基有很高的亲和力, 可与多种重要巯基酶、GSH及非蛋白巯基结合, 破坏机体氧化还原平衡, 干扰细胞能量产生, 阻碍细胞的呼吸和正常代谢(Susan et al., 2019), 从而引发毒性.检测发现小鼠器官组织中的总砷含量与饮用水砷含量呈正相关, 但是不同器官中砷的化学态不同, 不同器官的砷含量排序在不同品系小鼠中相差悬殊(Kenyon et al., 2008;Li et al., 2020), 给量化比较带来了困难.
5 结论(Conclusions)1) 10 mg · L-1饮水砷暴露60 d能诱发小鼠全身性的氧化应激, 引发多系统器官组织(消化系统、循环系统、呼吸系统、泌尿系统与生殖系统等)的氧化胁迫和结构损伤, 使机体生理代谢紊乱、组织器官的功能和结构异常.相较于其他器官, 饮水砷暴露对肝脏的损伤更为严重.
2) ROS的大量生成、抗氧化防御系统损耗以及由此引发的组织过度炎症反应可能是砷产生毒性作用的主要机制, 由于不同组织器官中砷的代谢转化、滞留时间等不同, 各器官对ROS升高的敏感性不同, 导致砷摄入后不同组织器官的损伤程度出现差异.
3) 饮水砷摄入在引发动物全身性器官组织氧化损伤的同时, 造成了主要脏器组织形态结构的病变, 说明氧化应激反应在砷暴露致机体多系统脏器毒性损伤过程中发挥了重要作用.本研究为进一步探讨饮水砷暴露致主要脏器损伤的分子机制提供了基础实验数据.
Abdulkadhar J, Woo H, Ran L, et al. 2016. Biochanin A ameliorates arsenic-induced hepato- and hematotoxicity in rats[J]. Molecules, 21(1): 69-82. DOI:10.3390/molecules21010069 |
Chakraborti D, Rahman M M, Das B, et al. 2017. Groundwater arsenic contamination and its health effects in India[J]. Hydrogeology Journal, 25(4): 1165-1181. DOI:10.1007/s10040-017-1556-6 |
Flora S J. 2011. Arsenic-induced oxidative stress and its reversibility[J]. Free Radical Biology and Medicine, 51(2): 257-281. DOI:10.1016/j.freeradbiomed.2011.04.008 |
Gao S, Duan X, Wang X, et al. 2013. Curcumin attenuates arsenic-induced hepatic injuries and oxidative stress in experimental mice through activation of Nrf2 pathway, promotion of arsenic methylation and urinary excretion[J]. Food and Chemical Toxicology, 59: 739-747. DOI:10.1016/j.fct.2013.07.032 |
Gora R H, Kerketta P, Baxla S L, et al. 2014. Ameliorative effect of tephrosia purpurea in arsenic-induced nephrotoxicity in rats[J]. International Journal of Toxicology, 21(1): 78-83. |
Hu Y H, Wei M, Niu Q, et al. 2019. Grape seed proanthocyanidin extract alleviates arsenic-induced lung damage through NF-κB signaling[J]. Experimental Biology and Medicine (Maywood), 244(3): 213-226. DOI:10.1177/1535370219829881 |
Hughes M F, Beck B D, Chen Y, et al. 2011. Arsenic exposure and toxicology: A historical perspective[J]. Toxicological Sciences, 123(2): 305-332. DOI:10.1093/toxsci/kfr184 |
Jomova K, Jenisova Z, Feszterova M, et al. 2011. Arsenic toxicity, oxidative stress and human disease[J]. Journal of Applied Toxicology, 31(2): 95-107. |
吉鹏宇, 李秀娟, 仪慧兰. 2019. 二氧化硫加剧砷对小鼠肝脏的损伤[J]. 环境科学学报, 39(4): 1355-1360. |
Kenyon E M, Hughes M F, Adair B M, et al. 2008. Tissue distribution and urinary excretion of inorganic arsenic and its methylated metabolites in C57BL6 mice following subchronic exposure to arsenate in drinking water[J]. Toxicology and Applied Pharmacology, 232(3): 448-455. DOI:10.1016/j.taap.2008.07.018 |
Li J, Guo Y, Duan X, et al. 2020. Tissue- and region-specific accumulation of arsenic species, especially in the brain of mice, after long-term arsenite exposure in drinking water[J]. Biological Trace Element Research, 198(1): 168-176. DOI:10.1007/s12011-020-02033-x |
Li J, Zhao L, Zhang Y, et al. 2017. Imbalanced immune responses involving inflammatory molecules and immune-related pathways in the lung of acute and subchronic arsenic-exposed mice[J]. Environmental Research, 159: 381-393. DOI:10.1016/j.envres.2017.08.036 |
Li S G, Ding Y S, Niu Q, et al. 2015. Grape seed proanthocyanidin extract alleviates arsenic-induced oxidative reproductive toxicity in male mice[J]. Biomedical and Environmental Sciences, 28(4): 272-280. |
Li X J, Yi H L, Wang H. 2018. Sulphur dioxide and arsenic affect male reproduction via interfering with spermatogenesis in mice[J]. Ecotoxicology and Environmental Safety, 165: 164-173. DOI:10.1016/j.ecoenv.2018.08.109 |
李秀娟, 仪慧兰, 曾群. 2019. 砷暴露诱导小鼠空肠结构损伤和免疫紊乱[J]. 环境科学学报, 39(4): 1348-1354. |
Marchiset-Ferlay N, Savanovitch C, Sauvant-Rochat M P. 2012. What is the best biomarker to assess arsenic exposure via drinking water?[J]. Environment International, 39(1): 150-171. DOI:10.1016/j.envint.2011.07.015 |
Messarah M, Klibet F, Boumendjel A, et al. 2012. Hepatoprotective role and antioxidant capacity of selenium on arsenic-induced liver injury in rats[J]. Experimental and Toxicologic Pathology, 64(3): 167-174. DOI:10.1016/j.etp.2010.08.002 |
Naujokas M F, Anderson B, Ahsan H, et al. 2013. The broad scope of health effects from chronic arsenic exposure: update on a worldwide public health problem[J]. Environmental Health Perspectives, 121(3): 295-302. DOI:10.1289/ehp.1205875 |
Navasumrit P, Chaisatra K, Promvijit J, et al. 2019. Exposure to arsenic in utero is associated with various types of DNA damage and micronuclei in newborns: a birth cohort study[J]. Environmental Health, 18(1): 51-66. DOI:10.1186/s12940-019-0481-7 |
O'Bryant S E, Edwards M, Menon C V. 2011. Long-term low-level arsenic exposure is associated with poorer neuropsychological functioning: a project frontier study[J]. International Journal of Environmental Research and Public Health, 8(3): 861-874. DOI:10.3390/ijerph8030861 |
Pi J, Yamauchi H, Kumagai Y, et al. 2002. Evidence for induction of oxidative stress caused by chronic exposure of Chinese residents to arsenic contained in drinking water[J]. Environmental Health Perspectives, 110(4): 331-336. DOI:10.1289/ehp.02110331 |
Prakash C, Kumar V. 2016. Chronic arsenic exposure-induced oxidative stress is mediated by decreased mitochondrial biogenesis in rat liver[J]. Biological Trace Element Research, 173(1): 87-95. DOI:10.1007/s12011-016-0622-6 |
Rao C V, Pal S, Mohammed A, et al. 2017. Biological effects and epidemiological consequences of arsenic exposure, and reagents that can ameliorate arsenic damage in vivo[J]. Oncotarget, 8(34): 57605-57621. DOI:10.18632/oncotarget.17745 |
Ren X, McHale C M, Skibola C F, et al. 2011. An emerging role for epigenetic dysregulation in arsenic toxicity and carcinogenesis[J]. Environmental Health Perspectives, 119(1): 11-19. DOI:10.1289/ehp.1002114 |
Renu K, Madhyastha H, Madhyastha R, et al. 2018. Role of arsenic exposure in adipose tissue dysfunction and its possible implication in diabetes pathophysiology[J]. Toxicology Letters, 284: 86-95. DOI:10.1016/j.toxlet.2017.11.032 |
Sankar P, Telang A G, Kalaivanan R, et al. 2016. Oral nanoparticulate curcumin combating arsenic-induced oxidative damage in kidney and brain of rats[J]. Toxicology and Industrial Health, 32(3): 410-421. DOI:10.1177/0748233713498455 |
Sfaxi I, Charradi K, Limam F, et al. 2015. Grape seed and skin extract protects against arsenic trioxide induced oxidative stress in rat heart[J]. Canadian Journal of Physiology and Pharmacology, 94(2): 168-176. |
Susan A, Rajendran K, Sathyasivam K, et al. 2019. An overview of plant-based interventions to ameliorate arsenic toxicity[J]. Biomedicine and Pharmacotherapy, 109: 838-852. DOI:10.1016/j.biopha.2018.10.099 |
Wang W, Xie Z, Lin Y, et al. 2014. Association of inorganic arsenic exposure with type 2 diabetes mellitus: a Meta-analysis[J]. Epidemiology Community Health, 68(2): 176-184. DOI:10.1136/jech-2013-203114 |
Wang X, Mu X, Zhang J, et al. 2015. Serum metabolomics reveals that arsenic exposure disrupted lipid and amino acid metabolism in rats: A step forward in understanding chronic arsenic toxicity[J]. Metallomics, 7(3): 544-552. DOI:10.1039/C5MT00002E |
Wu L H, Yi H L, Yi M. 2010. Assessment of arsenic toxicity using Allium/Vicia root tip micronucleus assays[J]. Journal of Hazardous Materials, 176(1/3): 952-956. |
曾群, 仪慧兰, 黄立群, 等. 2018. 砷暴露对小鼠葡萄糖稳态的影响[J]. 环境科学学报, 38(8): 3353-3360. |
Zhang Z G, Gao L, Cheng Y Y, et al. 2014. Resveratrol, a natural antioxidant, has a protective effect on liver injury induced by inorganic arsenic exposure[J]. Biomedical Research International, 2014: 617202-617208. |
Zhao H J, Wang Y, Liu Z X, et al. 2018. Subchronic arsenism disorders mRNA expression of cytokines and immunoglobulins in the intestinal tract of the cock[J]. Biological Trace Element Research, 182(1): 111-118. DOI:10.1007/s12011-017-1073-4 |
 2021, Vol. 41
2021, Vol. 41


