2. 中国科学院生态环境研究中心, 北京 100085
2. Research Center of Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
自然界中的砷经常与有色金属(如Pb和Cu)或含贵金属(如Au)的矿物共存, 因此, 在选矿、金属冶炼及硫酸制备的过程中会产生大量呈酸性的高浓度含砷废水(Wang et al., 2014).针对这些废水, 最常用的处理方式是通过添加沉淀剂将水中的砷酸根转变成砷酸钙、砷酸铁和硫化砷等去除(Nabiyeva et al., 2019).然而该方法会产生大量的含砷废渣, 这些砷渣的尺寸通常在纳米范围内, 相对于块材的砷酸盐或硫化砷矿物而言其更容易受温度、pH值及微生物等因素的影响, 从而导致砷元素重新释放到环境中, 不但对环境产生危害, 而且还可以通过食物链影响人类的健康(魏洁群等, 2010;Liu et al., 2020).因此, 硫化砷渣的妥善处理显得尤为重要.
固化稳定化技术是处理固体废物尤其是危险废物的常用方法之一(Singh et al., 2006;Shi et al., 2015), 主要包括水泥固化(Paktunc et al., 2010)、聚合物包封(Shi et al., 2015)、玻璃固化(Shaw et al., 2008)、结晶固化(Ke et al., 2014)等.其中, 水泥、聚合物、玻璃固化都是将固体废物包裹在一种性能稳定的惰性物质中, 属于物理固化, 固化后含砷废渣的体积增大, 导致安全填埋过程中占用大量土地;另外, 包裹后的砷渣依然存在泄露的风险.而结晶固化是将有害物质以参与化学成键的方式形成具有稳定晶体结构的物质, 从而将其有效地固定.例如, Su等(2015)将含镉废渣与γ-Al2O3通过高温烧结形成具有稳定晶体结构的CdAl4O7, 稳定后的CdAl4O7晶体中镉元素的溶出浓度大大降低.
目前含砷废渣的结晶固化一般采用两步法, 首先将含砷废渣中的砷浸出再氧化成五价砷, 最终采用类似去除废水中五价砷的方法将其在水热条件下或者常压加热的条件下转化成结构稳定的物质, 如砷酸钙、臭葱石、类明矾石等.如Zhang等(2019)首先将硫化砷渣碱浸后加双氧水氧化成五价砷, 然后再引入硫酸铁和硫酸, 常压下加热到95 ℃形成臭葱石, 但浸出实验表明砷的溶出浓度依然可达3.41 mg · L-1(pH=7), 这与Abumiya等(2019)的研究结果相似;Viñals等(2010)先将砷酸钙废渣经硫酸浸渍后再经臭氧氧化, 然后利用水热法将砷酸根引入到明矾石的结构中, 其毒性浸出结果(< 0.5 mg · L-1)远小于国家危险废物毒性浸出标准(5 mg · L-1).由于该方法生成的含砷类明矾石的稳定性好, 因此, 经常被应用到废水中砷酸根的去除, 如Sunyer等(2011;2013)根据类质同象的原理利用砷酸根(AsO43-)替代钾明矾石中的部分硫酸根(SO42-)形成砷钾明矾石, 从而将水中的五价砷有效地固定在钾明矾石的晶格中, 溶出实验表明砷的浸出浓度小于0.1 mg · L-1.另外, 有研究表明(Sunyer et al., 2011), 砷钠明矾石固溶体中砷的短期浸出浓度与固溶体中砷的长期浸出浓度均为0.5 mg · L-1.由此说明通过将砷酸根有效地结合到类明矾石的结构中是一种有效的砷酸根固定方法, 其稳定性远大于臭葱石和砷酸钙.然而正如上所述, 该方法主要应用于含砷废水的处理, 关于含砷废渣的处理较少采用该方法, 因为如果将砷渣中的砷转化成更加稳定的含砷物质, 往往涉及砷渣的溶解再转化等多个步骤;另外, 砷渣的溶解通常需要在较为极端的条件(如强酸或者强碱)下完成, 这会造成后续的处理步骤更加繁琐.因此, 寻找一种简单、高效的结晶固化砷渣的方法具有重要的实际意义.
基于此, 本文选取模拟硫化砷渣作为典型的含砷废渣, 通过添加Na+、Al3+和SO42-将硫化砷渣在水热条件下一步直接转化成砷钠明矾石, 并对反应温度、时间及Al/As比等条件进行优化;同时, 评估所获得的砷钠明矾石的短期和长期稳定性;最后, 将该方法用于实际砷渣的结构转化处理, 以期为砷渣的有效固定提供借鉴.
2 实验部分(Experimental section) 2.1 材料实验材料:亚砷酸钠(NaAsO2, 纯度99%)、九水合硫化钠(Na2S · 9H2O, 纯度99%)、浓硫酸(H2SO4)、九水合硫酸钠(Na2SO4 · 9H2O)、十八水硫酸铝(Al2(SO4)3 · 18H2O)均为优级纯, 购自国药控股化学试剂有限公司.所有实验均采用去离子水, 实验均重复3次.
2.2 硫化砷的合成首先配置80 mL 0.4 mol · L-1的NaAsO2溶液和110 mL 0.42 mol · L-1的Na2S · 9H2O溶液, 然后用46%的H2SO4将NaAsO2溶液调至pH值为1, 在室温条件下, 边搅拌边滴加Na2S溶液.反应0.5 h后, 用蒸馏水洗涤离心5次后干燥, 得到黄色固体样品.
2.3 硫化砷的结构转化实验—砷钠明矾石的生成称取0.1 g模拟硫化砷于反应釜中, 加入10 mL 10%的H2O2和5 mL一定浓度(0.08~0.48 mol · L-1)的Al2(SO4)3 · 18H2O, 再加入0.371 g Na2SO4 · 9H2O固体(As/Na物质的量比为1 ∶ 3), 最终的固液比为1 ∶ 150 g · mL-1;用1 mol · L-1的H2SO4或者1 mol · L-1的NaOH调节混合液的pH至1~3, 搅拌10 min后将反应釜放入160~200 ℃的鼓风干燥箱内反应2~4 h, 自然冷却至室温, 离心分离并用蒸馏水洗涤沉淀物5次, 沉淀物在60 ℃下干燥24 h.
2.4 样品表征采用配备Cu Kα12、X射线辐射和LynxEve探测器的Bruker D8 X射线粉末衍射仪收集样品的XRD图谱, 扫描范围(2θ)为5°~90°, 步长为0.02°, 扫描速度为0.5 s · 步-1.用Quanta200型扫描电镜观察样品的微观形貌和颗粒大小.用美国尼高力仪器公司生产的FT-IR AVATAR-360型傅里叶变换光谱仪获取样品的红外谱图, 分辨率为4 cm-1, 范围为500~3800 cm-1.采用电感耦合等离子体质谱(ICP-MS)测定溶液中砷的浓度.
2.5 毒性浸出实验在pH=1~11范围内, 对砷钠明矾石进行短期浸出毒性测试, 采用稀释的H2SO4或NaOH溶液配置不同pH值的浸出液.在烧杯中加入0.5 g固体样品和10 mL浸出液, 使液固比(L/S)为20 L · kg-1, 然后在25 ℃恒温振荡器中振荡18 h, 最终用0.22 μm滤头进行过滤, 收集上清液, 采用ICP-MS测定上清液中砷的浓度.砷钠明矾石的长期浸出实验(90 d)参照《HJ/T 300—2007固体废物浸出毒性浸出方法醋酸缓冲溶液法》标准, 选取醋酸缓冲溶液为浸出液, 浸出液配置如下:将5.7 mL冰醋酸溶入500 mL去离子水中, 再加入64.3 mL 1 mol · L-1的NaOH溶液, 最后定容至1 L, 用1 mol · L-1 HNO3或1 mol · L-1 NaOH调至pH为4.93左右.浸出实验及测试步骤同上.
3 结果与讨论(Results and discussion) 3.1 硫化砷的表征图 1给出了合成的硫化砷的XRD及SEM图.由图 1a可以看出, 在2θ=18.392°、33.153°、54.582°处有衍射峰, 峰位与PDF(01-071-2435) 卡片大致相符, 说明合成的样品是硫化砷;另外, 衍射峰的强度低说明合成的硫化砷的结晶度不高;由谢乐公式可得其粒径约为50 nm.由图 1b可以看出, 合成的硫化砷为纳米颗粒的团聚体.为了比较纳米颗粒状和块材的硫化砷的溶出性能, 本研究将合成的硫化砷在200 ℃下水热反应10 h, 水热后的产物记作As2S3-H.图 1c给出了As2S3-H的XRD图, 可以看出水热后的样品的衍射峰与雌黄晶体的PDF(01-071-2435)卡片完全一致, 高强度的衍射峰说明水热后的硫化砷的结晶度大大提高, 且水热后硫化砷的形貌由纳米颗粒团聚体变成了尺寸约为40 μm的微球(图 1d).水热处理前后硫化砷中的砷浸出浓度分别为大于600 mg · L-1和25 mg · L-1, 由此可见无定形的硫化砷更易二次溶出砷, 而工业上通过沉淀法处理含砷废水所获得的硫化砷的结晶度普遍不高, 因此, 本研究选取无定形的硫化砷进行结构转化实验.
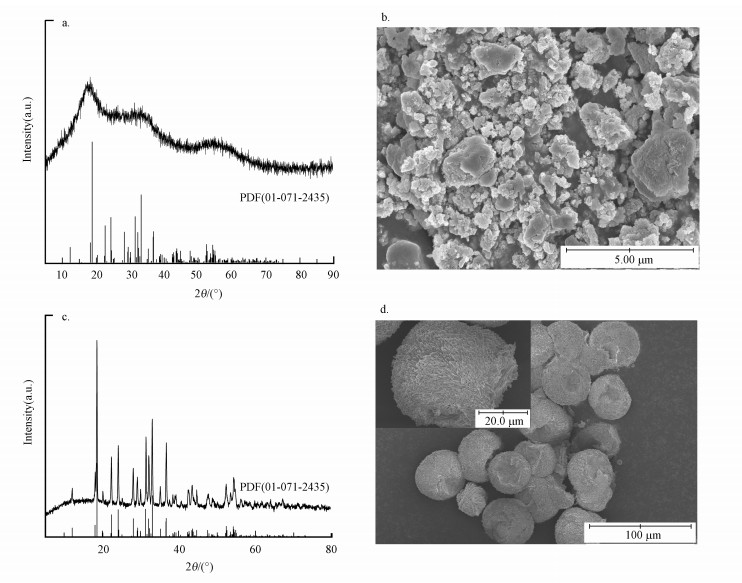 |
| 图 1 合成的硫化砷的XRD图(a)和SEM图(b) 及水热后的硫化砷(As2S3-H)的XRD图(c)和SEM图(d) Fig. 1 XRD pattern (a) and SEM image (b) of the synthesized arsenic sulfide and XRD pattern (c) and SEM image (d) of the arsenic sulfide (As2S3-H) after hydrothermal treatment |
本文首先探索了温度对结构转化过程的影响, 为此将Al/As物质的量比固定为3 ∶ 1, pH设为2, 反应时间定为2 h.图 2给出了产物的XRD和SEM图.由图 2a可以看出, 在180 ℃和200 ℃下获得的产物的衍射峰与钠明矾石PDF(00-041-1467)卡片一致, 说明所获得的产物的结构与钠明矾石相同, 均为四方晶系, 同时高强度的衍射峰说明其结晶度较高.由于砷酸根(AsO43-)和钠明矾石结构中的硫酸根(SO42-)之间存在类质同象取代(Zhu et al., 2019;Zhu et al., 2019), 且替代量在一定范围内, 钠明矾石的结构不会发生明显改变, 因此, 推断结构转化后所产生的水热产物可能是砷钠明矾石.然而对于160 ℃下的产物, 除了砷钠明矾石的衍射峰外还在2θ为18.5°处出现衍射峰, 经过比对分析及之后的SEM图推断其为未完全反应的硫化砷.
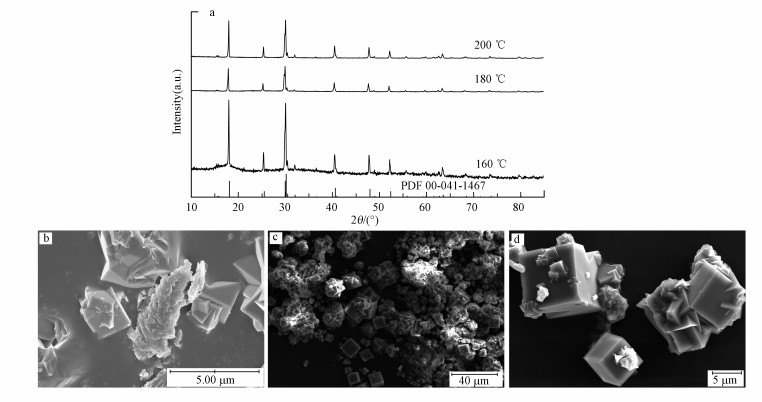 |
| 图 2 不同水热温度下产物的XRD图(a)和SEM图(b.160 ℃, c.180 ℃, d.200 ℃) Fig. 2 XRD patterns (a) and SEM images of the products at 160 ℃(b), 180 ℃(c) and 200 ℃(d) |
由图 2a~2c可以看出, 160~200 ℃下均可以生成立方块状的砷钠明矾石, 在160 ℃下还发现有未反应的硫化砷聚集体存在, 此时砷钠明矾石的颗粒较小, 约2.5 μm;随着水热温度的提高, 大粒径的砷钠明矾石越来越多, 且表面越来越光滑, 200 ℃下生成的砷钠明矾石结构完整, 颗粒大小约20~30 μm.由此可以看出, 温度对砷钠明矾石的结晶度和尺寸有较大影响.为了获得结晶度高的砷钠明矾石, 本研究选取水热温度200 ℃进行以下实验.
3.2.2 反应时间的影响图 3给出了硫化砷结构转化处理不同反应时间后产物的XRD和SEM图.由图 3a可以看出, 水热处理1~4 h后产物的XRD图与PDF(00-041-1467)卡片一致, 表明此条件下均可以形成砷钠明矾石.由SEM图可以看出, 砷钠明矾石为规则的立方体形状, 反应1 h后大部分砷钠明矾石结构不够完整, 以小的立方块相互交叉状为主(图 3b);当反应时间延长到2 h, 小的立方块逐渐长大且棱角分明, 显露面更加光滑(图 3c);当水热时间继续延长, 形貌没有明显的改善提高.因此, 本研究选取水热时间为2 h.
 |
| 图 3 不同反应时间后产物的XRD图(a)和SEM图(b.1 h, c.2 h, d.3 h, e.4 h) Fig. 3 XRD patterns (a) and SEM images of the products at 1 h (b), 2 h (c), 3 h (d) and 4 h (e) |
图 4为不同pH值下产物的XRD和SEM图.由XRD图(图 4a)可知, 在pH=1和2时只有砷钠明矾石存在, 且pH=2时砷钠明矾石的峰型更高且尖锐, 说明此时砷钠明矾石的结晶度较高;在pH值为3时, XRD图中不仅出现了砷钠明矾石的衍射峰, 在2θ为16.25°、20.35°、22.37°、28.87°处也出现衍射峰, 经比对其与砷铝石一致(PDF:00-005-0226), 说明在pH=3时开始形成砷铝石.图 4b~4e所示为不同pH下沉淀物的形貌, pH=1时, 砷钠明矾石为小的立方块聚集体(图 4b);pH=2时, 砷钠明矾石呈较大粒径的立方块, 且表面光滑(图 4c);然而当pH=3时, 除了较大粒径的砷钠明矾石外, 还有砷铝石的存在(图 4d中箭头所示), 砷铝石的形貌为棱柱形(图 4e).Berre等(2007)研究表明, 砷铝石的稳定性较差不适于长期储存.因此, 本研究选取pH值为2进行下一步的实验.
 |
| 图 4 不同pH值下水热产物的XRD图(a)和SEM图(b.pH=1, c.pH=2, d.pH=3) 及砷铝石的SEM图(e) Fig. 4 XRD patterns (a) and SEM images of the products at different pH values(pH=1, c.pH=2, d.pH=3) and SEM image of arsenic diaspore (e) |
图 5给出了不同Al/As物质的量比时水热产物的XRD和SEM图.从XRD图可以看出(图 5a), 当Al/As比在2 ∶ 1~6 ∶ 1范围内, 不同晶面的特征峰与标准PDF(00-041-1467)卡片一致, 并未见杂质峰, 确定沉淀物为砷钠明矾石, 由此说明掺入一定量的砷酸根到钠明矾石的结构中并不会改变钠明矾石的基本结构, 因此, 沉淀产物的外观形貌依然为立方体形状(图 5b~5e).当Al/As比为1 ∶ 1时, XRD图中出现砷铝石的衍射峰, 同时从SEM图中可以看出产物为立方块状的砷钠明矾石和棱柱形的砷铝石两相(图 5b).由于砷铝石的长期稳定性欠佳, 本文研究了Al/As比为6 ∶ 1~2 ∶ 1时砷钠明矾石中砷的质量分数.图 5f给出了不同Al/As比时获得的砷钠明矾石的红外谱图, 可以看出, 随着Al/As比的减小(6 ∶ 1~2 ∶ 1), 在870~950 cm-1范围内AsO43-吸收峰逐渐增强, 说明砷酸根的取代率逐渐增大.此外, 本文也利用ICP-MS测量了不同Al/As比(6 ∶ 1~2 ∶ 1)条件下形成的砷钠明矾石中砷的含量, 结果表明, 随着体系中铝含量的增大, 砷钠明矾石中砷的质量分数从2.86%降低到1.20%, 但固砷率变化不大, 最低为29.3%(Al/As=2 ∶ 1)而最高为35.3%(Al/As=3 ∶ 1).但由XRD分析可知, 当Al/As比为1 ∶ 1时会生成砷铝石, 因此, 基于固砷率且为了保证反应的充分进行, 本研究选定Al/As物质的量比为3 ∶ 1, 此时砷钠明矾石中砷的质量分数达到2.52%.
 |
| 图 5 不同的Al/As比下产物的XRD图(a)和SEM图(b.Al/As=1 ∶ 1, c.Al/As=2 ∶ 1, d. Al/As=3 ∶ 1, e.Al/As=4 ∶ 1)和不同Al/As比下产物的红外光谱图(f)(实验条件:pH=2, 水热温度200℃, 反应时间为2h) Fig. 5 XRD patterns (a) and SEM images of the products at different Al/As ratio (b.Al/As=1, c.Al/As=2, d.Al/As=3, e.Al/As=4) and FTIR of the hydrothermal products under different aluminum-arsenic molar ratios (pH=2, T=200℃, t=2 h)(f) |
值得注意的是, 在该反应体系下, 硫化砷中的S2-在双氧水的氧化作用下被氧化成单质硫, 且反应后漂浮在液体上方, 易于分离回收, 从而在实现砷酸根的有效转化的同时回收高纯度的单质硫, 副产物单质硫的XRD、SEM图及元素分布情况如图 6所示.从XRD图可以看出(图 6a), 获得的产物的衍射峰与单质硫的PDF(01-085-0799)卡片一致, 说明所获得的产物确实为硫单质, 由元素分布和EDS数据可以看出(图 6b), 硫单质的纯度大于90%, 证明该方法可以为硫化砷渣的资源化提供新的思路.
 |
| 图 6 水热副产物硫单质的XRD图(a) 及SEM图和EDS图(b) Fig. 6 XRD pattern (a) and SEM and EDS images (b) of the by-product sulfur |
本文提供了一种将硫化砷渣通过结构转化进行稳定化处理的同时回收单质硫的方法.由于水热过程的氧化性条件是通过添加适量双氧水来提供, 因此在水热过程中, 过氧化氢在高温下分解成氧气和水, 氧气将砷渣中溶出的硫离子、三价砷分别被氧化成单质硫和五价砷;然后利用砷酸根(AsO43-)与钠明矾石结构中的硫酸根(SO42-)之间的类质同象原理, 部分取代钠明矾石(NaAl3(SO4)2(OH)6)中SO42-的位置, 从而形成砷钠明矾石固溶体(NaAl3(SO4)2-x(AsO4)x(OH)6), 最终实现硫化砷渣的结构转化.涉及到的方程式如下:

|
(1) |

|
(2) |
图 7a给出了砷钠明矾石在不同pH浸出液中砷的浸出浓度.从图中可以看出, 当浸出液pH为1时, 浸出液中砷的浓度为0.5 mg · L-1;当浸出液pH为2~11时, 浸出液中砷的浓度小于0.05 mg · L-1;当浸出液pH大于11时, 浸出液中砷的浓度大于5 mg · L-1, 此时砷钠明矾石固溶体开始缓慢溶解.由此可以看出, 砷钠明矾石在较宽的pH范围(1~11)内都具有优越的短期稳定性.参照《HJ/T 300—2007固体废物浸出毒性浸出方法醋酸缓冲溶液法》的标准, 砷钠明矾石浸渍14 d后浸出液中砷的浓度为0.04 mg · L-1, 90 d后浸出液中砷的浓度为0.05 mg · L-1(图 7b), 由此说明砷钠明矾石的长期稳定性较高.长、短期稳定性实验结果表明, 利用外加Na+、Al3+和SO42-与硫化砷在氧化性环境中通过水热处理一步形成砷钠明矾石是一种可行、高效的稳定硫化砷的方法.
 |
| 图 7 砷钠明矾石固溶体中砷的浸出浓度随pH值的变化图(短期稳定性评估)(a)和硫化砷及砷钠明矾石在pH=4.93的醋酸缓冲溶液浸渍90 d后砷的浸出浓度(长期稳定性评估)(b) Fig. 7 The relationship between the leached As concentration and pH value of leachate (a) and the leached As concentration for arsenic sulfide and arsenical natroalunite in acetic acid buffer solution (pH=4.93) after 90 days (b) |
本研究利用实际砷渣评估此方法的普适性, 两种实际砷渣(河南某砷渣HN-ASR和福建某砷渣FJ-ASR)主要含有As、S、O、Cu和Al几种元素.图 8给出了实际砷渣水热处理前后的SEM图及处理前后的浸出实验结果, 可以看出原来的砷渣(HN-ASR和FJ-ASR)为纳米颗粒的聚集体, 而水热处理后砷渣(HN-Natroalunite和FJ-Natroalunite)转化为立方块状, 这与模拟硫化砷的实验结果相似.由处理前后砷渣的浸出实验结果可以看出, 两种实际砷渣中砷的浸出浓度均大于400 mg · L-1, 而水热处理后砷渣中砷的浸出浓度均小于0.1 mg · L-1.说明该方法可以有效地处理实际砷渣, 而且既实现了硫化砷渣的结构转化还获得了副产物单质硫, 为硫化砷渣的稳定化及资源化提供了一种可行的方法.
 |
| 图 8 两种实际砷渣的SEM图(a.HN-ASR;b.FJ-ASR;c.HN-Natroalunite;d.FJ-Natroalunite) 及处理前后浸出液中砷的浓度(e) Fig. 8 SEM images of actual arsenic slag before and after treatment(a.HN-ASR, b.FJ-ASR, c.HN-Natroalunite, d.FJ-Natroalunite) and the leached As concentration before and after treatment of actual arsenic slag(e) |
本文通过固定As/Na物质的量比为1 ∶ 1, 调控Al/As物质的量比, 在氧化性环境中通过水热(200 ℃, 2 h)处理将硫化砷通过一步法直接转化成砷钠明矾石, 当pH为2及Al/As=3 ∶ 1时硫化砷可以一步转化成砷钠明矾石, 此时砷钠明矾石中砷的质量分数达到2.52%.砷酸根可通过类质同象原理部分替代钠明矾石中的SO42-.短期和长期稳定性实验表明, 砷钠明矾石中砷的浸出浓度远远低于国家关于危险废物的鉴别标准中的限值(5 mg · L-1).实际砷渣的有效处理表明该方法是一种简单、高效的通过结构转化处理硫化砷渣的方法.
Abumiya M, Mikami H, Sato Y, et al. 2012. Method of processing non-ferrous smelting intermediates containing arsenic[P]. US8092765, 2012-10-1
|
Berre L, Cheng T C, Gauvin R, et al. 2007. Hydrothermal synthesis and stability evaluation of mansfieldite in comparison to scorodite[J]. Canadian Metallurgical Quarterly, 46(1): 1-9. DOI:10.1179/cmq.2007.46.1.1 |
Bruggeman K, Paktunc D. 2010. Solubility of nanocrystalline scorodite and amorphous ferric arsenate: Implications for stabilization of arsenic in mine wastes[J]. Applied Geochemistry, 25(5): 674-683. DOI:10.1016/j.apgeochem.2010.01.021 |
Chai L Y, Min X B, Ke Y, et al. 2014. Sulfidation of heavy-metal-containing neutralization sludge using zinc leaching residue as the sulfur source for metal recovery and stabilization[J]. Minerals Engineering, 61: 105-112. DOI:10.1016/j.mineng.2014.03.022 |
Chai L, Liang Y, Shi M, et al. 2015. Raman and FTIR spectra of modified iron phosphate glasses containing arsenic[J]. Journal of Molecular Structure, 1081: 389-394. DOI:10.1016/j.molstruc.2014.10.061 |
Chuang K H, Liao C, Su M, et al. 2015. Cadmium stabilization efficiency and leachability by CdAl4O7 monoclinic structure[J]. Environmental Science & Technology, 49(24): 14452-14459. |
Currubi M, Sunyer A, Viñals J. 2013. Arsenic immobilization as alunite-type phases: The arsenate substitution in alunite and hydronium alunite[J]. Journal of the Hazardous Materials, 261: 559-569. |
Fathordoobadi S, Shaw J K, Zelinski B J, et al. 2008. Stabilization of arsenic-bearing solid residuals in polymeric matrices[J]. Journal of Hazardous Materials, 152(3): 1115-1121. DOI:10.1016/j.jhazmat.2007.07.106 |
Geng L A, Ying S B, et al. 2020. Soil pollution characteristics and systemic environmental risk assessment of a large-scale arsenic slag contaminated site[J]. Journal of Cleaner Production, 251: 119721. DOI:10.1016/j.jclepro.2019.119721 |
Jiang Z N, Zhu Y N, et al. 2019. Arsenic immobilization from aqueous solution by the precipitation of the pseudo-octahedral arsenate-substituted natroalunite solid solutions[J]. Science of the Total Environment, 669: 754-766. DOI:10.1016/j.scitotenv.2019.03.137 |
Kulenova N A, Nabiyeva A A, et al. 2019. Studying kinetics of arsenic recovery from copper dross by alkaline sulfide leaching[C]. Materials Science Forum, 946: 547-551
|
Luo H, Wang C, Zhang Z, et al. 2014. Removal of As(Ⅲ) and As(Ⅴ) from aqueous solutions using nanoscale zero valent iron-reduced graphite oxide modified composites[J]. Journal of Hazardous Materials, 268: 124-131. DOI:10.1016/j.jhazmat.2014.01.009 |
Molera P, Viñals J, Sunyer A, et al. 2010. Arsenic stabilization of calcium arsenate waste by hydrothermal precipitation of arsenical natroalunite[J]. Hydrometallurgy, 104(2): 247-259. |
Pant K K, Singh T S. 2006. Solidification/stabilization of arsenic containing solid wastes using portland cement, fly ash and polymeric materials[J]. Journal of Hazardous Materials, 131(1/3): 29-36. |
Sunyer A, Viñals J. 2011. Arsenate substitution in natroalunite: A potential medium for arsenic immobilization.Part 1:Synthesis and compositions[J]. Hydrometallurgy, 109(1/2): 54-64. |
Viñals J, Sunyer A. 2011. Arsenate substitution in natroalunite: A potential medium for arsenic immobilization.Part 2:Cell parameters and stability tests[J]. Hydrometallurgy, 109(1/2): 106-115. |
魏洁群. 2010. 新疆奎屯高砷区深井水水质和改水后当地居民健康状况调查研究[D]. 乌鲁木齐: 新疆医科大学
|
Xuan H L, Zhu Y N, et al. 2019. Dissolution and solubility of the synthetic natroalunite and the arsenic-incorporated natroalunite at pH of 2.00~5.60 and 25~45℃[J]. Journal of Chemistry: 9568360. |
Yuan Z, Zhang G, Zhang D, et al. 2019. Fate of adsorbed arsenic during early stage sulfidization of nano-ferrihydrite[J]. Environmental Science: Nano, 6: 2228-2240. DOI:10.1039/C9EN00436J |
 2021, Vol. 41
2021, Vol. 41


