近年来, 基于逆电渗析(Reverse Electro-Dialysis, RED)法的低品位热直接发电技术的提出(Zhu et al., 2015; Hu et al., 2018; Hu et al., 2019a), 为实现“以废治废”这一目标提供了借鉴.其基本工作原理是:通过热分离方法先将低品位热能转换为工作溶液的浓差(化学势)能, 然后利用RED电堆将工作溶液浓差能转换成电能(徐士鸣等, 2015;2018b;吴曦等, 2019).若将循环系统中的RED电堆更换为RED反应器, 则可实现“废热治理废水”的目的.
目前, 对于利用RED反应器处理各类废水的研究非常少.Scialdone等(2014; 2015)采用RED反应器对含Cr(VI)电镀污水和印染污水处理进行了实验研究, 结果表明, 处理15 min后, 浓度为25 mg·L-1的Cr(VI)电镀废水毒性可完全脱除;而处理30 min后, 酸性橙印染废水的脱色率可达到99%, 处理240 min后, 其TOC去除率为55%.Zhou等(2018)利用RED反应器阳极对浓度为10 mg·L-1氨氮废水处理进行了实验研究, 结果显示, 氨氮去除率最大可达到98%, 同时输出功率密度也可达到0.06 W·m-2.徐士鸣等(2018a;2020)也探究了将RED反应器用于降解酸性橙印染废水处理.
目前, 利用RED反应器处理有机废水的研究相对较少且并不全面深入, 尤其是尚未见将其用于处理甲基橙废水的报道.与外电源提供电力的高级氧化降解技术(AOPs)处理有机废水不同的是, RED反应器属于内生电源, RED反应器结构和操作参数变化均会对其工作特性产生影响.因此, 本研究考察反应器输出电流、电极液流率、pH值、亚铁离子浓度和曝气流率等操作参数变化对RED反应器阴/阳极独立回路中甲基橙废水降解效果的影响, 并探究其原因, 以期为后续开展的“废热治理废水”热力循环特性研究提供参考.
2 实验材料和方法(Materials and instruments) 2.1 RED反应器本实验所使用的RED反应器基本结构与前期研究酸性橙印染废水降解所使用的RED反应器基本相同(徐士鸣等, 2018;2019; Xu et al., 2020), 只是将新的气泡发生器设置在阴极流道下部用以生成更为细小的气泡, 以提高废水中的溶氧量, 强化阴极电芬顿(EF)反应.因此, 对RED反应器结构和工作原理仅作简单介绍.
RED反应器由阴/阳电极、交错排布的阴/阳离子交换膜及隔开阴/阳离子交换膜并构成浓/稀溶液流道的丝网隔垫, 通过两端压板夹装而成.当浓、稀工作溶液分别流经其相应的流道时, 在化学势差的作用下溶液中的阴/阳离子进行跨膜迁移, 从而在膜两侧形成膜电势(Donnan电势)(Post et al., 2008).当膜电势作用在RED反应器阴/阳电极时, 就会产生电子得/失的电化学(氧化/还原)反应.其中, 阳极发生氧化(AO)反应, 阴极发生还原(EF)反应.电极反应所得失的电子通过外电路迁移, 从而在外电路中产生电流.
在本次实验前, 对原有的RED反应器进行拆洗、还原和重新组装.离子交换膜还原过程是:将拆下的离子交换膜浸入去离子水中48 h, 每24 h更换一次去离子水, 以达到恢复离子交换膜性能的目的.RED反应器阴/阳极仍采用多孔碳毡气体扩散阴极和钛镀铱钌(DAS)阳极.
2.2 材料及仪器实验中所采用工作溶液和甲基橙模拟废水均为人工配制, 其中, 配制所需的电解质(NaCl、FeSO4、H2SO4, 分析纯级)购自天津大茂化学试剂厂, 甲基橙(纯度96%)购自上海阿拉丁试剂有限公司, 配制所需的溶剂水为RO净水器产生的去离子水.配制的浓、稀NaCl溶液(工作溶液)浓度分别为3、0.03 mol·kg-1(浓稀浓度比=100), 配制的模拟废水中含有甲基橙(浓度为100 mg·L-1)和相应的支撑电解质, 阴/阳极回路内模拟废水各为500 mL.阴阳两极电极室均为7 cm×13 cm×5 cm的腔室, 其中, 阳极采用厚度为1 mm的钛镀钌铱电极(Ti/RuO2-IrO2), 阴极采用厚度为5 mm、孔隙率约为75%的气体扩散电极.离子交换膜采用旭硝子公司生产的Selimion型离子膜, 有效面积为7 cm×11.5 cm.实验中所使用的设备和测试仪器仪表基本与文献(徐士鸣等, 2018a;2019; Xu et al., 2020)所述相同, 但本次实验增加了模拟废水COD测试(5B-3C型COD测试仪, 连华科技有限公司).
2.3 实验流程及方法图 1为RED反应器有机废水降解实验流程, 采用阴/阳极回路独立降解模式.两台蠕动泵分别将浓/稀溶液(HC/LC)以设定的0.2 cm·s-1过膜流速流经RED反应器.由两台蠕动泵分别泵送作为电极液的甲基橙模拟废水, 并在阴/阳极回路内作循环流动.为了探究操作参数对RED反应器阴/阳极回路甲基橙模拟废水降解特性的影响, 通过向阳极回路的模拟废水中添加氯盐(NaCl)用以产生间接的AO反应;向阴极回路模拟废水中添加亚铁盐(FeSO4)和稀硫酸调节pH值, 并向阴极电极流道内泵入空气以提高废水的溶氧量等手段来改变废水的操作参数.在实验过程中, 每隔4 min取一次水样, 以测取各回路内模拟废水中甲基橙脱色率和降解率随时间的变化关系.
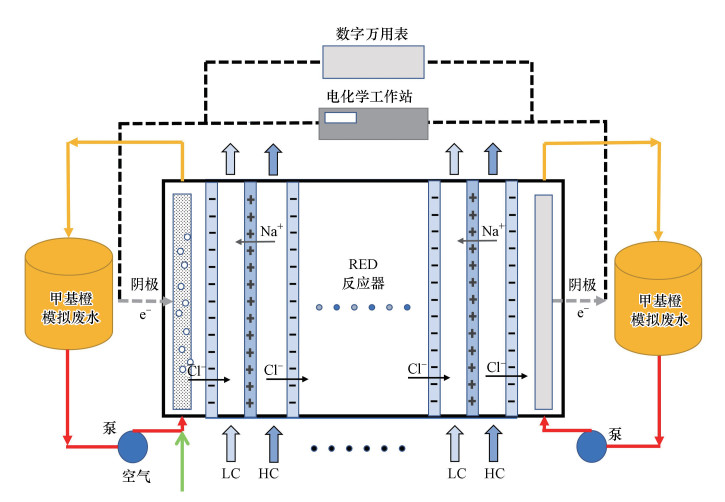 |
| 图 1 RED反应器降解甲基橙废水实验流程 Fig. 1 Working principle of RED reactor for methyl orange wastewater treatment |
采用紫外分光光度计和COD测定仪测量取样废水中的甲基橙浓度和COD值, 然后按式(1)和(2)分别计算其脱色率(RDC)和COD去除率(RCOD).
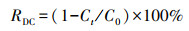
|
(1) |
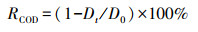
|
(2) |
式中, C0为甲基橙废水初始浓度(mg·L-1);Ct为降解反应t时间后测得的甲基橙浓度(mg·L-1);D0为甲基橙废水初始COD值(mg·L-1);Dt为降解反应t时间后测得的COD值(mg·L-1).
为了探索操作参数变化对甲基橙模拟废水降解效果的影响, 实验设定的操作参数变化范围如表 1所示.采用单因素变化法进行实验研究, 对于表 1中确定的每一个操作参数变化的实验重复3次, 取其平均值作为实际的降解效果值.3次实验数据误差由各图中的误差棒表示.
| 表 1 操作参数变化范围 Table 1 The range of operating parameters |
由于RED反应器属于内生电源, 通过外电路连接的阴/阳两极电化学反应会相互影响, 因此, 在探索操作参数变化对阳极回路甲基橙模拟降解影响时, 需固定阴极回路模拟废水操作参数(Fe2+浓度为0.1 mmol·L-1, pH值为2, 电极液流率为82 mL·min-1, 曝气流率为600 mL·min-1, 输出电流为0.25 A).
3.1.1 氯盐(Cl-)浓度的影响当有机废水中含有氯盐时, RED反应器阳极除了金属氧化物电极(DAS)表面直接氧化降解反应外, 还会产生次氯酸(HClO)间接氧化降解反应.图 2给出了氯盐浓度变化对阳极回路内甲基橙模拟废水脱色率的影响(实验条件:废水流率为82 mL·min-1).
由图 2可见, 在相同的降解时间内, 阳极回路内模拟废水脱色率随废水中NaCl浓度的升高而增大.当废水中NaCl浓度为0 mol·L-1时, 因废水中无Cl-存在, 一方面阳极AO反应仅为直接氧化反应, 而无HClO间接氧化反应;另一方面, 废水电导率很小, 导致阳极流道溶液电阻增大, RED反应器性能变差.这两个原因均导致阳极回路内甲基橙模拟废水脱色率最低.随着添加到废水中NaCl浓度的增加, 在废水中电离出的Cl-浓度也随之升高, 阳极间接氧化反应能力增强, 同时废水的电导率增大.但从图 2中还可以看到, 只要模拟废水中氯盐浓度达到0.05 mol·L-1时, 废水脱色率迅速提高, 循环12 min后, 甲基橙废水脱色率就可达到100%, 再继续向废水中添加氯盐对其脱色率影响不大.实验结果也说明, RED反应器阳极间接氧化反应对甲基橙废水脱色的影响要大于DAS直接氧化反应.氯盐浓度对废水COD降解率也有很大影响(见后续COD降解).
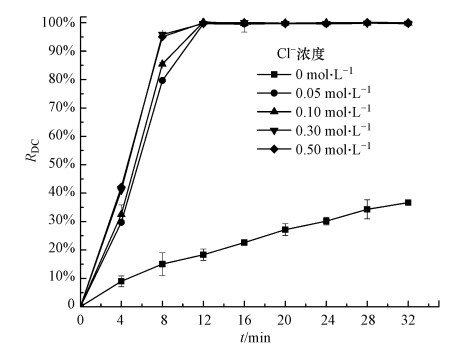 |
| 图 2 Cl-浓度变化对阳极回路甲基橙模拟废水脱色率的影响 Fig. 2 Effect of Cl- concentration on the decolorization efficiency of synthetic methyl orange wastewater in the anodic loop |
需指出的是, 废水中有机物在氧化降解反应过程中是由大分子降解为小分子再降解为无机物的过程.在有Cl-存在的情况下, 某些有机物降解时有可能会与Cl-结合生成有毒且难降解的有机氯(Radjenovic et al., 2015), 需要避免此类情况的发生.
3.1.2 电极液流速的影响有机废水与电极之间的氧化降解反应过程是一个质传递过程(Garcia-Segura et al., 2018).当RED反应器阴/阳电极流道结构尺寸确定时, 废水流经阴/阳电极流道的流速变化可以用流率变化来表示.流速变化会改变电极反应过程的传质系数, 进而改变废水中有机物的降解率.图 3给出了电极液流速对阳极回路内甲基橙模拟废水降解率的影响(实验条件:氯盐浓度为0.5 mol·L-1).由图 3可见, 在短的循环时间内(0~8 min)电极液流率变化对废水脱色率有较显著的影响.当电极液流率由32 mL·min-1增至128 mL·min-1时, 循环8 min后, 脱色率从74.3%增加到99.1%.其原因在于:当流率增大后, 单位时间内流经电极流道的废水量增加, 废水中的电极反应过程(传质)会得到增强;另外, 流率增大意味着废水在回路内循环次数增加, 废水中的甲基橙与阳极反应产物的接触概率增大.然而, 当降解时间超过12 min后, 电极液流率变化对废水脱色率几乎不具有任何影响, 均能达到100%的脱色率.
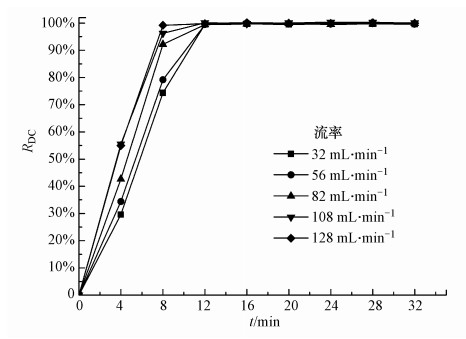 |
| 图 3 电极液流率变化对阳极回路甲基橙模拟废水脱色率的影响 Fig. 3 Effect of flow rate on the decolorization efficiency of synthetic methyl orange wastewater in the anodic loop |
与影响阳极氧化反应的因素相比, 影响阴极EF反应的因素相对较多, 诸如Fe2+浓度、pH值、曝气量和电极液流率等均会对阴极EF反应产生影响, 进而影响有机废水的降解效果.在探究操作参数变化对阴极回路甲基橙废水脱色率的影响时, 也需要固定阳极回路操作参数(氯盐浓度为0.5 mol·L-1, 电极液流率为82 mL·min-1, 输出电流为0.25 A).
3.2.1 亚铁离子(Fe2+)浓度的影响图 4a所示为了Fe2+浓度变化对阴极回路甲基橙模拟废水脱色率的影响(实验条件:电极液pH值为2, 曝气流率为600 mL·min-1, 电极液流率82 mL·min-1).由图 4a可见, 即使当模拟废水中Fe2+浓度为0 mmol·L-1时, 模拟废水流经阴极流道后, 废水中的甲基橙也会被氧化而脱色.其原因在于, 由阴极反应所产生的过氧化氢(H2O2)本身也是一种氧化剂, 尽管H2O2的氧化电位较羟基自由基(·OH)低(1.78 V vs. 2.80 V), 但对废水中的有机物也具有较强的氧化作用.
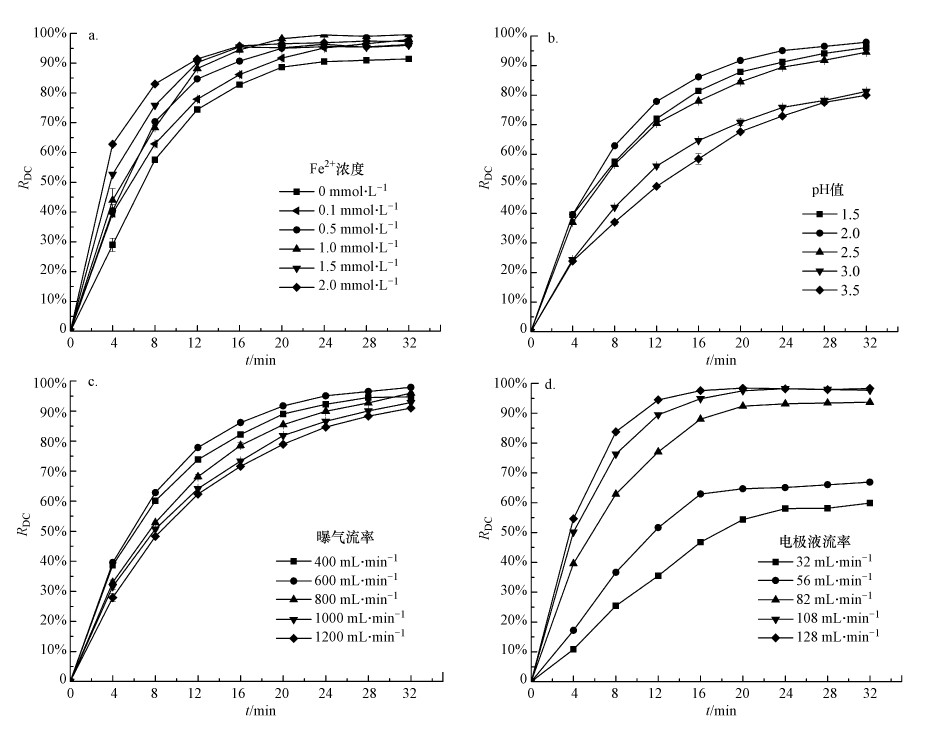 |
| 图 4 Fe2+浓度(a)、pH值(b)、曝气流率(c)及电极液流率(d)对阴极回路甲基橙模拟废水脱色率的影响 Fig. 4 Effects of Fe2+ concentration (a), pH value (b), aeration flow rate (c) and flow rate(d) on the decolorization efficiency of synthetic methyl orange wastewater in the cathodic loop |
图 4a也反映出, 当向模拟废水中添加FeSO4后, 在Fe2+作用下H2O2会被分解成·OH和氢氧根(OH-).因·OH具有更高的氧化电位, 更容易氧化降解废水中的有机物.因此, 随着模拟废水中Fe2+浓度增加, 在短的降解时间(0~20 min)内, 阴极回路内废水脱色率提高.但随着循环时间延长, Fe2+浓度变化对阴极回路废水脱色率影响不大, 其脱色率均能超过92%.表明微量的二价铁离子(Fe2+)即可维持EF反应的进行, 这与其他文献给出的结果相同(Flox et al., 2007).当降解时间足够长时, 尽管废水中Fe2+浓度对甲基橙模拟废水脱色率影响不大, 但对废水整体矿化率却有较大的影响(Wang et al., 2005)(见后续COD降解).
3.2.2 pH值的影响图 4b所示为pH值变化对阴极回路甲基橙模拟废水脱色率的影响(实验条件:Fe2+浓度为0.1 mmol·L-1, 曝气流率为600 mL·min-1, 电极液流率82 mL·min-1).在实验过程中, 模拟废水pH值分别控制为1.5、2.0、2.5、3.0和3.5.由于阴极EF反应需要消耗H+并与溶解在废水中的氧气结合生成H2O2, H2O2经催化生成·OH的同时还会生成OH-, 对酸起到中和作用, 故当酸性废水经RED反应器阴极处理后其pH值一定会升高.为了维持EF反应, 需向模拟废水中连续添加pH值为0.1的稀硫酸来维持其pH值.
由图 4b可见, 随着处理时间的延长, 阴极回路甲基橙模拟废水脱色率一直在增加, 但增幅逐渐减小.但在相同的处理时间内, 模拟废水pH值变化会对其脱色率产生影响.当废水pH值从1.5逐渐升高到3.5时, 模拟废水脱色率随处理时间呈现出先略有升高后逐渐降低的趋势.但当废水pH值从2.5增加为3.0时, 其脱色率下降明显.当模拟废水pH值为2.0时, 在相同的处理时间内, 其脱色效率最高, 处理20 min后, 模拟废水脱色率就可达到91.71%.而pH值为3.5时, 在相同的处理时间内, 其脱色率仅为67.6%.原因在于:废水pH值过高, 会使流经阴极流道后的废水呈碱性, 而导致亚铁离子沉淀, 影响其降解进程.实验结果也发现, 当pH值为3.0和3.5时, 阴极流道出口废水pH可达到10.24和10.79.但过低的pH值也会抑制强氧化性物质·OH的生成(Wang et al., 2016), 其反应方程如下所示:
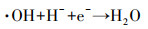
|
(3) |
图 4c所示为曝气流率变化对阴极回路甲基橙模拟废水脱色率的影响(实验条件:Fe2+浓度0.1 mmol·L-1, pH值为2, 电极液流率82 mL·min-1).在实验过程中, 曝气流率分别控制为400、600、800、1000和1200 mL·min-1.由实验结果可见, 曝气流率变化对阴极回路甲基橙模拟废水脱色率影响规律与pH值变化对其影响规律相似.随着处理时间的延长, 废水脱色率不断增加, 但增幅逐渐减小.在相同的处理时间内, 曝气流率变化也会对废水脱色率产生影响.当曝气流率从400 mL·min-1逐渐增大到1200 mL·min-1时, 脱色率也呈现出先略有升高后逐渐降低的趋势.当曝气流率为600 mL·min-1时, 处理20 min后的废水脱色率为91.71%.而当曝气流率为1200 mL·min-1时, 脱色率降为78.96%.原因在于:当曝气流率增大时, 废水中溶氧量也会随之增大, 使得阴极反应能产生更多的过氧化氢和自由羟基;但曝气量增大到一定程度时, 废水中的溶解氧将达到饱和, 此时过氧化氢的生成主要受电极反应动力学控制, 再向废水中增加曝气量将不会提高过氧化氢的产量(古振澳等, 2015).同时由于电极室空间狭小, 过大的曝气量反而会使电极室内充满过多的空气, 导致电极表面被气泡覆盖, 一方面减小了电极反应溶解氧还原为过氧化氢的效率, 另一方面降低了Fe3+在电极表面转换为Fe2+的效率, 从而减慢了电芬顿反应过程, 使阴极回路中甲基橙的降解效率降低.
3.2.4 电极液流率的影响图 4d所示为电极液流率变化对阴极回路内甲基橙模拟废水脱色率影响(实验条件:Fe2+浓度0.1 mmol·L-1, pH值为2, 曝气流率为600 mL·min-1), 电极液流率分别控制为32、56、82、108和128 mL·min-1.由图 4d可见, 在相同的降解时间内, 电极液流率增大, 模拟废水脱色率也随之增大.当阴极回路电极液流率从32 mL·min-1增加到128 mL·min-1后, 经20 min处理后, 其脱色率从54.32%快速升高到98.42%.
比较图 3和图 4d可以发现, 电极液流率变化对阴极回路甲基橙模拟废水脱色率的影响远大于对阳极回路的影响.原因在于:阳极采用厚度为1 mm的钛镀铱钌板, 流道总宽为5 mm, 而阴极采用5 mm厚、孔隙率为75%的碳毡, 流道总宽为5 mm, 在相同的流率下, 阴极流道的平均流速仅为阳极流道的1/2左右, 因此, 电极液在阴极流道内的流速达到与阳极流道相同的水平, 其流率就要加倍;另外, 对于阴极回路而言, 当鼓入溶液中的空气流率不变的条件下, 电极液流率增大也意味着单位时间废水平均溶氧量增加, 导致阴极反应生成的H2O2和·OH浓度也随之增大, 废水中的有机物降解率就会提高.
3.3 电流变化对阴/阳极回路甲基橙脱色率的影响实际上电化学法处理有机废水过程就是一个电子交换的过程, 而电流强度则表征了单位时间内电子交换量.因此, RED反应器输出电流大小直接影响其阴/阳电极回路内甲基橙模拟废水降解效果.图 5所示为输出电流变化对阴/阳回路内甲基橙模拟废水脱色率的影响(实验条件:阳极电极液, 氯盐浓度为0.5 mol·L-1;阴极电极液, pH值为2, Fe2+浓度为0.1 mmol·L-1, 曝气流率为600 mL·min-1;电极液流率均为82 mL·min-1).RED反应器输出电流由电化学工作站分别控制在0.05、0.10、0.15、0.20和0.25 A.
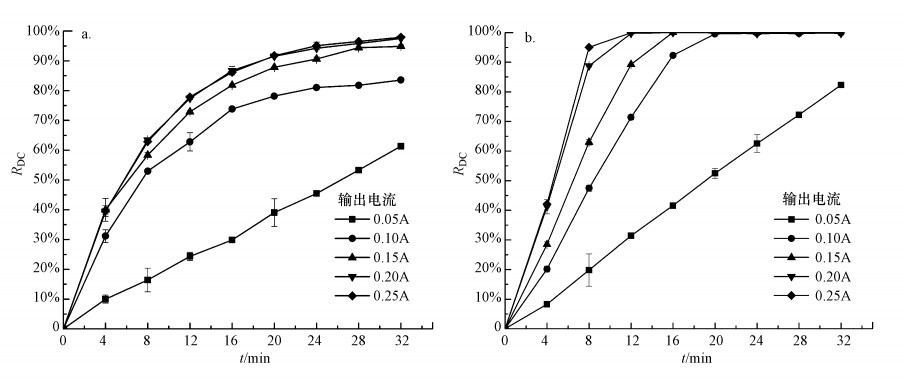 |
| 图 5 输出电流变化对阴极回路(a)及阳极回路(b)甲基橙废水脱色率的影响 Fig. 5 Effect of output current on decolorization efficiency of synthetic methyl orange wastewater in the cathodic loop (a) and the anodic loop (b) |
实验结果显示, 输出电流变化对RED反应器阴/阳极回路甲基橙模拟脱色率有显著影响.在相同的降解时间内, 阳极回路甲基橙模拟废水脱色率总是大于阴极回路.如图 5所示, 当电流为0.05 A时, 阴/阳回路甲基橙模拟废水脱色率随降解时间近似呈线性变化.降解20 min后, 阳极回路废水脱色率达到52%, 而阴极回路仅为39%.但随着输出电流增加, 阴/阳极回路甲基橙废水脱色率也随之增大.相同降解时间, 当电流增大到0.1 A后, 阳极回路废水脱色率就可达到100%, 阴极回路废水脱色率也可达到78.5%, 分别增加192%和201%.然而, 继续增加输出电流, 对于阳极回路而言, 仅会使废水脱色率到达100%的时间提前;对于阴极回路而言, 甲基橙模拟废水脱色率会继续增加, 但增幅逐渐减小.当输出电流达到0.2 A后, 继续增加输出电流, 阴极回路内废水脱色率几乎不再增加.这是因为对于阴极EF反应, 增大电流的同时也会促使一些副反应的产生, 从而影响H2O2的浓度(Ma et al., 2019).
3.4 COD去除率对于印染废水处理除了考虑其脱色率外, 更大程度上是要考虑对其COD的去除率.图 6给出了是否添加氯盐和亚铁盐两种情况下阴/阳极回路内甲基橙模拟废水COD去除率随降解时间的变化关系(实验条件:阴/阳极电极液流率均为82 mL·min-1;阴极电极液, pH值为2, 曝气流率为600 mL·min-1).实验结果显示, 阳极回路模拟废水是否添加氯盐和阴极回路模拟废水是否添加亚铁盐对甲基橙模拟废水COD去除率有很大影响;且在相同的降解时间内, 阴极回路甲基橙模拟废水COD去除率总是高于阳极回路.
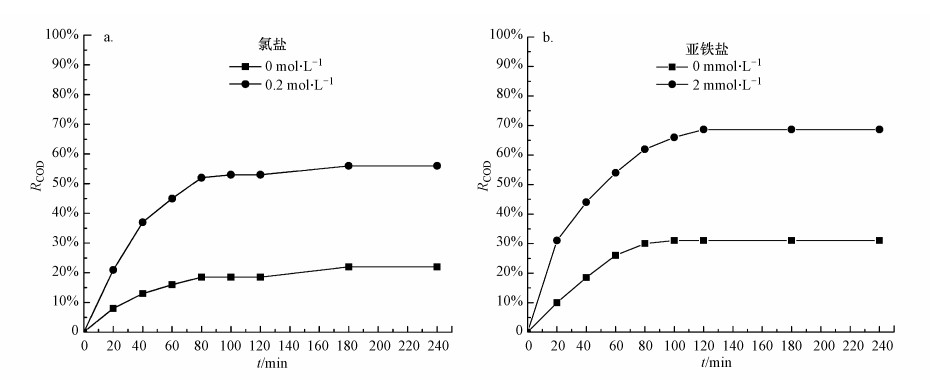 |
| 图 6 阳极回路(a)及阴极回路(b)COD去除率随时间变化 Fig. 6 Variation of COD removal efficiency with time at anodic loop (a) and cathodic loop (b) |
由图 6a可见, 模拟废水不添加氯盐时, 降解80 min后, 废水COD去除率仅为18.5%;但向模拟废水中添加0.2 mol·L-1氯盐后, COD去除率迅速增加到52%, 增加280%.同样, 由图9b可见, 模拟废水不添加亚铁盐时, 降解80 min后, COD去除率仅为30%;但向模拟废水添加2 mmol·L-1亚铁盐后, COD去除率迅速增加到62%, 增加206%.另外, 从实验结果中还可以看到, 在0~80 min降解时间内, 模拟废水COD去除率随降解时间的增加而迅速提高;此后, 再继续增加降解时间, COD去除率提高非常缓慢.从能量利用效率角度考虑, 此后再继续增加降解时间, 水处理能效比将急剧降低.
3.5 不同处理方法比较表 2列出了活性氯和EF氧化降解印染废水脱色率及COD去除率数据.将上述实验数据与表中数据对比可以发现, 尽管RED反应器阴/阳极回路也能在较短的时间内将印染废水几乎完全脱色, 但废水COD去除率还相对较低.原因主要在于:印染废水COD去除率与电极电流密度有很大关系, 对于外电源供电的AOPs法可以在高电压、大电流密度下处理印染废水, 从表 2中可以发现, 最小电流密度也达到20 A·m-2.而对于属于内生电源的RED反应器而言, 在膜对(电池单元)数确定的条件下, 输出电压与输出电流呈线性下降关系.对于本实验所用的由40个膜对构成的RED反应器, 即使当其输出电流达到0.25 A时, 电流密度仅为3.1 A·m-2, 而此时的输出电压仅为1 V.在工作溶液浓度差和过膜流速一定的条件下, 要提高RED反应器输出电流密度, 就需增加其膜对数量以提高反应器的开路电压(Hu et al., 2019b).
| 表 2 活性氯AO和EF技术对染料废水的降解效果 Table 2 The degradation effect of active chlorine and electro-Fenton technology on dye wastewater |
1) RED反应器阴/阳极回路均能处理甲基橙印染废水, 在相对较佳的操作参数下, 经20 min降解处理后, 甲基橙印染废水脱色率分别为98%和100%, 阳极回路甲基橙模拟废水脱色率高于阴极回路.与其它降解方法相比, RED反应器阴/阳极回路甲基橙印染废水COD去除率相对较低, 在相对较佳的操作参数下, 经80 min降解处理后, 甲基橙印染废水COD去除率分别为62%和52%, 阴极回路甲基橙模拟废水COD去除率高于阳极回路.
2) 电极液流率变化对阳极回路甲基橙模拟废水脱色率影响较小, 但氯盐浓度变化却对阳极回路甲基橙模拟废水脱色率和COD去除率影响较大.当氯盐浓度为0 mol·L-1时, 经20 min降解处理后, 甲基橙模拟废水脱色率仅为27.13%.而相同时间内, 废水中氯盐浓度为0.05 mol·L-1时, 脱色率迅速增加到100%.同样情况下, 经80 min降解处理后, COD去除率也从18.5%迅速增加到52.0%.
3) 亚铁离子浓度变化对阴极回路甲基橙模拟废水脱色率影响较小, pH值和曝气流率变化使废水脱色率呈现先增大再减小的趋势, 电极液流率变化则对其影响较大.电极液pH值和曝气流率分别为2和600 mL·min-1, 电极液流率从32 mL·min-1增加到128 mL·min-1, 经20 min处理后, 模拟废水脱色率从54.32%快速升高到98.42%.然而, 亚铁离子浓度变化对阴极回路甲基橙模拟废水COD去除率有较大的影响, 当亚铁离子浓度分别为0和2 mmol·L-1时, 经80 min降解后, 其COD去除率分别为30%和62%.
4) 输出电流变化对阴/阳极回路甲基橙模拟脱色率有显著影响.在相同的降解时间内, 输出电流越大, 阴/阳极回路内模拟废水脱色率也越大, 且阳极回路甲基橙模拟废水脱色率总是大于阴极回路.
实验结果表明, 由低品位热能转换而来溶液浓差能驱动的RED反应器阴/阳极回路均能有效处理甲基橙印染废水.因此, 基于RED法的低品位热能处理有机废水的技术具有良好的应用前景.然而, 对于热分离单元与RED反应器单元耦合的热力循环能量转换特性还有待于进一步研究.但由上述RED反应器阴/阳极回路处理印染废水的实验研究结果可为今后研究高效、清洁、低处理成本的“废热治理废水”提供依据.
El-Desoky H S, Ghoneim M M, Zidan N M, et al. 2010. Decolorization and degradation of Ponceau S azo-dye in aqueous solutions by the electrochemical advanced Fenton oxidation[J]. Desalination, 264: 143-150. DOI:10.1016/j.desal.2010.07.018 |
Garcia-Segura S, Ocon J D, Chong M N. 2018. Electrochemical oxidation remediation of real wastewater effluents-A review[J]. Process Safety and Environmental Protection, 113: 48-67. DOI:10.1016/j.psep.2017.09.014 |
古振澳, 柴一荻, 杨乐, 等. 2015. 以泡沫镍为阴极的电芬顿法对苯酚的降解[J]. 环境工程学报, 9(12): 5843-5848. DOI:10.12030/j.cjee.20151232 |
He W, Ma Q, Wang J, et al. 2014. Preparation of novel kaolin-based particle electrodes for treating methyl orange wastewater[J]. Applied Clay Science, 99: 178-186. DOI:10.1016/j.clay.2014.06.030 |
Hu J Y, Xu S M, Wu X, et al. 2018. Theoretical simulation and evaluation for the performance of the hybrid multi-effect distillation-reverse electrodialysis power generation system[J]. Desalination, 443: 172-183. DOI:10.1016/j.desal.2018.06.001 |
Hu J Y, Xu S M, Wu X, et al. 2019a. Exergy analysis for the multi-effect distillation - reverse electrodialysis heat engine[J]. Desalination, 467: 158-169. DOI:10.1016/j.desal.2019.06.007 |
Hu J Y, Xu S M, Wu X, et al. 2019b. Multi-stage reverse electrodialysis: Strategies to harvest salinity gradient energy[J]. Energy Conversion and Management, 183: 803-815. DOI:10.1016/j.enconman.2018.11.032 |
Ma P F, Ma H R, Galia A, et al. 2019. Reduction of oxygen to H2O2 at carbon felt cathode in undivided cells. Effect of the ratio between the anode and the cathode surfaces and of other operative parameters[J]. Separation and Purification Technology, 208: 116-122. DOI:10.1016/j.seppur.2018.04.062 |
Panizza M, Cerisola G. 2007. Electrocatalytic materials for the electrochemical oxidation of synthetic dyes[J]. Applied Catalysis B-Environmental, 75: 95-101. DOI:10.1016/j.apcatb.2007.04.001 |
Post J W, Hamelers H V M, Buisman C J N. 2008. Energy recovery from controlled mixing salt and fresh water with a reverse electrodialysis system[J]. Environmental Science & Technology, 42: 5785-5790. |
Puttappa S, Venkatarangaiah V T. 2011. Treatment of aqueous and simulated wastewater of Luganil blue N dye - a new electrochemical approach[J]. Environmental Technology, 32: 1939-1945. DOI:10.1080/09593330.2011.569956 |
Radjenovic J, Sedlak D L. 2015. Challenges and opportunities for electrochemical processes as next-generation technologies for the treatment of contaminated water[J]. Environmental Science & Technology, 49: 11292-11302. |
Scialdone O, D′Angelo A, De Lume E, et al. 2014. Cathodic reduction of hexavalent chromium coupled with electricity generation achieved by reverse-electrodialysis processes using salinity gradients[J]. Electrochimica Acta, 137: 258-265. DOI:10.1016/j.electacta.2014.06.007 |
Scialdone O, D′Angelo A, Galia A. 2015. Energy generation and abatement of Acid Orange 7 in reverse electrodialysis cells using salinity gradients[J]. Journal of Electroanalytical Chemistry, 738: 61-68. DOI:10.1016/j.jelechem.2014.11.024 |
Xu S M, Leng Q, Jin D X, et al. 2020. Experimental investigation on dye wastewater treatment with reverse electrodialysis reactor powered by salinity gradient energy[J]. Desalination, 495: 114541. DOI:10.1016/j.desal.2020.114541 |
徐士鸣, 冷强, 吴曦, 等. 2019. 逆电渗析反应器阴、阳极联合降解酸性橙Ⅱ实验研究[J]. 环境科学学报, 39(7): 2163-2171. |
徐士鸣, 徐志杰, 吴曦, 等. 2018a. 溶液浓差能驱动的逆电渗析有机废水氧化降解机理研究[J]. 环境科学学报, 38(12): 4642-4651. |
徐士鸣, 吴曦, 冷. 2018b. 一种利用低品位热能氧化降解有机废水的方法[P]. 中国. CN201711384061.2.2018 -05-29
|
徐士鸣, 吴曦, 吴德兵. 2015. 一种新型低品位热能发电方法及装置[P]. 中国. CN201510694726.4.2015-10-21
|
Wang A M, Qu J H, Ru J, et al. 2005. Mineralization of an azo dye Acid Red 14 by electro- Fenton′s reagent using an activated carbon fiber cathode[J]. Dyes and Pigments, 65: 227-233. DOI:10.1016/j.dyepig.2004.07.019 |
Wang N N, Zheng T, Zhang G S, et al. 2016. A review on Fenton-like processes for organic wastewater treatment[J]. Journal of Environmental Chemical Engineering, 4: 762-787. DOI:10.1016/j.jece.2015.12.016 |
吴曦, 徐士鸣. 2019. 一种低品位热能驱动的双路联合制氢方法[P]. 中国. CN201910103006.4.2019-06-21
|
Zhou Y, Zhao K, Hu C, et al. 2018. Electrochemical oxidation of ammonia accompanied with electricity generation based on reverse electrodialysis[J]. Electrochimica Acta, 269: 128-135. DOI:10.1016/j.electacta.2018.02.136 |
Zhu X P, He W H, Logan B E. 2015. Influence of solution concentration and salt types on the performance of reverse electrodialysis cells[J]. Journal of Membrane Science, 494: 154-160. DOI:10.1016/j.memsci.2015.07.053 |
 2021, Vol. 41
2021, Vol. 41


