2. 兰州交通大学能源与动力工程学院, 兰州 730070
2. School of New Energy and Power Engineering, Lanzhou Jiaotong University, Lanzhou 730070
中国作为传统农业大国, 每年产生的畜禽粪便和秸秆等农业废弃物产量不断增加.据报道, 中国2018年产生秸秆总量超过9亿t, 产生畜禽粪污总量近40亿t, 是工业固体废弃物的1.29倍(Wang et al., 2018;Yao et al., 2020), 如果得不到有效处理会造成一系列环境问题, 比如水体富营养化、病原体释放、气味问题等(Liu et al., 2020; 唐涛涛 et al., 2020).厌氧消化作为一种将鸡粪等农业废弃物资源化的有效处理方式之一, 可以通过利用不同种类细菌对废弃物中的有机物进行降解, 具有成本低、可控制、易操作等优点(Qian et al., 2018).但鸡粪相较于牛粪等其他畜禽粪便, 氨氮含量较高(Zhang et al., 2014), 单一鸡粪厌氧消化容易产生氨抑制现象, 会阻碍工业规模反应器生产沼气, 玉米秸秆由于其木质素和纤维素含量较高, 会延迟厌氧消化水解阶段, 不利于厌氧消化反应的进行(Fu et al., 2018;Jeung et al., 2019).Abouelenien (2014)将鸡粪与农业废弃物混合物(椰子渣、木薯渣和咖啡渣)进行联合厌氧消化, 发现鸡粪与农业废弃物混合物共消化比单独鸡粪厌氧消化具有更大的协同效应, 并且甲烷产量提高了93%, 氨累积减少39%;由于碳氮比是衡量厌氧微生物营养元素平衡水平的基本指标, 因此将鸡粪与秸秆进行共消化可以提高反应系统内的C/N, 提高甲烷产量, 同时处理掉鸡粪与秸秆这种农业废弃物, 所以国内外学者针对这一方法进行了大量的研究, 但研究结果却不尽相同.
Hassan (2017)利用半连续搅拌式反应器, 研究了鸡粪与氧化裂解后的麦秸共消化过程, 发现氧化裂解的小麦秸秆能够有效降低木质素含量和C/N, 当C/N比为20, 有机负荷为2 g·L-1·d-1时, 厌氧消化系统具有最佳产甲烷能力, Wang等(2014)研究了温度与C/N对牛粪、鸡粪和稻草厌氧共消化性能的影响, 发现35 ℃时, 最佳C/N为25∶1, 随着温度升高, 需要提高C/N来降低氨抑制的风险;Li等(2013)通过研究鸡粪秸秆混合消化实验发现秸秆∶鸡粪=3∶1时(以VS计), 湿法厌氧消化甲烷产率最高, 秸秆∶鸡粪=1∶1时(以VS计), 干式厌氧消化甲烷产率最高;Zahan等(2019)在总固体(TS)=15%的环境下, 将C/N控制在26.5, 取得了较好地产气效果;Kainthola等(2019)利用响应面法研究了C/N、食物/微生物比(F/M)和pH对甲烷产率(mL·g-1)的单独影响及其交互作用, 发现厌氧共消化最佳条件是C/N=29.7、F/M=2.15、pH=7.3, 其甲烷产率是对照组的1.84倍.宁静等(2018)以猪粪和玉米秸秆为底物在连续式反应器中进行中温厌氧消化, 通过控制不同梯度的C/N来考察底物对厌氧消化工艺性能的影响, 发现当C/N为25时, 反应系统最为稳定, 产气效果最好;沈飞等(2017)以稻草和畜禽粪便为原料, 发现最佳C/N为30, 梁银春等(2016)研究不同初始C/N混合物料对甘蔗叶厌氧消化理化参数及微生物多样性的影响, 发现C/N为15时产甲烷效率最高, 物种多样性最为丰富.通过大量学者的研究可以发现, 在不同环境下, 受物料基础性质等因素的影响, 鸡粪秸秆共消化最佳C/N不尽相同, 所以本研究在借鉴前人研究经验的同时, 基于辽宁省北票宏发食品有限公司旗下养殖基地的鸡粪处理处置问题, 开展鸡粪与秸秆厌氧消化实验, 将系统TS逐步提高到20%以上, 探究鸡粪与秸秆共消化最优配比, 并利用分子生物学动态变化过程及相关水解酶活性的变化分析微生物多样性变化机制及其协同作用, 以提高厌氧消化效率, 为实际工程提供理论指导与技术支撑.
2 材料与方法(Materials and methods) 2.1 实验材料本次实验所用鸡粪取自辽宁朝阳某肉食鸡养鸡场;所用秸秆取自沈阳市沈北新区某农户, 秸秆在实验前需经过预处理, 将其研磨粉碎至60目以下, 用来增加秸秆反应接触面积, 提高厌氧消化效率;接种污泥取自沈阳市北部市政污水处理厂, 实验原料及接种污泥性质如表 1所示.
| 表 1 鸡粪、秸秆和接种物的性质 Table 1 Characteristics of CM, MS and inoclum |
本次连续式厌氧干发酵实验采用三联30 L CSTR(连续搅拌反应器, continuous stirred tank reactor)厌氧发酵生化反应器, 如图 1所示.连续式厌氧发酵实验装置罐体材料为不锈钢, 罐体总容积为30 L, 实验过程有效容积为20 L, 发酵罐内部没有死角;发酵罐底部为排料口, 由其上球阀控制物料排出, 排料装置由防腐防酸材料制成, 内无死角, 不会发生积液现象.罐顶为机械密封装置, 具有良好的密封性能, 设有不锈钢搅拌桨、高性能消泡桨.
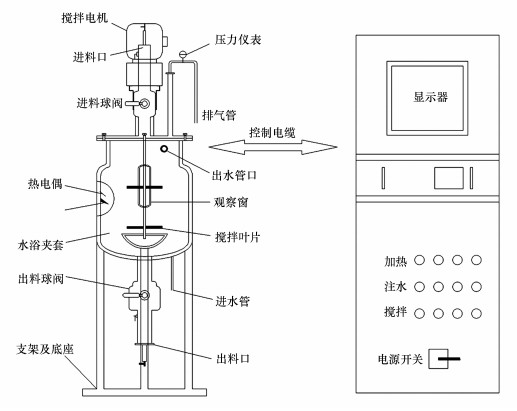 |
| 图 1 连续式厌氧消化实验装置图 Fig. 1 Diagram of continuous anaerobic digestion experimental device |
本次实验以新鲜鸡粪与粉碎到200目秸秆为研究对象, 反应器共设置3组C1~C3, 其中C1为对照组只加入新鲜鸡粪;C2和C3为实验组, 其中鸡粪与秸秆VS比分别为5∶2和1∶1;各组反应器接种污泥均为3000 mL, 各组物料的投加量见表 2.投加后用去离子水定容至20 L并搅拌混匀, 然后向反应罐中吹脱氮气2 min, 防止氧气进入, 保证严格厌氧环境.温度设置为(37 ± 0.2) ℃, 实验周期为100 d.根据有机负荷(OLR)将整个实验周期划分为4个阶段, 第一阶段为启动阶段, C1~C3 3组实验OLR分别为0.38、0.54、0.61 g·L-1·d-1, 进料频率为3 d.
| 表 2 连续式各组实验物料配比 Table 2 The proportion of continuous experimental materials in each group |
甲烷产量采用湿式气体流量计(LML-1)和甲烷气体检测仪(GT901)进行测量, pH采用便携式pH计进行测量(PHB-4), 反应系统内物料TS/VS采用重量法进行测量(GB/T28731—2012);化学需氧量(COD)采用重铬酸钾法进行测量(GB/T32208-2015);氨氮(TAN)含量通过纳氏试剂分光光度法进行确定(HJ535-2009);总挥发性脂肪酸(VFAs)利用比色法进行测量(Lv et al., 2013), 通过设置不同梯度乙酸建立标线, 利用乙酸浓度进行表征;酶活性利用ELISA检测试剂盒配制标样与待测样品, 后利用酶标仪(Rayto RT-6100)来测量其吸光度并计算酶活性(李永灿等, 2011);扫描电镜委托东北大学分析测试中心利用场发射扫描电子显微镜(ULTRA PLUS)进行观察, 观察秸秆微观组织表面形态变化.
微生物多样性采用16S rDNA技术, 先采用CTAB方法提取样品中的DNA (李金璐等, 2013), 然后利用琼脂糖电泳检测DNA的纯度和浓度, 以待测基因组的DNA为模板, 选用16S V4区域引物515F和特异引物806R进行PCR细菌扩增, 选用16S V4+V5区域引物Arch519F和特异引物Arch915R进行PCR古菌扩增, 并利用2%的琼脂糖凝胶对PCR产物进行电泳检测及纯化, 然后进行文库构建, 并利用Ion S5TMXL进行上机测序.
3 结果与讨论(Results and discussion) 3.1 厌氧消化产甲烷性能甲烷产量是反映厌氧消化效率的最直观指标(Li et al., 2015), 如图 2a所示, 在第一阶段, 此时整个厌氧发酵系统处于启动阶段, 进料频率为3 d, 所以在此阶段3组实验的甲烷日产量均呈现出往复式变化趋势, 进料当天的甲烷产量能够达到峰值, 约为6.04~13.32 L, 在此阶段厌氧消化系统的TS不断上升, 反应系统开始由湿发酵向干发酵转变.第二阶段, C1~C3 3组实验OLR (有机负荷)分别为1.14、1.53、1.80 g·L-1·d-1, HRT (水力停留时间)为40 d, 进料频率为2 d, 此阶段持续时间为6 d, 是间隔进料向连续进料的过渡阶段, 此阶段甲烷产量变化规律与第一阶段一致.随着反应进行, 进料频率变为1 d, 此阶段OLR为2.87、3.87、4.05 g·L-1·d-1, HRT为20 d, 此阶段在不调节pH的条件下, 随着VFAs的积累, 系统中产生大量游离的H+导致pH逐渐下降到5.5~6.5, 产甲烷菌活性受到抑制, 甲烷产量处于较低水平, 系统出现酸化现象.于是在第70 d开始通过加入4.5 mol·L-1 NaOH进行调节, 使pH逐渐升高, 3组实验产气逐渐恢复, C3组甲烷日产量峰值为31.46 L, 并在第四阶段达到稳定, C1~C3在此阶段的OLR分别为7.31、7.49、7.88 g·L-1·d-1, HRT为8 d, 产甲烷菌活性恢复, 在此阶段C3组甲烷日产量最高, 平均值为20.70 L, 其次是C2组甲烷日产量平均值为17.50 L, C1组最低为12.50 L.C1~C3在稳定期容积产甲烷量分别为25.92、34.74、40.37 mL·g-1.在有机负荷相同的条件下, C/N的变化对厌氧消化影响十分明显, C/N过高, 可能会导致氮源含量太低, 从而影响微生物生长;C/N过低则会导致反应系统内氨氮含量过高, 出现氨抑制现象.C1、C2、C3 3组实验的C/N分别为9、13和17, 当C/N为17时, 产甲烷效果最好.为此, 将两种农业废弃物协同发酵达到了调节C/N的效果, 解决了单独利用鸡粪或秸秆进行厌氧消化时出现的因碳氮比不适宜而造成发酵效果不好的问题.
通过对比C1~C3累计甲烷产量的变化可以看出, 3组实验在前中期变化趋势大致相同, 在实验后期, C3累计产甲烷量最高为940.96 L, 其次是C2累计产甲烷量为773.81 L, C1累计产甲烷量最少为642.56 L, 原因是秸秆比例的添加提高了反应系统内C/N, 提高了微生物的代谢水平, 同时使秸秆和鸡粪形成构架, 图 3a~3d分别反映了实验30 d时厌氧消化前后秸秆等纤维素类物质微观组织表面形态变化, 以观察厌氧消化过程中秸秆降解程度.由图 3d可以看出C3组秸秆表面形态呈现破碎状, 相对于其他两组降解效果最佳, 秸秆中纤维素和木质素在整个水力停留时间内得到了有效降解.原因是在此阶段受系统内C/N影响, C3组各水解酶活性均高于C1和C2组, 尤其是纤维素酶活性, 达到258.94U·mL-1, C2和C1组纤维素酶活性分别为244.20、202.18 U·mL-1, 这与Duan等的研究结果类似(Duan et al., 2019).在此阶段Megasphaera和Bacteroides作为分泌纤维素酶主要作用菌属, 丰度高于C2组, 其中Megasphaera发酵果糖和乳酸, 广泛存在于牛和羊的瘤胃中;Bacteroides属于拟杆菌门, 能够降解纤维素和氨基酸等有机质, 并产酸产气(Zhao et al., 2018), 具体变化分别如图 4和图 5所示.
 |
| 图 3 反应物料局部表面结构 (a.反应物料整体表面结构, b.C1反应过程中秸秆表面结构, c.C2反应过程中秸秆表面结构, d.C3反应过程中秸秆表面结构) Fig. 3 Partial surface structure of reaction material (a.the overall surface structure of the reaction material, b. the surface structure of the straw in C1, c. the surface structure of the straw in C2, d.the surface structure of the straw in C3) |
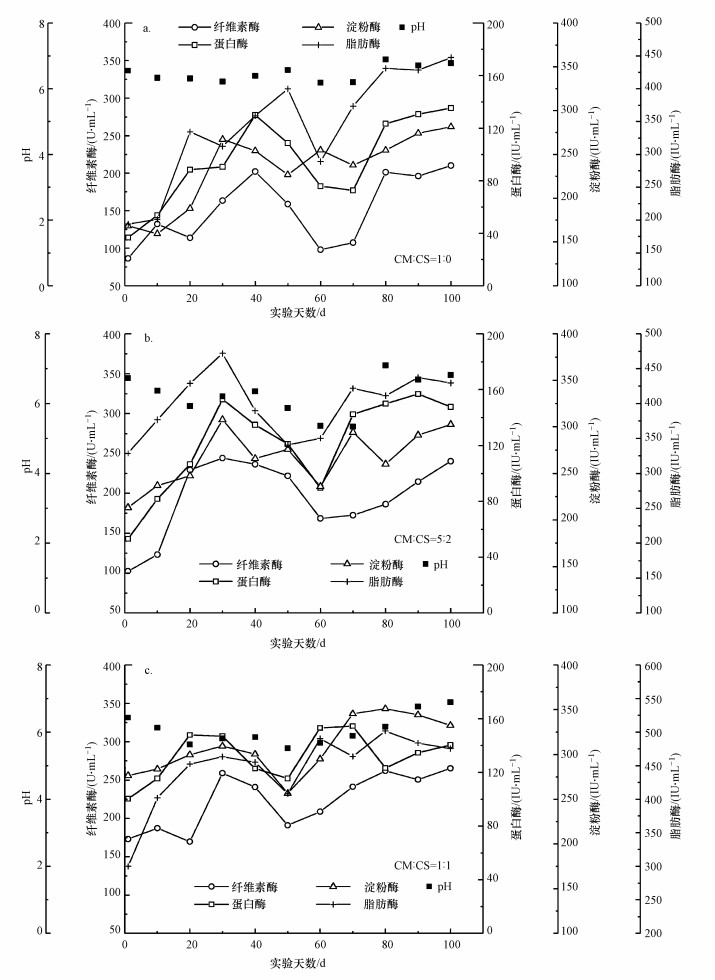 |
| 图 4 各水解酶与pH相关性变化关系 Fig. 4 Correlation variation between various hydrolytic enzymes and pH |
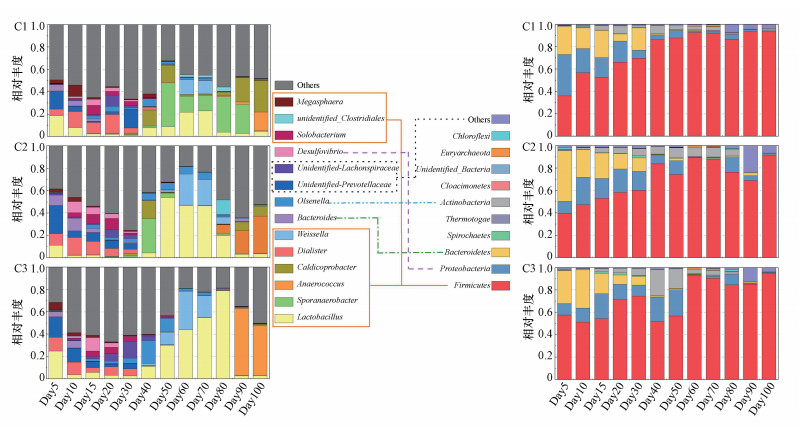 |
| 图 5 细菌菌群相对丰度变化图 Fig. 5 The relative abundance of bacterial flora changes |
由图 2c可以看出, 消化系统中的总氨氮(TAN)浓度先增加后降低, 到实验结束达到860 mg·L-1左右, 反应器中的TAN浓度主要受到底物组成(尤其含氮有机物)、进料底物与排出消化液的体积比与生物固定量的影响(Mata-Alvarez et al., 2014).TAN的主要来源是底物中含氮有机物的水解, 游离氨氮(FAN) 可以利用TAN浓度进行计算得出, 公式见式(1) (Duan et al., 2019).
 |
| 图 2 甲烷产量, OLR, VFAs, NH4+-N等随时间的变化 Fig. 2 The proportion of continuous experimental materials in each group |
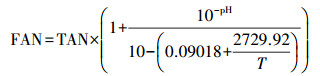
|
(1) |
式中, pH为反应器中确定的pH值, T为温度(K).
根据亨利定律可知溶液中的FAN浓度越高, 气态FAN损失越大, 但是在实验前中期pH一直处于6.5以下, 导致FAN含量较低, 大量高活性微生物促进更多的氮同化为细胞物质, 并产生更多的可溶性产物(Mahdy et al., 2020), 大多数氮以有机氮的形式存在, 在实验后期通过pH的调节, FAN含量逐渐升高, 这也是消化系统中TAN波动的主要原因.根据前人报告, 低浓度的氨氮可以用作微生物生长的有效氮源, 而高浓度的氨氮则会抑制产甲烷菌的活性, Duan等(2019)研究指出当TAN浓度超过3000 mg·L-1时, 氨被认为具有毒性, 会产生氨抑制现象, 本研究中TAN浓度均保持在1000 mg·L-1左右, 均不会产生明显的氨中毒现象.反应系统内化学需氧量(COD) 与VS变化如图 2e和图 2f所示, 随着OLR的增加, 系统TS逐渐升高, 于45 d左右达到20%并趋于稳定, 在实验前中期COD明显增加, 并在65 d左右达到峰值, C1~C3峰值分别为110.4、103.4、104.1 g·L-1, 原因是此时pH较低, 反应系统过载, 出现酸化现象, 非离子态有机酸抑制了水解细菌和产甲烷菌活性, 产甲烷效率较低, 在实验后期通过人为调控pH, 提高了微生物对有机质的利用效率.在实验后期系统相对稳定后C1~C3 3组实验COD去除率分别达到53.5%、57.8%、54.1%, 有机质能够得到有效降解, 其中C2、C3组去除率较高, 较为稳定.
总挥发性脂肪酸(VFAs)是厌氧产酸细菌在代谢过程中产生的, pH能够通过影响产酸细菌的代谢过程间接影响VFAs浓度(Shen et al., 2018).在不控制pH的条件下, 消化系统中的pH会迅速下降, 非离子态有机酸会抑制产酸菌的活性, 从而抑制VFAs的产生(Yan et al., 2019).图 2d反映了C1~C3厌氧消化过程中VFAs和pH的变化规律, 可以看出随着时间的延长, VFAs浓度总体呈现出先上升后趋于平稳的变化趋势.有研究表明, 当厌氧消化系统内的pH处于5~7时, 产酸阶段的产物主要为乙酸和丁酸(Feng et al., 2018).对比3组实验可以看出, 在实验前期由于进料频率的变化和pH的降低, VFAs浓度波动较大;在实验后期, 通过人为调控将pH调到6.8以上, 反应系统内的pH随时间并不会发生明显的降低现象并能维持在相对稳定状态, 且此阶段进出料相对稳定, COD逐渐降低, 产甲烷量逐渐升高, 系统内有机质得到有效降解, 水解酸化细菌与产甲烷菌OUT数目也具有明显上升, 这与Ma等的研究结果一致(Ma et al., 2020), VFAs浓度均能保持在18000 mg·L-1左右, 产酸细菌的产酸效率与产甲烷菌对VFAs的利用效率达到相对平衡的状态, 厌氧消化效率较高且较为稳定.
3.2 厌氧消化酶活性水解作为厌氧消化过程中的限速步骤, 本文探究不同配比条件下厌氧消化水解过程酶活性与pH变化机制, 图 4反映了C1~C3水解酶与pH的相关性变化关系, 结果表明pH的变化对酶活性的影响较大, 水解酶与pH的变化趋势大致相同.在实验初始阶段, 3组实验pH均处于6.5~7.0, 为厌氧消化过程的水解作用提供了较好的环境, C1组各水解酶酶活性在第40 d达到峰值, C2和C3组各水解酶活性在30 d达到峰值.随着反应的进行, 大分子有机物水解为脂肪酸的同时, 产生了大量游离的H+导致pH下降, 使厌氧消化系统产生酸化现象, 抑制了水解酸化细菌胞外酶的分泌, 酶活性随之降低(Liang et al., 2020).在实验中后期, 通过对pH的调节, 各水解酶活性逐渐升高, Lu等(2007)对固体废物厌氧消化过程中的酶活性进行分析发现低pH的情况下, 水解蛋白酶活性较低, 后来随着pH的增加而增加.可以得出结论, 在实际工程中要通过控制pH的变化来提高厌氧消化过程中水解速率, 以提高厌氧消化效率.
纤维素酶可以将纤维素降解为寡糖或单糖(Isikhuemhen et al., 2009), 主要分泌菌群有:Megasphaera、Bacteroides、unidentified_Spirochaetaceae和Candidatus_Cloacimonas等, 通过对比图 4a~4c可以看出纤维素酶相对于淀粉酶和蛋白酶活性较高, 且随秸秆比例升高, 纤维素酶活性逐渐升高, 其中C3组纤维素酶活性显著高于C1组和C2组, 且C3和C2组在第30 d左右达到峰值分别为258.94 U·mL-1和244.20 U·mL-1, C1组在第40 d左右达到峰值为202.18 U·mL-1.这一结果表明, 秸秆含量的增多提高厌氧消化过程中纤维素酶活性, 提高了对原料的利用效率.蛋白酶主要水解原料中粗蛋白分子间的肽链而形成氨基酸, 淀粉酶负责葡萄糖的释放和多糖的水解(Neumann et al., 2017), 脂肪酶主要催化甘油三酯转变为甘油和脂肪酸(Ruan et al., 2019), 其在水解酸化过程中的优势菌群主要有:Candidatus_Cloacimonas、Lactobacillus、Ruminiclostridium和Bacteroides.对比C1~C3 3组实验结果表明, C3和C2组蛋白酶、淀粉酶、脂肪酶活性整体高于C1组, 且C3和C2 3种水解酶活性均在30 d左右达到峰值, 峰值分别为:146.96 IU·L-1 (蛋白酶)、153.06 IU·L-1 (蛋白酶)、309.50 IU·L-1 (淀粉酶)、307.76 IU·L-1 (淀粉酶)、463.27 IU·L-1 (脂肪酶)、471.93 IU·L-1 (脂肪酶), 而C1组蛋白酶、淀粉酶、脂肪酶活性均在40 d左右达到峰值, 分别为129.90、254.07、399.65 IU·L-1.这一结果同样可以使我们认为, 秸秆的添加提高了反应系统内的C/N, 进一步优化了系统内的营养结构, 提高了各水解酶的活性, 增加了对原料的利用效率.
3.3 细菌多样性变化为了研究厌氧消化过程中细菌界主要作用菌群相对丰度变化, 通过对36个样本进行测序, 得到序列后以97%的序列相似性聚类到OTU中, 实验基于有效数据进行OTUs聚类和物种聚类分析, 3组实验分别得到了1151、1329、1215个细菌的OTU, 如图 5所示, 其中主要门类是Firmicutes、Proteobacteria、Bacteroidetes和Spirochaetes, 这是因为其对较复杂的有机物(如蛋白质、碳水化合物等)均具有水解和酸化能力.通过本研究可以看出, Firmicutes相对丰度随时间的变化逐渐升高, 原因是Firmicutes中包含众多重要的功能性微生物, 能够对氨基酸、甘油、葡萄糖、脂质和碳水化合物等具有一定的降解能力(宋壮壮等, 2019), 并产生VFAs.有研究表明秸秆的添加会抑制Proteobacteria的生长(Peng et al., 2018), Proteobacteria在厌氧消化过程中会消耗乙酸、丙酸和丁酸, 所以Proteobacteria相对丰度的降低有利于VFAs的积累.在后续研究中我们可以通过提取优势菌种, 探究优势菌群互营共生关系来改善厌氧消化体系中VFAs含量以提高厌氧消化效率.
如图 5所示, C1组实验过程中属水平上的优势菌种主要有:Sporanaerobacter、Caldicoprobacter、Lactobacillus、Dialister和Anaerococcus, 其中Sporanaerobacter、Caldicoprobacter和Anaerococcus在实验中期和后期丰度较高, 属于专性厌氧菌, 可以将蛋白质和葡萄糖水解为有机酸和醇类等物质(Lin et al., 2012);Lactobacillus属于乳杆菌目, 在实验中期丰度较高, 可产生乳酸和多种脂肪酶, 增加厌氧消化系统中丁酸的含量, 值得注意的是Lactobacillus对酸性环境具有较好的耐受能力, 且能为其他细菌提供可利用的有机硒, 有利于抗细胞凋亡(Peng et al., 2018), 但Lactobacillus的益生作用机制和与其他益生菌的协同作用还有待进一步研究;Dialister是一种革兰氏阴性菌, 在实验前期丰度较高, 在严格厌氧环境下可以将葡萄糖水解为乙酸或琥珀酸(Lin et al., 2017a).C2组细菌菌群属水平上的优势菌种主要有Lactobacillus、Anaerococcus、Sporanaerobacter、Unidentified- Prevotellaceae和Bacteroides, 其中Lactobacillus的丰度随秸秆含量的增加而增加, 原因是由于C2和C3在实验中期有机负荷较高, 导致厌氧消化系统产生了酸化现象, pH值低于C1组, Lactobacillus具有较好的抗逆性从而导致其在C2和C3组丰度较高, 可作为鸡粪秸秆混合厌氧消化的优势菌种.相比于C1组, C2组中的Unidentified-Prevotellaceae和Bacteroides在实验前期丰度较高.图 5还反映了C3组细菌菌群丰度变化, 可以看出其优势菌种主要为:Lactobacillus、Anaerococcus、Unidentified-Prevotellaceae、Dialister、Weissella和Olsenella.其中Weissella能够分泌β-葡糖苷酶, 能够分解寡糖和细胞壁等成分并将纤维二糖水解为葡萄糖, 有利于加快对厌氧消化系统中纤维素等物质的降解(史宏伟等, 2012);Olsenella属于放线菌的一种, 它能够将淀粉、纤维素和各种有机酸作为能源, 促进有机固体废物生物处理过程中的物质循环(Lin et al., 2017b).
3.4 古菌多样性变化厌氧消化系统中古菌菌落主要是产甲烷古菌等相关菌种, 通过对36个样本进行测序并基于有效数据进行OTUs聚类和物种聚类分析, C1~C3 3组实验分别得到了373、340、321个古细菌的OTU, 鉴定出古细菌大多属于Euryarchaeota门, 其中属水平上优势菌种主要有:Methanosphaera、Methanosaeta、Fastidiosipila、Methanobrevibacter和Methanobacterium.由图 6可以看出随着秸秆配比升高, 优势菌种相对丰度逐渐升高, 有研究表明秸秆含量的升高会对食乙酸产甲烷菌和食氢产甲烷菌生长产生不同程度的抑制作用, 但会显著提高甲基型产甲烷菌的相对丰度(Li et al., 2017; Manosane et al., 2017).在本研究中Methanosphaera、Methanobrevibacter和Methanobacterium为3组实验的主要优势菌种, 且Methanobrevibacter和Methanobacterium相对丰度随着秸秆比例的增加逐渐升高, 其均属于食氢产甲烷古菌, 主要利用H2、甲醇和乙酸等物质进行产甲烷代谢, 并将其转化为CH4和CO2 (Krause et al., 2008);Methanosaeta属于食乙酸产甲烷古菌, 是实验前期优势菌种, 相对丰度随时间变化逐渐降低, 且受秸秆添加量的影响, C2、C3组Methanosaeta相对丰度较C1逐渐降低, Methanosaeta在厌氧消化过程中可以利用多种不同类型底物, 主要将甲基胺或甲醇歧化为CH4和CO2, 或将H2、CO2和乙酸转化为CH4 (Salama et al., 2020);结果表明C3组物种多样性较高, 菌群丰度变化较为稳定, 在实验中后期与C2组对比具有较大差异, C3组在30~70 d优势菌群主要为Methanosphaera和Methanobrevibacter, C2组在30~70 d的主要优势菌种为Methanosphaera和Methanobacterium, 造成这种差异的原因是C3组在实验中期pH一直维持在5.9左右, 变化较为稳定, 且Methanobrevibacter最适pH偏弱酸性, 有效增加了甲烷产量, 减少了VFAs的积累.C2组pH变化波动幅度较大, 微生物丰富度较高但多样性较低, 厌氧消化系统较不稳定.C3组在80~100 d优势菌群主要为Methanosaeta、Methanospirillum和Methanoregula, 且变化较为稳定, C2组在80~100 d优势菌群依旧为Methanosphaera和Methanobacterium, 原因是C3组在实验后期出现了一定的酸化现象, 通过16S rDNA测序发现Firmicutes丰度较高, 此时Methanosaeta、Methanospirillum和Methanoregula作为食乙酸产甲烷菌丰度逐渐升高, 符合微生物生态学变化规律.同时该结论还可以得出配比的变化会对体系中的细菌群落产生较大的影响, 从而改变微生物的生长环境, 最终影响产甲烷菌的生长.Mata-Alvarez等通过对联合厌氧消化的研究也发现, 细菌群落结构易受到原料比例的影响, 而甲烷菌更易受到环境条件(如VFAs和NH4+-N浓度)的影响.由此可见, 秸秆配比变化是导致体系中微生物群落发生变化的主要影响因素.
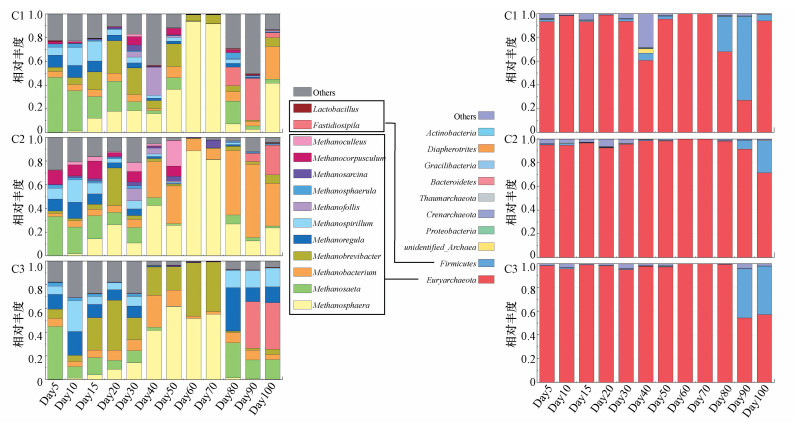 |
| 图 6 古菌菌群相对丰度变化图 Fig. 6 The relative abundance of archaeal flora |
厌氧消化系统内微生物动力学特征可以通过α多样性来表示, α多样性可以用来评估菌群群落的丰富度、多样性和均匀性(潘婧冉等, 2019).表 3反映了厌氧消化过程中各组实验细菌和古菌的α多样性, 其中Chao1指数和ACE指数能够估算样品中所含OTU数目的指数, 数值越大代表样本中所含物种越多(Ros et al., 2017);表 3中可以看出细菌群落Chao1和ACE指数的增加表明秸秆的添加有利于微生物丰富度的增加, 但随着配比增加微生物丰富度逐渐降低.古菌群落Chao1和ACE指数逐渐降低, 说明随秸秆添加量的提高, 古菌丰富度逐渐降低.Shannon指数能够评估样本中物种组成的丰富度和均匀度, 值越大表示该环境中物种越丰富, 各物种分配越均匀(Ros et al., 2017);Simpson指数是指从一个样本数据中随机取两个OTU, 它们属于不同物种的概率, 这一概率越大表示样本的物种多样性越高, 反之越低(Karakashev et al., 2006);这些指数均可以评估优势种在群落中的地位和作用.就OTU、丰富度、均匀度和多样性等指标而言, 细菌群落价值要高于古菌群落, 这与之前的研究结果一致(Ziganshina et al., 2015).表 3中Shannon和Simpson指数变化表明, 秸秆配比的变化使系统中微生物多样性发生不同程度的变化, 随着秸秆配比的增加, 细菌菌群多样性逐渐增加, 古菌菌群多样性逐渐减少, 可以看出秸秆配比的变化是导致细菌和古细菌多样性变化的主要原因, 有相关研究表明, 细菌多样性的增加和古菌多样性的减少有利于甲烷产量的增加, 这与本研究得出的结论基本一致(Niu et al., 2015).
| 表 3 细菌与古细菌群落的多样性指数 Table 3 Diversity index of bacterial and archaeal communities |
1) C/N及pH的变化是限制厌氧消化速率的影响因素, 本研究基于实际工程发现鸡粪和秸秆厌氧干发酵最优配比为1∶1, C/N为17, pH的变化会导致TAN、VFAs与酶活性产生波动, 在实际工程中要通过控制OLR使pH稳定在中性范围, 提高厌氧消化过程中的水解速率.
2) C2、C3组各水解酶活性均高于C1组, 秸秆适量的增加一定程度上提高了水解酶活性, 提高秸秆的降解效率, 缩短其达到峰值所需时间, 且能够增加细菌多样性和减少古菌多样性.
3) 3组实验水解阶段的优势菌种主要有Firmicutes、Proteobacteria、Bacteroidetes和Spirochaetes, 其中Lactobacillus属于Bacteroidetes由于具有较好的抗逆性在C2、C3组丰度较高, 可作为鸡粪秸秆联合厌氧消化的优势产酸菌.
4) C3组产甲烷古菌丰度变化较为稳定, 且受pH变化的影响与C2组存在较大差异, 在实验中期以食氢产甲烷菌为主, 优势菌属主要有Methanosphaera和Methanobrevibacter, 实验后期以食乙酸产甲烷菌为主, 优势均属主要为Methanosaeta、Methanospirillum和Methanoregula.
Abouelenien F, Namba Y, Kosseva M R, et al. 2014. Enhancement of methane production from co-digestion of chicken manure with agricultural wastes[J]. Bioresource Technology, 159: 80-87. DOI:10.1016/j.biortech.2014.02.050 |
Duan N, Zhang D J, Lin C, et al. 2019. Effect of organic loading rate on anaerobic digestion of pig manure: Methane production, mass flow, reactor scale and heating scenarios[J]. Journal of Environmental Management, 231: 646-652. DOI:10.1016/j.jenvman.2018.10.062 |
Feng J Y, Li Y Q, Zhang E L, et al. 2018. Solid-State Co-digestion of NaOH-Pretreated corn straw and chicken manure under mesophilic condition[J]. Waste and Biomass Valorization, 9(6): 1027-1035. DOI:10.1007/s12649-017-9834-z |
Fu Y R, Luo T, Mei Z L, et al. 2018. Dry anaerobic digestion technologies for agricultural straw and acceptability in China[J]. Sustainability, 10(12): 1-13. |
Hassan M, Umar M, Ding W, et al. 2017. Methane enhancement through co-digestion of chicken manure and oxidative cleaved wheat straw: Stability performance and kinetic modeling perspectives[J]. Energy, 141: 2314-2320. DOI:10.1016/j.energy.2017.11.110 |
Isikhuemhen O S, Mikiashvili N A, Kelkap V. 2009. Application of solid waste from anaerobic digestion of poultry litter in Agrocybe aegerita cultivation: mushroom production, lignocellulolytic enzymes activity and substrate utilization[J]. Biodegradation, 20(3): 351-361. DOI:10.1007/s10532-008-9226-y |
Jeung J H, Chung W J, Chang S W. 2019. Evaluation of anaerobic co-digestion to enhance the efficiency of livestock manure anaerobic digestion[J]. Sustainability, 11(24): 1-12. |
Kainthola J, Kalamdhad A S, Goud V V. 2019. Optimization of methane production during anaerobic co-digestion of rice straw and hydrilla verticillata using response surface methodology[J]. Fuel, 235: 92-99. DOI:10.1016/j.fuel.2018.07.094 |
Karakashev D, Batstone D J, Trably E, et al. 2006. Acetate oxidation is the dominant methanogenic pathway from acetate in the absence of Methanosaetaceae[J]. Applied and Environmental Microbiology, 72(7): 5138-5141. DOI:10.1128/AEM.00489-06 |
Krause L, Diaz N N, Edwards R A, et al. 2008. Taxonomic composition and gene content of a methane-producing microbial community isolated from a biogas reactor[J]. Journal of Biotechnology, 136(1): 91-101. |
Li D, Liu S, Mi L, et al. 2015. Effects of feedstock ratio and organic loading rate on the anaerobic mesophilic co-digestion of rice straw and cow manure[J]. Bioresource Technology, 189: 319-326. DOI:10.1016/j.biortech.2015.04.033 |
李金璐, 王硕, 于婧, 等. 2013. 一种改良的植物DNA提取方法[J]. 植物学报, 48(1): 72-78. |
Li R, Duan N, Zhang Y, et al. 2017. Anaerobic co-digestion of chicken manure and microalgae Chlorella sp.: Methane potential, microbial diversity and synergistic impact evaluation[J]. Waste Management, 68: 120-127. DOI:10.1016/j.wasman.2017.06.028 |
Li Y, Zhang R, Chen C, et al. 2013. Biogas production from co-digestion of corn stover and chicken manure under anaerobic wet, hemi-solid, and solid state conditions[J]. Bioresource Technology, 149: 406-412. DOI:10.1016/j.biortech.2013.09.091 |
李永灿, 严群, 阮文权. 2011. 餐厨垃圾厌氧消化产沼气过程中酶学表征[J]. 工业微生物, 41(3): 76-80. DOI:10.3969/j.issn.1001-6678.2011.03.015 |
梁银春, 黄逸鑫, 郭晓博, 等. 2016. 不同碳氮比对干法厌氧消化产沼气特性及细菌群落多样性的影响[J]. 环境工程学报, 10(10): 5978-5986. DOI:10.12030/j.cjee.201505096 |
Liang Y G, Xu L, Bao J, et al. 2020. Attapulgite enhances methane production from anaerobic digestion of pig slurry by changing enzyme activities and microbial community[J]. Renewable Energy, 145: 222-232. DOI:10.1016/j.renene.2019.06.037 |
Lin J, Zuo J, Ji R, et al. 2012. Methanogenic community dynamics in anaerobic co-digestion of fruit and vegetable waste and food waste[J]. Journal of Environmental Sciences, 24(7): 1288-1294. DOI:10.1016/S1001-0742(11)60927-3 |
Lin L, Yu Z, Li Y. 2017a. Sequential batch thermophilic solid-state anaerobic digestion of lignocellulosic biomass via recirculating digestate as inoculum-Part II: Microbial diversity and succession[J]. Bioresource Technology, 241: 1027-1035. DOI:10.1016/j.biortech.2017.06.011 |
Lin Q, De Vrieze J, Li C, et al. 2017b. Temperature regulates deterministic processes and the succession of microbial interactions in anaerobic digestion process[J]. Water Research, 123: 134-143. DOI:10.1016/j.watres.2017.06.051 |
Liu W R, Zeng D, She L, et al. 2020. Comparisons of pollution characteristics, emission situations, and mass loads for heavy metals in the manures of different livestock and poultry in China[J]. Science of the Total Environment, 734: 139023. DOI:10.1016/j.scitotenv.2020.139023 |
Lu S G, Imai T, Ukita M, et al. 2007. Start-up performances of dry anaerobic mesophilic and thermophilic digestions of organic solid wastes[J]. Journal of Environmental Sciences, 19(4): 416-420. DOI:10.1016/S1001-0742(07)60069-2 |
Lv W, Zhang W, Yu Z. 2013. Evaluation of system performances and microbial communities of two temperature-phased anaerobic digestion systems treating dairy manure[J]. Bioresource Technology, 143(Complete): 431-438. |
Ma X X, Yu M, Song N, et al. 2020. Effect of ethanol pre-fermentation on organic load rate and stability of semi-continuous anaerobic digestion of food waste[J]. Bioresource Technology, 299: 133587. |
Mahdy A, Bi S, Song Y, et al. 2020. Overcome inhibition of anaerobic digestion of chicken manure under ammonia-stressed condition by lowering the organic loading rate[J]. Bioresource Technology Reports, 9: 100359. DOI:10.1016/j.biteb.2019.100359 |
Manosane A, 杨朝晖, 徐锐, 等. 2017. 猪粪与污泥不同配比对其厌氧共消化与微生物多样性的影响[J]. 环境工程学报, 11(11): 6014-6021. DOI:10.12030/j.cjee.201702001 |
Mata-alvarez J, Dosta J, Romero Iza M S, et al. 2014. A critical review on anaerobic co-digestion achievements between 2010 and 2013[J]. Renewable and Sustainable Energy Reviews, 36: 412-427. DOI:10.1016/j.rser.2014.04.039 |
Neumann P, Gonz Lez Z, Vidal G. 2017. Sequential ultrasound and low-temperature thermal pretreatment: Process optimization and influence on sewage sludge solubilization, enzyme activity and anaerobic digestion[J]. Bioresource Technology, 234: 178-187. DOI:10.1016/j.biortech.2017.03.029 |
宁静, 朱葛夫, 吕楠, 等. 2018. 碳氮比对猪粪与玉米秸秆混合厌氧消化产沼气性能的影响[J]. 农业工程学报, 34(S1): 93-98. |
Niu Q G, Kubota K, Qiao W, et al. 2015. Effect of ammonia inhibition on microbial community dynamic and process functional resilience in mesophilic methane fermentation of chicken manure[J]. Journal of Chemical Technology and Biotechnology, 90(12): 2161-2169. DOI:10.1002/jctb.4527 |
潘婧冉, 高苏, 赵国柱, 等. 2019. 餐厨垃圾厌氧消化处理主要过程的微生物群落结构分析[J]. 微生物学通报, 46(11): 2886-2899. |
Peng X, Zhang S, Li L, et al. 2018. Long-term high-solids anaerobic digestion of food waste: Effects of ammonia on process performance and microbial community[J]. Bioresource Technology, 262: 148-158. DOI:10.1016/j.biortech.2018.04.076 |
Qian Y, Song K, Hu T, et al. 2018. Environmental status of livestock and poultry sectors in China under current transformation stage[J]. Science of the Total Environment, 622: 702-709. |
Ros M, De souza O F J, Perez murcia M D, et al. 2017. Mesophilic anaerobic digestion of pig slurry and fruit and vegetable waste: Dissection of the microbial community structure[J]. Journal of Cleaner Production, 156: 757-765. DOI:10.1016/j.jclepro.2017.04.110 |
Ruan D, Zhou Z, Pang H, et al. 2019. Enhancing methane production of anaerobic sludge digestion by microaeration: Enzyme activity stimulation, semi-continuous reactor validation and microbial community analysis[J]. Bioresource Technology, 289: 121643. DOI:10.1016/j.biortech.2019.121643 |
Salama E S, Jeon B H, Kurade M B, et al. 2020. Enhanced anaerobic co-digestion of fat, oil, and grease by calcium addition: Boost of biomethane production and microbial community shift[J]. Bioresource Technology, 296: 122353. DOI:10.1016/j.biortech.2019.122353 |
Shen F, Li H, Wu X, et al. 2018. Effect of organic loading rate on anaerobic co-digestion of rice straw and pig manure with or without biological pretreatment[J]. Bioresource Technology, 250: 155-162. DOI:10.1016/j.biortech.2017.11.037 |
沈飞, 李汉广, 钟斌, 等. 2017. 碳氮比对稻草和猪粪生物处理及厌氧消化的影响[J]. 环境科学学报, 37(11): 4212-4219. |
史宏伟, 邹德勋, 左剑恶, 等. 2012. 梯度负荷下果蔬垃圾厌氧消化性能及微生物群落结构的研究[J]. 环境科学学报, 32(1): 232-240. |
宋壮壮, 吕爽, 刘哲, 等. 2019. 厌氧氨氧化耦合反硝化工艺的启动及微生物群落变化特征[J]. 环境科学, 40(11): 5057-5065. |
唐涛涛, 李江, 杨爱江, 等. 2020. 秸秆类型及配比变化对污泥厌氧消化中微生物群落的影响[J]. 化工进展, 39(2): 667-678. |
Wang H X, Xu J L, Liu X J, et al. 2018. Study on the pollution status and control measures for the livestock and poultry breeding industry in northeastern China[J]. Environmental Science and Pollution Research, 25(5): 4435-4445. DOI:10.1007/s11356-017-0751-2 |
Wang X J, Lu X G, Li F, et al. 2014. Effects of temperature and carbon-nitrogen (C/N) ratio on the performance of anaerobic co-digestion of dairy manure, chicken manure and rice straw: Focusing on ammonia inhibition[J]. Plos One, 9(5): 1-7. |
Yan Y L, Du Z W, Zhang L Q, et al. 2019. Identification of parameters needed for optimal anaerobic co-digestion of chicken manure and corn stover[J]. Rsc Advances, 9(51): 29609-29618. DOI:10.1039/C9RA05556H |
Yao Y, Huang G, An C, et al. 2020. Anaerobic digestion of livestock manure in cold regions: Technological advancements and global impacts[J]. Renewable and Sustainable Energy Reviews, 119: 109494. DOI:10.1016/j.rser.2019.109494 |
Zahan Z, Othman M Z. 2019. Effect of pre-treatment on sequential anaerobic co-digestion of chicken litter with agricultural and food wastes under semi-solid conditions and comparison with wet anaerobic digestion[J]. Bioresource Technology, 281: 286-295. DOI:10.1016/j.biortech.2019.01.129 |
Zhang T, Yang Y H, Liu L L, et al. 2014. Improved biogas production from chicken manure anaerobic digestion using cereal residues as co-substrates[J]. Energy & Fuels, 28(4): 2490-2495. |
Zhao Y, Sun F, Yu J, et al. 2018. Co-digestion of oat straw and cow manure during anaerobic digestion: Stimulative and inhibitory effects on fermentation[J]. Bioresource Technology, 269: 143-152. DOI:10.1016/j.biortech.2018.08.040 |
Ziganshina E E, Belostotskiy D E, Ilinskaya O N, et al. 2015. Effect of the organic loading rate increase and the presence of zeolite on microbial community composition and process stability during anaerobic digestion of chicken wastes[J]. Microbial Ecology, 70(4): 948-960. DOI:10.1007/s00248-015-0635-2 |
 2021, Vol. 41
2021, Vol. 41


