2. 国家地质实验测试中心, 北京 100037;
3. 中海国亚环保工程有限公司, 太原 030006
2. National Research Center for Geoanalys, Beijing 100037;
3. Chinasea Group Co. Ltd., Taiyuan 030006
多环芳烃(PAHs)是由两个或两个以上的苯环构成的持久性难降解有机污染物, 是一种疏水性化学物质, 在水中的溶解度小, 因具有高毒、致癌及致突变等性质而备受关注(Zhang et al., 2012b; Fan et al., 2018; Kong et al., 2018).同时, 也由于其自身的物理化学性质, 导致其极易在环境中富集与积累, 会给生态及人类健康带来很大的危害(Ke et al., 2018).PAHs的形成主要来源于人类活动, 包括煤炭开采、化石燃料发电、石油精炼、煤及化学品的生产等(Zhang et al., 2012b; Kong et al., 2018).焦炭生产过程是我国PAHs的主要来源之一, 除向大气排放外, PAHs在工艺过程中主要以废水的形式排放(Zhang et al., 2012b), 并且废水中存在的苯酚等有机物可一定程度地促进其溶解(Kong et al., 2018).PAHs也被检测到存在于我国众多的流域水体中, 其中4环以下的PAHs浓度较高, 难以降解(范博等, 2019), 这给水体中PAHs的处理带来了很大的挑战.PAHs若在处理过程中未实现有效的降解, 而以污泥的形式排出, 也会造成土壤的二次污染(Zhang et al., 2012b).因此, 需寻求高效降解PAHs的方法, 明晰其作用机理, 以期为PAHs在水体中的控制提供理论与技术支持.
高铁酸盐(Fe(Ⅵ)), 被认为是一种绿色的强氧化剂.在酸性环境中Fe(Ⅵ)离子相对于标准氢电极的氧化还原电位为2.20 V, 并且在水中的最终产物主要为环境友好的分子氧和Fe(Ⅲ), 其中Fe(Ⅲ)还可在水处理中起到絮凝的作用(Sharma et al., 2015; Wang et al., 2016; Ye et al., 2017; Deng et al., 2018; Xie et al., 2019).Fe(Ⅵ)因具有可以进行自由基和电子转移反应的能力而引起人们的关注(Sharma et al., 2015; Sharma et al., 2016), 但Fe(Ⅵ)的氧化却具有一定的选择性, 如优先攻击富电子基团(Wang et al., 2016; Ye et al., 2017; Xie et al., 2019), 致使目标物或产物无法实现完全的降解与矿化(Velo-Gala et al., 2014; Yang et al., 2019).谭雪梅(2015)与虞丹尼等(2015)研究pH为7.1及10.3~10.7时Fe(Ⅵ)氧化菲的降解动力学和反应路径, 发现菲的矿化效果远不及菲的降解效果.
Fenton氧化法则通过Fe(Ⅱ)与Fe(Ⅲ)的转化, 同时催化H2O2产生具有2.80 V氧化还原电位的羟基自由基(·OH), ·OH可无选择性地氧化大部分有机物(Wang et al., 2016).采用Fenton法降解PAHs, 如菲、荧蒽、苯并a芘等, 虽可使最大降解率达到90%以上, 但反应条件却过于苛刻, 如需控制pH为2.5左右、温度为60 ℃(Shih et al., 2016; Usman et al., 2016; Bendouz et al., 2017).基于两种氧化法中Fe(Ⅱ)与Fe(Ⅲ)的生成与转化, 并结合其各自优势, 考虑将两种氧化法联用, 以提高PAHs的降解效果(王艺霏等, 2016).Martins等(2007)发现Fe(Ⅵ)/Fenton联合法可有效用于含除草剂三氟拉林废水的处理.王亚星(2018)研究了Fe(Ⅵ)-类Fenton体系处理晚期垃圾渗滤液, 发现对渗滤液中CODCr的去除明显优于单独的Fe(Ⅵ)氧化法.
菲(PHE)是含3个苯环的典型多环芳烃, 选用菲作为Fe(Ⅵ)/Fenton联合体系氧化降解PAHs的研究对象.课题组前期对Fe(Ⅵ)/Fenton联合体系氧化降解菲的研究表明, 体系的氧化过程分为两步, 第一步是Fe(Ⅵ)对菲的氧化, 氧化时间为5 min; 第二步是加入Fenton试剂, 利用Fe(Ⅵ)氧化法产生的Fe(Ⅱ)及后续投加的少量Fe(Ⅱ)催化H2O2产生·OH, 依靠·OH的无选择性, 继续对菲及上一步氧化产物进行降解, 氧化时间为15 min(王艺霏等, 2016).实验均在pH为5的条件下进行, 并且联合氧化体系中菲的降解率分别比单一Fe(Ⅵ)氧化法和Fenton氧化法高10.35%与31.40%, 有效提高了菲的降解效率(王艺霏等, 2016).但联合体系对菲的降解机理及路径仍需进一步被探究.本实验在前期研究的基础上, 也分为两步对联合体系的氧化机理及菲的降解路径进行研究.先考察弱酸条件下Fe(Ⅵ)降解菲的效果, 并结合中性及碱性条件, 分析弱酸条件下Fe(Ⅵ)的氧化机理, 后与Fenton氧化法联用, 对联合氧化机理及菲的降解路径进行研究.
2 材料与方法(Materials and methods) 2.1 主要试剂菲(PHE, 97%, 上海麦克林生化科技有限公司)、高铁酸钾(K2FeO4, ≥95%, 上海易恩化学技术有限公司); 双氧水(30%)、乙腈(分析纯)、二氯甲烷(农残级)、盐酸羟胺、无水硫酸钠、氯化钠、叔丁醇、磷酸二氢钠、磷酸二氢钾、磷酸氢二钾、硼砂、盐酸、硫酸亚铁铵、硫酸、邻菲罗啉、乙酸铵和冰乙酸均购买自太原津昌华科贸有限公司.
2.2 实验方法 2.2.1 储备液的配制菲储备液: 取0.0053 g菲溶于乙腈中, 用乙腈定容至100 mL, 得到0.3 mmol·L-1的菲储备液.研究显示, 菲的水溶性极低, 但水中有机物可促进其溶解(Kong et al., 2018), 并且2%(V/V)的乙腈对氧化反应影响甚小(Lee et al., 2009).
高铁酸钾储备液: 取0.0198 g K2FeO4溶于硼砂-盐酸缓冲溶液(pH=9)中, 继续用缓冲溶液定容至50 mL, 得到2 mmol·L-1的K2FeO4储备液, 现配现用.
2.2.2 实验步骤Fe(Ⅵ)对菲的氧化实验: 室温(约25 ℃)下, 取2 mL的菲储备液, 定容至100 mL的磷酸盐缓冲溶液中, 得到6 μmol·L-1的菲反应液, 置于250 mL的烧杯中.将K2FeO4储备液加入反应液中, 搅拌均匀.反应一定时间后, 采用荧光分析法测定菲的浓度.
Fe(Ⅵ)/Fenton体系对菲的氧化实验: 室温下, 在pH为5(磷酸盐缓冲溶液)的6 μmol·L-1的菲反应液中, 加入K2FeO4储备液, 反应5 min后加入H2O2和FeSO4·7H2O, 继续反应15 min, 药品投加比例为n(PHE): n(K2FeO4): n(H2O2)=1:2:2和n(H2O2): n(FeSO4)=15:1(王艺霏等, 2016).过程中取样采用荧光分析法测定菲的浓度, 采用邻菲罗啉络合显色法检测离子态Fe(Ⅱ)和Fe(Ⅲ)的浓度.
·OH的掩蔽与捕获实验: 在菲的氧化实验中加入过量的叔丁醇进行·OH掩蔽实验; 加入过量的对苯二甲酸以捕获氧化过程中产生的·OH, 检测其产物2-羟基对苯二甲酸的生成情况.
GC-MS样品预处理及产物分析: 实验过程中取样并加入盐酸羟胺终止反应后, 加入3 g NaCl, 待其完全溶解, 加入20 mL二氯甲烷, 摇床振荡15 min, 移至分液漏斗进行分离, 收集二氯甲烷层.水层依次加入5 mL二氯甲烷进行两次萃取, 收集到的二氯甲烷层加入过量的无水硫酸钠吸水, 过滤后氮吹至1 mL(虞丹尼等, 2015).样品经预处理后采用GC-MS检测产物, 并与MS数据库对比进行定性分析.
2.3 分析方法菲与2-羟基对苯二甲酸的荧光分析: 取样至提前加好0.5 mol·L-1盐酸羟胺的离心管中, 终止氧化反应, 过滤后采用荧光分光光度计测定菲与2-羟基对苯二甲酸的含量.菲的检测条件: Ex=250 nm, Em=300~500 nm(虞丹尼等, 2015).2-羟基对苯二甲酸的检测条件: Ex=312 nm, Em=325~575 nm(谭雪梅, 2015).步长为3 nm, 扫描速度为2000 nm·min-1.
Fe(Ⅱ)和Fe(Ⅲ)的浓度检测: 参照《水和废水监测分析方法》(第四版), 采用邻菲罗啉络合显色法检测Fe(Ⅱ)和Fe(Ⅲ)的浓度, 水样过滤后在510 nm的波长下测定, 缓冲溶液为乙酸-乙酸铵溶液.
GC-MS检测: 采用GCMS-TQ8040气相色谱/三重四级杆, Rxi-5Sil色谱柱(30 m×0.25 mm×0.25 μm)进行产物检测.气相色谱升温程序: 70 ℃保持1 min, 70~300 ℃(10 ℃·min-1), 300 ℃保持10 min; 分流进样(分流比为10), 氦气作载气, 流速为1.0 mL·min-1.质谱参数: 离子源: 电子轰击源(温度: 230 ℃), 发射电子能量: 70 eV, 接口温度: 280 ℃, 进样口温度: 300 ℃, 柱箱温度: 70 ℃, 扫描范围: 50~500 m/z.
2.4 数据分析所有实验数据均经过3次重复测定得到, 数据分析及绘图采用OriginPro (OriginPro 8.0, OriginLab Corporation, Northampton, MA, USA).
3 结果分析与讨论(Results analysis and discussion) 3.1 弱酸条件下Fe(Ⅵ)投加量对Fe(Ⅵ)氧化降解菲的影响弱酸条件下Fe(Ⅵ)氧化降解菲是Fe(Ⅵ)/Fenton联合体系降解菲的第一步, 因此先考察弱酸条件下Fe(Ⅵ)对菲的氧化效果, 以探究其氧化机理.在初始pH为5的反应液中, 考察弱酸条件下不同的Fe(Ⅵ)投加量(n(PHE): n(K2FeO4)=3:1;2:1;1:1;1:2;1:3)对Fe(Ⅵ)氧化降解菲的影响, 如图 1所示.在Fe(Ⅵ)氧化过程中, 菲的浓度在前20 s内急剧下降后趋于稳定, 这可能是由于Fe(Ⅵ)在酸性条件下易受水解作用的影响而稳定性较差、氧化效能发挥极快导致的(Sharma, 2011; Sharma et al., 2015; Manoli et al., 2017a; Liu et al., 2019).菲的降解率随Fe(Ⅵ)/PHE物质的量的比的增加而增加, Fe(Ⅵ)浓度的增大可能会一定程度地导致分子碰撞频率的提高.虽然在酸性条件下Fe(Ⅵ)受水解作用的影响较大, 但当n(PHE): n(K2FeO4)为1:2与1:3时菲的降解率仍可分别达到61.81%与62.93%, 这可能归因于该条件下Fe(Ⅵ)的高氧化性能(Manoli et al., 2017a).当投加比从1:2增加到1:3时, 菲的降解率增加量较小, 表明高浓度的Fe(Ⅵ)对菲的降解促进作用有限, 这可能是Fe(Ⅵ)在酸性条件中氧化性能发挥时间较短而碰撞频率有限所导致的(Sharma, 2011; Sharma et al., 2015; Manoli et al., 2017a; Liu et al., 2019).结合经济成本, 选取n(PHE): n(K2FeO4)为1:2进行实验.
 |
| 图 1 弱酸条件下Fe(Ⅵ)投加量对Fe(Ⅵ)氧化降解菲的影响 Fig. 1 Effect of Fe(Ⅵ) dosage on phenanthrene degradation by Fe(Ⅵ) under weak acid conditions |
对比中性及碱性条件, 进一步分析弱酸条件下Fe(Ⅵ)氧化降解菲的机理.当Fe(Ⅵ)投加量为n(PHE): n(K2FeO4)=1:2时, 考察pH为5、7、9时Fe(Ⅵ)氧化降解菲的效果.据报道, Fe(Ⅵ)氧化法中主要起氧化作用的为Fe(Ⅵ)、Fe(Ⅴ)和Fe(Ⅳ)等高价态铁和活性氧自由基, 如·OH自由基(Han et al., 2015; Sharma et al., 2015; Xie et al., 2019; Tian et al., 2020).由于溶液的pH是产生自由基类型和数量的关键, 因此以叔丁醇为·OH的掩蔽剂(Wang et al., 2016), 在不同pH溶液中进行自由基掩蔽实验, 检测Fe(Ⅵ)氧化过程中可能存在的·OH.然而, Yamazaki等(1991)及Shao等(2019)研究表明, 叔丁醇也可能会与Fe(Ⅴ)/Fe(Ⅳ)发生反应, 消耗高价态铁, 从而影响目标污染物的氧化.对苯二甲酸是一种比较稳定的物质, 捕获·OH后会被氧化为2-羟基对苯二甲酸(Buxton et al., 1988; Tian et al., 2020), 故检测2-羟基对苯二甲酸的形成情况以确定·OH的生成.
不同pH中Fe(Ⅵ)氧化降解菲的效果如图 2所示, pH越低, Fe(Ⅵ)氧化降解菲趋于稳定的时间越短, 酸性条件下菲的降解率(61.81%)偏低于中性(67.46%)及碱性(72.04%).研究表明, 大部分可被Fe(Ⅵ)氧化的有机物在酸性条件下具有较高的反应速率(Sharma et al., 2015; Manoli et al., 2017a).不可避免的是, 由于Fe(Ⅵ)自身的不稳定性, 极易发生水解, 导致部分Fe(Ⅵ)没有被有效利用, 使降解效率无法达到理论值.尤其是在酸性条件下, 受到H+的影响, Fe(Ⅵ)的水解反应较为严重, 这可能是该条件下降解效果稍差的主要原因(Manoli et al., 2017a).但此时的Fe(Ⅵ)却具备高氧化性能, Fe(Ⅵ)的4种质子化形式(pKa1=1.6;pKa2=3.5;pKa3=7.3)中单质子化形式(HFeO4-)占据主导地位(Zhang et al., 2012a; Sharma, 2013; Deng et al., 2018), HFeO4-在含氧配体上具有较大的自旋密度, 是一种比FeO42-氧化能力更强的物质(Sharma, 2013; Han et al., 2015; Liu et al., 2019), 这一性质增强了Fe(Ⅵ)的氧化能力.在碱性溶液中Fe(Ⅵ)较为稳定, 仅有0.70 V的氧化还原电位, 有较充足的时间与目标物接触氧化并形成Fe(OH)3絮体吸附目标物(Jiang, 2014; Xie et al., 2019).基于Fe(Ⅵ)的稳定性、氧化及絮凝能力, 酸性条件下菲的降解效率偏低.
 |
| 图 2 pH为5、7、9时有无叔丁醇对Fe(Ⅵ)氧化降解菲的影响 Fig. 2 Degradation of phenanthrene by Fe(Ⅵ) in the absence and presence of tert-butanol at pH 5, 7, 9 |
图 2还显示, 叔丁醇对碱性条件中菲的降解率影响较大, 中性次之, 酸性较小.作为自由基掩蔽剂, 溶液中叔丁醇的存在会中断Fe(Ⅵ)的自由基链反应, 从而降低菲的降解率, 然而, 中间高价态铁Fe(Ⅴ)和Fe(Ⅳ)可能仍然发挥着重要的氧化作用(Zhang et al., 2012a; Sharma et al., 2015).不同pH溶液中2-羟基对苯二甲酸随时间的生成情况如图 3a~3c所示, 结果与叔丁醇掩蔽实验的结果一致, 即在碱性条件下, 较多的·OH参与氧化反应, 可能是Fe(Ⅵ)氧化时间接地形成了·OH (2FeO42-+H2O→2Fe(OH)3+5[O]; [O]+H2O→2·OH)(Han et al., 2015).而酸性条件下·OH的捕获较少, 这证明在酸性条件下Fe(Ⅵ)的高氧化性能可能是中间高价态铁的存在而导致的.中间高价态铁对污染物降解具有高度的反应性, 其中Fe(Ⅴ)和Fe(Ⅳ)的反应活性比Fe(Ⅵ)高2~5级(Sharma et al., 2015; Manoli et al., 2017a; Tian et al., 2020).Fe(Ⅴ)、Fe(Ⅳ)等离子的参与可增强反应体系的氧化能力, 其形成可能有两种途径: ①通过1-e-/2-e-转移步骤, 将Fe(Ⅵ)直接还原为Fe(Ⅱ)/Fe(Ⅲ), 如Fe(Ⅵ)→Fe(Ⅳ)→Fe(Ⅱ)或Fe(Ⅵ)→Fe(Ⅴ)→Fe(Ⅲ).已有文献报道了这种在Fe(Ⅵ)分解过程中形成Fe(Ⅴ)和Fe(Ⅳ)的推测(Sharma, 2011; Sharma et al., 2016); ②有机物还原Fe(Ⅵ)产生中间高价态铁, 如Fe(Ⅵ)+Fe(Ⅱ)→Fe(Ⅴ)+Fe(Ⅲ); Fe(Ⅱ)-org/Fe(Ⅲ)-org+O2/H2O2→Fe(Ⅳ)-org/Fe(Ⅴ)-org(org表示为有机物) (Sharma, 2013; Lee et al., 2014; Manoli et al., 2017a; Manoli et al., 2017b; Shao et al., 2019).Fe(Ⅱ)和Fe(Ⅲ)是Fe(Ⅵ)的最终还原物质, O2和H2O2是由酸分解Fe(Ⅵ)而得(Lee et al., 2014; Manoli et al., 2017a; Shao et al., 2019).
 |
| 图 3 pH为5(a), 7(b), 9(c)时2-羟基对苯二甲酸随时间的荧光强度变化 Fig. 3 The fluorescence intensity variations of 2-hydroxyterephthalic acid over time at pH 5(a), 7(b) and 9(c) |
联合氧化体系中第二步为Fenton氧化法, 在Fe(Ⅵ)氧化5 min时加入Fenton试剂, 继续氧化降解菲及产物.课题组前期研究成果表明, 联合氧化体系的最佳条件为pH=5, n(PHE): n(K2FeO4): n(H2O2)=1:2:2, n(H2O2): n(FeSO4)=15:1, K2FeO4与Fenton试剂反应时间分别为5 min与15 min.在该条件下, 菲的降解率分别比单一Fe(Ⅵ)氧化法和Fenton氧化法高10.35%与31.40%, 有效地提高了目标物的降解效率(王艺霏等, 2016).
为探究Fe(Ⅵ)/Fenton联合体系的氧化机理, 基于上述的最佳反应条件, 考察了叔丁醇对联合体系氧化降解菲的影响, 如图 4a所示.前5 min Fe(Ⅵ)氧化菲的降解率为61.81%, 后续Fenton法继续对菲进行氧化降解, 总降解率可达到83.64%, 这与之前的研究相近(王艺霏等, 2016; Li et al., 2019).联合氧化体系中Fe(Ⅵ)氧化法如3.2节所讨论, 主要起氧化作用的是中间高价态铁.而由图 4a发现, 后续的Fenton氧化法中叔丁醇的加入明显抑制了体系对菲的降解, 这表明Fenton法中起氧化作用的为·OH.联合体系不仅提高了菲的降解率, 而且实现了高价态铁与·OH联合对菲的氧化降解, 发挥了Fe(Ⅵ)氧化法与Fenton氧化法各自的优势.
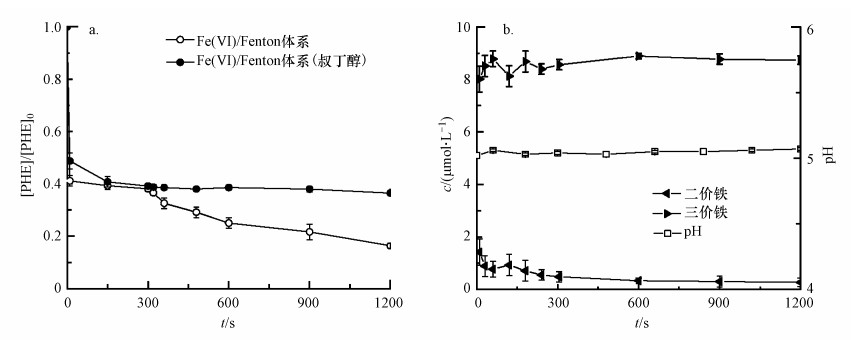 |
| 图 4 Fe(Ⅵ)/Fenton体系中有无叔丁醇对菲降解效果的影响(a)及pH值、溶解的铁离子浓度随时间的变化(b) Fig. 4 Degradation of phenanthrene in the absence and presence of tert-butanol (a) and pH, concentration of dissolved iron ions as a function of time(b) in the combined system of Fe(Ⅵ) and Fenton |
对联合体系的pH值、离子态Fe(Ⅱ)和Fe(Ⅲ)的浓度进行检测以考察体系中二三价铁离子可能发挥的作用, 如图 4b所示.缓冲溶液使得体系pH值稳定在5左右.溶液中Fe(Ⅲ)的浓度在反应过程中较稳定.依据文献及铁的氢氧化物的溶度积得知, 当pH=5时Fe(Ⅲ)大多数以Fe(OH)2+的形式存在, 稳定的pH及温度使得溶液中Fe(Ⅲ)的浓度也相对稳定(陈海祥, 2013), 但磷酸盐缓冲溶液也对其存在着一定的络合作用(李巧玲等, 2000; Xie et al., 2019), 结果可能是两者共同作用所致.Fe(Ⅱ)在pH=5时呈离子态(Sharma, 2011), Fe(Ⅱ)的浓度在反应过程中呈小幅度下降趋势, 这可能是由于溶度积较大的Fe(OH)2(Ksp=8.0×10-16)易转化为溶度积较小的难溶物Fe(OH)3(Ksp=4.0×10-38)(陈海祥, 2013).Fe(Ⅵ)氧化降解菲5 min时Fe(Ⅱ)的浓度为0.48 μmol·L-1, 加入Fenton试剂后, Fe(Ⅱ)/H2O2为1:9.375, 这与Fenton法降解菲的最佳比值1:10接近(Bendouz et al., 2017), 故呈现出良好的降解效果, 也正是这一特点促使两种氧化法的有效结合.Fenton法氧化过程中, Fe(Ⅱ)因参与二三价铁离子转化而被消耗, 协同催化H2O2产生·OH继续氧化有机物(Fe(Ⅱ)+H2O2→Fe(Ⅲ)+·OH; Fe(Ⅲ)+H2O2→Fe(Ⅱ)+H++HO2·)(Velo-Gala et al., 2014).联合体系的第二步Fenton氧化法, 合理地利用了第一步反应中Fe(Ⅵ)氧化产生的Fe(Ⅱ), 减少Fenton试剂中Fe(Ⅱ)的投加量, Fe(Ⅱ)催化H2O2产生·OH, 实现了对有机物的进一步降解.
3.4 联合体系氧化降解菲的主要产物分析Fe(Ⅵ)/Fenton联合体系降解菲的实验中分别取Fe(Ⅵ)反应阶段的0 s、30 s、2.5 min、5 min及Fenton法反应阶段的30 s、5 min、15 min的样品进行GC-MS检测, 以考察联合体系降解菲的过程中主要产物的变化, 其GC图谱见图 5.通过检索MS数据库, 并对比Fe(Ⅵ)-0 s图谱分析发现, 弱酸条件下Fe(Ⅵ)氧化降解菲的主要产物为邻苯二甲酸酯衍生物和9-芴甲醛衍生物, 随着Fe(Ⅵ)氧化时间的增长, 9-芴甲醛衍生物最终转为邻苯二甲酸酯衍生物.两种产物均为菲在被氧化时常见的产物(Gupta, 2016; Rodriguez et al., 2017; Fan et al., 2018).Fe(Ⅵ)氧化5 min时, 反应体系基本稳定, 这时菲虽具有较高的降解率, 但氧化后的有机物并未被完全矿化.研究表明, Fe(Ⅵ)在中性及碱性条件下氧化降解菲的主要产物为9, 10菲醌, 在这两种反应条件下菲的矿化效果较差(谭雪梅, 2015; 虞丹尼等, 2015).本实验中菲的主要产物可能是9, 10-菲醌被弱酸条件下存在的多种铁离子, 如Fe(Ⅴ)、Fe(Ⅳ)以及Fe(Ⅲ)等进一步氧化的产物(Gupta, 2016; Rodriguez et al., 2017; Fan et al., 2018).据报道, 在存在Fe(Ⅲ)的情况下, 9, 10-菲醌稳定性较差, Fe(Ⅲ)可被还原为Fe(Ⅱ), 同时菲醌被氧化(Milko et al., 2009).这也说明在酸性条件下Fe(Ⅵ)氧化菲的矿化程度高于中性及碱性.
 |
| 图 5 Fe(Ⅵ)/Fenton体系氧化降解菲的GC图谱 (图 5中保留时间为15.255、16.390和16.830 min的峰依次对应菲、9-芴甲醛衍生物和邻苯二甲酸酯衍生物.) Fig. 5 GC spectrum of phenanthrene degradation by the combined system of Fe(Ⅵ) and Fenton |
后续的Fenton氧化阶段初期继续生成邻苯二甲酸酯衍生物, 但反应15 min时菲与Fe(Ⅵ)氧化菲的主要产物的特征峰均明显降低, 可见, Fenton氧化法可进一步降解菲及产物.尤其是邻苯二甲酸酯, 其不仅对内分泌系统的激素活性有一定的抑制作用, 而且易在环境中累积和富集, 对人类健康和生态系统具有潜在的威胁(朱峥嵘等, 2019).经过Fenton法氧化后, 体系有效实现了菲及产物的矿化, 减轻了水中的有机物负荷.特别说明, 在Fenton-15 min的GC-MS图谱中, 9-芴甲醛衍生物有明显峰, 这是由于总有机物含量很低, 使得其相对占比突出.可见, 在联合体系中, 第一步Fe(Ⅵ)氧化法主要实现了对菲的降解, 第二步Fenton氧化法进一步对Fe(Ⅵ)氧化菲的产物进行降解与矿化, 弥补了单一Fe(Ⅵ)氧化法的选择性与不完全氧化性等不足.
3.5 联合体系氧化降解菲的产物路径推测在整个联合氧化过程中, 检测到菲的产物见表 1(通过检索MS数据库得到).实验中衍生物的出现可能是菲的产物与烷基自由基R·发生了复杂的反应.基于表 1确定的有机中间产物并结合其它文献, 推测Fe(Ⅵ)/Fenton体系降解菲的可能路径, 如图 6所示.
| 表 1 联合氧化体系中GC-MS检测到菲的产物 Table 1 Identified products of phenanthrene by GC-MS analysis in the combined system of Fe(Ⅵ) and Fenton |
 |
| 图 6 联合氧化体系中菲的降解路径 Fig. 6 Proposed phenanthrene degradation pathway in the combined system of Fe(Ⅵ) and Fenton |
菲在高价态铁与·OH的作用下, 逐步被氧化、羟基化、脱碳、加氢而分解为长链酸、酯, 最终降解为CO2和H2O.菲的9~10位电子云密度相对较大, 化学反应活性较强(Wang et al., 2016), 易受到氧化攻击而形成9, 10菲醌(A)(谭雪梅, 2015; 虞丹尼等, 2015; Ye et al., 2017).反应中H+的存在, 使得Fe(Ⅵ)受水解作用的影响较大, 以二电子转移的形式释放出O2与H2O2并生成Fe(Ⅲ).在Fe(Ⅲ)及高价态铁的作用下, 9, 10菲醌活性极大未被捕捉到, 被氧化为联苯酸酐(B)(Fan et al., 2018).Milko等(2009)使用简单的气相模型研究表明菲醌能积极参与铁的氧化还原过程, 同时还原Fe(Ⅲ)为Fe(Ⅱ).联苯酸酐可能通过以下3种路径转化为长链酸、酯.
① 联苯酸酐(B)的酸酐键断裂形成二苯基-2, 2-二甲醛(C)(Gu et al., 2018), 其中单个苯环脱离或被氧化开环, 降解为邻苯二甲酸酯衍生物(P2); ②联苯酸酐(B)脱去CO2降解为9-芴酮(D), 酮基被氧化为醛基(P1), 之后降解为邻苯二甲酸酯衍生物(P2); ③9-芴酮(D)加氢形成二苯甲酮(E), 两个苯环依次被氢加成或被氧化(P3→P4→P5)(Gupta, 2016).最终转化为长链酸、酯, 进而被完全矿化.
结合2.5节可知, 路径二为联合体系中菲的主要降解路径.其中, Fe(Ⅵ)氧化降解菲的主要路径为PHE→P2, 体现了对菲的降解; 而后续Fenton氧化法的主要路径则为P1→CO2+H2O, 体现了对产物的进一步降解与矿化.这也验证了联合氧化体系可有效地提高菲的矿化程度.
4 结论(Conclusions)1) Fe(Ⅵ)在弱酸性条件下降解菲的效率稍差于中性及碱性条件.但在弱酸条件下, 菲的降解速率较高, 降解率随Fe(Ⅵ)/PHE物质的量的比的增加而增加.当n(PHE): n(K2FeO4)为1:2时, 菲的降解率为61.81%, 其主要起氧化作用的是中间高价态铁, ·OH参与反应较少.经产物分析发现, 酸性条件下Fe(Ⅵ)的高氧化性可提高菲的矿化效果.
2) Fe(Ⅵ)/Fenton联合体系不仅提高了菲的降解率, 还合理利用Fe(Ⅱ), 结合高价态铁与·OH, 发挥了单一氧化法各自的优势, 有效提高了菲的矿化效果.其中Fe(Ⅵ)氧化菲产生的Fe(Ⅱ)可被后续Fenton氧化法利用, 减少了Fe(Ⅱ)的投加量并催化H2O2产生·OH继续对有机物进行降解; Fe(Ⅵ)氧化法主要为高价态铁对菲的降解, Fenton氧化法则主要为·OH对菲与产物的进一步降解, 有效实现了对有机物的降解与矿化.
3) 菲在联合氧化体系中逐步被氧化、羟基化、脱碳、加氢而分解为长链酸、酯, 最后被矿化为CO2和H2O.可能的降解路径有三条, 主要的中间产物为邻苯二甲酸酯衍生物和9-芴甲醛衍生物.
Bendouz M, Tran L H, Coudert L, et al. 2017. Degradation of polycyclic aromatic hydrocarbons in different synthetic solutions by Fenton′s oxidation[J]. Environmental Technology, 38(1): 116-127. DOI:10.1080/09593330.2016.1188161 |
Buxton G V, Greenstock C L, Helman W P, et al. 1988. Critical Review of rate constants for reactions of hydrated electrons, hydrogen atoms and hydroxyl radicals (·OH/·O- in Aqueous Solution[J]. Journal of Physical and Chemical Reference Data, 17(2): 513e886. |
陈海祥. 2013. 检测纸浆铁含量新方法与酸洗去除未漂麦草浆中铁离子的研究[D]. 广州: 华南理工大学
|
Deng Y, Jung C, Liang Y, et al. 2018. Ferrate(Ⅵ) decomposition in water in the absence and presence of natural organic matter (NOM)[J]. Chemical Engineering Journal, 334: 2335-2342. DOI:10.1016/j.cej.2017.12.006 |
范博, 王晓南, 黄云, 等. 2019. 我国七大流域水体多环芳烃的分布特征及风险评价[J]. 环境科学, 40(5): 2101-2114. |
Fan G, Liu X, Lin C, et al. 2018. Peroxymonosulfate assisted mechanochemical method for the degradation of phenanthrene in contaminated soils[J]. Emerging Contaminants, 4(1): 22-31. DOI:10.1016/j.emcon.2018.10.002 |
Gu M, Sui Q, Farooq U, et al. 2018. Enhanced degradation of trichloroethylene in oxidative environment by nZVI/PDA functionalized rGO catalyst[J]. Journal of Hazardous Materials, 359: 157-165. DOI:10.1016/j.jhazmat.2018.07.013 |
Gupta H. 2016. Photocatalytic degradation of phenanthrene in the presence of akaganeite nano-rods and the identification of degradation products[J]. RSC Advances, 6: 112721-112727. DOI:10.1039/C6RA24602H |
Han Q, Wang H, Dong W, et al. 2015. Degradation of bisphenol A by ferrate(Ⅵ) oxidation: Kinetics, products and toxicity assessment[J]. Chemical Engineering Journal, 262: 34-40. DOI:10.1016/j.cej.2014.09.071 |
Jiang J Q. 2014. Advances in the development and application of ferrate(Ⅵ) for water and wastewater treatment[J]. Journal of Chemical Technology and Biotechnology, 89: 165-177. DOI:10.1002/jctb.4214 |
Ke Y, Ning X, Liang J, et al. 2018. Sludge treatment by integrated ultrasound-Fenton process: characterization of sludge organic matter and its impact on PAHs removal[J]. Journal of Hazardous Materials, 343: 191-199. DOI:10.1016/j.jhazmat.2017.09.030 |
Kong Q, Wu H, Liu L, et al. 2018. Solubilization of polycyclic aromatic hydrocarbons (PAHs) with phenol in coking wastewater treatment system: Interaction and engineering significance[J]. Science of the Total Environment, 628-629: 467-473. DOI:10.1016/j.scitotenv.2018.02.077 |
Lee Y, Kissner R, von Gunten U. 2014. Reaction of ferrate(Ⅵ) with ABTS and self-decay of ferrate(Ⅵ): kinetics and mechanisms[J]. Environmental Science & Technology, 48(9): 5154-5162. |
Lee Y, Zimmermann S G, Kieu A T, et al. 2009. Ferrate (Fe(Ⅵ)) application for municipal wastewater treatment: A novel process for simultaneous micropollutant oxidation and phosphate removal[J]. Environmental Science & Technology, 43(10): 3831-3838. |
李巧玲, 魏雨, 李琳. 2000. 含磷酸根的三价铁盐水解机理的研究[J]. 华南理工大学学报(自然科学版), 28(12): 12-17. DOI:10.3321/j.issn:1000-565X.2000.12.003 |
Liu H, Pan X, Chen J, et al. 2019. Kinetics and mechanism of the oxidative degradation of parathion by Ferrate(Ⅵ)[J]. Chemical Engineering Journal, 365: 142-152. DOI:10.1016/j.cej.2019.02.040 |
Li Y N, Duan Z H, Wang Y F, et al. 2019. Preliminary treatment of phenanthrene in coking wastewater by a combined potassium ferrate and Fenton process[J]. International Journal of Environmental Science and Technology, 16: 4483-4492. DOI:10.1007/s13762-018-2037-8 |
Manoli K, Nakhla G, Ray A K, et al. 2017a. Enhanced oxidative transformation of organic contaminants by activation of ferrate(Ⅵ): Possible involvement of FeV/FeIV species[J]. Chemical Engineering Journal, 307: 513-517. DOI:10.1016/j.cej.2016.08.109 |
Manoli K, Nakhla G, Ray A K, et al. 2017b. Oxidation of caffeine by acid-activated ferrate(Ⅵ): Effect of ions and natural organic matter[J]. Aiche Journal, 63: 4998-5006. DOI:10.1002/aic.15878 |
Martins A F, Frank C D S, Wilde M L. 2007. Treatment of a trifluraline effluent by means of oxidation-coagulation with Fe(Ⅵ) and combined fenton processes[J]. CLEAN-Soil Air Water, 35(1): 88-99. DOI:10.1002/clen.200600017 |
Milko P, Roithová J. 2009. Redox processes in the iron(Ⅲ)/9, 10-phenanthraquinone system[J]. Inorganic Chemistry, 48(24): 11734-11742. DOI:10.1021/ic901789h |
Rodriguez J, García A, Poznyak T, et al. 2017. Phenanthrene degradation in soil by ozonation: Effect of morphological and physicochemical properties[J]. Chemosphere, 169: 53-61. DOI:10.1016/j.chemosphere.2016.10.141 |
Shao B, Dong H, Sun B, et al. 2019. Role of Ferrate(Ⅳ) and Ferrate(Ⅴ) in activating Ferrate(Ⅵ) by calcium sulfite for enhanced oxidation of organic contaminants[J]. Environmental Science & Technology, 53(2): 894-902. |
Sharma V K. 2011. Oxidation of inorganic contaminants by ferrates (VI, V, and IV)-kinetics and mechanisms: a review[J]. Journal of Environmental Management, 92(4): 1051-1073. DOI:10.1016/j.jenvman.2010.11.026 |
Sharma V K. 2013. Ferrate(Ⅵ) and ferrate(Ⅴ) oxidation of organic compounds: Kinetics and mechanism[J]. Coordination Chemistry Reviews, 257(2): 495-510. DOI:10.1016/j.ccr.2012.04.014 |
Sharma V K, Chen L, Zboril R. 2016. Review on high valent FeVI (Ferrate): A sustainable green oxidant in organic chemistry and transformation of pharmaceuticals[J]. ACS Sustainable Chemistry & Engineering, 4(1): 18-34. |
Sharma V K, Zboril R, Varma R S. 2015. Ferrates: greener oxidants with multimodal action in water treatment technologies[J]. Accounts of Chemical Research, 48(2): 182-191. DOI:10.1021/ar5004219 |
Shih Y J, Binh N T, Chen C W, et al. 2016. Treatability assessment of polycyclic aromatic hydrocarbons contaminated marine sediments using permanganate, persulfate and Fenton oxidation processes[J]. Chemosphere, 150: 294-303. DOI:10.1016/j.chemosphere.2016.01.112 |
谭雪梅. 2015. 多环芳烃在高铁酸钾和CuO/TiO2及其协同氧化体系中的转化特性研究[D]. 重庆: 重庆大学
|
Tian S Q, Wang L, Liu Y L, et al. 2020. Degradation of organic pollutants by ferrate/biochar: Enhanced formation of strong intermediate oxidative iron species[J]. Water Research, 183: 116054. DOI:10.1016/j.watres.2020.116054 |
Usman M, Hanna K, Haderlein S. 2016. Fenton oxidation to remediate PAHs in contaminated soils: A critical review of major limitations and counter-strategies[J]. Science of the Total Environment, 569-570: 179-190. DOI:10.1016/j.scitotenv.2016.06.135 |
Velo-Gala I, López-Peñalver J J, Sánchez-Polo M, et al. 2014. Comparative study of oxidative degradation of sodium diatrizoate in aqueous solution by H2O2/Fe2+, H2O2/Fe3+, Fe(Ⅵ) and UV, H2O2/UV, K2S2O8/UV[J]. Chemical Engineering Journal, 241: 504-512. DOI:10.1016/j.cej.2013.10.036 |
Wang C, Klamerth N, Messele S A, et al. 2016. Comparison of UV/hydrogen peroxide, potassium ferrate(Ⅵ), and ozone in oxidizing the organic fraction of oil sands process-affected water (OSPW)[J]. Water Research, 100: 476-485. DOI:10.1016/j.watres.2016.05.037 |
王亚星. 2018. 缓释型高铁酸钾联合过氧化氢处理晚期垃圾渗滤液的试验研究[D]. 郑州: 郑州大学
|
王艺霏, 李亚男, 王迪, 等. 2016. 高铁酸钾-Fenton联合氧化法对菲的去除[J]. 环境工程学报, 10(11): 6536-6540. DOI:10.12030/j.cjee.201603162 |
Xie X, Cheng H. 2019. A simple treatment method for phenylarsenic compounds: Oxidation by ferrate (Ⅵ) and simultaneous removal of the arsenate released with in situ formed Fe(Ⅲ) oxide-hydroxide[J]. Environment International, 127: 730-741. DOI:10.1016/j.envint.2019.03.059 |
Yamazaki I, Piette L H. 1991. EPR spin-trapping study on the oxidizing species formed in the reaction of the ferrous ion with hydrogen peroxide[J]. Journal of the American Chemical Society, 113(20): 7588e7593. |
Yang T, Wang L, Liu Y L, et al. 2019. Ferrate oxidation of bisphenol F and removal of oxidation products with ferrate resulted particles[J]. Chemical Engineering Journal, 383: 123167. |
Ye T, Wei Z, Spinney R, et al. 2017. Quantitative structure-activity relationship for the apparent rate constants of aromatic contaminants oxidized by ferrate (Ⅵ)[J]. Chemical Engineering Journal, 317: 258-266. DOI:10.1016/j.cej.2017.02.061 |
虞丹尼, 黎司, 何强, 等. 2015. 联合多种荧光光谱和GC-MS研究高铁酸钾对菲的降解机理[J]. 环境工程学报, 34(1): 117-122. |
Zhang P, Zhang G, Dong J, et al. 2012a. Bisphenol A oxidative removal by ferrate (Fe(Ⅵ)) under a weak acidic condition[J]. Separation & Purification Technology, 84: 46-51. |
Zhang W, Wei C, Chai X, et al. 2012b. The behaviors and fate of polycyclic aromatic hydrocarbons (PAHs) in a coking wastewater treatment plant[J]. Chemosphere, 88(2): 174-182. DOI:10.1016/j.chemosphere.2012.02.076 |
朱峥嵘, 王明新, 张金永, 等. 2019. Fe(Ⅵ)/CaO2双氧化体系降解水环境中的DMP[J]. 中国环境科学, 39(7): 2838-2846. DOI:10.3969/j.issn.1000-6923.2019.07.018 |
 2021, Vol. 41
2021, Vol. 41