2. 浙江工商大学食品与生物工程学院, 杭州 310018
2. School of Food and Biotechnology Engineering, Zhejiang Gongshang University, Hangzhou 310018
挥发性有机物(VOCs)为熔点低于室温而沸点在50~260 ℃之间的物质, 主要包括卤代烃、烷烃、烯烃、醛、醚、酯、芳烃、链烷烃、酮和含硫化合物等(黄楠, 2019).VOCs既是臭氧/烟雾的前体间接贡献者, 又是对环境有毒的物质直接贡献者(Amann et al., 2000;Miranda-Trevino et al., 2003;Peng et al., 2007;Soylu et al., 2010;Lakshmanan et al., 2010;Doggali et al., 2012).由于多数VOCs具有致癌性、致畸性、致突变性, 不仅对大气环境造成影响, 而且直接对人体健康构成威胁(Ozturk et al., 2006;Ke et al., 2009;Mirzaei et al., 2016).因此, VOCs的减排与治理对于保护环境和人体健康具有重要意义, 其净化处理技术已成为当前环境领域的研究热点.
目前VOCs的处理技术包括吸附法、吸收法、冷凝法、膜分离法、生物降解法、等离子体法、光催化法、热力燃烧法和催化氧化法等(Shah et al., 2000;Heymes et al., 2006;Pi et al., 2018).由于具有操作温度低、几乎不产生副产物等优点, 催化氧化法相对而言对环境更加友好(Jamalzadeh et al., 2013), 具有更广阔的应用前景.催化氧化法中催化剂是关键, 可分为贵金属系催化剂(Liotta et al., 2010;Ojala et al., 2011)和过渡金属催化剂(Ozturk et al., 2006;Dai et al., 2008;Ke et al., 2009;Mirzaei et al., 2016;王淑媛等, 2016;张菊茹等, 2018;王军伟等, 2020).其中, 贵金属催化剂活性高, 但成本昂贵, 容易烧结、中毒而失活;而过渡金属氧化物价格较低, 且易于获得, 具有较强的低温催化活性, 被认为是一种具有竞争性的替代材料.例如, Zhang等(2016)制备了铜改性的锰-铈催化剂降解邻二甲苯, 其T90(降解率为90%时的氧化反应温度)为277 ℃.胡明华等(2020)制备了铜锰铈三元复合催化剂降解甲醛, 研究发现, Cu元素结合Mn元素形成了新的活性中心, 提高了催化剂的催化活性.这些研究表明, Cu-Mn-Ce催化剂的催化活性较好, 但其低温催化活性和热稳定性有待进一步提高.
La是一种丰富且环保的材料, 电子结构独特, 储氧能力也比较强.引入La可改变催化剂的电子和结构性质, 充当结构和电子助催化剂(Cho et al., 2009;Sanad et al., 2014).如Yu等(2011)制备了一系列Mn-Ce-La混合氧化物催化剂, 对氯苯(CB)的催化T90为229 ℃.Pan等(2019)按照共沉淀法制备了掺La的CuMn混合氧化物催化剂, 制备的CuMn/La-4 mol%催化氧化甲苯的T90为255 ℃, 而不含La的CuMn催化剂的T90高达274 ℃, 表明引入适量的La可显著提高低温催化活性.因此, 考虑到La在催化应用中的潜在优势, 将其掺入CuMnCe氧化催化剂中可能会进一步提高其催化性能与热稳定性.
基于此, 本文采用溶胶凝胶法制备一种新型Cu-Mn-La-Ce复合氧化催化剂, 并将其用于催化降解对二甲苯废气.同时, 利用BET、SEM、XRD、XPS等对不同物质的量比的复合催化剂进行深入表征, 研究复合催化剂在不同初始浓度、空速、O2含量、混合气体等影响因素下降解对二甲苯的特性.最后, 利用FT-IR和GC-MS等分别分析反应后催化剂的表面特征及降解产物, 推测其降解对二甲苯的机理.
2 材料与方法(Materials and methods) 2.1 实验试剂硝酸锰、硝酸铜、硝酸镧、硝酸铈、无水乙醇、氨水、柠檬酸均为分析纯.
2.2 催化剂制备以无水乙醇为溶剂, 分别配制硝酸铜溶液、硝酸锰溶液、硝酸铈溶液和硝酸镧标准溶液;按照不同元素比例(物质的量比)配制混合溶液, 然后向溶液中加入柠檬酸, 用玻璃棒搅拌, 加入适量氨水调节pH至7;放入磁力搅拌器中, 80 ℃下加热搅拌约0.5 h左右, 至溶液形成溶胶;将装有蒸干后样品的烧杯取出放入烘箱内, 在110 ℃条件下干燥12 h;将干燥后的样品移入马弗炉内, 在400 ℃条件下煅烧4 h;待样品降至室温后取出, 研磨过筛得60目的Cu-Mn-La-Ce复合催化剂样品.
2.3 催化剂活性评价方法实验流程如图 1所示.石英管反应器内径为8 mm, 放置在电阻炉中, 通过反应温度控制器控制炉内温度.反应气体发生系统由两路氮气和一路氧气组成(V(N2)∶V(O2)=4∶1), 其中一路氮气用于鼓泡得到对二甲苯反应气体, 另一路氮气作为补充气与之混合.为防止气体冷凝, 管壁包裹加热带, 温度控制在80 ℃左右, 在测试前先通入对二甲苯气体保持2 h至催化剂吸附平衡.随后逐步升温至对二甲苯完全氧化, 升温过程中每个温度达到之后稳定30 min.在该温度点取样3次, 取其平均值为有效数据.
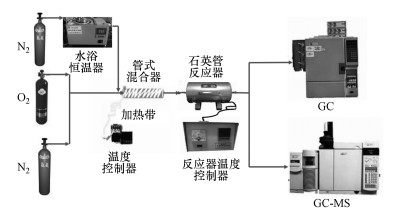 |
| 图 1 对二甲苯催化氧化实验流程图 Fig. 1 Flow chart of the catalytic oxidation of p-xylene |
将约150 mg的催化剂样品填充到石英管(内径8 mm)中, 并在两侧用石英棉固定, 把石英管装入反应器固定好开始升温, 反应器加热温度为50~300 ℃.气体总流量为100 mL·min-1, 反应空速为15000 h-1, 通过气相色谱仪(GC)分析测定进入与离开反应器的对二甲苯的浓度.
2.4 催化剂表征采用美国麦克公司Tristarer Ⅱ 3020仪器对催化剂的孔径分布及比表面积进行BET表征.采用美国FEI公司Quanta400 FEG型台式扫描电子显微镜(SEM)观察各种催化剂样品的表面形态.采用布鲁克D8 Advance型X射线衍射仪在5°~90°范围内表征材料的晶相, 扫描步长为0.02°, 测试速率为0.1 s·步-1, 电压为40 kV, 电流为40 mA, Cu Kα(λ=0.15418 nm).采用美国麦克公司AUTOChem Ⅱ 2920型程序升温仪测试催化剂的氧化还原能力, 测试温度为50 ~800 ℃, 升温速率为10 ℃·min-1, 测试氛围为5%的H2/He混合气体.采用ESCALAB 250Xi光电子能谱仪(美国赛默飞世尔科技公司), 用单色Al Kα (hv=1486.6 eV)辐射, 通过XPS测定表面组成, 结合能以C1s 284.8 eV校准.傅里叶红外光谱(FT-IR)采用美国赛默飞尼高力红外光谱仪(Nicolet iS5), 溴化钾压片制样, 取反应前后的催化剂各大于10 mg进行测定.
2.5 影响因素实验选用Cu-Mn-La-Ce催化剂, 在石英管(内径8 mm)中填装催化剂150 mg, 实验温度为100~300 ℃, 总流量为100 mL·min-1, 初始浓度为600 mg·m-3, 空速为15000 h-1, O2含量为20%, 选定在180、220、260 ℃温度条件下进行实验.研究初始浓度、空速、氧含量和混合物对对二甲苯降解效率的影响.初始浓度实验中控制对二甲苯的初始浓度分别为200、400、600、800和1000 mg·m-3, 其他条件不变;空速实验控制空速分别为7500、10000、15000、30000、60000 h-1, 其他条件不变;O2含量实验控制O2含量分别为5%、10%、15%、20%和25%, 其他条件不变;混合气体影响实验向对二甲苯溶液中加入苯, 通过调节混入苯的量控制实验苯和对二甲苯的浓度各为600 mg·m-3, 其他条件不变.
2.6 催化剂稳定性试验选择性能最好的催化剂, 进行48 h的稳定性实验.实验条件为反应温度为235 ℃, 空速为15000 h-1, 对二甲苯浓度为600 mg·m-3, 加入催化剂量150 mg, 温度稳定60 min开始进样, 测定对二甲苯的降解率.
2.7 降解产物的测定实验利用FT-IR手段对催化剂进行表征, 通过对比反应前后催化剂的官能团的变化, 从而推测催化反应的降解途径, 采用GC-MS测定降解中间产物.在温度达到200 ℃和260 ℃时, 分别用10 mL二氯甲烷吸收降解尾气, 通过GC-MS测定.最后, 进行产物分析, 以推测对二甲苯的降解机理.
3 结果与讨论(Results and discussion) 3.1 催化剂的催化活性图 2显示了不同物质的量比催化剂的催化活性和CO2选择性.由图 2a可知, 4种催化剂在260 ℃时对对二甲苯的降解率均大于95%, 其中, Cu-Mn-La-Ce(1∶2∶1∶1)复合催化剂的催化效果最好, 在235 ℃时对二甲苯已经完全降解, 其催化活性顺序为:Cu-Mn-La-Ce(1∶2∶1∶1)>Cu-Mn-La-Ce(1∶1∶2∶1)>Cu-Mn-La-Ce(1∶1∶1∶1)> Cu-Mn-La-Ce(1∶1∶0∶1), 其T50(降解率为50%时的氧化反应温度)分别为217、219、230和232 ℃, T90分别为230、233、235和247 ℃.掺杂La之后的催化剂较掺杂前效果有了明显的提升.Cu-Mn-La-Ce(1∶1∶1∶1)与Cu-Mn-La-Ce(1∶1∶0∶1)比较可以发现添加镧可以提高催化剂的催化效果, 添加镧后催化剂的T90降低12 ℃, 催化效果有明显的提升.赵梦戈等(2019)制备了Ce-Co-Cu催化剂来降解邻二甲苯, 其T50为237 ℃, T90为250 ℃, 本实验所制催化剂的低温催化活性要优于该文献中催化剂.
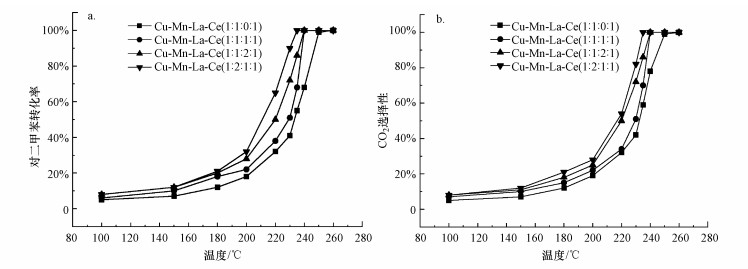 |
| 图 2 催化剂对对二甲苯的降解率(a)和CO2选择性(b) Fig. 2 The degradation rate (a) and CO2 selectivity (b) of catalysts to p-xylene |
由图 2b可知, CO2选择性的变化趋势与对二甲苯的降解率基本保持一致, CO2选择性都随着温度的升高而增大, Cu-Mn-La-Ce(1∶1∶2∶1)催化剂的CO2选择性最好, 其中, Cu-Mn-La-Ce(1∶1∶1∶2)的CO2选择性与之相近.
3.2 催化剂表征结果分析 3.2.1 BET分析表 1显示了不同物质的量比催化剂的比表面积、孔容、平均孔径.从表 1可知, Cu-Mn-La-Ce催化剂的比表面积和孔容比Cu-Mn-Ce催化剂较大, Cu-Mn-Ce催化剂的SBET为61.272 m2·g-1, 而Cu-Mn-La-Ce催化剂的SBET为64.930~70.628 m2·g-1; Cu-Mn-Ce催化剂的孔容仅为0.061 cm3·g-1, 而Cu-Mn-La-Ce催化剂的孔容为0.065~0.134 cm3·g-1.这表明催化剂的SBET值随La的掺杂而增加, 掺入La可以在一定程度上促进Cu-Mn-Ce催化剂的分散.但随着La进一步掺杂, 催化剂的SBET和孔容有所下降.其中, Cu-Mn-La-Ce(1∶2∶1∶1)催化剂的比表面积、孔容最大, 分别为70.628 m2·g-1和0.134 cm3·g-1, 孔径最小, 为3.812 nm.较大的比表面积、较小的孔径有利于污染物在孔系内的扩散和吸附, 从而提高降解效率.Lu等(2015)采用溶胶凝胶法制备了Cu1Mn2Ce4, 其表面积为45.3 m2·g-1, 而本实验所得催化剂的比表面积较之要大.
| 表 1 不同催化剂的结构性能 Table 1 Catalyst structure performance |
图 3显示了不同比例催化剂的SEM图.由图 3可知, 每种催化剂都显示出纤维状的样貌, 都具有不规则的孔结构.这可能是因为硝酸盐和柠檬酸在分解过程中生成的气体所致, 这种无序的孔分布和不规则的孔结构会影响催化剂的吸附能力和活性位点的分布.La掺杂后催化剂粒径减小, 孔数量增多, 这将有利于活性组分的分散和催化能力的提高.Cu-Mn-La-Ce(1∶1∶0∶1)催化剂粒径较大, 活性组分分布不均匀(图 3a);Cu-Mn-La-Ce(1∶1∶1∶1)催化剂粒径减小, 但结构较为杂乱(图 3b);Cu-Mn-La-Ce(1∶1∶2∶1)催化剂孔数量减少, 粒径变大, 不利于活性组分分散(图 3 d);Cu-Mn-La-Ce(1∶2∶1∶1)催化剂分散性较好, 呈现出纤维状结构, 表面形态不固定, 比表面积较大(图 3c), 将有利于活性位点的分布.经过对比发现, Cu-Mn-La-Ce(1∶2∶1∶1)催化剂颗粒组分分布较均匀, 结合BET结果可以看出, Cu-Mn-La-Ce在物质的量比为1∶2∶1∶1条件下制备的催化剂具有最大的比表面积(70.628 m2·g-1)和最小的孔径(3.812 nm), 较大的比表面积在催化剂中可提供大量的活性位点, 这可以增强催化剂的催化性能(漆维霞等, 2017).
 |
| 图 3 不同Cu-Mn-La-Ce催化剂的SEM图 (a.Cu-Mn-La-Ce(1∶1∶0∶1), b.Cu-Mn-La-Ce(1∶1∶1∶1), c.Cu-Mn-La-Ce(1∶2∶1∶1), d.Cu-Mn-La-Ce(1∶1∶2∶1)) Fig. 3 SEM image of different Cu-Mn-La-Ce catalyst |
图 4为催化剂的XRD图谱.由图 4可见, Cu-Mn-Ce催化剂在2θ=38.95°处的峰对应于CuO (赵梦戈等, 2019), 在2θ=32.95°处的峰对应于Mn2O3, 在2θ=54.07°处可以观察到La2O3(40-1281)的衍射峰;在2θ=27.66°、32.23°、46.89°、58.52°、68.64°和76.12°处观测到6个明显的衍射峰, 分别对应于CeO2晶体的(111)、(200)、(220)、(222)、(400)和(331)晶面, 说明该催化剂具有立方型萤石结构.Cu-Mn-La-Ce催化剂主要衍射峰出现的位置与CeO2相似, 但整体向低角度方向偏移.以CeO2 (111)面的衍射峰为例, 从28.68°位移到了27.66°, 表明La可能进入CeO2萤石晶格中.由于La3+的离子半径大于Ce4+的离子半径, 因此, 有部分La3+进入CeO2萤石型晶格形成LaCeOx固溶体时, CeO2晶格参数变大, 导致催化剂的衍射峰向低偏移.Cu-Mn-La-Ce催化剂中La2O3的特征衍射峰变弱, 这也证实形成了LaCeOx固溶体.此过程会形成氧空位, 这有利于提高氧迁移率, 进而提高催化剂的氧化还原性.各催化剂中晶体颗粒粒径见表 2, Cu-Mn-Ce催化剂中CeO2晶体颗粒尺寸为50.61 nm, 而Cu-Mn-La-Ce催化剂中CeO2晶体颗粒尺寸为46.49~ 48.82 nm; Cu-Mn-Ce催化剂中CuO晶体颗粒尺寸为41.66 nm, 而Cu-Mn-La-Ce催化剂中CuO晶体颗粒尺寸为36.12~38.48 nm; Cu-Mn-Ce催化剂中Mn2O3晶体颗粒尺寸为38.25 nm, 而Cu-Mn-La-Ce催化剂中Mn2O3晶体颗粒尺寸为34.53~36.18 nm.这些表明随着La的掺入, 晶体颗粒尺寸变小, 说明La掺杂会阻碍晶体的产生, 前述BET结果也说明La可能会增大催化剂的比表面积.
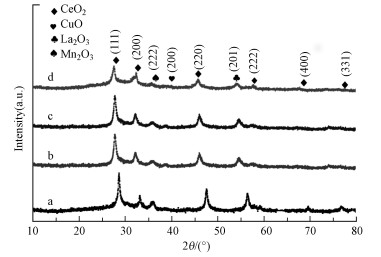 |
| 图 4 不同Cu-Mn-La-Ce催化剂的XRD图谱 (a.Cu-Mn-La-Ce(1∶1∶0∶1), b.Cu-Mn-La-Ce(1∶1∶1∶1), c.Cu-Mn-La-Ce(1∶2∶1∶1), d.Cu-Mn-La-Ce(1∶1∶2∶1)) Fig. 4 XRD patterns of different Cu-Mn-La-Ce catalysts |
| 表 2 催化剂的物理化学特性 Table 2 Physical and chemical properties of the catalyst |
图 5a中782 ℃的峰归因于表面Ce4+向Ce3+的还原, 503 ℃对应的是MnO2/Mn2O3还原为MnO, 270 ℃对应于CuO的还原峰.Cu-Mn-La-Ce的还原温度低于Cu-Mn-Ce, 说明La掺杂后促进了Cu、Mn、Ce氧化物的还原, 样品的还原温度高低排序为∶Cu-Mn-La-Ce(1∶2∶1∶1) < Cu-Mn-La-Ce(1∶1∶1∶1) < Cu-Mn-La-Ce(1∶1∶2∶1) < Cu-Mn-La-Ce(1∶1∶0∶1).这说明掺杂La的催化剂样品呈现较低的初始还原温度.由XRD可知掺杂La会形成LaCeOx固溶体, 可提高迁移率并促进晶格氧的释放, 从而提高CuMnCe催化剂的氧化还原能力.由BET可知La掺杂会提高催化剂的比表面积, 然而, 当La掺杂量过高, 则会降低氧化还原能力.其中, Cu-Mn-La-Ce(1∶2∶1∶1)催化剂还原温度最低, 催化效果最好.
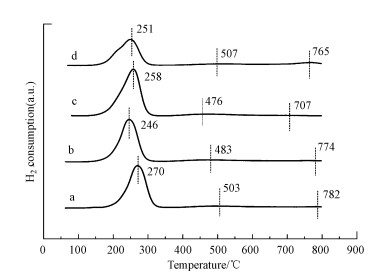 |
| 图 5 不同Cu-Mn-La-Ce催化剂的H2-TPR图谱 (a.Cu-Mn-La-Ce(1∶1∶0∶1), b.Cu-Mn-La-Ce(1∶1∶1∶1), c.Cu-Mn-La-Ce(1∶2∶1∶1), d.Cu-Mn-La-Ce(1∶1∶2∶1)) Fig. 5 H2-TPR spectrum of different Cu-Mn-La-Ce catalysts |
Cu 2p的XPS图谱如图 6a所示, 在束缚能934.2 eV和932.6 eV处有两个特征峰, 可分别归结为Cu2+和还原态的Cu+(竺新波, 2015).Cu2+对Ce3+的部分取代促进了Ce4+向Ce3+的还原, 这促进了氧化还原反应的进行, 提高了催化剂的催化能力.Cu-Mn-La-Ce(1∶0∶1∶1)的Cu2+/Cu++Cu2+最小, 为0.282, 掺杂La之后此比例变大, 为0.301~0.325, 其中, Cu-Mn-La-Ce(1∶2∶1∶1) 催化剂的Cu2+/Cu++Cu2+最大, 由活性评价结果可知此时催化活性最好.
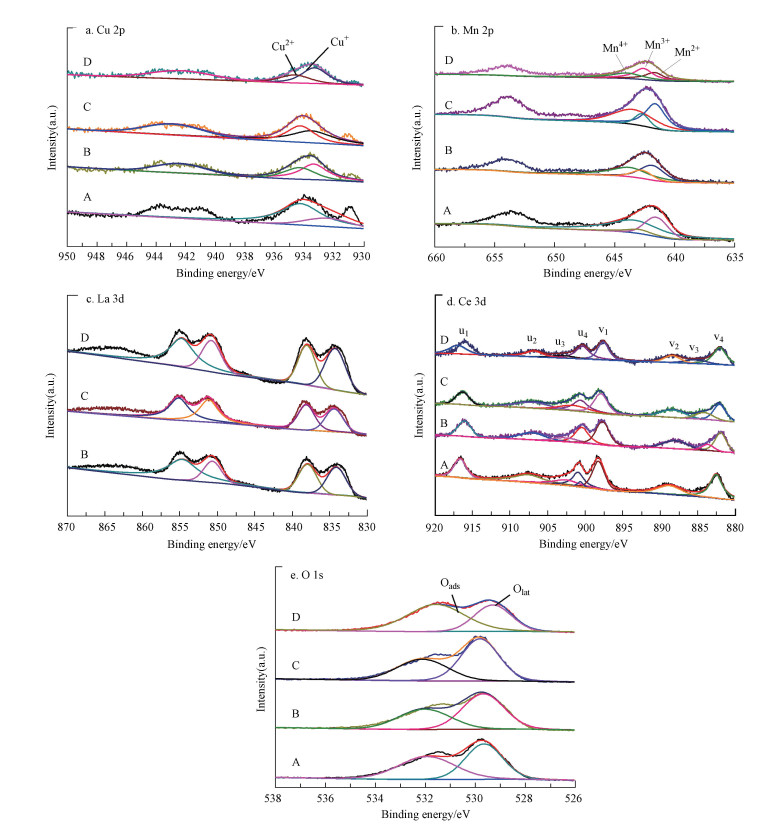 |
| 图 6 不同Cu-Mn-La-Ce催化剂Cu 2p、Mn 2p、La 3d、Ce 3d、O 1s的XPS图谱 (A.Cu-Mn-La-Ce(1∶1∶0∶1), B.Cu-Mn-La-Ce(1∶1∶1∶1), C.Cu-Mn-La-Ce(1∶2∶1∶1), D.Cu-Mn-La-Ce(1∶1∶2∶1)) Fig. 6 XPS spectra of Cu 2p, Mn 2p, La 3d, Ce 3d and O 1s of different Cu-Mn-La-Ce catalysts |
Mn 2p的XPS图谱如图 6b所示, 在Mn2p3/2光谱段有3个特征峰, 分别位于641.0、642.5及643.9 eV处, 分别对应于Mn2+、Mn3+及Mn4+物种.根据各价态锰物种特征峰峰面积, 可以得到它们在催化剂表面的含量比例.由表 2可知, Mn4+/Mntotal的比值大小依次为Cu-Mn-La-Ce(1∶2∶1∶1)>Cu-Mn-La-Ce(1∶1∶2∶1)> Cu-Mn-La-Ce(1∶1∶1∶1)>Cu-Mn-La-Ce(1∶0∶1∶1).由此可见, 当未掺杂La, 物质的量比为1∶1∶0∶1时, Mn4+所占比例最小, 为0.321;掺杂La后此比例均有不同程度的上升, 当物质的量比为1∶2∶1∶1时, Mn4+所占比例最大, 为0.454.显然, La的掺杂影响了催化剂表面各价态锰物种的含量.Cu-Mn-La-Ce(1∶2∶1∶1)催化剂活性比较高, 这可能归因于Mn4+含量较高.
样品的La 3d光谱如图 6c所示, 对于掺杂La的样品, 可以在(854.9±0.2)和(850.9±0.1) eV处观察到与La 3d3/2相关的两个峰, 可以在(838.1±0.2)和(834.1±0.2) eV处观察到与La 3d5/2相关的峰.纯La2O3出现峰的位置为838.0和834.4 eV, 两者非常接近, 由XRD结果可知样品中存在三价La离子.
Ce 3d的XPS图谱如图 6d所示, 包括Ce 3d3/2和Ce 3d5/2两个自旋轨道, 分别标记为u和v, Ce4+是Ce主要的存在形式.Ce3+的存在说明氧空位出现(竺新波, 2015), 催化剂表面Ce3+含量比例见表 2.不掺杂La, 物质的量比例为1∶1∶0∶1时, Ce3+所占比例最小, 为0.135;掺杂La后此比例均有不同程度的上升, 其中, Cu-Mn-La-Ce(1∶2∶1∶1)催化剂中Ce3+所占比例最大, 为0.239.显然, La的掺杂复合影响了催化剂表面各价态铈物种的含量.Cu-Mn-La-Ce(1∶2∶1∶1)催化剂中Ce3+所占比例最大, 说明氧空位最多, 故催化还原性能较好.
O ls的XPS图谱如图 6e所示, 该图谱可分为两个峰, 其中, 529.6 eV处可以观察到催化剂晶格氧物种(用Olat表示), 531.6 eV处可观察到催化剂表面的吸附氧物种(表面吸附氧, 用Oads表示), 催化剂表面吸附氧可以增强氧化还原性和氧气迁移率, 可以用来衡量催化剂的氧化能力(竺新波, 2015).本实验中晶格氧所占比例较大, 是氧元素的主要存在形式.当不掺杂La时, Cu-Mn-La-Ce(1∶1∶0∶1)催化剂中吸附氧所占比例最小, 为0.223, 掺杂La后此比例均有不同程度的上升, 并且随着锰元素比例的增加, 吸附氧的占比随之增大, 将有利于增加催化剂的活性.其中, Cu-Mn-La-Ce(1∶2∶1∶1)催化剂中Ce3+所占比例最大, 为0.397, 表明La的掺杂复合影响了催化剂表面各氧物种的含量, 进而影响了催化剂的氧化能力.
3.3 催化剂降解对二甲苯的影响因素 3.3.1 初始浓度影响图 7a为不同初始浓度对对二甲苯降解的影响.从图 7a中可知, 当对二甲苯初始浓度从200 mg·m-3增加至1000 mg·m-3, 260 ℃时, 其降解率基本不变, 即此范围内的反应物浓度对完全降解的影响并不明显.180 ℃和220 ℃时, 对二甲苯降解率随初始浓度增加而明显降低, 如在180 ℃时, 200、400、600、800、1000 mg·m-3浓度对应的降解率分别为35.0%、33.1%、28.0%、27.3%、25.0%, 在220 ℃时对应的降解率分别为60.0%、59.2%、54.0%、52.5%、50.4%.这是因为催化剂活性位点有限, 当对二甲苯浓度较低时, 其可以充分与催化剂反应, 因而降解率较高; 当对二甲苯浓度过高时, 导致其不能与催化剂充分反应, 故而降解率随之降低.Zhang等(2016)采用溶胶-凝胶法制备了改性Mn-Ce混合氧化物催化剂降解对二甲苯, 当浓度从473 mg·m-3增加到4732 mg·m-3时, T90值较稳定; 但当浓度超过4732 mg·m-3时, T90值会大大增加.本实验结果与之基本相类似.
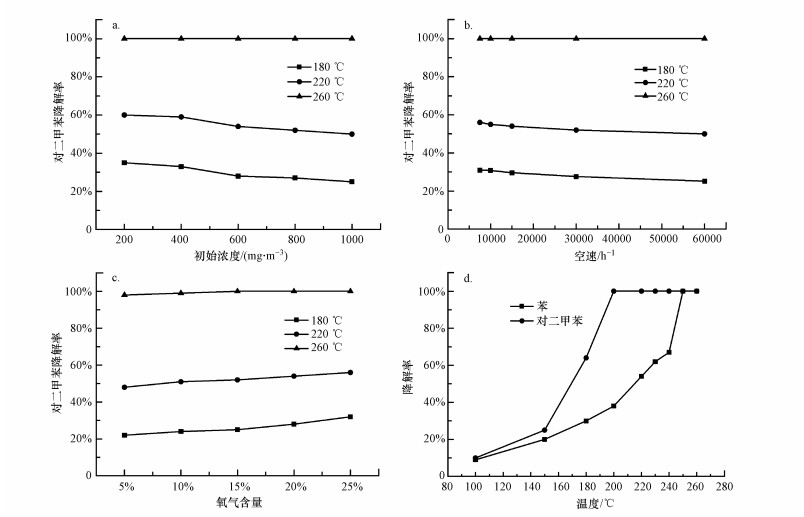 |
| 图 7 不同因素对对二甲苯降解率的影响 (a.初始浓度, b.空速, c.氧含量, d.混合物) Fig. 7 Influence of different factors on the degradation rate of paraxylene (a.initial concentration, b.space velocity, c.oxygen content, d.mixture) |
图 7b为不同空速(7500、10000、15000、30000、60000 h-1)对对二甲苯降解的影响.由图 7b可知, 催化剂的催化活性随着空速的增加而降低.当空速从7500 h-1增加到15000 h-1时, 同样温度下对二甲苯的降解率只有稍微下降, 如在180 ℃时7500、10000、15000 h-1空速对应的降解率分别为30.1%、29.3%、27.5%;但空速增加到30000 h-1和60000 h-1时, 降解率明显下降, 如在180 ℃下对应的降解率分别为20.0%和18.2%.空速较低时, 对降解活性影响不显著, 此时实验目标污染物可以与催化剂充分接触反应.空速较高时, 催化活性明显下降, 这是因为目标污染物与活性位点之间的接触时间明显减少.本实验结果与文献(Zhang et al., 2016)报道基本一致.
3.3.3 O2含量影响图 7c为不同O2含量(5%、10%、15%、20%和25%)对对二甲苯降解的影响, 可发现随着O2含量的增加, 对二甲苯的降解率逐渐升高.在180 ℃时, O2含量为5%、10%、15%、20%和25%时对应的对二甲苯降解率分别为22.1%、24.3%、25.2%、28.4%和32.1%;在220 ℃时, 对二甲苯的降解率分别为48.1%、51.2%、52.3%、54.1%和56.2%;而在260 ℃时, 对二甲苯的降解率分别为98.1%、99.2%、100%、100%和100%.由此看出, 随着反应温度的提升, O2含量的影响逐渐降低, 如180 ℃时, O2含量从5%升到25%, 对应的对二甲苯降解率从22.1%升到32.1%;220 ℃时对应的对二甲苯降解率从48.1%升到56.2%;260 ℃对应的对二甲苯降解率从98.1%升到100%.这说明高温段O2含量对降解率的影响不大, 此时温度对降解率的影响较大.这些结果也表明氧含量增加有利于对二甲苯的降解, 这是因为气流中的氧气能够被催化剂捕获, 参与氧化还原反应.故随着氧气含量的增大, 催化剂的催化活性提升.本实验结论与文献(张菊茹等, 2018)报道基本一致.
3.3.4 混合物的影响图 7d为催化剂对600 mg·m-3对二甲苯和600 mg·m-3苯混合气体的降解曲线.由图可知, 随着反应温度的升高, 对二甲苯的降解率随之提高, 混合气体中对二甲苯的降解率高于苯, 且混合物中对二甲苯的催化活性相对于单独的对二甲苯降解有所提高, 其T90降低了30 ℃左右.这表明适当浓度的混合气体能够提高催化剂对对二甲苯的降解率.这是因为在双组分VOCs体系中, 苯会发生氧化反应, 此反应属于放热反应, 氧化释放出的热量能提高催化剂的表面温度, 这将促进对二甲苯的分解, 从而提高双组分VOCs在催化剂上的催化氧化速率.另外, 在苯的降解过程中, Cu2+被还原为Cu+, Mn4+被还原为Mn3+、Mn2+, Ce4+被还原成Ce2+.苯降解过程中活性物质价态的相互转变提供了电子的转移, 这也促进了对二甲苯的降解.赵梦戈等(2019)制备了Ce-Co-Cu催化剂催化氧化邻二甲苯, 并在邻二甲苯中混入乙酸乙酯, 结果表明, 低浓度的混合气体能够提高3DOMCe-Co-Cu(2∶1∶1)催化剂的催化活性, 提高催化剂对邻二甲苯的降解率, 本实验结果与之一致.
3.4 催化剂的稳定性图 8为Cu-Mn-La-Ce催化剂在催化温度230 ℃下连续工作48 h对对二甲苯的降解效果.由图 8可知, Cu-Mn-La-Ce催化剂在48 h内都保持了非常高的催化活性, 对二甲苯的降解率都接近98%, 初步说明催化剂稳定性较好.
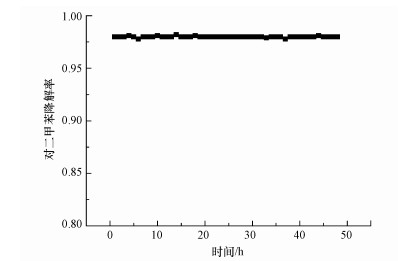 |
| 图 8 催化剂对对二甲苯降解率的稳定性测试 Fig. 8 Stability test of catalyst to para-xylene conversion rate |
图 9a为催化剂反应前后的FT-IR光谱.由图 9a可知, 1392 cm-1处的吸收峰与碳酸盐基团相关.反应前后的催化剂峰面积有较大的变化, 催化剂表面酸性对应于催化剂的活性, 由此可以看出反应前催化剂的性能较好, 反应后的峰面积减小, 催化性能较差.1080 cm-1处的峰表明C—H振动, 在3431 cm-1和1525 cm-1处的峰对应于水和O—H, 位于621 cm-1的峰对应于金属—氧键的伸缩振动(赵梦戈等, 2019), 其中, 反应后的催化剂表面的金属—氧键、C=O、O—H和C—H都减少, 说明在反应过程中发生了氧化还原反应.
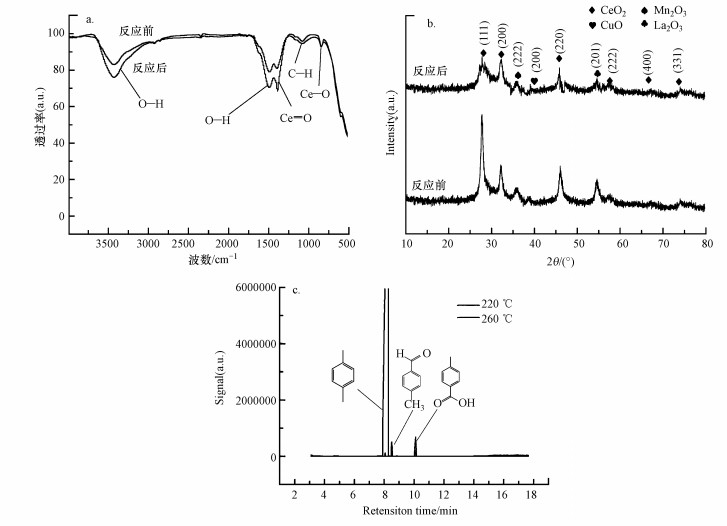 |
| 图 9 催化剂反应前后的FT-IR光谱(a)、XRD图(b)及对二甲苯降解产物GC-MS图(c) Fig. 9 FT-IR(a), XRD(b) pattern of Cu-Mn-La-Ce catalyst before and after reaction and GC-MS analysis of p-xylene degradation products(c) |
图 9b显示了Cu-Mn-La-Ce催化剂催化降解邻二甲苯反应前后的XRD图. 2θ=38.9°处的峰对应于CuO, 2θ=32.95°处的峰对应于Mn2O3(PDF#24-0508), 在2θ=54.07°处可以观察到La2O3(40-1281)的衍射峰, 在2θ=27.66°、32.23°、46.89°、58.52°、68.64°和76.12°处观测到6个明显的衍射峰, 对应于CeO2晶体.从图 9b可以看出, 反应后的催化剂衍射峰强度下降, 这可能是因为催化剂在反应过程中发生了积碳现象, 导致催化剂的分散性降低, 催化活性下降.
3.5.3 GC-MS分析图 9c为对二甲苯降解产物分析GC-MS图, 图中显示了对二甲苯、对甲基苯甲醛和对甲基苯甲酸的峰位, 在7.8~8.8 min处出现的峰为对二甲苯, 在8.4~8.6 min处出现的峰为对甲基苯甲酸, 在10.1~10.3 min处出现的峰为对甲基苯甲醛.在220 ℃条件下可以检测出对甲基苯甲酸和对甲基苯甲醛, 在260 ℃条件下基本检测不出这些中间产物, 根据GC可以判断对二甲苯的最终产物为CO2和H2O.
3.6 降解机理图 10显示了对二甲苯的催化降解途径.根据上述分析结果, 推测对二甲苯的催化降解途径涉及MVK机理, 反应过程分为两步: 第1步, 催化剂被吸附在催化剂表面, 催化剂晶格氧与对二甲苯反应, 催化剂被还原;第2步, 气相中的氧气分子被催化剂捕获补充, 催化剂被氧化, 对二甲苯与催化剂晶格氧反应, 形成对甲基苯甲醛, 然后被氧化成对甲基苯甲酸, 最终形成CO2和H2O.
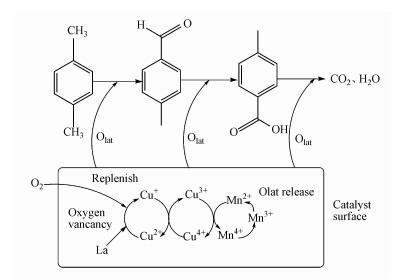 |
| 图 10 对二甲苯催化降解途径 Fig. 10 The catalytic degradation pathway of p-xylene |
在反应过程中, Cu、Mn和Ce均含有多种可变价态, 它们的氧化物之间发生氧化还原循环供给氧气.由BET可知La掺杂增大了催化剂的比表面积和孔容, 由XRD可知La掺杂抑制了晶体的产生, 并且形成LaCeOx固溶体, 由XPS可以看出La掺杂改变了各元素不同价态的占比, 提高了其催化还原反应能力.
4 结论(Conclusions)1) La掺杂增大了催化剂比表面积和孔容, 促进了金属氧化物的分散, 抑制了晶体的形成.催化剂的元素比例(物质的量比)对催化剂有较大影响.
2) 初始浓度、空速、和O2含量对对二甲苯的降解均有一定影响.对二甲苯的降解率随着初始浓度和空速的增加而降低, 随着O2含量的增加而增加, 气流中混入苯提高了对二甲苯的降解率.
3) 对二甲苯降解途径为对二甲苯被氧化成对甲基苯甲醛, 再氧化成对甲基苯甲酸, 最终生成CO2和H2O.
Amann M, Lutz M. 2000. The revision of the air quality legislation in the European Union related to ground-level ozone[J]. Journal of Hazardous Materials, 78(1/3): 41-62. |
Cho Y G, Choi K H, Kim Y R, et al. 2009. Characterization and catalytic properties of surface La-rich LaFeO3 perovskite[J]. Bulletin of the Korean Chemical Society, 30(6): 1368-1372. DOI:10.5012/bkcs.2009.30.6.1368 |
Dai Q, Wang X, Lu G. 2008. Low-temperature catalytic combustion of trichloroethylene over cerium oxide and catalyst deactivation[J]. Applied Catalysis B: Environmental, 81(3/4): 192-202. |
Doggali P, Teraoka Y, Mungse P, et al. 2012. Combustion of volatile organic compounds over Cu-Mn based mixed oxide type catalysts supported on mesoporous Al2O3, TiO2 and ZrO2[J]. Journal of Molecular Catalysis A: Chemical, 358: 23-30. DOI:10.1016/j.molcata.2012.02.004 |
Heymes F, Manno-Demoustier P, Charbit F, et al. 2006. A new efficient absorption liquid to treat exhaust air loaded with toluene[J]. Chemical Engineering Journal, 115(3): 225-231. DOI:10.1016/j.cej.2005.10.011 |
黄楠. 2019. 铜锰复合氧化物催化氧化甲苯的反应机制探究[D]. 南京: 南京理工大学
|
胡明华, 石零, 丁莹, 等. 2020. 铜锰铈三元复合氧化物的共沉淀法制备及其甲苯催化氧化性能研究[J]. 江汉大学学报(自然科学版), 48(1): 16-22. |
Jamalzadeh Z, Haghighi M, Asgari N. 2013. Physicochemical characterizations and catalytic performance of Pd/carbon-zeolite and Pd/carbon-CeO2 nanocatalysts used for total oxidation of xylene at low temperatures[J]. Frontiers of Environmental Science & Engineering, 7(3): 365-381. DOI:10.1007/s11783-013-0520-5 |
Ke M T, Lee M T, Lee C Y, et al. 2009. A MEMS-based benzene gas sensor with a self-heating WO3 sensing layer[J]. Sensors, 9(4): 2895-2906. DOI:10.3390/s90402895 |
Konsolakis M, Carabineiro S A C, Tavares P B, et al. 2013. Redox properties and VOC oxidation activity of Cu catalysts supported on Ce1-xSmxOδ mixed oxides[J]. Journal of Hazardous Materials, 261: 512-521. DOI:10.1016/j.jhazmat.2013.08.016 |
Lakshmanan P, Delannoy L, Richard V, et al. 2010. Total oxidation of propene over Au/xCeO2-Al2O3 catalysts: Influence of the CeO2 loading and the activation treatment[J]. Applied Catalysis B: Environmental, 96(1/2): 117-125. |
Liotta L F. 2010. Catalytic oxidation of volatile organic compounds on supported noble metals[J]. Applied Catalysis B: Environmental, 100(3/4): 403-412. |
Lu H, Kong X, Huang H, et al. 2015. Cu-Mn-Ce ternary mixed-oxide catalysts for catalytic combustion of toluene[J]. Journal of Environmental Sciences, 32: 102-107. DOI:10.1016/j.jes.2014.11.015 |
Miranda-Trevino J C, Coles C A. 2003. Kaolinite properties, structure and influence of metal retention on pH[J]. Applied Clay Science, 23(1/4): 133-139. |
Mirzaei A, Leonardi S G, Neri G. 2016. Detection of hazardous volatile organic compounds (VOCs) by metal oxide nanostructures-based gas sensors: A review[J]. Ceramics International, 42(14): 15119-15141. |
Ojala S, Pitkäaho S, Laitinen T, et al. 2011. Catalysis in VOC abatement[J]. Topics in Catalysis, 54(16/18): 1224. |
Ozturk B, Yilmaz D. 2013. Absorptive removal of volatile organic compounds from flue gas streams[J]. Process Safety and Environmental Protection, 84(5): 391-398. |
Pan J, Du W, Liu Y, et al. 2019. Lanthanum-doped CuMn composite oxide catalysts for catalytic oxidation of toluene[J]. Journal of Rare Earths, 37(6): 602-608. DOI:10.1016/j.jre.2018.10.004 |
Peng J, Wang S. 2007. Performance and characterization of supported metal catalysts for complete oxidation of formaldehyde at low temperatures[J]. Applied Catalysis B: Environmental, 73(3/4): 282-291. |
Pi Y, Li X, Xia Q, et al. 2018. Adsorptive and photocatalytic removal of persistent organic pollutants (POPs) in water by metal-organic frameworks (MOFs)[J]. Chemical Engineering Journal, 337: 351-371. DOI:10.1016/j.cej.2017.12.092 |
漆维霞, 王璐, 王丰, 等. 2017. 一锅法制备铋基催化剂在乙炔氢氯化反应中催化性能的研究(英文)[J]. 新疆大学学报(自然科学版), 34(2): 127-132. |
Sanad M M S, Rashad M M, Abdel-Aal E A, et al. 2014. Effect of Y3+, Gd3+ and La3+dopant ions on structural, optical and electrical properties of o-mullite nanoparticles[J]. Journal of Rare Earths, 32(1): 37-42. DOI:10.1016/S1002-0721(14)60031-4 |
Shah R K, Thonon B, Benforado D M. 2000. Opportunities for heat exchanger applications in environmental systems[J]. Applied Thermal Engineering, 20(7): 631-650. DOI:10.1016/S1359-4311(99)00045-9 |
Soylu G S P, Özçelik Z, Boz. 2010. Total oxidation of toluene over metal oxides supported on a natural clinoptilolite-type zeolite[J]. Chemical Engineering Journal, 162(1): 380-387. DOI:10.1016/j.cej.2010.05.020 |
王淑媛, 李济吾, 洪亚军. 2016. Ti-Cu-Mn复合物负载石墨烯催化剂制备及其降解二甲苯性能[J]. 环境科学学报, 36(7): 2375-2381. |
王军伟, 李济吾, 蔡伟建. 2020. 介孔ZnO负载Fe-Cu-Zr复合催化剂用于催化氧化降解乙酸丁酯[J]. 环境科学学报, 40(5): 1640-1649. |
Yu D, Xing W, Dao L, et al. 2011. Catalytic combustion of chlorobenzene over Mn-Ce-La-O mixed oxide catalysts[J]. Journal of Hazardous Materials, 188(1/3): 132-139. |
Zhang X, Wu D. 2016. Ceramic monolith supported Mn-Ce-M ternary mixed-oxide (M=Cu, Ni or Co) catalyst for VOCs catalytic oxidation[J]. Ceramics International, 42(15): 16563-16570. DOI:10.1016/j.ceramint.2016.07.076 |
张菊茹, 李济吾. 2018. Cu-Mn-Zr复合催化剂制备及其催化氧化乙酸乙酯性能[J]. 中国环境科学, 38(8): 2927-2933. DOI:10.3969/j.issn.1000-6923.2018.08.017 |
赵梦戈, 李济吾. 2019. 三维有序介孔铈钴铜催化剂的制备及其降解邻二甲苯的机制[J]. 环境科学学报, 39(6): 1959-1969. |
竺新波. 2015. 等离子体协同催化脱除挥发性有机物(VOCs)的机理研究[D]. 杭州: 浙江大学
|
 2021, Vol. 41
2021, Vol. 41


