2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. The Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Cluster, Ministry of Education, Guangzhou 510006
硝酸盐是地表和地下水主要污染物之一, 主要来源于化石燃料的燃烧、氮肥的过度使用和工业废水的排放(杜新强等, 2018).水体中硝酸盐浓度过高可能引起水体富营养化, 从而降低水中溶解氧并破坏水生生态系统.此外, 胃肠道微生物可将人体摄入的硝酸盐还原为亚硝酸盐, 从而引发肝功能异常、高铁血红蛋白血症、甚至癌症(Knobeloch et al., 2000; 徐庆勇等, 2018).因硝酸盐可对生态环境和人类健康构成严重威胁, 全球范围内已经严格控制硝酸盐排放到地表水的浓度(Jie et al., 2016).
迄今为止, 已有许多方法用于去除水体中硝酸盐, 如离子交换、反渗透、电渗析等(Ahn et al., 2008; 李琪等, 2015; Belkada et al., 2018).然而, 以上的物理化学方法仅是将硝酸盐进行分离、浓缩, 而非直接转化硝酸盐, 反而会产生更难处理的浓盐水.近年来, 电化学还原法因其独特优势在硝酸盐去除中备受关注.电化学还原过程直接利用电子充当还原剂, 无需投加化学药剂, 几乎不产生二次污染.此外, 电化学还原过程由电能驱动, 易于实现自动化控制, 并可通过设计电极材料和调整运行参数定向转化污染物, 实现污染物无害化处理(Garcia-Segura et al., 2018; Peng et al., 2019; Liu et al., 2020).
过渡金属氧化物因其催化活性强、来源广泛和较好的稳定性在电化学还原中引发了人们广泛的兴趣(Li et al., 2016; Su et al., 2017; Jia et al., 2020).近期的大量研究表明(Gao et al., 2019a; 2019b; Chen et al., 2020), Co3O4具有良好的硝酸盐还原反应(NO3RR)催化活性, 并且可通过复合其他金属氧化物、原子掺杂和构建表面缺陷等方式提升其稳定性和催化活性.值得注意的是, NiCo2O4作为混合过渡金属氧化物, 相较于Co3O4具有更为丰富的氧化还原电对, 在氧还原反应(ORR)领域引起了广泛关注, 被许多科学家认为有可能取代Pt/C催化剂(Pu et al., 2013; Zhang et al., 2014; Chen et al., 2021).然而, 作为混合金属氧化物, 低导电性和有限的比表面积是影响其催化活性的重要因素.针对上述缺点, 有学者发现将NiCo2O4与石墨烯结合, 可改善NiCo2O4的电子转移能力, 提升其氧还原反应催化活性(Zhang et al., 2014).另一方面, 硝酸盐通常以双齿配位氧吸附的形式结合在电催化剂表面, 氧空位的构建可增强电催化剂吸附硝酸盐的能力, 进而改善电催化剂NO3RR性能(Garcia-Segura et al., 2018).因此, 通过引入高导电性能载体与合理构建氧空位有望激发NiCo2O4在电催化硝酸盐还原领域的潜能.
基于此, 本研究采用溶胶-凝胶法耦合硼氢化钠还原法在XC-72导电碳粉上合成具有丰富氧空位的NiCo2O4, 并利用扫描电子显微镜(Scanning Electron Microscope, SEM)、透射电子显微镜(Transmission Electron Microscopy, TEM)、X射线衍射仪(X-ray diffractometer, XRD)和电子顺磁共振(Electron Paramagnetic Resonance, EPR)波谱仪等对催化剂进行表征.同时, 探讨不同电流密度和pH等操作条件对硝酸盐还原的影响, 并结合掩蔽实验和EPR研究硝酸盐还原的机理.最后, 通过处理焦化废水生物出水验证所合成电催化剂处理实际废水的能力.
2 材料与方法(Materials and methods) 2.1 主要试剂六水合硝酸镍(Ni(NO3)2·6H2O)、六水合硝酸钴(Co(NO3)2·6H2O)、柠檬酸(C6H8O7·H2O)、5, 5-二甲基-1-吡咯啉-N-氧化物(DMPO)购自Aladdin Ind. Co., 硝酸钠(NaNO3)、氯化钠(NaCl)、浓硝酸、硼氢化钠(NaBH4)购自广州化学试剂厂, 以上试剂均为AR级.实验中所有其余试剂纯度至少为分析纯, 并且实验用水均为去离子水.
2.2 主要材料与仪器Pt片电极(中国, 腾丰);TGP-H-060碳纸(日本, 东丽);Sigma 300场发射扫描电子显微镜(SEM)(德国, Zeiss);JEM-2100F透射电子显微镜(TEM)(日本, JEOL);Empyrean X射线衍射仪(XRD)(英国, Malvern Panalytical);EMX A300电子顺磁共振波谱仪(EPR)(德国, Bruker);Evolution 300紫外-可见光分光光度计(美国, Thermo Fisher);CHI 760E电化学工作站(中国, 辰华);GPD-3303S直流电源(中国, 固纬).
2.3 NiCo2O4催化剂制备首先, 将0.02 mol Ni(NO3)2·6H2O和0.04 mol Co(NO3)2·6H2O置于20 mL去离子水中, 进行为期1 h的60 ℃水浴加热;随后, 向溶液中加入0.06 mol柠檬酸, 继续水浴加热2 h;水浴加热完毕后, 升温至90 ℃, 将水分完全蒸干, 形成柠檬酸硝酸混合凝胶;最后, 将混合凝胶置于马弗炉中在400 ℃中煅烧2 h, 即可获得NiCo2O4.
在溶解Ni(NO3)2·6H2O和Co(NO3)2·6H2O的过程中加入0.5 g XC-72碳粉, 并辅以搅拌, 使XC-72碳粉完全分散于溶液中.其余步骤与制备NiCo2O4催化剂相同, 即可制得碳负载的NiCo2O4/C. 将NiCo2O4/C置于1 mol·L-1 NaBH4中浸泡1 h, 收集还原粉末并真空干燥, 即得富含氧空位的NiCo2O4-x/C. 取50 mg催化剂加入至混合溶液(0.4 mL 5% Nafion溶液、2 mL乙醇、8 mL去离子水)中, 随后超声分散30 min得到均匀的黑色浆液, 最后将浆液滴涂于碳纸上, 晾干待用(Peng et al., 2018).
2.4 电化学还原NO3--N电化学还原NO3--N实验在单室电解池(100 mL)以恒电流模式进行, 以Pt片(3 cm×3 cm)作为对电极, 负载电催化剂的碳纸(3 cm×3 cm)(催化剂负载量约为5.56 mg·cm-2)作为阴极, 电极间隔为10 mm.电解质溶液包含作为反应物的NO3--N(100 mg·L-1)和作为支持电解质的Na2SO4(0.1 mol·L-1).所有电解实验均在敞开的气氛和中性条件下进行, 并通过磁力搅拌器控制以350 r·min-1的搅拌速度进行.在反应过程中, 以指定的时间间隔用注射器采集样品, 并立即通过0.45 μm的聚四氟乙烯(PTFE)膜过滤, 然后使用紫外-可见光分光光度计检测水中氮物种的浓度变化.
为了验证NiCo2O4-x/C催化剂应用于实际中硝酸盐电化学还原的可行性, 以广东韶关宝钢集团韶钢公司焦化废水厂生物出水为研究对象, 考察电极用于实际废水中硝氮去除性能.实际废水主要水质参数如下: 化学需氧量(COD)(205±12) mg·L-1、NO3--N (71.4±2.3) mg·L-1、总氮(TN)(74.9±3.1) mg·L-1、电导率(13.4±0.4) mS·cm-1、pH=7.6±0.2.
3 结果与讨论(Results and discussion) 3.1 催化剂的物理化学表征采用溶胶-凝胶法耦合NaBH4还原法制备NiCo2O4-x/C.在合成方法中, 首先在含有硝酸镍和硝酸钴的混合溶液(Ni∶C物质的量比为1∶2)中将XC-72碳粉充分分散, 随后加入柠檬酸制备柠檬酸硝酸混合溶胶, 最后经400 ℃煅烧后, 通过NaBH4还原制得NiCo2O4-x/C.利用SEM和TEM对材料形貌结构进行表征, SEM图像显示原始的NiCo2O4材料基本形貌为纳米球状, 并且引入导电碳载体及构建氧空位并未使催化剂的表面形貌发生太大变化(图 1a~1c).通过TEM(图 1d)可知, NiCo2O4-x/C纳米颗粒均匀分散, 尺寸大小较为一致.HRTEM图显示纳米颗粒尺寸约为15 nm(图 1e), 其中可见的晶格条纹间距为0.245 nm, 对应NiCo2O4的(311)晶面(Liu et al., 2019).进一步地, 通过EDS进行元素分析, 在图 1c中选择区域进行面元素分析, 结果如图 1f所示, C、O、Co、Ni 4种元素均匀分散在选区中, 表明NiCo2O4-x均匀分散在导电碳载体上, 成功制得NiCo2O4-x/C催化剂.
 |
| 图 1 NiCo2O4(a)、NiCo2O4/C(b)和NiCo2O4-x/C(c)的SEM图像及NiCo2O4-x/C的TEM图像(d)、NiCo2O4-x/C的HRTEM图像(e)和NiCo2O4-x/C的EDS谱图(f) Fig. 1 SEM images of NiCo2O4(a), NiCo2O4/C(b) and NiCo2O4-x/C (c), TEM image(d), HRTEM image(e), and EDS spectrum(f) of NiCo2O4-x/C |
为了研究经上述方法制备所获得的样品晶体结构, 对样品进行了XRD分析.从图 2a可知, 采用上述方法合成的材料结晶程度较好, 通过与标准NiCo2O4立方相PDF No.73-1072卡片对比发现, 所有获得的催化剂材料均显示出明显的纯相特性, 说明获得了纯度较高的NiCo2O4材料.值得注意的是, NiCo2O4-x/C所有衍射峰与NiCo2O4/C的衍射峰完全一致, 表明富含氧空位的NiCo2O4-x/C可以保持原有的晶体结构, 氧缺陷并未对其晶体结构产生影响.为了证实NiCo2O4-x/C中存在更多的氧空位, 电子顺磁共振测试被用于分析不同样品氧空位含量差异.从图 2b可以看到, 具有G值为2.002的EPR信号可归属为顺磁氧空位特征信号(Chen et al., 2021), NiCo2O4-x/C样品中检测出极高的信号强度说明其氧空位丰度远超过NiCo2O4/C.
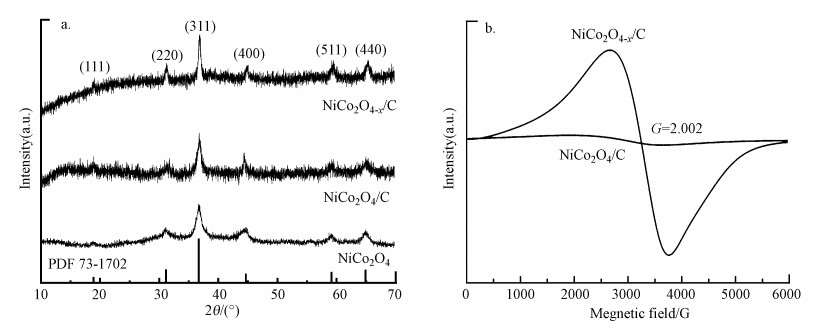 |
| 图 2 NiCo2O4、NiCo2O4/C和NiCo2O4-x/C的XRD图(a)及NiCo2O4/C和NiCo2O4-x/C的EPR图(b) Fig. 2 XRD spectra of NiCo2O4, NiCo2O4/C and NiCo2O4-x/C(a) and EPR spectra of NiCo2O4/C and NiCo2O4-x/C(b) |
采用三电极体系对电催化剂进行电化学表征分析, 负载催化剂的碳纸、Pt片电极和饱和甘汞电极(SCE)分别作为工作电极、对电极及参比电极, 含有100 mg·L-1 NO3--N的0.1 mol·L-1 Na2SO4溶液作为电解质溶液.如图 3a所示, 线性扫描伏安(LSV)曲线显示3种催化剂之间电流密度存在明显差异.相较于原始的NiCo2O4催化剂, 加入导电碳载体后的NiCo2O4/C硝酸盐还原电流有明显提升, 这说明通过碳负载改善了NiCo2O4导电性, 可增强其电子传输能力, 从而提高硝酸盐还原效率.NiCo2O4-x/C比NiCo2O4/C具有更大的硝酸盐还原电流, 这表明向催化剂引入氧空位降低了硝酸盐吸附能, 可有效增强硝酸盐还原反应.
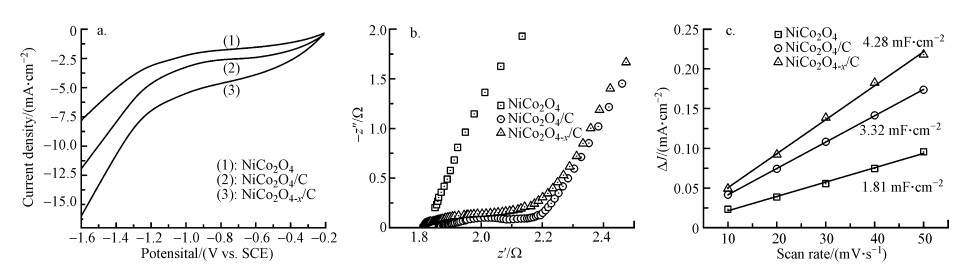 |
| 图 3 NiCo2O4、NiCo2O4/C和NiCo2O4-x/C在硝酸盐溶液中的LSV曲线(a)和EIS谱图(b)及NiCo2O4、NiCo2O4/C和NiCo2O4-x/C在-0.35 V vs. SCE电位下的电流密度与对应扫描速率之间的关系(c) (实验条件: 扫描速率50 mV·s-1, NO3--N浓度100 mg·L-1, Na2SO4浓度0.1 mol·L-1, 频率范围105~10-2 Hz, 交流电压幅度5 mV) Fig. 3 LSV curves (a) and EIS spectra (b) of the NiCo2O4, NiCo2O4/C and NiCo2O4-x/C electrodes in the nitrate solution and relationship between the current density of the NiCo2O4, NiCo2O4/C, and NiCo2O4-x/C electrodes at -0.35 V vs. SCE and the corresponding scan rate(c) |
通常认为导电碳载体在改善半导体型催化剂催化性能中起到重要作用, 因其能显著改变界面电荷密度, 提高催化剂电子传输速率(Zhang et al., 2014).图 3b为3种催化剂的电化学阻抗(EIS)图谱, 从图中发现, 对比无导电碳载体的催化剂, 复合导电碳载体的催化剂(NiCo2O4/C和NiCo2O4-x/C)具有更小的圆环半径, 这说明导电碳载体可极大降低电催化剂的电荷转移电阻, 提高电催化剂的导电能力, 从而具有更强的硝酸盐还原性能.电化学活性表面积(ECSA)反映电催化剂实际参与电化学反应的有效面积, 一般而言, ECSA越大, 电催化剂的潜在活性位点越多(Garcia-Segura et al., 2018).电催化剂的ECSA可通过双电层电容估算, 更大的双电层电容意味着更大的ECSA.如图 3c所示, NiCo2O4-x/C拥有最大的双电层电容(4.28 mF·cm-2), 说明其具有最大的ECSA, 拥有最多的硝酸盐还原潜在活性位点, 可更高效还原硝酸盐.
3.3 电催化还原水中硝酸盐 3.3.1 催化剂类型对电催化还原水中硝酸盐的影响3种催化剂还原硝酸盐的性能如图 4所示.从图 4a可知, NiCo2O4-x/C阴极具有最佳的硝酸盐还原性能, 在3 h内可去除水中94.8%的NO3--N, 高于NiCo2O4阴极(58.2%)和NiCo2O4/C阴极(82.6%).此外, 作为阴极基底的碳纸几乎不能还原硝酸盐, 并且导电碳载体对硝酸盐还原也只起到微乎其微的作用.有趣的是, 引入碳载体使NiCo2O4/C阴极性能明显优于NiCo2O4阴极, 表明碳载体可有效提升过渡金属氧化物电催化性能.图 4b为3种催化剂还原硝酸盐过程中NH4+-N的生成情况.NH4+-N是硝酸盐深度还原的产物, NiCo2O4-x/C阴极还原硝酸盐可生成更多NH4+-N也证明其具有更强的硝酸盐还原能力.值得注意的是, 相较于NiCo2O4/C阴极, NiCo2O4-x/C阴极还原硝酸盐过程中毒性中间体NO2--N积累量更低, 这可能是硝酸盐中的氧原子填充进催化剂中的氧空位后, 削弱了N—O键键合强度, 从而抑制了副产物的生成(Jia et al., 2020)(图 4c).除了基本降解性能对比以外, 能量效率方面的参数(如法拉第效率和能耗)也作为考察电极性能的指标.图 4d显示了3种电催化剂的法拉第效率(Faradaic Efficiency, FE), 其中, NiCo2O4-x/C去除硝酸盐的FE为19.6%, 高于NiCo2O4(13.7%)和NiCo2O4/C(17.3%), 亦优于文献所报道的金属氧化物阴极(6.7%~18.2%)(Su et al., 2017; Gao et al., 2019a; Jonoush et al., 2020).NiCo2O4-x/C电催化剂具有更高的FE, 说明其催化产生的副反应更少, 在动力学和选择性方面更具优势.能耗由两方面因素决定: 硝酸盐去除速率及电化学反应器槽压.在恒电流模式下, 3种阴极反应体系的槽压分别为3.8 V(NiCo2O4-x/C)、4.1 V(NiCo2O4/C)和4.3 V(NiCo2O4).由于NiCo2O4-x/C具有更好的反应活性, 在相对较小的阴极电位下可发生电化学脱氮反应, 最终使得去除硝酸盐的能耗低于其他电催化剂.如图 4e所示, NiCo2O4-x/C、NiCo2O4/C及NiCo2O4阴极对应能耗分别为287.3、341.1和475.6 kWh·kg-1.
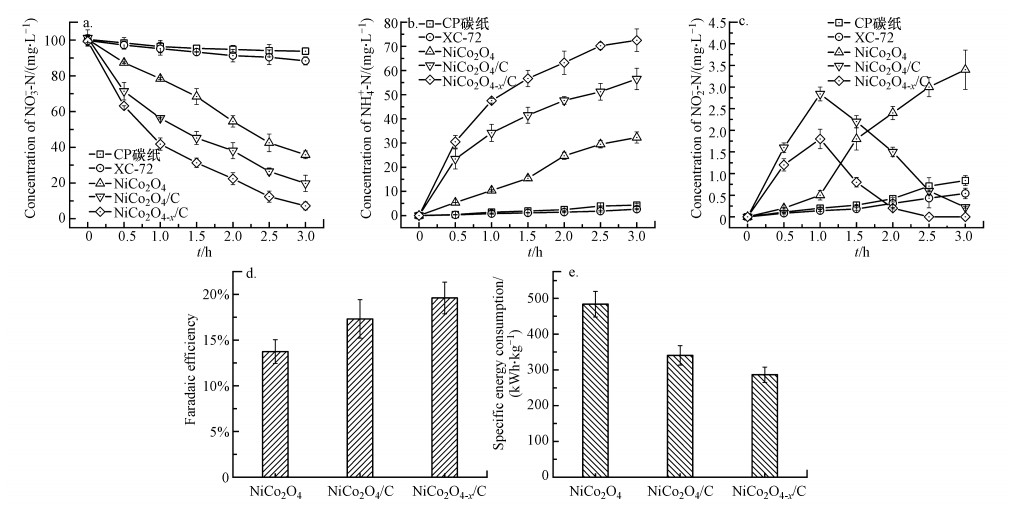 |
| 图 4 NO3--N(a)、NH4+-N(b)和NO2--N(c)浓度在不同阴极系统还原硝酸盐过程中随时间变化情况及不同阴极系统还原硝酸盐过程中的法拉第效率(d)和能耗(e) (实验条件: NO3--N浓度100 mg·L-1, Na2SO4浓度0.1 mol·L-1, 溶液pH=7, 电流密度20 mA·cm-2) Fig. 4 Time-course NO3--N(a), NH4+-N(b), and NO2--N(c) concentrations in different cathode systems for nitrate reduction and Faradaic efficiency(d) and energy consumption(e) in the process of nitrate reduction under different cathode systems |
电流密度会显著影响阴极反应动力学, 是电催化还原硝酸盐的重要影响因素.本实验在pH=7、初始NO3--N浓度为100 mg·L-1的条件下, 考察电流密度对硝酸盐去除效果的影响, 实验结果如图 5所示.
 |
| 图 5 不同电流密度(a)及不同溶液pH(b)对NiCo2O4-x/C阴极去除硝酸盐的影响及NiCo2O4-x/C阴极还原硝酸盐的循环稳定实验(c) (实验条件: a.NO3--N浓度100 mg·L-1, Na2SO4浓度0.1 mol·L-1, 溶液pH=7;b.NO3--N浓度100 mg·L-1, Na2SO4浓度0.1 mol·L-1, 电流密度20 mA·cm-2;c.NO3--N浓度100 mg·L-1, Na2SO4浓度0.1 mol·L-1, 溶液pH=7, 电流密度20 mA·cm-2) Fig. 5 Effect of the current density(a) and the solution pH(b) on the performance of nitrate removal by NiCo2O4-x/C cathode and the cycle stability experiment of NiCo2O4-x/C cathode for nitrate reduction(c) |
由图 5a可知, 当施加的电流密度处于5~25 mA·cm-2范围内, 硝酸盐去除率随电流密度的增加而提高, 以上结果是可预见的.首先, 电流密度越大, 电极界面可供给更多的电子用于硝酸盐还原, 硝酸盐去除效果越好;其次, 更大的电流密度可促进更多H*生成, 通过H*间接还原途径, 提升水中硝酸盐去除效率;最后, 过大的阴极电流也会使副反应加剧, 生成更多的H2, 大量气泡的析出会影响水中硝酸盐与电极界面之间的反应, 降低电子利用效率, 使得继续增大电流不能明显提升硝酸盐去除速率(Li et al., 2016; Gao et al., 2019a).因此, 综合实验结果, 20 mA·cm-2作为最佳电流密度被选择为后续实验条件.
3.3.3 溶液pH对电还原硝酸盐的影响溶液pH会对电极反应电势和吉布斯自由能变产生影响, 是影响水溶液中电化学反应的重要因素(Duca et al., 2012; Garcia-Segura et al., 2018; Liu et al., 2019; Zeng et al., 2020).为了考察溶液pH对NiCo2O4-x/C阴极电催化还原硝酸盐的影响, 本实验在不同初始pH(3~9)条件下进行, 结果如图 5b所示.
由图 5b可知, 当pH从5增加至9时, 硝酸盐去除率逐渐下降, 并且pH从7升高至9时硝酸盐去除率下降明显.这可解释为: 溶液pH的升高使硝酸盐脱氧加氢还原过程发生需要更大的驱动力(Li et al., 2020).因此, 在施加相同电流密度条件下, 硝酸盐去除率呈现下降趋势.另外, 当pH从5下降至3时, 硝酸盐去除受到抑制.这是因为低溶液pH更有利于H2析出, 使副反应加剧, 从而抑制硝酸盐还原(Su et al., 2016).总体而言, 虽然过高和过低的溶液pH会对NiCo2O4-x/C阴极还原硝酸盐造成负面影响, 但NO3--N去除率仍保持在较高的水平(>81.2%).这说明该阴极具有较宽的pH工作范围, 有望在宽pH范围处理硝酸盐废水.
3.3.4 NiCo2O4-x/C阴极稳定性电极稳定性是评价电催化剂性能的重要指标, 长期稳定运行是电催化剂应用的前提.为了研究NiCo2O4-x/C阴极的稳定性, 对该阴极进行了循环降解实验.如图 5c所示, NiCo2O4-x/C催化剂经5次循环处理后, 性能未出现明显下降.这表明该催化剂不仅具有优良的催化活性, 还具备良好的稳定性.
3.4 电催化还原硝酸盐的机理研究电化学还原硝酸盐途径包括直接还原和间接还原(Garcia-Segura et al., 2018; Gao et al., 2019a).其中, 直接还原途径直接利用电子充当还原剂, 使硝酸盐在电极界面发生电子转移, 接收来自阴极的电子, 并结合水中H+, 逐步脱氧加氢, 实现硝酸盐还原(式(1)~(7))(Zeng et al., 2020);间接还原途径则通过阴极表面吸附态原子H*充当还原剂介导还原反应, 利用Volmer反应生成的原子H*间接还原硝酸盐(式(8)~(14))(Gao et al., 2019b).因原子H*具有强还原性, 间接还原途径在硝酸盐还原过程中起到的作用不可忽视.
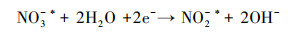
|
(1) |
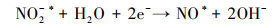
|
(2) |
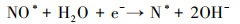
|
(3) |
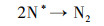
|
(4) |
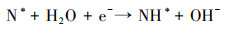
|
(5) |
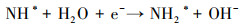
|
(6) |
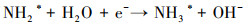
|
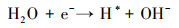
|
(8) |
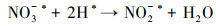
|
(9) |
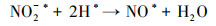
|
(10) |

|
(11) |
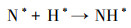
|
(12) |

|
(13) |
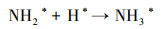
|
(14) |
为了研究以上两种还原途径在NiCo2O4-x/C阴极还原硝酸盐中的作用, 叔丁醇被用来清除原子H*以定量研究其还原硝酸盐的贡献(Liu et al., 2019).实验结果如图 6a所示, 叔丁醇的加入可明显抑制硝酸盐的去除.当外加叔丁醇的浓度为50 mmol·L-1时, 相较于对照组, NO3--N去除率从95.4%下降至72.7%.当外加叔丁醇的浓度增加至100 mmol·L-1时, NO3--N去除率进一步降低约32%.但当外加叔丁醇的浓度从100 mmol·L-1增加至200 mmol·L-1时, 硝酸盐去除仅发生微小变化, 说明此加入量的叔丁醇几乎完全清除了原子H*对硝酸盐还原的贡献.综合以上实验结果, 通过原子H*间接还原作用在NiCo2O4-x/C阴极还原硝酸盐中起到约34%的贡献, 该间接还原途径在硝酸盐还原中起到重要作用.此外, 电子顺磁共振(EPR)波谱也被用在检测电化学还原硝酸盐过程中原子H*的生成.如图 6b所示, 在NiCo2O4-x/C体系中检测出归属于DMPO-H的九重特征峰(Gao et al., 2019b), 该信号是原子H*生成的有力证据.
 |
| 图 6 TBA浓度对NiCo2O4-x/C阴极去除硝酸盐的影响(a)及以DMPO为自选捕获剂的EPR谱图(b)(实验条件: NO3--N浓度100 mg·L-1, Na2SO4浓度0.1 mol·L-1, 溶液pH=7, 电流密度20 mA·cm-2) Fig. 6 Effect of the TBA concentration on the performance of nitrate removal by NiCo2O4-x/C cathode(a) and DMPO spin-trapping EPR spectra(b) |
以往研究表明, 直接电子转移途径主要发生在强吸附硝酸盐的非贵金属基阴极(如Cu和Co)(Su et al., 2017; Gao et al., 2019a; Shih et al., 2020);原子H*间接还原途径通常发生在氢吸附能力强的贵金属基阴极(如Pd)(Wang et al., 2006; Shen et al., 2020).然而上述实验结果证实, 非贵金属基催化剂NiCo2O4-x/C亦可催化生成大量的原子H*, 并对硝酸盐还原起到重要作用.这可能是由于催化剂所含的氧空位能够加速电子从H2O向原子H*传输, 强化原子H*的生成及提升原子H*的稳定性, 进而原子H*参与硝酸盐还原反应(Liu et al., 2018; Gao et al., 2019b).这表明引入氧缺陷可促进原子H*生成, 是一种提升电催化剂还原硝酸盐性能的有效策略.
以广东韶钢焦化废水生物出水为研究对象, 考察NiCo2O4-x/C阴极去除实际废水中硝氮的性能.该废水主要含有(205±12) mg·L-1的COD和(71.4±2.3) mg·L-1的NO3--N, 因该废水含有一定量的难降解有机物, 有机组分对电还原硝酸盐的影响也被同时考虑.如图 7所示, 在处理实际废水过程中, 经5 h处理后, NO3--N浓度从72.1 mg·L-1减少至15.4 mg·L-1, 约78.6%的NO3--N从废水中去除.当原废水经过芬顿预处理(COD从205 mg·L-1减少至34 mg·L-1)后, NO3--N浓度可从70.2 mg·L-1降低至2.5 mg·L-1, NO3--N去除率显著升高至96.3%.以上结果表明NiCo2O4-x/C阴极可以有效去除实际废水中硝酸盐, 并且去除难降解有机物有利于该阴极还原.这可能是由于有机物吸附在阴极表面, 占据硝酸盐吸附及反应活性位点引起的(Duan et al., 2019).
 |
| 图 7 NiCo2O4-x/C阴极去除焦化废水生物出水中硝酸盐(实验条件: 溶液pH=7.6, 电流密度20 mA·cm-2) Fig. 7 Nitrate removal in bio-treated coking wastewater (BTCW) with the NiCo2O4-x/C cathode |
1) NiCo2O4-x/C电催化剂可通过溶胶-凝胶法耦合NaBH4还原法制得.引入导电碳载体可改善NiCo2O4导电性, 从而使电极具备更小的界面电荷转移电阻, 实现硝酸盐还原性能的大幅提升(NO3--N去除率从58.2%升高至82.6%);引入氧空位可加强催化剂的硝酸盐吸附能力并促进生成原子H*作用于硝酸盐还原, 进一步提升硝酸盐还原性能(NO3--N去除率从82.6%升高至94.8%).
2) 在电解时间为3 h, 电流密度为20 mA·cm-2, pH=5时, 硝酸盐去除率可达96.3%.在不同初始pH(3~9)条件下NO3--N去除率始终处于较高的水平(>81.2%), 展现出NiCo2O4-x/C在宽pH范围内的硝酸盐还原潜能.此外, 经5次循环处理后, 催化剂仍能保持良好性能.
3) 原子H*掩蔽实验证明, 原子H*介导间接还原途径在NiCo2O4-x/C阴极还原硝酸盐中起到约34%的贡献;EPR波谱证实在NiCo2O4-x/C阴极还原硝酸盐过程中原子H*的生成.
4) NiCo2O4-x/C电催化剂可有效去除实际焦化废水生物出水中硝酸盐, 但吸附于阴极表面的有机物会抑制部分催化活性.
5) 该工作证实导电碳载体负载和氧空位构建可提升半导体型过渡金属氧化物的硝酸盐还原性能, 为开发非贵金属基阴极材料提供新思路.
Ahn J H, Choo K H, Park H S. 2008. Reverse osmosis membrane treatment of acidic etchant wastewater: Effect of neutralization and polyelectrolyte coating on nitrate removal[J]. Journal of Membrane Science, 310(1/2): 296-302. |
Belkada F D, Kitous O, Drouiche N, et al. 2018. Electrodialysis for fluoride and nitrate removal from synthesized photovoltaic industry wastewater[J]. Separation & Purification Technology, 204: 108-115. |
Chen L A, Kan L, Chen C A, et al. 2020. Electrochemical removal of nitrate using a nanosheet structured Co3O4/Ti cathode: Effects of temperature, current and pH adjusting[J]. Separation and Purification Technology, 237: 116485. DOI:10.1016/j.seppur.2019.116485 |
Chen S, Huang D, Liu D, et al. 2021. Hollow and porous NiCo2O4 nanospheres for enhanced methanol oxidation reaction and oxygen reduction reaction by oxygen vacancies engineering[J]. Applied Catalysis B: Environmental, 291: 120065. DOI:10.1016/j.apcatb.2021.120065 |
Duan W, Li G, Lei Z, et al. 2019. Highly active and durable carbon electrocatalyst for nitrate reduction reaction[J]. Water Research, 161: 126-135. DOI:10.1016/j.watres.2019.05.104 |
Duca M, Koper M T M. 2012. Powering denitrification: the perspectives of electrocatalytic nitrate reduction[J]. Energy & Environmental Science, 5(12): 9726-9742. |
杜新强, 方敏, 冶雪艳. 2018. 地下水"三氮"污染来源及其识别方法研究进展[J]. 环境科学, 39(11): 428-437. |
Gao J N, Jiang B, Ni C, et al. 2019a. Non-precious Co3O4-TiO2/Ti cathode based electrocatalytic nitrate reduction: Preparation, performance and mechanism[J]. Applied Catalysis B: Environmental, 254: 391-402. DOI:10.1016/j.apcatb.2019.05.016 |
Gao J, Jiang B, Ni C, et al. 2019b. Enhanced reduction of nitrate by noble metal-free electrocatalysis on P doped three-dimensional Co3O4 cathode: Mechanism exploration from both experimental and DFT studies[J]. Chemical Engineering Journal, 382: 123034. |
Garcia-Segura, Sergi, Lanzarini-Lopes, et al. 2018. Electrocatalytic reduction of nitrate: Fundamentals to full-scale water treatment applications[J]. Applied Catalysis B: Environmental, 236: 546-568. DOI:10.1016/j.apcatb.2018.05.041 |
Jia R, Wang Y, Wang C, et al. 2020. Boosting selective nitrate electroreduction to ammonium by constructing oxygen vacancies in TiO2[J]. ACS Catalysis, 10(6): 3533-3540. DOI:10.1021/acscatal.9b05260 |
Jie C, Hao W, Hui Q, et al. 2016. Assessing nitrate and fluoride contaminants in drinking water and their health risk of rural residents living in a semiarid region of northwest China[J]. Exposure & Health, 9: 183-195. |
Jonoush Z A, Rezaee A, Ghaffarinejad A. 2020. Electrocatalytic nitrate reduction using Fe0/Fe3O4 nanoparticles immobilized on nickel foam: Selectivity and energy consumption studies[J]. Journal of Cleaner Production, 242: 118569. DOI:10.1016/j.jclepro.2019.118569 |
Knobeloch L, Salna B, Hogan A, et al. 2000. Blue babies and nitrate-contaminated well water[J]. Environmental Health Perspectives, 108(7): 675-675. DOI:10.1289/ehp.00108675 |
Li C, Li K, Chen C, et al. 2020. Electrochemical removal of nitrate using a nanosheet structured Co3O4/Ti cathode: Effects of temperature, current and pH adjusting[J]. Separation and Purification Technology, 237: 116485. DOI:10.1016/j.seppur.2019.116485 |
李琪, 黄斌, 陈欣, 等. 2015. 高硝酸盐地下水离子交换再生液的生物脱硝及循环利用[J]. 环境工程学报, 9(5): 2303-2309. |
Li W, Xiao C, Zhao Y, et al. 2016. Electrochemical reduction of high-concentrated nitrate using Ti/TiO2 nanotube array anode and Fe cathode in dual-chamber cell[J]. Catalysis Letters, 146(12): 1-11. |
Liu H, Han J, Yuan J, et al. 2019. Deep dehalogenation of florfenicol using crystalline CoP nanosheet arrays on a Ti plate via direct cathodic reduction and atomic H[J]. Environmental Science & Technology, 53(20): 11932-11940. |
Liu J, Zhang J, Wang D, et al. 2019. Highly dispersed NiCo2O4 nanodots decorated three-dimensional g-C3N4 for enhanced photocatalytic H2 generation[J]. ACS Sustainable Chemistry & Engineering, 7(14): 12428-12438. |
Liu J X, Richards D, Singh N, et al. 2019. Activity and selectivity trends in electrocatalytic nitrate reduction on transition metals[J]. ACS Catalysis, 9(8): 7052-7064. DOI:10.1021/acscatal.9b02179 |
Liu R, Zhao H, Zhao X, et al. 2018. Defect sites in Ultrathin Pd nanowires facilitate the highly efficient electrochemical hydrodechlorination of pollutants by H*ads[J]. Environmental Science & Technology, 52(17): 9992-10002. |
Liu Y, Gao G, Vecitis C D. 2020. Prospects of an electroactive carbon nanotube membrane toward environmental applications[J]. Accounts of Chemical Research, 53(12): 2892-2902. DOI:10.1021/acs.accounts.0c00544 |
Peng S, Gong F, Li L, et al. 2018. Necklace-like multishelled hollow spinel oxides with oxygen vacancies for efficient water electrolysis[J]. Journal of the American Chemical Society, 140(42): 13644-13653. DOI:10.1021/jacs.8b05134 |
Peng Y, Cui M, Zhang Z, et al. 2019. Bimetallic composition-promoted electrocatalytic hydrodechlorination reaction on silver-palladium alloy nanoparticles[J]. ACS Catalysis, 9(12): 10803-10811. DOI:10.1021/acscatal.9b02282 |
Pu J, Wang J, Jin X Q, et al. 2013. Porous hexagonal NiCo2O4 nanoplates as electrode materials for supercapacitors[J]. Electrochimica Acta, 106(9): 226-234. |
Shen Z, Liu D, Peng G, et al. 2020. Electrocatalytic reduction of nitrate in water using Cu/Pd modified Ni foam cathode: High nitrate removal efficiency and N2-selectivity[J]. Separation and Purification Technology, 241: 116743. DOI:10.1016/j.seppur.2020.116743 |
Shih Y J, Wu Z L, Huang Y H, et al. 2020. Electrochemical nitrate reduction as affected by the crystal morphology and facet of copper nanoparticles supported on nickel foam electrodes (Cu/Ni)[J]. Chemical Engineering Journal, 383: 123157. DOI:10.1016/j.cej.2019.123157 |
Su J F, Ruzybayev I, Shah I, et al. 2016. The electrochemical reduction of nitrate over micro-architectured metal electrodes with stainless steel scaffold[J]. Applied Catalysis B: Environmental, 180: 199-209. DOI:10.1016/j.apcatb.2015.06.028 |
Su L, Kan L, Zhang H, et al. 2017. Electrochemical nitrate reduction by using a novel Co3O4/Ti cathode[J]. Water Research, 120: 1-11. DOI:10.1016/j.watres.2017.04.069 |
Wang Y, Qu J H, Liu H J. 2006. Preparation and electrochemical properties of the Pd-modified Cu electrode for nitrate reduction in water[J]. Chinese Chemical Letters, 17(1): 61-64. |
徐庆勇, 武晓梅, 马宏, 等. 2018. 丰台区地下水硝酸盐氮分布特征及生态风险评价[J]. 环境科学与技术, 41(10): 219-225. |
Zeng Y, Priest C, Wang G, et al. 2020. Restoring the nitrogen cycle by electrochemical reduction of nitrate: Progress and prospects[J]. Small Methods, 4(12): 2000672. DOI:10.1002/smtd.202000672 |
Zhang G, Bao Y X, Wang X, et al. 2014. Strongly coupled NiCo2O4-rGO hybrid nanosheets as a methanol-tolerant electrocatalyst for the oxygen reduction reaction[J]. Advanced Materials, 26(15): 2408-2412. DOI:10.1002/adma.201304683 |
 2021, Vol. 41
2021, Vol. 41


