2. 陕西省黄河研究院, 西安 710127;
3. 中国科学院大学, 北京 100049;
4. 大连海洋大学水产与生命学院, 辽宁省水生生物重点实验室, 大连 116023;
5. 中国水产科学研究院黄河水产研究所, 西安 710086
2. Yellow River Institute of Shaanxi Province, Xi'an 710127;
3. University of Chinese Academy of Sciences, Beijing 100049;
4. College of Fisheries and Life Science, Key Laboratory of Hydrobiology in Liaoning Province, Dalian Ocean University, Dalian 116023;
5. Huanghe River Fisheries Research Institute of Chinese Academy of Fishery Sciences, Xi'an 710086
浮游植物作为水生态系统的初级生产者, 是水生态系统食物链中最基础和最重要的环节, 其种类和数量的变化直接或间接地影响其他水生生物的丰度和分布, 甚至会影响整个生态系统的稳定(胡韧等, 2002).由于浮游植物生长周期短, 对水环境的变化敏感且响应迅速, 其生物量和群落结构能很好地反映水质现状及变化趋势, 尤其是营养水平的变化, 是评价水环境质量的重要指标(王振方等, 2019).在水域生态系统中, 浮游植物与水环境因子密切相关, 浮游植物群落结构的季节性演替能够表征水环境的状态, 同时水环境的时空变化会影响浮游植物的组成与分布(Sommer et al., 2012).在水环境因素中, 水温、光照、营养盐等(Winder et al., 2012;俞秋佳等, 2014;陈延松等, 2015)是影响浮游植物群落结构变化的主要非生物因素, 滤食性鱼类、底栖动物、水生植物、浮游动物等(Brantes et al., 2006;段金荣等, 2009;张国栋, 2011;杨洋等, 2017;池仕运等, 2020)是主要的生物因素.因此, 探究浮游植物群落结构的变化以及与水环境因子的关系可以对水体保护提供重要参考.
渭河是黄河流域第一大支流, 担负着供水、灌溉、生态、旅游等功能, 在区域经济发展中具有重要的地位.渭河发源于甘肃省渭源县, 自西向东流经甘肃省和陕西省, 于渭南市潼关汇入黄河, 干流全长818 km, 流域面积13.48万km2, 海拔落差2200 m.渭河属典型的大陆季风性气候, 年降水量分布极不均匀, 渭河以南地区大于渭河以北(Deng et al., 2018;Song et al., 2018).渭河南岸支流发源于秦岭北麓, 是渭河径流量的主要来源, 孕育了许多水生生物, 近年来, 由于气候干旱和人类活动(城镇化建设)的加剧, 渭河面临着水量减少、水质退化、生物多样性降低等问题(李景宜, 2007), 现已成为西北典型的因人类活动剧烈干扰水生态系统的主要河流, 对水生生物的群落结构演变产生较大影响(张嘉嘉等, 2007).
渭河陕西段因其特有的地理位置、气候条件以及人类活动的影响, 具有泥沙含量高、污染严重、生物多样性少等特点, 成为渭河流域环境治理与生态保护的重要河段(胡德秀等, 2018).因此, “十二五”期间, 陕西省将渭河陕西段的综合治理作为水利建设的重点项目之一, 2011年启动了渭河陕西段综合整治工程, 先后出台了《渭河流域水污染防治三年行动方案(2012—2014)》和《渭河生态区建设总体规划》等相关政策文件, 并进行了一系列的河道生态环境调查研究(武玮等, 2014;闵文武等, 2015;杨海强等, 2020)及综合治理工程, 基于此, 渭河水生生物群落时空分布特征已成为研究热点(殷旭旺等, 2013;Wu et al., 2016;徐宗学等, 2016;王硕等, 2019).然而, 近年来对河道环境治理和湿地景观工程建设后渭河陕西段水生生物的时空格局研究鲜有报道.因此, 本研究通过实地采样调查, 聚焦于春(枯水期)秋(丰水期)两个季节渭河陕西段浮游植物的种类、密度和生物多样性时空变化, 运用聚类分析方法, 对其采样点进行相似性分类, 结合水文和水质参数, 分析浮游植物群落的季节演替规律及其与水环境的关系, 以期为渭河乃至黄河流域生态保护与高质量发展提供基础资料和依据.
2 材料与方法(Materials and methods) 2.1 采样断面和采样频率本研究依据渭河陕西段的水系分布以及前期调查研究(白海锋, 2014), 尽可能以最少的采样点获取足够有代表性的环境与生物信息.自西向东选取上游的宝鸡市陈仓区姜马村(W1)、眉县北兴村(W2), 中游的咸阳市武功县洪寨村(W3)、杨凌区万家村(W4)、西安市秦都区梁村(W5)、高陵区渭桥村(W6), 下游的渭南临渭区淹头村(W7)、潼关县四枝村(W8)和渭河入黄河处港口村(W9), 9个断面(27个采样点), 具体采样断面分布见图 1.河道自上游至下游分为山区型、城市型和平原型, 以城市型河道为主.采样时间为2017年9—10月和2018年3—4月, 陕西省水资源公报显示, 2017年和2018年渭河年平均降雨量分别为722.2 mm、703.0 mm, 根据降雨量季节分布特征, 确定9—10月为渭河陕西段丰水期, 3—4月为枯水期.采集浮游植物样品时, 使用GPS记录各采样断面的经纬度与海拔(ALT).
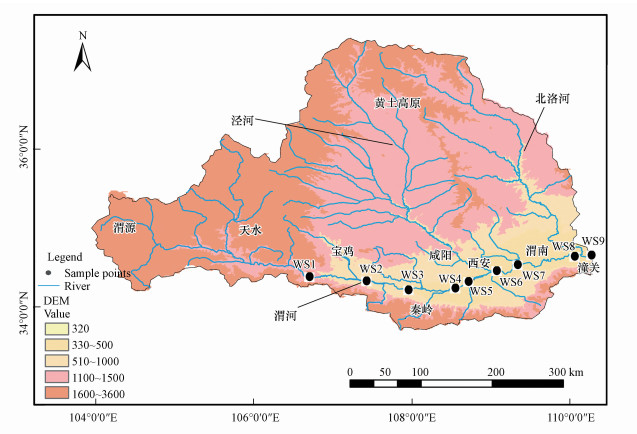 |
| 图 1 渭河陕西段采样断面示意图 Fig. 1 Location and sampling sites in Shaanxi section of Weihe River |
在各采样断面分左、中、右3个采样点进行样品采集, 定性样品采集:用浮游生物网在水面下0.5 m处呈“∞”形拖拽采集, 收集水样浓缩至50 mL, 加1.5%鲁哥氏液固定;定量样品采集:在各采样点用采水器取上、中下层水样各2 L, 混合均匀后取混合水样1 L, 加鲁哥氏液10 mL固定, 水样送回实验室, 静置沉淀48 h, 虹吸除去上清液, 浓缩至100 mL, 取0.1 mL水样置于浮游植物计数框内, 在显微(OlympusCX21)400倍镜下进行物种鉴定和细胞计数, 浮游植物样品采集、种类鉴定、定性定量参照文献(赵文, 2005;胡鸿钧等, 2006), 种类鉴定尽可能到最低分类单元(种或属级).
现场采用YSI-85型便携式水质分析仪测定水温(WT)、pH、溶解氧(DO)、总溶解性固体(TDS), 使用流速仪(FP111)测定流速(CV);现场取水样1 L, 低温(4 ℃)保存送实验室参照《水和废水检测分析方法》第四版(国家环境保护总局, 2002)测定总氮(TN)、总磷(TP)、氨氮(NH4+-N)、高锰酸钾盐指数(CODMn)等指标.浮游动物(Zoopl)物种采集、鉴定和计数定量等参考(韩茂森等, 1995;孟伟等, 2011).
2.3 数据处理与分析 2.3.1 群落多样性分析多样性采用Shannon-Weiner指数(H′)、Pielou均匀度指数(J)和Margalef丰富度指数(d), 其计算公式分别见式(1)~(3).
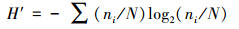
|
(1) |
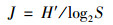
|
(2) |

|
(3) |
式中, ni为第i种个体数, N 为所有种个体数, S为样品中总种类数.
2.3.2 优势种和常见种确定浮游植物优势种属的确定采用优势度(Y)计算见式(4).
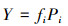
|
(4) |
式中, Y 为优势度, fi为第i个物种的出现频率, Pi为第i个物种个体数占总个体数的比例, 以Y ≥ 0.02确定为优势种.常见种属是根据物种的出现频率(f)来确定, 当f 大于65%时确定为常见种.
2.3.3 数据分析应用Origin2018软件对渭河陕西段浮游植物群落多样性、丰富度、均匀度指数做箱图对比;应用SPSS19.0软件对采样点进行密度聚类, 建立聚类树状图, 采用Pearson分析进行数据相关性分析;应用CANOCO4.5软件对浮游植物和水环境因子进行去趋势对应分析(DCA), 当排序梯度最大值大于4时选择典范对应分析(CCA)进行排序分析和作图, 所有种类密度和环境因子均进行lg(x+1)标准转换, 并将单个因子贡献率p<0.05的环境因子作为显著影响浮游植物群落分布的水环境因子.
3 结果(Results) 3.1 渭河陕西段浮游植物群落组成渭河陕西段枯水期和丰水期共鉴定出浮游植物8门69种(包括变种和变型), 种类组成主要集中在绿藻门、硅藻门和蓝藻门, 其中绿藻门27种, 占比39.13%, 硅藻门23种, 占比33.33%, 蓝藻门8种, 占比11.59%, 裸藻门、隐藻门、甲藻门、金藻门和黄藻门共计11种, 总占比15.95%(表 1, 图 2a).从空间分布来看, 浮游植物种类数在各采样点存在差异, 其中渭南河段WS8和WS9(平原型河段)种类较丰富, 宝鸡河段WS1(山谷型河段)种类较少(图 2b), 从季节来看, 浮游植物种类数存在较大变化, 枯水期种类数(59种)多于丰水期(40种)(图 3).
| 表 1 渭河陕西段浮游植物种类组成 Table 1 Species composition of phytoplankton in Shaanxi section of Weihe River |
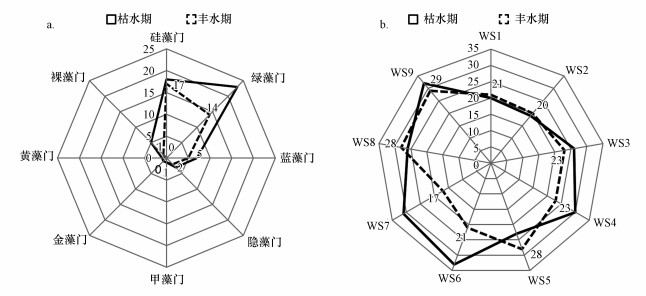 |
| 图 2 浮游植物群落结构特征(a)及种类时空分布(b) Fig. 2 Composition of the phytoplankton community in different seasons(a) andspecies composition of the phytoplankton in the different sampling sites and different seasons(b) |
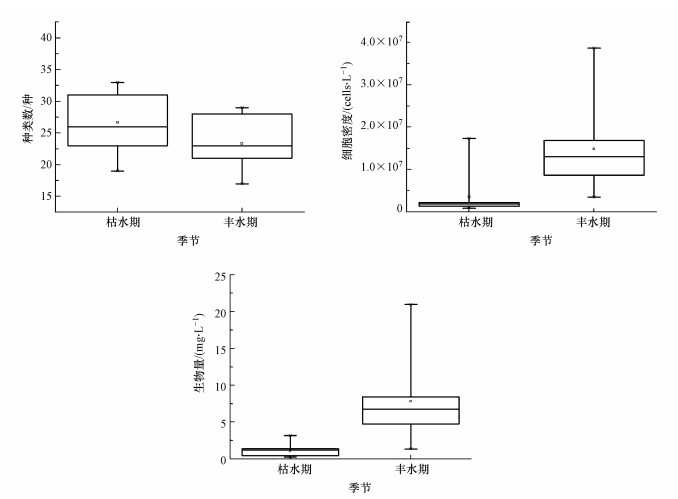 |
| 图 3 不同季节浮游植物种类数、密度和生物量变化 Fig. 3 Variations in phytoplankton species number, density and biomass in different seasons |
渭河陕西段浮游植物的细胞密度为84.9×104~3868.3×104 cells·L-1, 存在季节性差异, 丰水期浮游植物的细胞密度(1490.0×104 cells·L-1)显著高于枯水期(354.8×104 cells·L-1)(p < 0.05)(图 3), 丰水期浮游植物细胞密度主要以蓝藻为主, 平均细胞密度为158.12×104 cells·L-1, 占比为44.57%.从空间上看, 浮游植物细胞密度分布存在明显差异, 变化趋势表现为上游河段(WS1~WS4)>下游河段(WS5~WS9)(图 4).两个水期各采样点的浮游植物生物量与密度变化趋势基本一致, 变化范围为0.268~20.978 mg·L-1, 其中枯水期浮游植物平均生物量(1.152 mg·L-1)显著低于丰水期(7.864 mg·L-1)(p < 0.05)(图 3), 丰水期浮游植物生物量以硅藻和隐藻占比较高, 平均生物量分别为5.329、1.526 mg·L-1, 占比分别为67.76%、19.40%. 在空间分布上, 浮游植物生物量总体上呈现出宝鸡-咸阳河段生物量(10.360 mg·L-1)大于西安-渭南河段(5.866 mg·L-1)(图 4).
 |
| 图 4 各采样断面浮游植物密度和生物量变化 Fig. 4 Spatial-temporal variation of the phytoplankton density and biomass for each sampling section |
渭河陕西段浮游植物优势种共有12种(表 2), 其中硅藻门有3种:梅尼小环藻(Cyclotella meneghiniana)、肘状针杆藻(Synedra ulna)和篦形短缝藻(Eunotia pectinalis);绿藻门有4种:小球藻(Chlorella vulgaris)、狭形纤维藻(Ankistrodesmus angustus)、韦氏藻(Westella botryoides)和二形栅藻(Scenedesmus dimorphus);蓝藻门有3种:小席藻(Phormidium tenus)、小形色球藻(Chroococcus minor)和微小色球藻(Chroococcus minutus);隐藻门有2种:尖尾蓝隐藻(Chroomonas acuta)和卵形隐藻(Chroomonas ovata).常见种共有21种, 包括11种优势种.枯水期优势种(8种)多于丰水期(6种), 常见种丰水期(17种)多于枯水期(13种), 优势度最大的是梅尼小环藻, 在各采样点出现次数最多的是梅尼小环藻、篦形短缝藻、小球藻、二形栅藻和小形色球藻.
| 表 2 浮游植物优势种和常见种季节变化 Table 2 Seasonal variations in dominant species and common species of phytoplankton |
渭河陕西段枯水期和丰水期浮游植物群落多样性指数变动幅度存在差异, 枯水期多样性指数(H′)、丰富度指数(d)、均匀度指数(J)分别为2.332~4.222、0.507~0.852、1.111~1.787, 丰水期多样性指数(H′)、丰富度指数(d)、均匀度指数(J)分别为1.578~3.588、0.360~0.830、0.712~1.184, 表现为丰水期多样性指数、均匀度指数变动幅度较大, 枯水期丰富度指数变动幅度较大的特征.渭河陕西段丰水期和枯水期浮游植物各指数的对比箱体图见图 5, 表现出枯水期浮游植物平均Shannon-Weiner指数(3.329)、Pielou均匀度指数(0.705)、Margalef丰富度指数(1.434)均高于丰水期(2.491)、(0.547)、(0.955)的变化特征.
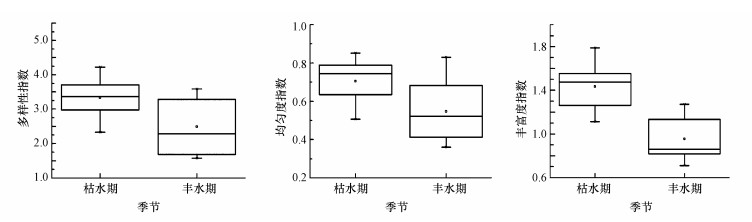 |
| 图 5 不同季节浮游植物物种多样性变化 Fig. 5 Variations in phytoplankton diversity in different seasons |
渭河陕西段浮游植物群落聚类分析结果如图 6所示, 枯水期和丰水期浮游植物群落-断面均分为两大类群, 其中枯水期第1大类群包括WS1、WS2、WS3、WS4、WS5、WS6、WS7、WS8断面, 浮游植物主要以篦形短缝藻、二形栅藻和镰形纤维藻奇异变种(Ankistrodesmus falcatus var. mirabilis)为优势种群, 第2大类群为渭河入黄口WS9断面, 主要以梅尼小环藻、小球藻和小席藻为优势种群;丰水期第1大类群包括W1、W2、W4、W45、W6、W7、W8、W9断面, 主要以放射舟形藻(Navicula radiosa)、狭形纤维藻、小形色球藻和尖尾蓝隐藻为优势种群, 第2大类群渭河武功县断面WS3, 主要以梅尼小环藻、小球藻、韦氏藻和卵形隐藻为优势种群.枯水期和丰水期浮游植物群落相似性聚类存在差异.
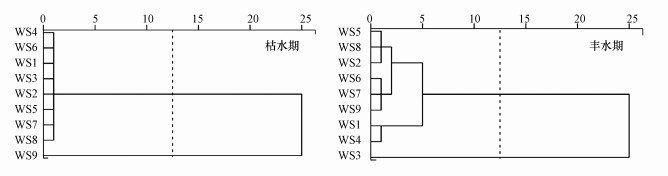 |
| 图 6 不同季节浮游植物群落树形聚类 Fig. 6 Clustering dendrogram of phytoplankton community in different seasons |
渭河陕西段水环境因子的变化如表 3所示, 其中, 枯水期和丰水期的环境因子在独立样本T检验下, 呈现出WT、CV、DO、TDS、TP、NH4+-N、CODMn和氮磷比呈显著差异(p < 0.05), ALT、pH、TN差异不显著(p>0.05).浮游动物群落调查显示, 浮游动物的丰度枯水期与丰水期差异性极显著(p < 0.01).氮磷营养盐含量在枯水期和丰水期均处于较高水平.
| 表 3 渭河陕西段枯水期和丰水期水环境因子变化 Table 3 Changes in aquatic environmental factors within two seasons in Shaanxi section of Weihe River |
对2个水期渭河陕西段浮游植物群落进行去趋势分析(DCA), 排序结果显示4个轴最大长度为12, 属于单峰型模型, 使用典范对应分析(CCA)枯水期和丰水期环境因子对浮游植物群落的影响. CCA分析所示, 在特征值、种类物种变量、浮游植物与环境因子的相关性及物种与环境关系的相关性4个方面, 枯水期和丰水期排序轴1均大于轴2, 前2轴的累积值占特征值总和的百分比分别为58.49%、75.37%, 两轴的物种-环境关系累积百分比分别为57.1%、68.0%(表 4), 表明前两轴的物种与环境因子有较高的相关性, 能够较好地反映主导因子对浮游植物水域分布的影响程度.排序结果表明, 10种环境因子中pH、TDS、TP、CODMn对浮游植物群落分布有显著影响(p<0.05)(表 5, 表 6), 说明TP、pH和TDS是影响枯水期浮游植物群落结构空间分布的主要环境因子, 而TP和CODMn是影响丰水期浮游植物群落结构空间分布的主要环境因子.
| 表 4 浮游植物群落与环境因子CCA分析结果 Table 4 CCA analysis results between phytoplankton and environmental variable |
| 表 5 枯水期环境因子与CCA前2轴之间的相关系数 Table 5 Correlation coefficients between environmental factors and the first two ordination axes of CCA in Dry season |
| 表 6 丰水期环境因子与CCA前2轴之间的相关性系数 Table 6 Correlation coefficients between environmental factors and the first two ordination axes of CCA in Wet season |
在CCA排序图中, 通过向量长短和夹角大小可见pH、TDS、TN、TP、CODMn和浮游动物丰度均对浮游植物生长和分布有较大影响.从浮游植物种类分布来看, 枯水期, 肘状针杆藻、二形栅藻、小席藻、微小色球藻等优势种群与pH呈正相关, 篦形短缝藻、狭形纤维藻等与TDS、TP、TN呈正相关, 与pH呈负相关, 梅尼小环藻和小球藻等对浮游动物的响应存在差异(图 7).丰水期, 韦氏藻喜欢生活在流速较大的水体, 小球藻、小形色球藻和尖尾蓝隐藻等与CODMn呈正相关, 梅尼小环藻和卵形隐藻对磷的需求显著, 但不适应在有机质(COD)含量高的水体生活(图 8).由CCA排序所示, 渭河陕西段各采样点水环境特点存在明显差异.枯水期, pH是影响山区型河道水体(WS1)浮游植物分布的主要环境因子, 氮、磷是影响城市型河道水体(WS4~WS6)的主要环境因子, 平原型河道水体(WS7~WS8)主要受流速、浮游动物的影响(图 7);丰水期, 流速和TDS是影响平原型河道水体(WS8~WS9)的主要环境因子, 城市型河道水体(WS3~WS6)主要受营养盐的影响, 山区型河道水体浮游植物受影响的环境因子不明显(图 8).
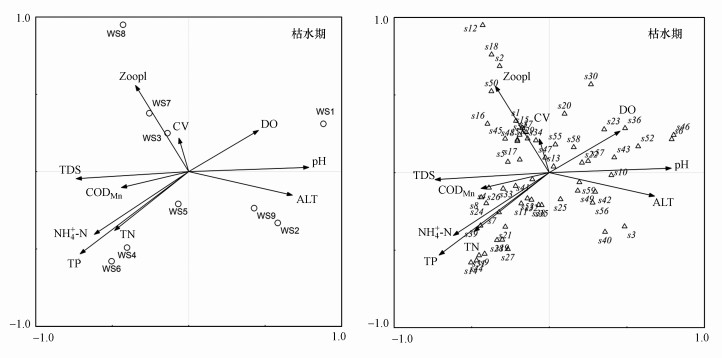 |
| 图 7 枯水期浮游动物与环境因子的CCA分析 Fig. 7 CCA analysis of the relationship between phytoplankton and environmental variable in dry season |
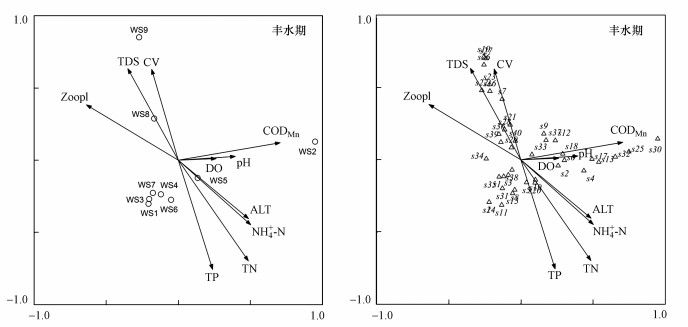 |
| 图 8 丰水期浮游植物与环境因子的CCA分析 Fig. 8 CCA analysis of the relationship between phytoplankton and environmental variable in wet season |
浮游植物群落结构特征受水环境、水生物、水文、水动力等因素直接影响外, 人类活动的干扰不可忽视, 具体可表现在季节时间和地理空间的变动上(Stomp et al., 2011;杨宋琪等, 2019).本研究发现, 渭河陕西段水体中浮游植物物种组成存在时空差异, 从时间尺度看, 枯水期共观察到浮游植物8门59种, 丰水期共观察到6门40种, 枯水期浮游植物的门类及种类数均高于丰水期, 枯水期出现了丰水期未出现的黄藻门和金藻门, 其群落组成存在较大差异.类似的研究结果也出现在其他季节性河流和湖泊中(陈红等, 2011;李娜等, 2020).渭河陕西段是渭河流域承受的环境和生态压力日益严重.2017—2018年的浮游植物调查数据显示, 渭河陕西段枯、丰水期浮游植物均以硅藻门和绿藻门为主, 物种组成表现为绿藻-硅藻-蓝藻型, 这与拉萨河春季(张军燕等, 2017)和黑河张掖段(杨宋琪等, 2019)等的研究结果基本一致, 表明渭河陕西段浮游植物种类组成具有一般河流的普遍性特征.2013年, 闵文武等对渭河流域的40个断面调查发现, 流域内浮游植物的种类组成、丰度与河流的季节性汛期存在相关性(闵文武等, 2015);2014年高宏伟等在渭河陕西段共发现35种浮游植物, 浮游植物的密度和生物量均存在明显的空间差异(高宏伟等, 2015).本次调查结果与渭河陕西段河道综合治理前的结果存在差异, 说明河道的修复和环境的治理对浮游植物的群落结构演变存在影响.研究表明, 菱形藻(Nitzschia sp.)、针杆藻(Synedra sp.)和舟形藻(Navicula sp.)是中污染指示种, 隐藻、蓝藻是中-重富营养水体的代表种类(胡鸿钧等, 1981;况琪军等, 2005), 渭河陕西段中下游(WS4~WS9)断面的优势种主要集中在硅藻门的针杆藻、隐藻门的尖尾蓝隐藻和蓝藻门的色球藻, 暗示了渭河陕西段水质仍存在一定程度的污染, 在河段中游区域由于城市生活的干扰污染程度有所加剧.
4.2 浮游植物群落多样性时空特征分析在水生态系统中, 生物多样性指数常被用作评价水体浮游植物群落现状及水污染状况, 其中Shannon-Wiener多样性指数(H′)反映环境变化对浮游植物的影响, 对环境敏感的种类消失会导致浮游植物群落结构整体趋于简单, 其稳定性呈下降趋势(Longuethiggins, 1971;Gao et al., 2005).Pielou均匀度指数(J)用来衡量群落中每个物种生物量分类的均匀度, 在一定程度上反映物种生物群落的稳定性(Tammi et al., 1999).Margalef丰富度指数(d)反映浮游植物群落与环境因子的相关关系, d 值越大, 表明所指示的环境稳定性越好(Margalef, 1958).本研究中调查发现, 2017—2018年渭河陕西段浮游植物H′为1.58~4.22, 均值为2.91;J在0.71~1.79变化区间, 均值为1.19;d在0.36~0.85之间变化, 均值为1.25.根据多样性指数对水质的评价分级标准(欧阳昊等, 2007), 渭河陕西段水质总体处于无污染或轻度污染至中度污染状态.与2014年调查结果(H′均值为1.69)(高宏伟等, 2015)相比, 浮游植物群落结构趋于复杂, 对环境的变化能表现出强大的反馈功能, 水环境受污染的程度减轻.其中, 枯水期渭河上游河段(WS2)多样性指数最小, 这可能与此河段两岸的猕猴桃种植业的施肥和灌溉有关, 有研究(Lv et al., 2020;程荣等, 2021)显示, 较高的氮、磷等营养物质浓度的变化对浮游植物的群落结构会产生直接影响, 导致渭河眉县河段水生态系统结构趋于不稳定.丰水期, 由于河道湿地生态公园的建设, 荷花、芦蒲等大型水生植物的种植, 改善了水生态环境, 使得渭河眉县段(WS2)和潼关入黄河段(WS9)的多样性指数性相对较高.水生植物的生长与浮游植物的繁殖之间存在营养物质的竞争, 一定量数量的水生植物能够对浮游植物的爆发式生长产生抑制, 进而提高生物多样性, 维持水生态系统趋于稳定(李娣等, 2014).
4.3 环境因子对浮游植物群落分布的影响分析浮游植物群落结构及其变化是多种环境因子在时间和空间序列上共同作用的结果, 环境的变化必然会导致浮游植物群落结构和优势种的变化, 在众多环境因子中, 存在起主导作用的因子(君珊等, 2019).由污染引起的环境因子变化是河湖生态系统中浮游植物群落变化的主要影响因素, 这些与浮游植物变化相关的关键环境因子在不同水体中存在差异(王爱爱等, 2014;Wu et al., 2019;王汨等, 2020).本研究CCA分析结果显示, pH、TDS、TP和COD是影响渭河陕西段浮游植物群落时空分布的主要环境因子.在水环境因子中, 水体的酸碱性对浮游植物的组成与分布存在重要影响, 不同种类生长繁殖有其不同的适宜范围(Kim et al., 2013), pH的变化会影响浮游植物的群落结构变动, 碱性环境对浮游植物光合作用有利, 在碱性水体中浮游植物具有较高的初级生产力(Jakobsen et al., 2015).CCA排序显示, 针杆藻、栅藻、色球藻、纤维藻等对pH变化响应显著, 说明pH对渭河陕西段浮游植物的生产力具有较大影响.磷是浮游植物生长繁殖所需的重要营养元素, 磷的供给促进了浮游植物的生长(Turner et al., 2013;刘俊鹏等, 2016).CCA分析发现, 小环藻、纤维藻、短缝藻和隐藻等指示种对TP呈正相关, 表明磷含量的变动会影响浮游植物的生长, 主要是因为PO43--P易被浮游植物吸收利用, 从而有利于硅藻的生长繁殖(刘霞等, 2012;Reed et al., 2016).TDS一般用来反映水中溶解的无机物和有机物含量, 与电导率存在相同关系, 电导率越高, TDS越大.有学者研究认为, 电导率与流域内周边土地利用类型(居民用地、工农业用地以及商业用地等)有极高的相关性, 能够较好地反映出通过径流进入水体的离子总量, 在城镇化发展较快的地区特别显著(Walker et al., 2006).渭河陕西段土地利用类型多样, 土地利用方式对污染物的排放具有重要影响(张妍等, 2019).本研究CCA分析显示TDS对浮游植物影响显著, 这与渭河陕西段河流沿岸城市快速化发展有关.COD是反映水体受到有机污染物和还原性无机物污染程度的综合指标, 与浮游植物的生长呈正相关关系, 水体中有机物会促进浮游植物群落发展, 同时浮游植物通过光合作用产生大量有机物, 使水体COD升高(于洋等, 2017;刘洋等, 2018).丰水期COD高于枯水期, 成为浮游植物生长的限制因素, 因此可以通过有效控制有机污染物和磷的排放改善渭河陕西段的水环境质量.此外, 水温也是影响浮游植物群落时空分布的重要因子, 在浮游植物光合作用、呼吸作用中通过影响细胞中酶的代谢效率影响浮游植物的生长繁殖(李红飞等, 2019).本研究发现, 丰水期浮游植物细胞密度、生物量和多样性均高于枯水期, 温度是形成渭河陕西段不同类型河段水体浮游植物群落季节差异的主要环境因子.
5 结论(Conclusions)1) 渭河陕西段共检出浮游植物69种, 绿藻门和硅藻门占绝对优势, 种类数在空间上呈现下游河段>中游河段>上游河段, 时间上丰水期浮游植物细胞密度和生物量均显著高于枯水期.
2) 浮游植物Shannon-Wiener多样性指数、Pielou均匀度指数和Margalef丰富度指数的时间规律为枯水期>丰水期.依据浮游植物及多样性指数对水质评价显示, 渭河陕西段水质总体呈无污染或轻度污染至中轻度污染, 中游河段污染程度相对较高, 因此需采取必要措施保护水环境, 防治水污染.
3) CCA分析结果显示, 渭河陕西段水体中浮游植物的群落分布受环境影响显著.其中TP、pH和TDS是影响枯水期浮游植物群落结构空间分布的主要环境因子, 而TP和CODMn是影响丰水期浮游植物群落分布的主要环境因子, 环境因子的识别对提高生物多样性和保护水环境意义重大.因此不同时期需对不同环境因子予以关注, 以确保渭河陕西段浮游植物多样性及水生态平衡与健康.
白海锋, 赵乃锡, 殷旭旺, 等. 2014. 渭河流域浮游动物的群落结构及其与环境因子的关系[J]. 大连海洋大学学报, 29(3): 260-266. |
Brantes N, Antunes S C, Pereira M J, et al. 2006. Seasonal succession of cladocerans and phytoplankton and their interactions in a shallow eutrophic lake (Lake Vela, Portugal)[J]. Acta Oecologica, 29(1): 54-64. DOI:10.1016/j.actao.2005.07.006 |
陈红, 魏彤宇, 张良运, 等. 2011. 北方城市景观河道浮游藻类群落结构特征[J]. 湖北农业科学, 50(12): 2435-2437. DOI:10.3969/j.issn.0439-8114.2011.12.018 |
程荣, 陈惠鑫, 亓畅, 等. 2021. 北运河流域沙河水库的浮游生物群落特征分析[J]. 环境科学学报, 41(1): 239-246. |
陈延松, 刘宁, 赵秀侠, 等. 2015. 苏州七浦塘流域浮游植物群落特征及其与环境因子分析[J]. 合肥师范学院学报, 33(3): 56-61, 65. DOI:10.3969/j.issn.1674-2273.2015.03.015 |
池仕运, 韦翠珍, 胡俊, 等. 2020. 富营养深水水库底栖动物群落与浮游生物相关性分析[J]. 湖泊科学, 32(4): 1060-1075. |
Deng W, Song J, Bai H, et al. 2018. Analyzing the impacts of climate variability and land surface changes on the annual water-energy balance in the Weihe River Basin of China[J]. Water, 10: 1792-1807. DOI:10.3390/w10121792 |
段金荣, 张宪中, 刘凯, 等. 2009. 鲢鳙鱼和藻类治理关系的初步研究[J]. 中国农学通报, 25(20): 327-330. |
高宏伟, 李晓春, 陈晓霞, 等. 2015. 渭河陕西段浮游植物群落结构及水质评价[J]. 河北渔业, (11): 12-13, 77. DOI:10.3969/j.issn.1004-6755.2015.11.005 |
Gao X, Song J. 2005. Phytoplankton distributions and their relationship with the environment in the Changjiang Estuary, China[J]. Marine Pollution Bulletin, 50(3): 327-335. DOI:10.1016/j.marpolbul.2004.11.004 |
国家环境保护总局《水和废水监测分析方法》编委会. 2002. 水和废水监测分析方法4版[M]. 北京: 中国环境科学出版社
|
韩茂森, 束蕴芳. 1995. 中国淡水生物图谱[M]. 北京: 海洋出版社.
|
胡德秀, 李立, 张艳, 等. 2018. 渭河干流陕西段综合治理前后的水质变化与趋势[J]. 水土保持通报, 38(5): 91-96. |
胡鸿钧, 李尧英, 魏印心, 等. 1981. 中国淡水藻类[M]. 上海: 上海科学技术出版社.
|
胡鸿钧, 魏印心. 2006. 中国淡水藻类: 系统、分类及生态[M]. 北京: 科学出版社.
|
胡韧, 林秋奇, 段舜山, 等. 2002. 热带亚热带水库浮游植物叶绿素与磷分布的特征[J]. 生态科学, 21(4): 310-315. |
Jakobsen H H, Blanda E, Staehr P A, et al. 2015. Development of phytoplankton communities: Implications of nutrient injections on phytoplankton composition, Ph and ecosystem production[J]. Journal of Experimental Marine Biology and Ecology, 473: 81-89. DOI:10.1016/j.jembe.2015.08.011 |
君珊, 王东波, 周建华, 等. 2019. 拉萨河流域浮游植物群落结构特征及与环境因子的关系[J]. 生态学报, 39(3): 787-798. |
Kim H, Spivack A J, Menden-Deuer S. 2013. pH alters the swimming behaviors of the raphidophyte Heterosigma akashiwo: Implications for bloom formation in an acidified ocean[J]. Harmful Algae, 26: 1-11. DOI:10.1016/j.hal.2013.03.004 |
况琪军, 马沛明, 胡征宇, 等. 2005. 湖泊富营养化的藻类生物学评价与治理研究进展[J]. 安全与环境学报, 5(2): 87-91. DOI:10.3969/j.issn.1009-6094.2005.02.024 |
李娣, 李旭文, 牛志春, 等. 2014. 太湖浮游植物群落结构及其与水质指标间的关系[J]. 生态环境学报, 23(11): 1814-1820. DOI:10.3969/j.issn.1674-5906.2014.11.014 |
李红飞, 林森杰. 2019. 南海浮游植物生态学研究进展[J]. 厦门大学学报(自然科学版), 58(1): 1-10. |
李景宜. 2007. 陕西渭河下游湿地环境风险因素分析[J]. 地理科学, 27(3): 371-375. DOI:10.3969/j.issn.1000-0690.2007.03.014 |
李娜, 周绪申, 孙博闻, 等. 2020. 白洋淀浮游植物群落的时空变化及其与环境因子的关系[J]. 湖泊科学, 32(3): 772-783. |
刘俊鹏, 屈亮, 刘信勇, 等. 2016. 不同营养条件对地表水藻类生长的影响[J]. 环境工程, 34(S1): 407-410. |
刘霞, 陆晓华, 陈宇炜. 2012. 太湖浮游硅藻时空演化与环境因子的关系[J]. 环境科学学报, 32(4): 321-827. |
刘洋, 吕俊平, 刘琪, 等. 2018. 太原汾河蓄水区浮游植物细胞密度及其与营养元素的关系[J]. 生态学报, 38(3): 991-1002. |
Longuethiggins M S. 1971. On the Shannon-Weaver index of diversity, in relation to the distribution of species in bird censuses[J]. Theoretical Population Biology, 2(3): 271-289. DOI:10.1016/0040-5809(71)90020-7 |
Lv X, Zhang J, Liang P, et al. 2020. Phytoplankton in an urban river replenished by reclaimed water: Features, influential factors and simulation[J]. Ecological Indicators, 112: 106090. DOI:10.1016/j.ecolind.2020.106090 |
孟伟, 张远, 渠晓东, 等. 2011. 河流生态调查技术方法[M]. 北京: 科学出版社, 92-97.
|
Margalef D R. 1958. Information theory in ecology[J]. General Systems, 3: 36-71. |
闵文武, 王培培, 李丽娟, 等. 2015. 渭河流域浮游植物功能群与环境因子的关系[J]. 环境科学研究, 28(9): 1397-1406. |
欧阳昊, 韩博平. 2007. 从东江调水后契爷石水库的水质和浮游植物群落结构特征[J]. 湖泊科学, 19(2): 204-211. DOI:10.3321/j.issn:1003-5427.2007.02.015 |
Reed M L, Pinckney J L, Keppler C J, et al. 2016. The influence of nitrogen and phosphorus on phytoplankton growth and assemblage composition in four coastal, southeastern USA systems[J]. Estuarine, Coastal and Shelf Science, 177: 71-82. DOI:10.1016/j.ecss.2016.05.002 |
Sommer U, Adrian R, DeSenerpont Domis L, et al. 2012. Beyond the plankton ecology group (PEG) model: Mechanisms driving plankton succession[J]. Annual Review of Ecology, Evolution, and Systematics, 43(1): 429-448. DOI:10.1146/annurev-ecolsys-110411-160251 |
Song J, Tang B, Zhang J, et al. 2018. System dynamics simulation for optimal stream flow regulations under consideration of coordinated development of ecology and socio-economy in the Weihe River Basin, China[J]. Ecological Engineering, 124: 51-68. DOI:10.1016/j.ecoleng.2018.09.024 |
Stomp M, Huisman J, Mittelbach G G, et al. 2011. Large-scale biodiversity patterns in freshwater phytoplankton[J]. Ecology, 92: 2096-2107. DOI:10.1890/10-1023.1 |
Turner R E, Rabalais N N. 2013. Nitrogen and phosphorus phytoplankton growth limitation in the northern Gulf of Mexico[J]. Aquatic Microbial Ecology, 68(10): 159-169. |
Tammi J, Lappalainen A, Mannio J, et al. 1999. Effects of eutrophication on fish and fisheries in Finnish lakes: A survey based on random sampling[J]. Fisheries Management and Ecology, 6(3): 173-186. DOI:10.1046/j.1365-2400.1999.00152.x |
Walker C E, Pan Y D. 2006. Using diatom assemblages to assess urban stream condition[J]. Hydrobiologia, 561: 179-189. DOI:10.1007/s10750-005-1613-3 |
王爱爱, 冯佳, 谢树莲, 等. 2014. 汾河中下游浮游藻类群落特征及水质分析[J]. 环境科学, 35(3): 915-923. |
王汨, 杨柏贺, 马思琪, 等. 2020. 北运河水系浮游植物功能群与水体环境因子的关系[J]. 水产学杂志, 33(2): 70-76. DOI:10.3969/j.issn.1005-3832.2020.02.013 |
王硕, 杨涛, 李小平, 等. 2019. 渭河流域浮游动物群落结构及其水质评价[J]. 水生生物学报, 43(6): 1333-1345. |
Winder M, Sommer U. 2012. Phytoplankton response to a changing climate[J]. Hydrobiologia, 689(1): 5-16. DOI:10.1007/s10750-012-1149-2 |
Wu W, Xu Z X, Mark J K, et al. 2016. Do human disturbance variables influence more on fish community structure and function than natural variables in the Weihe River basin, China?[J]. Ecological indicators, 61: 438-446. DOI:10.1016/j.ecolind.2015.09.045 |
武玮, 徐宗学, 殷旭旺, 等. 2014. 渭河流域鱼类群落结构特征及其完整性评价[J]. 环境科学研究, 27(9): 981-989. |
Wu Z, Liu J, Huang J, et al. 2019. Do the key factors determining phytoplankton growth change with water level in China's largest freshwater lake?[J]. Ecological Indicators, 107: 105675. DOI:10.1016/j.ecolind.2019.105675 |
徐宗学, 武玮, 殷旭旺. 2016. 渭河流域水生态系统群落结构特征及其健康评价[J]. 水利水电科技进展, 36(1): 23-30. |
杨海强, 潘保柱, 朱朋辉, 等. 2020. 渭河干流和秦岭北麓典型支流底栖动物群落结构及水质生物评价[J]. 湖泊科学, 32(6): 1793-1805. |
杨宋琪, 祖廷勋, 王怀斌, 等. 2019. 黑河张掖段浮游植物群落结构及其与环境因子的关系[J]. 湖泊科学, 31(1): 159-170. |
杨洋, 王梦梦, 潘宏博, 等. 2017. 不同密度的大型溞对浮游植物群落结构的影响[J]. 上海海洋大学学报, 26(3): 406-414. |
殷旭旺, 徐宗学, 高欣, 等. 2013. 渭河流域大型底栖动物群落结构及其与环境因子的关系[J]. 应用生态学报, 24(1): 218-226. |
俞秋佳, 徐凤洁, 蒋跃, 等. 2014. 夏秋季苏州河浮游植物群落特征及其影响因子[J]. 生态与农村环境学报, 30(4): 450-457. DOI:10.3969/j.issn.1673-4831.2014.04.007 |
于洋, 彭福利, 孙聪, 等. 2017. 典型湖泊水华特征及相关影响因素分析[J[J]. 中国环境监测, 33(2): 88-94. |
张国栋. 2011. 利用鲢鳙鱼及水生植物控制平原水库富营养化的研究[D]. 青岛: 青岛理工大学
|
张嘉嘉, 赵景波, 董雯, 等. 2007. 关中平原近十年来渭河水环境演变研究[J]. 干旱区资源与环境, 21(1): 68-72. DOI:10.3969/j.issn.1003-7578.2007.01.015 |
张军燕, 高志, 沈红保, 等. 2017. 拉萨河春季浮游生物群落结构特征研究[J]. 淡水渔业, 47(4): 23-31. DOI:10.3969/j.issn.1000-6907.2017.04.005 |
张妍, 毕直磊, 张鑫, 等. 2019. 土地利用类型对渭河流域关中段地表水硝酸盐污染的影响[J]. 生态学报, 39(12): 4319-4327. |
赵文. 2005. 水生生物学[M]. 北京: 中国农业出版社.
|
 2021, Vol. 41
2021, Vol. 41


