重金属污染具有持久性, 累积性以及毒害性的特点(Dong et al., 2010), 是当今主要环境问题之一.随着工业化和城市化进程加快, 重金属进入大气、土壤和水体中, 威胁着生态安全和人类健康(Jiang et al., 2019).镉是一种毒性较高的重金属, 摄入大量镉可对人体健康造成严重伤害, 包括腹泻、胃部疾病、肾脏损害, 甚至死亡;体内镉的积累也可能会对包括胰腺、肺、肝和肠在内的不同器官产生不利影响(Fowler, 2009; Guo et al., 2017), 近几十年来, 镉污染事件频频发生, 尤其是稻田土壤, 受污染的稻田土壤会产生“镉大米”.据报道, 中国超过10%的稻谷样品超过了0.2 mg·kg-1的允许范围(Cui et al., 2017), 所以解决镉的污染问题非常重要.
胞外聚合物(Extracellular Polymeric Substances, EPS)的产生是自然环境中微生物的普遍属性(Xiao et al., 2016).EPS是指由微生物分泌或细胞膜裂解形成的呈包膜状覆裹在细胞膜上或呈溶解状、胶状分散在细胞外的生化大分子聚合物, 主要由蛋白质、多糖、核酸等大分子以及腐殖质、脂类等小分子组成(Lin et al., 2014).EPS在细胞外形成一个缓冲层为微生物的生长提供相对稳定的环境, 是微生物抵御外界不良影响(如重金属、有毒有机化合物等)的一种自我保护机制, 通过EPS中的羧基、羟基和巯基等官能团与重金属配位使其失去流动性而大大降低了重金属对生物的毒性(More et al., 2014; Xie et al., 2020).
近年来EPS由于其作为吸附剂环境友好且高效的特点受到了国内外广大研究者的关注, 研究主要集中在EPS对重金属的吸附及其吸附机理上.EPS中的化学组成与官能团种类及其浓度对于重金属吸附有很大的影响(Drozdova et al., 2014).研究发现—OH、—COOH、—NH2、—CH2—与—CO等官能团在重金属吸附中起关键作用(Wei et al., 2017);而在EPS的各组分中, 蛋白质组分与重金属的结合能力最强(Vimalnath et al., 2018);有研究采用EPS模式物质(牛血清白蛋白、葡聚糖、腐殖酸钠)与重金属Cd(Ⅱ)和Zn(Ⅱ)的配合, 同样表明蛋白质是主要参与者(Yan et al., 2017).可见, EPS中的蛋白组分在重金属的吸附过程中起到了十分重要的作用.
由于EPS化学组成对重金属吸附性能的重要影响, 近年来逐渐出现对EPS组分化学组成和性能调控方法的研究.Pb(Ⅱ)胁迫下Phanerochaete chrysosporium EPS组分中的多糖与蛋白质均有所增加, 吸附实验表明结合态EPS较溶解态EPS在重金属吸附过程中发挥了更为重要的作用(Butzen et al., 2019);Li等用Na2S对Bacillus vallismortis sp.进行胁迫培养, 达到了改变菌株EPS组分的目的并发现在重金属溶液的吸附过程中EPS蛋白质中的官能团尤其—SH发挥了至关重要的作用(Li et al., 2020).以上研究表明了定向调控菌株EPS组分的可行性.
铜绿假单胞菌对重金属去除效果良好, 有较强的产生EPS的能力(Celik et al., 2008).环境常见的重金属当中镉对微生物具有较高的毒性(Parmar et al., 2020), 研究表明, 铜绿假单胞菌对重金属尤其是镉具有较高的耐受性, Lin等分离得到的铜绿假单胞菌对镉的耐受浓度高达2200 mg·L-1 (Lin et al., 2016b).已有文献在不同方面研究了镉与EPS的作用, 但在镉的胁迫/诱导下, EPS化学成分和吸附性能如何变化依然是个非常令人感兴趣的问题.
本研究通过在不同浓度梯度的Cd(Ⅱ)条件下对铜绿假单胞菌进行胁迫培养, 找到了菌株EPS产量尤其是其中的蛋白产量最高的最佳胁迫点, 达到了定向调控EPS组分尤其是蛋白组分的目的, 增强了EPS的吸附性能, 验证了EPS中蛋白组分在重金属吸附过程中的重要作用, 并用三维荧光和红外光谱对胁迫前后EPS中主要组分和官能团进行了表征分析.
2 材料与方法(Materials and methods) 2.1 材料本文所用到的菌种为铜绿假单胞菌(Pseudomonas aeruginosa), 从广东省微生物菌种保藏中心购得, 菌种经活化培养后用甘油于-20 ℃保存待用.
营养琼脂培养基:称取3.2 g营养琼脂干粉培养基, 加入去离子水100 mL, 于锥形瓶中121 ℃高压灭菌20 min, 灭菌后在无菌操作台倒平板备用.
LB培养基:称取蛋白胨10 g、氯化钠10 g、酵母粉5 g, 用去离子水定容至1000 mL, 调节pH值为(7.2±0.2), 于锥形瓶中121 ℃高压灭菌20 min, 冷却备用.
Cd(Ⅱ)溶液:实验过程中的金属离子以硝酸镉的形式加入, 换算成Cd(Ⅱ)的浓度进行称量定容.
2.2 菌种活化与胁迫培养铜绿假单胞菌解冻后接种环接种到营养琼脂固体培养基上, 于37 ℃恒温培养箱中静置培养24 h, 然后用接种环挑取在固体培养基上长出的单个菌落, 接种至100 mL LB液体培养基中, 于37 ℃, pH 7.2±0.2, 150 r·min-1转速下振荡培养24 h, 再以体积百分比为5%的菌种(干重约6 mg)接种到浓度梯度分别为0、10、20、30、40、50、60、80、100 mg·L-1 Cd(Ⅱ)的LB液体培养基中, 再于37 ℃, pH 7.2±0.2, 150 r·min-1转速下振荡培养24 h.以上接种过程均在无菌条件下进行.
2.3 EPS提取与测定取30 mL经胁迫培养后的菌液, 于冷冻离心机中离心15 min(4 ℃, 4500 r·min-1).离心完毕, 倒掉上清液, 保留菌体, 再分别用pH为3.0和pH为7.0的蒸馏水在相同条件下离心清洗, 保留菌体(Nouha et al., 2016).本实验中以加热法提取EPS(董明等, 2016), 将菌体重悬于0.9%的氯化钠溶液中在60 ℃下加热30 min, 然后于4 ℃, 10000 r·min-1条件下离心15 min.取上清液用0.22 μm滤膜进行过滤, 转移到分子量为4000预处理过的透析袋中, 透析24 h, 得到纯净EPS于-20 ℃条件下保存备用.
EPS产量用蛋白质、多糖、核酸之和表示, 单位为mg·g-1(以VSS计).3组分测定方法分别为考马斯亮蓝法、蒽酮比色法和二苯胺法(Tang et al., 2020), 实验结果均取3次平行实验结果的平均值.
2.4 表征实验分析 2.4.1 三维荧光光谱(3D-EEM)分析采用CARY ECLIPSE(安捷伦, 美国)型荧光分光光度计测定, 对重金属Cd(Ⅱ)胁迫前后铜绿假单胞菌裸EPS主要成分进行比较分析, 激发光(Ex)和发射光(Em)扫描范围分别为200~500 nm、280~550 nm.
2.4.2 傅里叶红外光谱(FTIR)分析采用NICOLETIS10(安捷伦, 美国)型红外光谱仪对铜绿假单胞菌裸细胞和重金属Cd(Ⅱ)胁迫后的细胞进行比较分析.波长扫描范围为800~4000 cm-1, 分辨率为4 cm-1, 扫描次数设置为32.
2.5 Cd(Ⅱ)吸附实验以及分析 2.5.1 Cd(Ⅱ)吸附实验配制浓度为15 mg·L-1的Cd(Ⅱ)溶液, 调节溶液pH为5.0, 取不同浓度梯度重金属胁迫下等质量(0.3 mg)的胞外聚合物于含15 mL Cd(Ⅱ)溶液的锥形瓶中, 在温度为35 ℃、转速为150 r·min-1条件下吸附2 h, 吸附后将混合物转移到截留分子量为4000的透析袋中用去离子水透析12 h, 用火焰原子吸收分光光度计测定透析后样品中的Cd(Ⅱ)浓度.EPS胁迫过程中所携带的Cd(Ⅱ)在EPS的提取过程中已基本洗脱, 样品经测定几乎不含有Cd(Ⅱ), 可忽略不计, 实验结果均取3次平行实验结果的平均值.EPS吸附量公式如下:
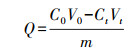
|
(1) |
式中, Q为重金属吸附量(mg·g-1);C0为金属离子初始浓度(mg·L-1);V0为初始溶液体积(L);Ct为吸附结束后金属离子浓度(mg·L-1);Vt为透析液体积(L);m为EPS质量(g).
2.5.2 吸附动力学研究其他吸附条件不变, 以吸附时间作为变量进行吸附动力学研究, 实验数据分别用准一级动力学模型和准二级动力学模型进行拟合, 两种动力学模型方程如下:
一级动力学:

|
(2) |
二级动力学:

|
(3) |
式中, Qe为平衡吸附量(mg·g-1);Qt为t时刻吸附量(mg·g-1);k1为一级吸附常数(min-1);k2为二级吸附常数(g·mg-1·min-1), t为吸附时间(min).
2.5.3 吸附等温模型其他吸附条件不变的, 以吸附初始浓度作为变量进行吸附等温模型分析, 采用Langmuir型和Freundlich型这两种模型对实验数据进行拟合, 两种模型的等温方程如下:
Langmuir吸附等温式:

|
(4) |
式中, Qe为平衡吸附量(mg·g-1);Ce为吸附平衡时重金属离子的浓度(mg·L-1);Qm为最大吸附量(mg·g-1);b为平衡常数(L·mg-1).
Freundlich吸附等温式:
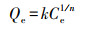
|
(5) |
式中, Qe为平衡时的吸附量(mg·g-1);k为与吸附剂吸附容量有关的常数(g·L-1);Ce为吸附平衡时金属离子浓度(mg·L-1), 1/n为吸附指数.
2.5.4 pH对胁迫前后EPS吸附Cd(Ⅱ)的影响在Cd(Ⅱ)初始浓度为15 mg·L-1, 其他吸附条件不变, 分别在pH为3.0、4.0、5.0、6.0、7.0、8.0条件下进行吸附实验, 探究pH对胁迫前后EPS吸附Cd(Ⅱ)的影响.
2.5.5 温度对胁迫前后EPS吸附Cd(Ⅱ)的影响在Cd(Ⅱ)初始浓度为15 mg·L-1, 其他吸附条件不变, 分别在温度为15、25、35、45、55 ℃条件下进行吸附实验, 探究温度对胁迫前后EPS吸附Cd(Ⅱ)的影响.
3 结果与讨论(Results and discussion) 3.1 不同浓度Cd(Ⅱ)胁迫下铜绿假单胞菌EPS组分变化及其吸附作用本研究中以重金属的不同浓度表示胁迫强度.不同胁迫强度的重金属对菌株生长及EPS产量的影响如图 1所示.
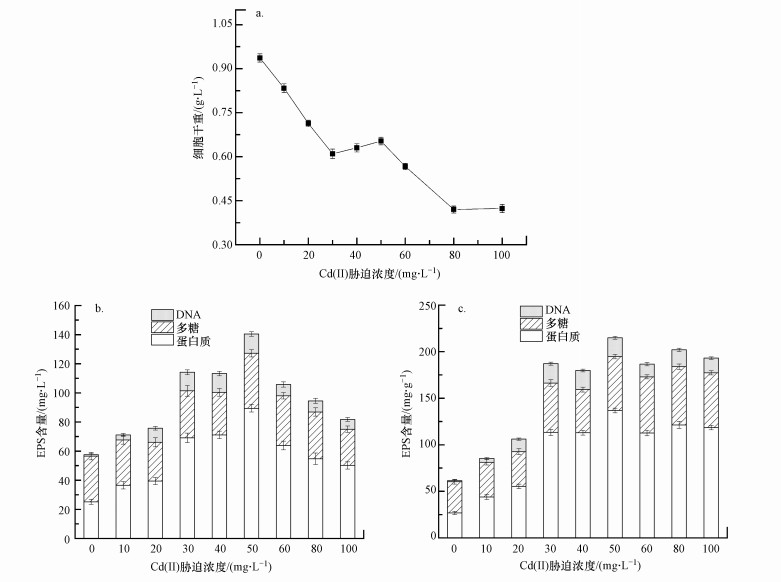 |
| 图 1 不同浓度Cd(Ⅱ)胁迫下铜绿假单胞菌细胞干重(a) 及单位体积培养基EPS产量(b)、单位质量微生物EPS产量(c) Fig. 1 The dry weight of Pseudomonas aeruginosa cells under different concentrations of Cd (Ⅱ) stress (a) and the amount of EPS produced per unit volume of medium (b), and the amount of EPS produced per unit mass of microorganisms (c) |
由图 1a图可以看出, 细菌生物量大致呈现下降的趋势, 说明重金属的存在对细菌生长存在一定的毒性且重金属浓度越高对细菌抑制越强烈, 当Cd(Ⅱ)胁迫浓度达到80 mg·L-1时, 细菌生物量为0.42 g·L-1, 较低浓度胁迫下降了55.32%, 严重抑制了微生物的生长;当Cd(Ⅱ)胁迫浓度达到200 mg·L-1时, 培养基几乎没有微生物(图中未画出).
图 1b为单位体积培养基EPS产量及成分图, 图 1c为单位质量微生物EPS产量及成分图.可以看出, 细菌EPS中的蛋白质含量随着Cd(Ⅱ)胁迫浓度的增加呈现先增加后降低的规律, 且在胁迫浓度为50 mg·L-1时达到最大值, 从胁迫前的26.84 mg·g-1增加到136.80 mg·g-1, 增加了409.69%.整体来看, 在Cd(Ⅱ)胁迫前后, 细菌EPS总量呈现先增加后降低的规律, 在胁迫浓度为50 mg·L-1时达到最大值214.96 mg·g-1.Cd(Ⅱ)胁迫下, 微生物活性随着Cd(Ⅱ)浓度的增加而逐渐降低, 此外, 细菌EPS中糖类含量也随着重金属Cd(Ⅱ)胁迫浓度的增加呈现先增加后降低的规律, 但是变化幅度较小;细菌EPS中DNA含量随着胁迫浓度的增加有少量增加.
胁迫前后EPS对Cd(Ⅱ)的吸附量以及EPS中蛋白质含量与吸附量的线性关系如图 2所示.由图 2a可以看出, EPS对Cd(Ⅱ)的吸附量总体上呈现先增加后降低的趋势, 在胁迫浓度为50 mg·L-1时吸附量达到最大值232.45 mg·g-1, 较胁迫前增加了42.87%, 且整体趋势与图 1中细菌EPS蛋白含量相近.我们已经知道, 在不利环境下产生EPS是微生物的一种自我保护机制, 产生的EPS也能够有效阻滞或减缓这种不利影响, 在本研究中就是使微生物产生更多更有效的EPS通过吸附而固定Cd(Ⅱ);在一定范围内, 胁迫浓度越高, 不仅EPS产量增加, 而且其吸附能力也增强, 但当超过一定限度, 这种胁迫就表现为破坏, 具体机制是胞内活性氧浓度升高, 破坏细胞器和DNA, 降低了细胞活性甚至杀灭细菌, 这种情况下EPS对Cd(Ⅱ)的吸附能力自然就会减弱(Gnanamani et al., 2010).
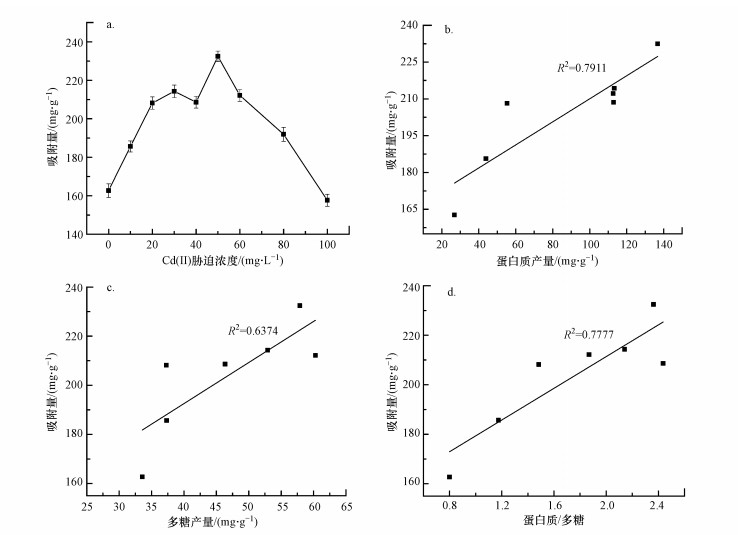 |
| 图 2 不同浓度Cd(Ⅱ)胁迫下EPS对Cd(Ⅱ)的吸附量(a) 以及EPS中蛋白质产量(b)、糖类产量(c)、蛋白质产量与糖类的比值(d) 与吸附量的线性关系 Fig. 2 The adsorption capacity of EPS to Cd(Ⅱ) under different concentrations of Cd(Ⅱ) stress (a) and the ratio of protein production (b), sugar production (c), protein production to carbohydrate ratio (d) and adsorption capacity in EPS Linear relationship |
由于后两个点微生物的生物量较低, 除去对菌株毒性最大即胁迫浓度最高的两个点, 对EPS中蛋白质含量与吸附量进行线性分析, 发现其相关性达到0.7911, 线性关系明显, 而多糖含量与吸附量的相关性为0.6374, 线性关系也较为明显, 但蛋白质含量与吸附量之间的相关系数更高, 说明蛋白质与重金属吸附中较多糖发挥了更为重要的作用, 蛋白质产量与糖类产量的比值与吸附量的相关性达到0.7777.
3.2 胁迫前后铜绿假单胞菌EPS的三维荧光分析根据3.1节实验结果, 选取胁迫浓度为50 mg·L-1时的样品与空白样品(分别称为Cd-EPS和Control-EPS), 采用三维荧光光谱进一步研究Cd(Ⅱ)胁迫因子对铜绿假单胞菌EPS主要成分的影响.两个样品均为原样品浓度, 前期实验测得Control-EPS浓度为57.53 mg·L-1, Cd-EPS浓度为140.44 mg·L-1, 由于EPS样品中含水, 实验结果均减去空白水样的吸光度.胁迫前后菌株EPS的荧光变化见图 2, 荧光光谱位置与最大荧光强度的相关参数见表 1.
| 表 1 荧光光谱中的谱峰信息及其对应物质 Table 1 Peak information and corresponding substances in the fluorescence spectrum |
由图 3可以看出, 相关研究表明, 荧光强度与EPS的含量具有密切的关系(Ma et al., 2018), 由表 1可知, Peak A与Peak B强度高, Peak C、Peak D与Peak E强度相对较低.Peak A与Peak B均为蛋白质类物质, 说明菌株EPS中蛋白含量较多, 胁迫后蛋白质含量尤其类色氨酸明显增加, 峰强度从7150增至9979, 增加了2829, Peak B所代表的类酪氨酸也有所增强, 部分官能团如C=O、—NH2/NH、—COOH等含量增加, 这些负电子基团更容易与重金属离子结合发生化学作用, 从而从介质中去除重金属.上述结果表明, 添加Cd(Ⅱ)胁迫可以改变EPS组分的含量并显著增加目标物质蛋白质的含量, 增强EPS对重金属的吸附能力.
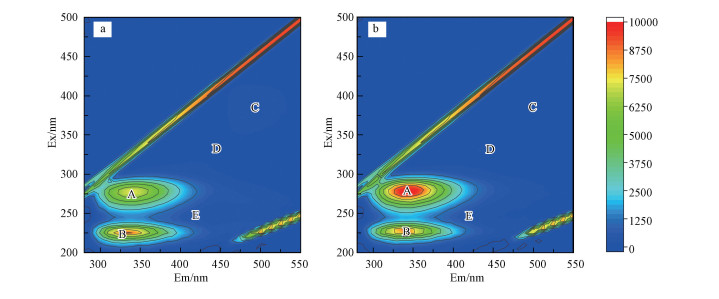 |
| 图 3 Cd(Ⅱ)胁迫前后EPS三维荧光谱图 (a.Control-EPS, b.Cd-EPS) Fig. 3 EPS three-dimensional fluorescence spectrum before and after Cd(Ⅱ) stress (a.Control-EPS, b. Cd-EPS) |
铜绿假单胞菌EPS在Cd(Ⅱ)胁迫前后关键基团峰值和峰位的移动情况可用傅里叶红外光谱进行分析, 根据3.1节实验结果, 选取胁迫浓度为50 mg·L-1时的样品与空白样品进行红外光谱分析, 见图 3.
由图 4可以看出, Cd(Ⅱ)胁迫前后红外光谱中的特征峰的位置基本不变, 但胁迫后的谱峰强度均有所加强, 有研究表明, 红外光谱谱峰强度与样品中所含官能团的浓度存在着密切联系, 峰值强度的大小能够反映相应官能团的相对浓度(Palencia, 2018), 所以胁迫后EPS中官能团浓度较胁迫前增加.通过查阅文献可知, 图中最为明显的吸收带3000~3700 cm-1为碳水化合物中结合水O—H键的伸缩振动(Yin et al., 2011), 吸收带2916~2960 cm-1为—CH2—的C—H的伸缩振动(Li et al., 2019b), 2930 cm—1与2854 cm-1处存在峰证明EPS的组分中含有脂族链(Lin et al., 2019), 吸收带1630~1680 cm-1和1530~1630 cm-1处为典型的蛋白质酰胺I带(C=O的伸缩振动)和酰胺Ⅱ带(N—H的弯曲振动和C—N的伸缩振动)的叠加(Kang et al., 2017; Shou et al., 2018), 还有研究表明, 酰胺Ⅱ带可以作为谷胱甘肽(GSH)的指纹峰, 其中—SH对于重金属的吸附有着重要的作用(Yu et al., 2017; Li et al., 2019a).吸收带1380~1410 cm-1处是羧酸基团中的O—H与C=O的叠加(Shukla et al., 2020), 吸收带1050~1090 cm-1处是与糖骨架有关的基团C—O—C和RHC(OH)(OR)(Shukla et al., 2020).此外吸收峰560~670 cm-1处为S—O键的伸缩振动(Wei et al., 2019).上述官能团中的—SH, C=O, N—H/C—N均是在重金属吸附中能发挥较大作用的官能团(Li et al., 2019b), 同样证明了Cd(Ⅱ)胁迫后菌种产生的EPS对重金属有更强的吸附能力.
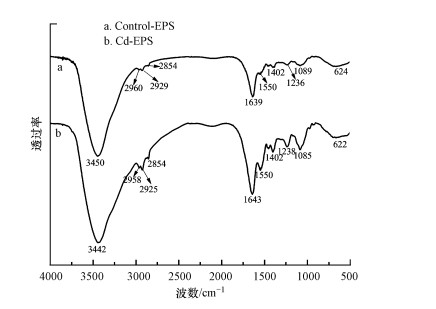 |
| 图 4 Cd(Ⅱ)胁迫前后EPS红外光谱图 (a.Control-EPS, b.Cd-EPS) Fig. 4 EPS infrared spectra before and after Cd(Ⅱ) stress (a. Control-EPS, b. Cd-EPS) |
本研究采用准一级动力学模型和准二级动力学模型对Control-EPS、Cd-EPS吸附Cd(Ⅱ)进行拟合, 胁迫前后两种EPS对Cd(Ⅱ)的吸附量随时间的变化规律见图 5, 两种模型的拟合数据见表 2.
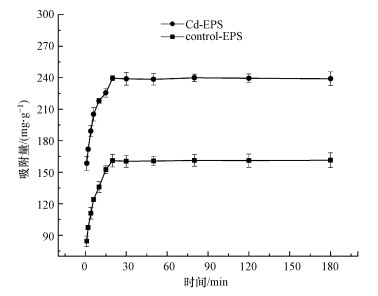 |
| 图 5 胁迫前后EPS在不同反应时间下对Cd(Ⅱ)的吸附性能 Fig. 5 Adsorption performance of EPS to Cd(Ⅱ) under different reaction time before and after stress |
| 表 2 胁迫前后EPS重金属吸附的动力学参数 Table 2 Kinetic parameters of EPS heavy metal adsorption before and after stress |
由图 5可以看出, 胁迫前后两种EPS均能在较短时间(20~30 min)内达到吸附平衡, 比一般的吸附剂吸附重金属至平衡的时间要短.
一级动力学模型一般只适用于吸附过程的初始阶段, 而二级动力学模型则可适用于多种吸附类型, 而且是由化学反应作为吸附过程的控速步骤(Jiang et al., 2020).由表 2可以看出, Control-EPS与Cd-EPS均非常好的符合二级动力学规律, 表明两种EPS对Cd(Ⅱ)的吸附由化学反应控制.
3.5 吸附等温模型研究采用Langmuir型和Freundlich型这两种模型分别对Control-EPS、Cd-EPS吸附Cd(Ⅱ)进行拟合, 不同浓度下胁迫前后EPS的吸附量见图 6, 两种EPS两种模型的拟合数据见表 3.
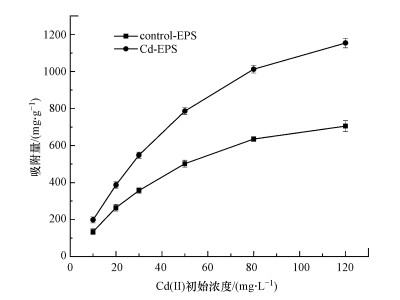 |
| 图 6 胁迫前后EPS在不同初始浓度下对Cd(Ⅱ)的吸附性能 Fig. 6 The adsorption performance of EPS before and after Cd(Ⅱ) stress under different initial concentrations |
| 表 3 胁迫前后EPS重金属吸附等温模型参数 Table 3 EPS heavy metal adsorption isotherm model parameters before and after stress |
由表 3可知EPS对Cd(Ⅱ)的吸附均较好地符合两种吸附模型, Langmuir模型拟合度更高, 相关系数达到0.99以上.最大吸附量反映了吸附剂的吸附能力和与金属离子结合的稳定性(Al-Ghouti et al., 2020), 通过Langmuir模型计算得到Control-EPS、Cd-EPS对Cd(Ⅱ)的理论最大吸附量分别为1010.65 mg·g-1和1663.34 mg·g-1, 说明EPS是一种吸附性能良好的生物吸附剂且胁迫后的EPS具有更好的吸附潜力.
3.6 pH对胁迫前后EPS吸附Cd(Ⅱ)的影响在Cd(Ⅱ)初始浓度为15 mg·L-1, 其他吸附条件不变的情况下, 探究pH对胁迫前后EPS吸附Cd(Ⅱ)的影响, 如图 7所示.
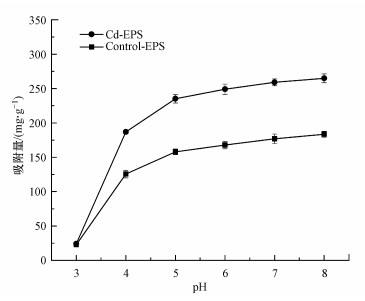 |
| 图 7 pH对胁迫前后EPS吸附Cd(Ⅱ)的影响 Fig. 7 The effect of pH on EPS adsorption Cd(Ⅱ) before and after stress |
由图 7可以看出, 随着pH的升高, 胁迫前后EPS对Cd(Ⅱ)的吸附均有所增加, pH对EPS表面的负电子基团如—COOH、—NH2/NH、—OH等有着很显著的影响(Lin et al., 2016a), 进而影响EPS对Cd(Ⅱ)的吸附性能, 且Cd-EPS的增幅较Control-EPS更为明显, 表明Cd-EPS受pH影响较大.
3.7 温度对胁迫前后EPS吸附Cd(Ⅱ)的影响在Cd(Ⅱ)初始浓度为15 mg·L-1, 其他吸附条件不变的情况下, 探究温度对胁迫前后EPS吸附Cd(Ⅱ)的影响, 如图 8所示.
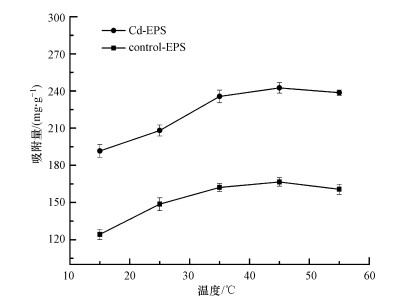 |
| 图 8 温度对胁迫前后EPS吸附Cd(Ⅱ)的影响 Fig. 8 The effect of temperature on EPS adsorption Cd(Ⅱ) before and after stress |
由图 8可以看出, 在实验选取的温度范围内, Cd-EPS的吸附效果均优于Control-EPS, 在15~45 ℃范围内, 胁迫前后EPS对Cd(Ⅱ)的吸附量均随温度的升高有所上升, 这是由于随着温度的升高, 吸附体系中粒子的布朗运动加快, 当温度到达55 ℃以后胁迫前后EPS对Cd(Ⅱ)的吸附量有小幅度的下降, 原因可能是EPS中的蛋白质某些组分活性受到影响, 进一步影响到吸附效果(Li et al., 2019b).
4 结论(Conclusions)1) 在一定浓度范围内, 铜绿假单胞菌的EPS总产量随着胁迫因子Cd(Ⅱ)浓度的增加总体上呈现先增加后降低的趋势, 且蛋白质产量的变化最为明显, 将胁迫前后提取的EPS进行Cd(Ⅱ)吸附实验, 最佳胁迫浓度下的EPS对Cd(Ⅱ)的平衡吸附量最高, 达到232.45 mg·g-1, 较胁迫前增加了42.87%;在一定浓度范围内, EPS的吸附量与EPS蛋白质产量的相关性最大, 说明了EPS中蛋白组分在Cd(Ⅱ)吸附中的重要作用.
2) 三维荧光结果表明, 胁迫后EPS中的蛋白质含量尤其类色氨酸含量增加明显, 蛋白质在吸附过程中发挥了重要作用, 红外光谱结果也表明官能团相对浓度的增加增强了吸附能力.
3) 吸附动力学分析表明EPS对重金属的吸附过程更符合二级动力学, 吸附等温模型研究表明EPS对重金属的吸附过程更符合Langmuir模型, 计算得到Control-EPS、Cd-EPS对Cd(Ⅱ)的理论最大吸附量分别为1010.65 mg·g-1和1663.34 mg·g-1.
Al-Ghouti M A, Da'ana D A. 2020. Guidelines for the use and interpretation of adsorption isotherm models: A review[J]. Journal of Hazardous Materials, 393: 122383. DOI:10.1016/j.jhazmat.2020.122383 |
Butzen M L, Fein J B. 2019. Influence of extracellular polymeric substances on the adsorption of cadmium onto three bacterial species[J]. Geomicrobiology Journal, 36: 412-422. DOI:10.1080/01490451.2018.1564804 |
Celik G Y, Aslim B, Beyatli Y. 2008. Characterization and production of the exopolysaccharide (EPS) from Pseudomonas aeruginosa G1 and Pseudomonas putida G12 strains[J]. Carbohydrate Polymers, 73: 178-182. DOI:10.1016/j.carbpol.2007.11.021 |
Cui J, Liu T, Li F, et al. 2017. Silica nanoparticles alleviate cadmium toxicity in rice cells: Mechanisms and size effects[J]. Environment Pollution, 228: 363-369. DOI:10.1016/j.envpol.2017.05.014 |
Dong X, Li C, Li J, et al. 2010. A novel approach for soil contamination assessment from heavy metal pollution: A linkage between discharge and adsorption[J]. Journal of Hazardous Materials, 175: 1022-1030. DOI:10.1016/j.jhazmat.2009.10.112 |
董明, 宋卫锋, 程亚杰. 2016. 苯胺黑药高效降解菌(Bacillus vallismortis)胞外聚合物去除重金属的研究[J]. 环境科学学报, 36(12): 4367-4375. |
Drozdova O Y, Pokrovsky O S, Lapitskiy S A, et al. 2014. Decrease in zinc adsorption onto soil in the presence of EPS-rich and EPS-poor Pseudomonas aureofaciens[J]. Journal of the Colloid Interface Science, 435: 59-66. DOI:10.1016/j.jcis.2014.08.025 |
Fowler B A. 2009. Monitoring of human populations for early markers of cadmium toxicity: A review[J]. Toxicology Applied Pharmacology, 238: 294-300. DOI:10.1016/j.taap.2009.05.004 |
Gnanamani A, Kavitha V, Radhakrishnan N, et al. 2010. Microbial products (biosurfactant and extracellular chromate reductase) of marine microorganism are the potential agents reduce the oxidative stress induced by toxic heavy metals[J]. Colloids and Surfaces B: Biointerfaces, 79: 334-339. DOI:10.1016/j.colsurfb.2010.04.007 |
Guo S, Jiao P, Dan Z, et al. 2017. Preparation of L-arginine modified magnetic adsorbent by one-step method for removal of Zn(Ⅱ) and Cd(Ⅱ) from aqueous solution[J]. Chemical Engineering Journal, 317: 999-1011. DOI:10.1016/j.cej.2017.02.136 |
Guo X J, He L S, Li Q, et al. 2014. Investigating the spatial variability of dissolved organic matter quantity and composition in Lake Wuliangsuhai[J]. Ecological Engineering, 62: 93-101. DOI:10.1016/j.ecoleng.2013.10.032 |
Jiang B, Adebayo A, Jia J, et al. 2019. Impacts of heavy metals and soil properties at a Nigerian e-waste site on soil microbial community[J]. Journal of Hazardous Materials, 362: 187-195. DOI:10.1016/j.jhazmat.2018.08.060 |
Jiang H, Yang Y, Lin Z, et al. 2020. Preparation of a novel bio-adsorbent of sodium alginate grafted polyacrylamide/graphene oxide hydrogel for the adsorption of heavy metal ion[J]. Science of the Total Environment, 744: 140653. DOI:10.1016/j.scitotenv.2020.140653 |
Kang F, Qu X, Alvarez P J, et al. 2017. Extracellular saccharide-mediated reduction of Au3+ to gold nanoparticles: New insights for heavy metals biomineralization on microbial surfaces[J]. Environmental Science and Technology, 51: 2776-2785. DOI:10.1021/acs.est.6b05930 |
Li J, Jiang Z, Chen S, et al. 2019a. Biochemical changes of polysaccharides and proteins within EPS under Pb(II) stress in Rhodotorula mucilaginosa[J]. Ecotoxicology and Environmental Safety, 174: 484-490. DOI:10.1016/j.ecoenv.2019.03.004 |
Li Q, Song W, Sun M, et al. 2019b. Composition change and adsorption performance of EPS from Bacillus vallismortis sp. induced by Na2S[J]. Ecotoxicology and Environmental Safety, 185: 109679. DOI:10.1016/j.ecoenv.2019.109679 |
Li Q, Song W, Sun M, et al. 2020. Response of Bacillus vallismortis sp. EPS to exogenous sulfur stress/induction and its adsorption performance on Cu(II)[J]. Chemosphere, 251: 126343. DOI:10.1016/j.chemosphere.2020.126343 |
Lin D, Ma W, Jin Z, et al. 2016a. Interactions of EPS with soil minerals: A combination study by ITC and CLSM[J]. Colloids and Surfaces B: Biointerfaces, 138: 10-16. DOI:10.1016/j.colsurfb.2015.11.026 |
Lin F, Zhu X, Li J, et al. 2019. Effect of extracellular polymeric substances (EPS) conditioned by combined lysozyme and cationic polyacrylamide on the dewatering performance of activated sludge[J]. Chemosphere, 235: 679-689. DOI:10.1016/j.chemosphere.2019.06.220 |
Lin H, Zhang M, Wang F, et al. 2014. A critical review of extracellular polymeric substances (EPSs) in membrane bioreactors: Characteristics, roles in membrane fouling and control strategies[J]. Journal of Membrane Science, 460: 110-125. DOI:10.1016/j.memsci.2014.02.034 |
Lin X, Mou R, Cao Z, et al. 2016b. Characterization of cadmium-resistant bacteria and their potential for reducing accumulation of cadmium in rice grains[J]. Science of the Total Environment, 569-570: 97-104. DOI:10.1016/j.scitotenv.2016.06.121 |
Ma B, Li S, Wang S, et al. 2018. Effect of Fe3O4 nanoparticles on composition and spectroscopic characteristics of extracellular polymeric substances from activated sludge[J]. Process Biochemistry, 75: 212-220. DOI:10.1016/j.procbio.2018.08.027 |
More T T, Yadav J S S, Yan S, et al. 2014. Extracellular polymeric substances of bacteria and their potential environmental applications[J]. Journal of Environmental Management, 144: 1-25. |
Nouha K, Kumar R S, Tyagi R D. 2016. Heavy metals removal from wastewater using extracellular polymeric substances produced by Cloacibacterium normanense in wastewater sludge supplemented with crude glycerol and study of extracellular polymeric substances extraction by different methods[J]. Bioresource Technology, 212: 120-129. DOI:10.1016/j.biortech.2016.04.021 |
Palencia M. 2018. Functional transformation of Fourier-transform mid-infrared spectrum for improving spectral specificity by simple algorithm based on wavelet-like functions[J]. Journal of Advanced Research, 14: 53-62. DOI:10.1016/j.jare.2018.05.009 |
Parmar P, Shukla A, Goswami D, et al. 2020. Comprehensive depiction of novel heavy metal tolerant and EPS producing bioluminescent Vibrio alginolyticus PBR1 and V. rotiferianus PBL1 confined from marine organisms[J]. Microbiological Research, 238: 126526. DOI:10.1016/j.micres.2020.126526 |
Shou W, Kang F, Lu J. 2018. Nature and value of freely dissolved EPS ecosystem services: Insight into molecular coupling mechanisms for regulating metal toxicity[J]. Environmental Science and Technology, 52: 457-466. DOI:10.1021/acs.est.7b04834 |
Shukla A, Parmar P, Goswami D, et al. 2020. Characterization of novel thorium tolerant Ochrobactrum intermedium AM7 in consort with assessing its EPS-Thorium binding[J]. Journal of Hazardous Materials, 388: 122047. DOI:10.1016/j.jhazmat.2020.122047 |
Tang Y, Dai X, Dong B, et al. 2020. Humification in extracellular polymeric substances (EPS) dominates methane release and EPS reconstruction during the sludge stabilization of high-solid anaerobic digestion[J]. Water Research, 175: 115686. DOI:10.1016/j.watres.2020.115686 |
Vimalnath S, Subramanian S. 2018. Studies on the biosorption of Pb(II) ions from aqueous solution using extracellular polymeric substances (EPS) of Pseudomonas aeruginosa[J]. Colloids Surf B Biointerfaces, 172: 60-67. DOI:10.1016/j.colsurfb.2018.08.024 |
Wang J, Li Q, Li M M, et al. 2014. Competitive adsorption of heavy metal by extracellular polymeric substances (EPS) extracted from sulfate reducing bacteria[J]. Bioresource Technology, 163: 374-376. DOI:10.1016/j.biortech.2014.04.073 |
Wei L, Li J, Xue M, et al. 2019. Adsorption behaviors of Cu2+, Zn2+ and Cd2+ onto proteins, humic acid, and polysaccharides extracted from sludge EPS: Sorption properties and mechanisms[J]. Bioresource Technology, 291: 121868. DOI:10.1016/j.biortech.2019.121868 |
Wei L, Li Y, Noguera D R, et al. 2017. Adsorption of Cu2+ and Zn2+ by extracellular polymeric substances (EPS) in different sludges: Effect of EPS fractional polarity on binding mechanism[J]. Journal of Hazardous Materials, 321: 473-483. DOI:10.1016/j.jhazmat.2016.05.016 |
Xiao R, Zheng Y. 2016. Overview of microalgal extracellular polymeric substances (EPS) and their applications[J]. Biotechnology Advances, 34: 1225-1244. |
Xie Q, Liu N, Lin D, et al. 2020. The complexation with proteins in extracellular polymeric substances alleviates the toxicity of Cd (II) to Chlorella vulgaris[J]. Environmental Pollution, 263: 114102. DOI:10.1016/j.envpol.2020.114102 |
Yan P, Xia J S, Chen Y P, et al. 2017. Thermodynamics of binding interactions between extracellular polymeric substances and heavy metals by isothermal titration microcalorimetry[J]. Bioresource Technology, 232: 354-363. DOI:10.1016/j.biortech.2017.02.067 |
Yin Y, Hu Y, Xiong F. 2011. Sorption of Cu(II) and Cd(II) by extracellular polymeric substances (EPS) from Aspergillus fumigatus[J]. International Biodeterioration & Biodegradation, 65: 1012-1018. |
Yu Q, Fein J B. 2017. Enhanced Removal of Dissolved Hg(II), Cd(II), and Au(III) from Water by Bacillus subtilis Bacterial Biomass Containing an Elevated Concentration of Sulfhydryl Sites[J]. Environmental Science Technology, 51: 14360-14367. DOI:10.1021/acs.est.7b04784 |
 2021, Vol. 41
2021, Vol. 41


