2. 西安建筑科技大学, 西北水资源与环境生态教育部重点实验室, 西安 710055;
3. 李家河水库管理有限公司, 西安 710055
2. Key Laboratory of Northwest Water Resource, Environment and Ecology, Ministry of Education, Xi'an University of Architecture and Technology, Xi'an 710055;
3. Lijiahe Reservoir Management Co., Ltd, Xi'an 710055
随着经济的发展, 氮素污染已经成为一个日益严重的问题, 尤其是在饮用水水源水库中(Fenech et al., 2012; Huang et al., 2015a; 蒋云霞等, 2020).水体中氮素超标会引发水质恶化, 特别是水源水的富营养化, 严重威胁水库供水安全(周石磊等, 2016; 康鹏亮等, 2018a).因此对水源水库氮素的去除成为了水源水库水质改善的研究重点.
生物脱氮技术以其效率高、成本低和二次污染少的特点被广泛应用(Wang et al., 2017; Cao et al., 2017).近年来, 越来越多的贫营养反硝化菌被筛选分离出来(Huang et al., 2013; Su et al., 2015; Wen et al., 2019).在反硝化过程中, 它们利用碳源作为电子供体, 硝酸盐作为电子受体, 同时去除水体中的碳和氮(闫苗苗等, 2020; 文刚等, 2020).但利用它们对实际水体进行生物修复仍有局限性.在低碳氮比条件下, 碳源浓度低不利于微生物的生长, 并且电子供体不足会限制反硝化的进程(Guo et al., 2013; Huang et al., 2015b; 刘雪晴, 2019), 从而难以有效去除水中氮素, 外加碳源则会增加处理成本, 同时在水源水库中投加碳源会对水库水质造成二次污染.近年来, 针对低碳氮比水处理, 许多研究学者采用无机电子供体, 将自养、异养脱氮结合优缺互补, 例如自养反硝化可以减少有机碳源的投加量、异养反硝化效率高, 从而使用混合营养型反硝化代替异养型反硝化进行高效经济地脱氮(Hang et al., 2017; 王佩琦, 2018; 李金龙, 2018; Su et al., 2018).
铁生物的还原作用广泛存在于土壤、河流、海洋、地表含水层等沉积环境中(连婷婷, 2018).早期有学者在对海洋沉积物研究时发现铁还原与硝酸盐还原过程相互作用, 提出铁还原过程可能与硝酸盐氮还原菌有关(Sørensen, 1982).之后, 越来越多的研究发现自然环境中广泛存在一些既能还原铁又能还原硝酸盐的细菌(Knight et al., 1998; Cummings et al., 1999).汪国威(2013)从富含铁氧化物尾矿库中筛选分离出一株能同时还原三价铁和硝酸盐的施氏假单胞菌CW, 发现铁的加入促进了亚硝酸盐向氮气的转化.程策(2017)从水库底泥筛选分离出的两株高效的铁还原菌CC76, 其在利用还原生成的二价铁作为电子供体的同时能去除90%以上的硝酸盐氮.连婷婷(2018)将零价铁耦合铁还原菌CC76, 对生物脱氮进行试验, 进一步提高脱氮效率.目前, 针对贫营养水源水库, 分离铁还原反硝化混合菌群并利用其脱氮的研究较少, 尤其是对于低碳氮比条件下的水库.因此, 加强铁还原反硝化菌群的筛选及其脱氮特性的研究, 对水源水库利用无机电子供体强化生物脱氮具有重要的意义.
本研究从西安市李家河水库表层沉积物中分离得到一组高效铁还原反硝化菌群FL6, 运用高通量DNA测序技术鉴定该菌群的种群结构, 探究了该菌群的反硝化及铁还原特性, 利用响应曲面法对其分析来确定最优脱氮条件, 以期为后续研究无机电子供体强化水源水库反硝化脱氮提供科学依据.
2 材料与方法(Materials and methods) 2.1 样品与培养基2019年7月从陕西省西安市李家河水库, 采集表层0~10 m沉积物置于灭菌的取样瓶中, 然后暂放置于有冰袋的泡沫箱, 48 h内带回实验室, 待用.
富集培养基(EM):CH3COONa, 0.06 g·L-1;NaNO3, 0.06 g·L-1;KH2PO4, 0.03 g·L-1;Fe(III)-citrate, 0.18 g·L-1;MgSO4·7H2O, 0.03 g·L-1;CaCl2, 0.03 g·L-1;微量元素溶液, 0.4 mL·L-1;调节pH为7.0±0.2.
微量元素溶液(Su et al., 2016): MgSO4·7H2O, 0.5 g·L-1;乙二胺四乙酸(EDTA), 1 g·L-1;ZnSO4, 0.2 g·L-1;MnCl2·4H2O, 0.1 g·L-1;FeSO4·7H2O, 0.5 g·L-1;CuSO4·5H2O, 0.5 g·L-1;CoCl2·6H2O, 0.2 g·L-1.
基础培养基(BM):CH3COONa, 0.02 g·L-1;NaNO3, 0.02 g·L-1;KH2PO4, 0.01 g·L-1;Fe(III)-citrate, 0.036 g·L-1;MgSO4·7H2O, 0.01 g·L-1;CaCl2, 0.01 g·L-1;微量元素溶液, 0.4 mL·L-1;调节pH为7.0±0.2.
BM固体培养基:CH3COONa, 0.02 g·L-1;NaNO3, 0.02 g·L-1;KH2PO4, 0.01 g·L-1;Fe(III)-citrate, 0.036 g·L-1;MgSO4·7H2O, 0.01 g·L-1;CaCl2, 0.01 g·L-1;微量元素溶液, 0.4 mL·L-1;琼脂粉12 g·L-1;调节pH为7.0±0.2.
2.2 铁还原反硝化菌的富集与筛选取适量泥水的混合样品与液体EM混匀后装入500 mL盐水瓶中, 用橡胶塞子密封, 30 ℃恒温培养, 每隔7 d更换一半新鲜的培养基.驯化28 d后, 取1 mL泥样与9 mL灭菌水, 经过梯度稀释后取150 μL在BM固体培养基平板上涂布, 再将同样的未完全凝固的培养基覆盖在涂布之后的培养皿上, 形成双层平板.待琼脂凝固后, 倒置于恒温培养箱中.待菌落长出后用1 mol·L-1的磷酸缓冲盐溶液(PBS)将固体平板上长势良好的菌落冲洗下来, 转接至装有液体BM培养基的50 mL盐水瓶中, 活化培养5 d后, 按照体积比10%的接种量转接入灭菌的液体BM里, 5 d后检测培养基中总氮、硝酸盐氮、三价铁及二价铁浓度进行初筛.将初筛后得到的菌群分别转接至液体BM中, 进一步筛选脱氮效果较好的菌群.
2.3 菌群结构分析 2.3.1 微生物总DNA提取和PCR扩增取培养至对数生长期的菌液200 mL经0.22 μm醋酸纤维滤膜过滤, 根据E.Z.N.A.®soil试剂盒(美国, Omega)说明书进行总DNA提取, 利用1%琼脂糖凝胶电泳检测DNA提取物的质量(Nano Drop 2000).采用引物338F(5′-ACTCCTCGGGAGGC AGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对V3~V4可变区进行PCR扩增(张婷月等, 2018).PCR扩增体系(20 μL)为:DNA模板10 ng、dNTPs 2 μL(2.5 mmol·L-1)、缓冲液4 μL、DNA聚合酶0.4 μL、338F引物0.8 μL(5 μmol·L-1)、806R引物0.8 μL(5 μmol·L-1)、ddH2O补至20 μL.扩增过程:95 ℃预变性3 min, 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s, 27个循环, 最后72 ℃延伸10 min(蒋云霞等, 2020).
2.3.2 Illumina MiSeq测序使用凝胶回收试剂盒(Axygen, USA)纯化回收PCR产物, Tris-HCl洗脱, 然后使用琼脂糖凝胶电泳(2%)检测.将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega, USA)进行定量检测.Illumina MiSeq高通量DNA测序在上海美吉生物公司进行.
2.4 菌群反硝化功能基因的扩增提取菌群的DNA作为16S rDNA的扩增模板.以nirS反硝化功能基因为PCR扩增基因.正向引物采用nirS1F(5′-CCTA(C/T))TGGCCGCC(A/G)CA(A/G)T-3′), 反向引物采用nirS5R(5′-CTTGTTG(A/T)ACTCG(C/G)(C/G)CTGCAC-3′), 基因扩增产物长度为751 bp(Braker et al., 1998).反应体系(25 μL)为:DNA模板(20~50 ng·μL-1)2 μL、正向引物(10 μmol·L-1)1 μL、反向引物(10 μmol·L-1)1 μL、dNTP mix(10 mmol·L-1 each)1 μL、10×Taq Buffer(with MgCl2)2.5 μL、Taq酶(5 U·μL-1)0.2 μL、ddH2O补至25 μL.PCR反应条件为:预变性5 min(95 ℃), 变性30 s(94 ℃), 退火30 s(58 ℃), 延伸60 s(72 ℃), 循环38次, 延伸10 min(72 ℃).菌群反硝化功能基因的扩增在上海生工生物公司进行.
2.5 菌群的脱氮特性分析将筛选出的优势反硝化菌群FL6转接至灭菌的BM中进行活化.将活化后的菌液按体积比10%的接种量转接至新鲜的BM中进行反硝化脱氮实验, 前16 h每隔4 h取样, 16 h后每隔8 h取样, 测定其上清液中总细菌数(Total Cell Counts, TCC)、pH、硝酸盐氮(NO3--N)、氨氮(NH4+-N)、亚硝酸盐氮(NO2--N)、总氮(Total Nitrogen, TN)、溶解性总氮(Total Dissolved Nitrogen, TDN)、总有机碳(Total Organic Carbon, TOC)、二价铁(Fe2+)和三价铁(Fe3+)的浓度, 同时设置相同培养条件下不加Fe3+的对照实验, 96 h后测定总氮、硝酸盐氮、亚硝酸盐氮和氨氮的浓度.每次样品重复测定3次.
2.6 响应曲面确定最优条件为探究多种环境因素条件下, 菌群FL6的反硝化最优条件, 采用Box-Behnken方法进行实验设计.在本次试验中, 设置3个独立变量, 分别为初始pH值、温度、碳氮比(C/N), 以+1、0、-1分别表示独立变量高、中、低水平, 以总氮去除率为响应值.使用RSM和Box-Behnken实验设计评估以上3个环境因素对反硝化脱氮效率的综合影响.Box-Behnken实验设计及各变量取值范围见表 1.
| 表 1 Box-Behnken实验设计及各变量取值范围 Table 1 Level and code of variables chosen for Box-Behnken experimental design |
通过多项式回归分析法对试验数据进行回归拟合, 确立最优拟合二次多项式方程:
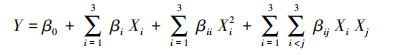
|
(1) |
式中, Y为预测值, Xi和Xj为变量, β0为常数, βi为线性常数, βii为二次系数, βij为相互作用系数.
2.7 测定方法总细菌数采用流式细胞分析仪(AccuriC6, BD公司, 美国)来测定.TN、TDN、NO3--N、NO2--N、NH4+-N、Fe3+、Fe2+等均参照文献(国家环境保护总局, 2002)测定(日本岛津, 紫外-可见分光光度计, UVmini-1240).其中, TN采用碱性过硫酸钾消解-紫外分光光度法;NO3--N采用紫外分光光度法;NO2--N采用N-(1-萘基)-乙二胺光度法;NH4+-N采用纳氏试剂光度法;Fe3+、Fe2+采用邻菲罗啉分光光度法测定.TOC采用总有机碳测定仪分析(TOC-L, 岛津公司, 日本).pH采用HQ30d便携式水质测定仪(美国, Hach)测定.每个水样重复测定3次.
3 结果与讨论(Results and discussions) 3.1 铁还原反硝化菌群的筛选在初筛基础上, 对获得的15组高效的铁还原反硝化菌群进行复筛, 复筛主要获得既能高效还原三价铁, 又能进行生物脱氮的铁还原菌反硝化菌群.最终选取生物脱氮能力最好的铁还原反硝化菌群FL6为后期实验菌群, 并将菌群样品保存于4 ℃冰箱和-80 ℃超低温冰箱.
3.2 铁还原反硝化菌群FL6的结构组成解析采用Illumina MiSeq高通量DNA测序分析测定铁还原反硝化菌群FL6结构及比例.从门水平上看, FL6中的细菌群落主要集中分布在变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)2个门类, 共占总量的99.96%.其中, 变形菌门丰度最高, 可达95.19%, Kern等(2009)研究报道发现变形菌门在反硝化过程中起关键作用.FL6具有极高的群落多样性, 覆盖了49个属, 相对丰度大于2%的有6个属, 由菌属水平形成的饼状图如图 1所示.主要有Dechloromonas(25.76%)、Acidovorax(20.76%)、Vogesella(19.3%)、Azoarcus(11.12%)、Zoogloea(10.32%)、Pseudomonas(8.08%).其中Pseudomonas曾在汪国威(2013)的研究中被分离出来, 具有还原铁和硝酸盐的能力.Zoogloea、Dechloromonas、Geothrix、和Sunxiuqinia等是稻田环境中参与NO3-与铁耦合过程的优势微生物(Li et al., 2016; 陈鹏程等, 2017), 并且在李爽等(2018)的研究中提出Dechloromonas具有硝酸盐还原型亚铁氧化功能.
 |
| 图 1 菌群FL6的群落结构组成 Fig. 1 The microbial community structure of the FL6 |
亚硝酸盐氮转化为氧化氮的过程, 是反硝化过程中第1个有气体产生的步骤, 也是反硝化过程中核心反应(Throbäck et al., 2004; 梁丽华等, 2009; 郭琳, 2015). 在菌群FL6反硝化的过程中, 血红素亚硝酸还原酶nirS基因被扩增检测到.由图 2可以看出, 在700~800 bp左右得到了比较清晰的751 bpDNA特异性条带, 表明菌群FL6中有血红素亚硝酸还原酶nirS基因片段.这证明了菌群FL6可以有效地表达血红素亚硝酸还原酶.由于亚硝酸盐还原酶是反硝化途径的关键酶, 这表明菌群FL6具备反硝化的特性.
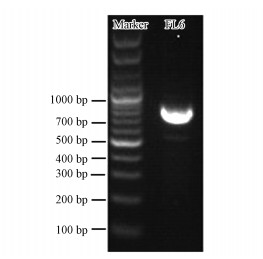 |
| 图 2 菌群FL6 nirS基因PCR扩增 Fig. 2 PCR Amplification of nirS gene of the FL6 |
以硝酸盐氮为唯一氮源, 混合菌群FL6的反硝化特性及生长曲线如图 3所示. 从中可知, 菌群总细菌数在56 h达到最大, 之后进入衰亡期.通过生长曲线可掌握该混合菌群的生长规律, 为研究它的脱氮特性奠定基础.在0~8 h, 菌群FL6处于对数增长期, 细菌数由0.167×107 cells·mL-1快速增长至1.20×107 cells·mL-1, 硝酸盐氮浓度下降明显, 菌体对其降解速率在此范围内迅速增大, 达到0.19 mg·L-1·h-1, 这与该时期菌体总量的不断增多有关;另外pH从7.04升高到7.65, 这是因为在反硝化过程中产生碱性物质(Zhu et al., 2012; Huang et al., 2015a).8 h后, 菌群总细菌数呈缓慢上升, 硝酸盐氮浓度逐渐下降.在96 h时, 95.23%的硝酸盐氮、69.56%的总氮以及80.76%的溶解性总氮被去除, 此时剩余的总氮以细菌细胞内氮素和溶解性有机氮的形式存在, 总氮和硝酸盐氮去除率有一定的差值, 这与其他反硝化菌的脱氮特性相似(Huang et al., 2015b; 文刚等, 2020; 蒋云霞等, 2020).另外总氮去除率明显高于蒋云霞等(2020)不加无机电子供体分离出的菌群, 而C/N却较其低.在整个反硝化过程中, 随着硝酸盐氮浓度的降低, 没有氨氮的生成, 而亚硝酸盐氮在12 h出现了少量的累积(0.17 mg·L-1), 随即逐渐降低直至消失.这与Su等(2016)、康鹏亮等(2018b)在研究菌群反硝化特性时的结果一致.
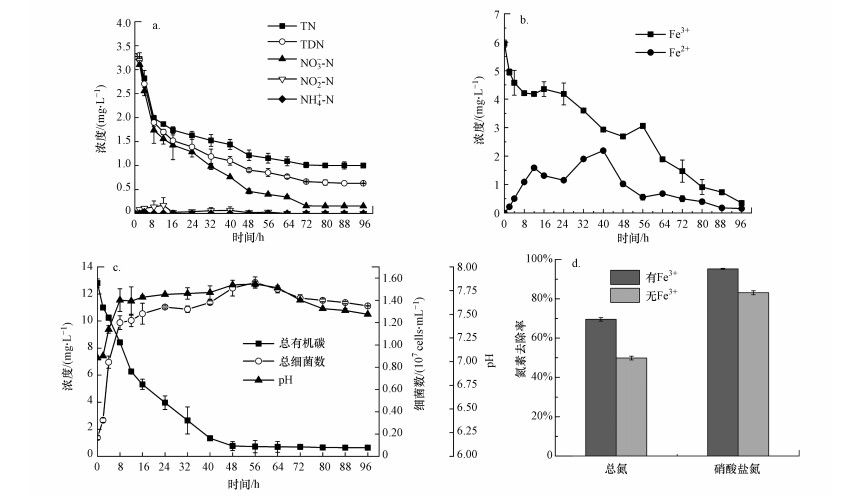 |
| 图 3 菌群FL6反硝化特性及生长曲线 Fig. 3 Denitrification performance and the growth curve of the FL6 |
另一方面, 在整个实验过程中, 由于产生铁循环, Fe2+浓度一直处于波动状态.当菌群FL6对Fe3+的还原速率强于对Fe2+的利用速率时, Fe2+的浓度将会增加(例如0.218~1.589 mg·L-1从2~12 h), 反之则会下降(例如1.589~1.150 mg·L-1从12~24 h).在40 h时, TOC浓度较低, 无法给反硝化过程提供足够的电子, 此时Fe2+作为主要的电子供体使反硝化过程继续进行.整个反应过程中Fe3+浓度整体呈下降趋势, 溶液由黄绿色逐渐变浅, 反应后期溶液瓶中观察到絮状沉淀, 这是因为发生铁离子水解生成氢氧化物.当培养基中不加入Fe3+时, 96 h菌群FL6对总氮和硝酸盐氮的去除率分别为49.87%、83.08%, 这远低于加入Fe3+时的脱氮效果, 同时观察到了亚硝氮的累积, 而在有Fe3+的反应体系中96 h时亚硝酸盐浓度为零.这说明铁的加入促进了亚硝酸盐向氮气的转化.
结果表明铁还原反硝化菌群FL6在贫营养培养条件下具有较好的反硝化能力, 对硝酸盐氮的去除可达95%以上, 可以为后续以铁为主的无机电子供体强化水源水库实际水体反硝化脱氮提供菌源.
3.5 基于Box-Behnken design的响应曲面实验优化 3.5.1 模型方程的拟合与分析对实验的统计设计和数据分析均采用Design-Expert 8.0.6统计软件, 设计出的15组实验见表 2.
| 表 2 Box-Behnken设计方案及响应值 Table 2 Box-Behnken experimental design along with the corresponding responses |
利用软件对表 2数据进行二次多项式回归拟合得到模型方程如下:

|
(2) |
通过求解回归方程(2), 确定各变量对菌群FL6脱氮效率的最优条件.结果表明, 在C/N比5.95, 温度24.33 ℃, pH 5.88条件下能最大限度地去除总氮, 去除率为64.72%.在该最优条件下, 通过3次平行试验进行验证, 验证试验的总氮去除率为63.11%±1.52%, 与实验数据吻合较好.
方差分析(ANOVA)可以用来评价模型的充分性和有效性(Juan et al., 2009).去除效率响应值的方差分析结果及区间高置信值和区间低置信值如表 3所示.模型的F值和p值可以用来决定模型的显著性, F值为344.83, 说明该模型是显著的;p值< 0.0001, 表明用该模型来预测菌群FL6总氮去除率是较可靠的.另外, 由表 4的方差分析可知, 此模型的相关系数R2=0.9984, 表明模型可以解释99.84%的变异, 这说明响应曲面预测结果能有效的反应真实情况.实验的信噪比为52.256, 通常情况下, 该值大于4是合理的, 说明此模型有足够分辨率, 能很好地反映实验结果.F(失拟项)=7.94表明失拟项与纯误差关系不显著, 该模型拟合程度良好.
| 表 3 二次多项式模型检验及其显著性分析1) Table 3 The ANOVA test of quadratic polynomial model(Y) and its significance analysis |
| 表 4 二次回归方程的方差分析 Table 4 Analysis of variance for the RSM results |
根据响应曲面图, 分析C/N比、温度、初始pH值对菌群FL6总氮去除率的影响.图 4为3个影响因素相互作用的响应曲面和等高线图.
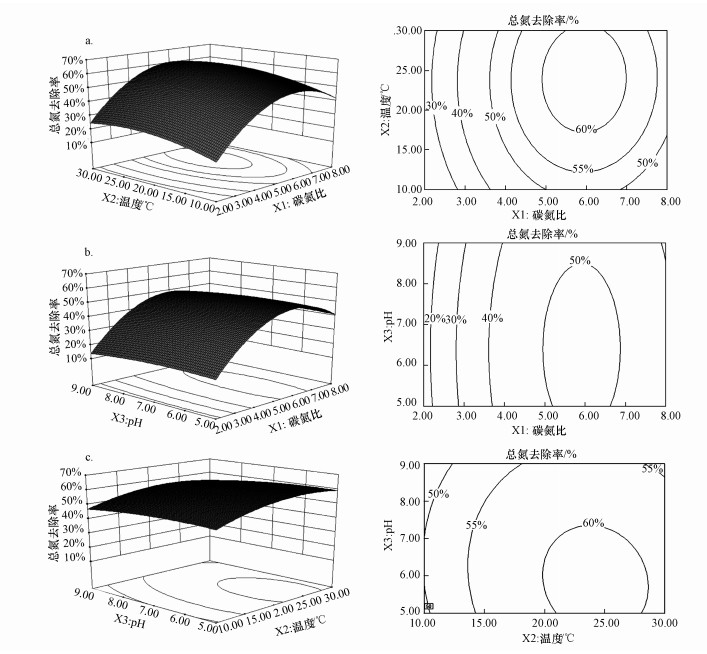 |
| 图 4 C/N比、温度、和初始pH对菌群FL6总氮去除率影响的3D响应曲面和等高线图 Fig. 4 Surface response and contour line of TN removal rate by the FL6 as a function of C/N ratio, temperature and initial pH |
其中图 4a考察了初始pH=7.00时, C/N比、温度的相互作用下对总氮去除率的影响.由图可知, C/N比在3.90~8.00, 温度在12.56~30.00 ℃范围内, 菌群FL6总氮去除率在50%左右;C/N比在4.95~6.95, 温度在17.50~28.50 ℃范围内, 总氮的去除率在60%左右.这证明了C/N比和温度作为环境因素对于总氮的去除有着重要的影响.同时C/N比对应曲线相对更陡, 说明C/N比的增加比温度的增加对总氮去除率影响更明显.
图 4b描述了温度=10.00 ℃时, C/N比和初始pH对总氮去除率的影响.在该低温下, 当C/N比为5.94, pH=6.50的情况下, 总氮去除率可以达到52.29%, 菌群FL6表现出不错的反硝化能力.等高线图的形状可反映出交互作用的强弱(Chen et al., 2012), 等高线图呈椭圆形表明C/N比和pH交互作用显著, 且对总氮去除率的影响, C/N比的作用要大于初始pH.
图 4c表示在C/N=5.00时, 温度和pH的相互作用对总氮率去除的影响.在此条件下, 温度=24.27 ℃, pH=5.96时, 可以达到最高总氮去除率为61.03%.从3D响应曲面图可以清晰的看到总氮去除率在pH值为5.00~5.96和温度为10.00~24.27 ℃时不断增加, 然后pH值为5.96~9.00和温度为24.27~30.00 ℃则逐渐下降.菌群FL6能在初始pH值为5.96时达到最佳的总氮去除率, 这是因为在酸性条件下细菌能够充分利用Fe 2+作为电子供体.温度相应的曲线相对较陡, 说明温度对总氮去除率的影响明显.
综上所述, 3个变量对菌群FL6反硝化去除总氮效率的影响大小顺序为C/N比>温度>初始pH.FL6反硝化脱除总氮效率受C/N比影响很大, 且在低温下(10.00 ℃)仍有不错的反硝化能力.
3.6 环境意义作为重要的饮用水水源, 水库的水质安全保障着群众正常生活用水, 但随着经济的发展, 目前湖库氮、磷营养盐富集也日趋严重.对于水源水库水体氮素超标的污染问题, 生物脱氮成了水源水库水质改善领域研究的热点话题.生物脱氮多依赖于各菌群之间的协调运作, 相比高碳氮浓度下污废水的生物脱氮处理, 在水源水库的低氮碳比条件下, 反硝化受到限制, 菌群很难发挥高效脱氮作用, 使得其无法大规模的在实际工程中进行运用.因此, 若利用无机电子供体强化反硝化菌群脱氮, 不仅去除超标氮, 也能实现自身循环, 延缓无机材料的损耗, 无需外加有机碳源, 避免二次污染的同时降低成本.
此外, 在水库水体连续流动以及周围其他不利环境因素影响下, 向水体直接投加的菌群通常不能成为优势菌种而被淘汰, 最终流失, 达不到稳定的强化作用.目前生物固定化技术可以克服水体流速过快菌剂流失的缺点, 提高菌种密度, 一定程度上缓解温度、有毒物质等对菌种活性的冲击.寻求合适的固定化载体, 将本研究分离出的铁还原反硝化菌群及课题组前期已分离的好氧反硝化菌附着在载体上, 形成生物膜, 再将载体包裹无机材料形成生物载体小球.一方面载体小球可以防止无机材料离子释放到水体中, 避免造成水库水体污染;另一方面载体的存在一定程度上抑制了溶解氧传质, 生物小球从外到内形成好氧、兼氧、缺氧的结构, 为铁还原反硝化菌群和好氧反硝化菌群提供理想的生存环境.这在一定的范围内高效的去除氮污染物质, 是一种经济有效的水源水质原位生物修复技术, 对水源水库实际水体应用生物脱氮上有着很重要的现实意义.
4 结论(Conclusions)1) 本研究从西安李家河水源水库沉积物中筛选分离得到一组高效铁还原反硝化菌群FL6, 经Illumina MiSeq高通量DNA测序可知Dechloromonas、Acidovorax、Vogesella、Azoarcus等是FL6中的优势菌属.
2) 通过对nirS型反硝化特异性条带的鉴定证实了菌群FL6具有反硝化血红素亚硝酸还原酶基因.
3) 在贫营养条件下, 菌群FL6能将Fe3+还原为Fe2+, 从而利用Fe2+作为电子供体进行高效率的反硝化脱氮, 对硝酸盐氮的去除可达95%以上, 且在此过程中没有亚硝酸盐氮及氨氮的积累.
4) 响应曲面法结果表明, 菌群FL6在C/N比5.95, 温度24.33 ℃, 初始pH5.88的条件下能最大限度地去除总氮, 并且环境因子对脱除总氮效率的影响顺序为C/N比>温度>pH.
5) 菌群FL6可以为后续以铁为主的无机电子供体强化水源水库实际水体反硝化脱氮提供菌源保障.
Braker G, Fesefeldt A, Witzel K P. 1998. Development of PCR primer systems for amplification of nitrite reductase genes (nirK and nirS) to detect denitrifying bacteria in environmental samples[J]. Applied and Environmental Microbiology, 64(10): 3769-3775. DOI:10.1128/AEM.64.10.3769-3775.1998 |
Cao S B, Du R, Li B K, et al. 2017. Nitrite production from partial-denitrification process fed with low carbon/nitrogen (C/N) domestic wastewater: Performance, kinetics and microbial community[J]. Chemical Engineering Journal, 326: 1186-1196. DOI:10.1016/j.cej.2017.06.066 |
Cummings D E, Caccavo J F, Spring S, et al. 1999. Ferribacterium limneticum, gen. nov., sp. nov., an Fe(III)-reducing microorganism isolated from mining-impacted freshwater lake sediments[J]. Archives of Microbiology, 171(3): 183-188. DOI:10.1007/s002030050697 |
Chen Q, Ni J R. 2012. Ammonium removal by Agrobacterium sp. LAD9 capable of heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 113(5): 619-623. DOI:10.1016/j.jbiosc.2011.12.012 |
程策. 2017. 基于铁还原菌耦合生物脱氮特性及其应用研究[D]. 西安: 西安建筑科技大学
|
陈鹏程, 李晓敏, 李芳柏. 2017. 水稻土Fe(Ⅱ)氧化耦合NO3-还原的微生物变化[J]. 中国环境科学, 37(1): 358-366. |
Fenech C, Rock L, Nolan K, et al. 2012. The potential for a suite of isotope and chemical markers to differentiate sources of nitrate contamination: A review[J]. Water Research, 46(7): 2013-2041. |
Guo L Y, Chen Q K, Fang F, et al. 2013. Application potential of a newly isolated indigenous aerobic denitrifier for nitrate and ammonium removal of eutrophic lake water[J]. Bioresource Technology, 142: 45-51. DOI:10.1016/j.biortech.2013.05.021 |
国家环境保护总局. 2002. 水与废水监测分析方法[M]. 第四版. 北京: 中国环境科学出版社, 254-370.
|
郭琳. 2015. 水源水库中好氧反硝化菌的筛选及脱氮性能研究-以周村水库为例[D]. 西安: 西安建筑科技大学
|
Huang T L, Guo L, Zhang H H, et al. 2015a. Nitrogen-removal efficiency of a novel aerobic denitrifying bacterium, Pseudomonas stutzeri strain ZF31, isolated from a drinking-water reservoir[J]. Bioresource Technology, 196: 209-216. DOI:10.1016/j.biortech.2015.07.059 |
Huang T L, Zhou S L, Zhang H H, et al. 2015b. Nitrogen removal characteristics of a newly isolated Indigenous aerobic denitrifier from oligotrophic drinking water reservoir, Zoogloea sp. N299[J]. International Journal of Molecular Sciences, 16(5): 10038-10060. |
Huang X F, Li W G, Zhang D Y, et al. 2013. Ammonium removal by a novel oligotrophic Acinetobacter sp. Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature[J]. Bioresource Technology, 146: 44-50. DOI:10.1016/j.biortech.2013.07.046 |
Hang Q H, Wang H Y, Chu Z S, et al. 2017. Nitrate-rich agricultural runoff treatment by Vallisneria-sulfur based mixotrophic denitrification process[J]. Science of the Total Environment, 587-588: 108-117. DOI:10.1016/j.scitotenv.2017.02.069 |
Juan T, Chen Y G. 2009. Recovery of nitrogen and phosphorus from alkaline fermentation liquid of waste activated sludge and application of the fermentation liquid to promote biological municipal wastewater treatment[J]. Water Research, 43(12): 2969-2976. DOI:10.1016/j.watres.2009.04.015 |
蒋云霞, 黄廷林, 杨尚业, 等. 2020. 水源水库贫营养好氧反硝化菌群脱氮特性研究[J]. 中国环境科学, 40(6): 2493-2502. DOI:10.3969/j.issn.1000-6923.2020.06.019 |
Knight V, Blakemore R. 1998. Reduction of diverse electron acceptors by Aeromonas hydrophila[J]. Archives of Microbiology, 169(3): 239-248. DOI:10.1007/s002030050567 |
Kern M, Simon J. 2009. Electron transport chains and bioenergetics of respiratory nitrogen metabolism in Wolinella succinogenes and other Epsilonproteobacteria[J]. Biochimica et Biophysica Acta, 1787(6): 646-656. DOI:10.1016/j.bbabio.2008.12.010 |
康鹏亮, 张海涵, 黄廷林, 等. 2018a. 湖库沉积物好氧反硝化菌群脱氮特性及种群结构[J]. 环境科学, 39(5): 2431-2437. |
康鹏亮, 陈胜男, 黄廷林, 等. 2018b. 好/厌氧条件下反硝化细菌脱氮特性与功能基因[J]. 环境科学, 39(8): 3789-3796. |
Li X M, Zhang W, Liu T X, et al. 2016. Changes in the composition and diversity of microbial communities during anaerobic nitrate reduction and Fe(II) oxidation at circumneutral pH in paddy soil[J]. Soil Biology and Biochemistry, 94: 70-79. DOI:10.1016/j.soilbio.2015.11.013 |
刘雪晴. 2019. 好氧反硝化混合菌群贫营养水库水脱氮特性与负载效能研究[D]. 西安: 西安建筑科技大学
|
李金龙. 2018. 基于Fe基质生物载体的低C/N比污水自养反硝化脱氮研究[D]. 北京: 北京交通大学
|
连婷婷. 2018. 铁还原菌-零价铁复合体系脱氮特性及其应用研究[D]. 西安: 西安建筑科技大学
|
李爽, 李晓敏, 李芳柏. 2018. Fe(Ⅱ)对反硝化过程及其功能微生物群落的影响[J]. 中国环境科学, 38(1): 263-274. DOI:10.3969/j.issn.1000-6923.2018.01.030 |
梁丽华, 左剑恶. 2009. 反硝化功能基因-检测反硝化菌种群结构的分子标记[J]. 微生物学通报, 36(4): 627-633. |
Su J F, Zhang K, Huang T L, et al. 2015. Heterotrophic nitrification and aerobic denitrification at low nutrient conditions by a newly isolated bacterium, Acinetobacter sp. SYF26[J]. Microbiology, 161: 829-837. DOI:10.1099/mic.0.000047 |
Su J F, Liang D H, Lian T T, et al. 2018. Comparison of denitrification performance by bacterium Achromobacter sp. A14 under different electron donor conditions[J]. Chemical Engineering Journal, 333: 320-326. DOI:10.1016/j.cej.2017.09.129 |
Su J F, Cheng C, Huang T L, et al. 2016. Characterization of coupling autotrophic denitrification with iron cycle bacterium Enterobacter sp. CC76 and its application of groundwater[J]. Journal of the Taiwan Institute of Chemical Engineers, 66: 106-114. DOI:10.1016/j.jtice.2016.05.046 |
Sørensen J. 1982. Reduction of ferric iron in anaerobic, marine sediment and interaction with reduction of nitrate and sulfate[J]. Applied and Environmental Microbiology, 43(2): 319-324. DOI:10.1128/aem.43.2.319-324.1982 |
Throbäck I N, Enwall K, Jarvis A, et al. 2004. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J]. FEMS Microbiology Ecology, 49: 401-417. DOI:10.1016/j.femsec.2004.04.011 |
Wang Z, Fei X, He S B, et al. 2017. Comparison of heterotrophic and autotrophic denitrification processes for treating nitrate-contaminated surface water[J]. Science of the Total Environment, 579: 1706-1714. DOI:10.1016/j.scitotenv.2016.11.194 |
Wen G, Wang T, Li K, et al. 2019. Aerobic denitrification performance of strain Acinetobacter johnsonii WGX-9 using different natural organic matter as carbon source: Effect of molecular weight[J]. Water Research, 164: 114956. DOI:10.1016/j.watres.2019.114956 |
文刚, 王彤, 黄廷林, 等. 2020. 贫营养好氧反硝化菌株的脱氮特性及氮/碳平衡分析[J]. 环境科学, 41(5): 2339-2348. |
王佩琦. 2018. 混合营养型反硝化的脱氮性能及其微生物群落解析[D]. 上海: 上海交通大学
|
汪国威. 2013. 一株铁/硝酸盐还原菌分离、特性鉴定及其与铁氧化物作用[D]. 安徽: 合肥工业大学
|
闫苗苗, 张海涵, 钊珍芳, 等. 2020. 生物脱氮技术中好氧反硝化细菌的代谢及应用研究进展[J]. 环境科学研究, 33(3): 668-676. |
Zhu L, Ding W, Feng L J, et al. 2012. Isolation of aerobic denitrifiers and characterization for their potential application in the bioremediation of oligotrophic ecosystem[J]. Bioresource. Technology, 108: 1-7. DOI:10.1016/j.biortech.2011.12.033 |
周石磊, 黄廷林, 张海涵, 等. 2016. 贫营养好氧反硝化菌群的筛选及源水脱氮特性[J]. 环境工程学报, 10(6): 2955-2961. |
张婷月, 丁钰, 黄民生. 2018. 异养硝化-好氧反硝化细菌的筛选及其脱氮性能研究[J]. 华东师范大学学报(自然科学版), (6): 22-31. DOI:10.3969/j.issn.1000-5641.2018.06.003 |
 2021, Vol. 41
2021, Vol. 41


